Jaká je elektromotorická síla galvanického článku. Velká encyklopedie ropy a plynu. Stanovení hodnoty standardního elektrodového potenciálu mědi
Pokud oddělíme procesy oxidace a redukce prostorově, pak lze redoxní reakci využít k výrobě elektrické energie.
Zařízení, které přeměňuje chemickou energii na elektrickou se nazývá galvanický článek. Galvanický článek je vytvořen ze dvou kovů ponořených do roztoku elektrolytu. Pokud tyto kovy spojíte s vodičem prvního druhu (kovovým drátem), vytvoří se elektrický proud, který se objeví v důsledku výskytu redoxního procesu. V galvanickém článku je anodou elektroda, jejíž elektrodový potenciál v daném roztoku je elektronegativnější. Oxidace probíhá na anodě. Katoda je elektroda vyrobená z méně aktivního kovu. Na katodě jsou redukovány kladné kovové ionty, vodíkové ionty nebo neutrální molekuly. V galvanickém článku je anoda označena znaménkem mínus a katoda znaménkem plus. Galvanický článek je znázorněn na obrázku.
Stanovení hodnoty standardního elektrodového potenciálu mědi
Galvanický článek je jednoduché zařízení, kterým se chemická energie přeměňuje na elektrickou energii. Galvanické články se skládají ze dvou samostatných oddílů, nazývaných poloviční články, obsahujících roztoky elektrolytů a elektrody, které lze zapojit do obvodu. Dva různé kovy jsou ponořeny do elektrolytu. Pokud jsou kovy spojeny vnější smyčkou, jeden kov se redukuje a druhý oxiduje.
Ve výše uvedeném příkladu je měď redukována a zinek oxidován. Rozdíl v oxidačních potenciálech těchto dvou kovů poskytuje elektrický výkon článku. Voltový článek lze postavit pomocí jednoduchých symbolů. V diagramu jsou elektrody na vnější straně diagramu a svislá čára se používá k oddělení elektrody od roztoku elektrolytu v oddělení. Typicky jsou v diagramu oxidované druhy zapsány vlevo od dvojitého lomítka. Zde je příklad Danielovy cely.
Zinková deska je ponořena do roztoku síranu zinečnatého, měděná deska je ponořena do roztoku síranu měďnatého. Destičky jsou spojeny drátem, roztoky jsou odděleny porézní přepážkou, aby se zabránilo smíchání roztoků. Elektrony jdou po vnějším obvodu od anody ke katodě a po vnitřním obvodu se anionty SO 4 2- pohybují v roztoku z mědi na zinek a uzavírají elektrický obvod galvanického článku.
Otázky a cvičení
Jména odkazují na italské vědce z 18. století Alessandra Volteho a Luigiho Galvaniho. Daniellův článek sestával ze skleněné nádoby obsahující měděné a zinkové elektrody, z nichž každá byla ponořena do příslušných kyselých síranových roztoků. Tyto dva roztoky byly odděleny porézním hliněným válcovým separátorem. Byl to galvanický článek, ve kterém samovolné elektrické vyhledávání zinku a galvanické pokovování mědi poskytovalo elektrický proud.
Elektrochemický článek je zařízení, které přeměňuje chemická energie na elektrickou energii nebo naopak, když v buňce dojde k chemické reakci. Skládá se ze dvou elektricky vodivých fází spojených iontově vodivou fází. Jak elektrický proud prochází, musí přejít z proudu elektronů na proud iontů a zpět na proud elektronů.
Galvanický článek je napsán jako elektrochemický obvod:
A(-) Zn | ZnSO 4 || CuSO4 | Cu(+)K
Protože elektrodový potenciál zinku je menší než elektrodový potenciál mědi, zinek bude anodou a měď bude katodou. Zinkový plech se oxiduje a měď se redukuje z roztoku na povrchu měděného plechu.
Měly by být zaznamenány procesy probíhající během provozu galvanického článku:
Podstatnou vlastností elektrochemického článku je, že současně probíhající redoxní reakce jsou prostorově odděleny. Například při spontánní chemické reakci během oxidace vodíku kyslíkem na vodu přecházejí elektrony přímo z vodíku na kyslík.
Naproti tomu při spontánní elektrochemické reakci v galvanickém článku se na anodě oxiduje vodík, který přenáší elektrony na anodu, a na katodě se redukuje kyslík, který přijímá elektrony z katody. Ionty vzniklé při elektrodových reakcích, v tomto případě kladné vodíkové ionty a záporné hydroxidové ionty, se v roztoku rekombinují za vzniku konečného reakčního produktu: vody. Během tohoto procesu jsou elektrony vedeny z anody ke katodě přes vnější elektrický obvod, kde může elektrický proud pohánět motor, rozsvěcet žárovku a tak dále. reakce může být také změněna: voda může být rozložena na vodík a kyslík použitím elektrické energie k elektrolytickému článku.
A Zn-2e = Zn2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Maximální potenciálový rozdíl elektrod, který lze získat při provozu galvanického článku, se nazývá elektromotorická síla (EMF) článku. Rovná se rozdílu mezi rovnovážnými potenciály katody a anody:
EMF = e K - e A
Pro měděno-zinkový elektrochemický článek za standardních podmínek:
Palivový článek je zařízení, které přeměňuje chemickou energii na elektrickou energii. Liší se od baterie tím, že přeměna energie pokračuje tak dlouho, dokud se do palivového článku dodává palivo a okysličovadlo; tedy v zásadě na dobu neurčitou. Jedná se o galvanický článek, kde spontánní chemické reakce. Palivo se oxiduje na anodě a okysličovadlo se redukuje na katodě. V současnosti je nejpoužívanějším palivem vodík. Konvenčnější paliva musí být před použitím v palivovém článku přeměněna na vodík.
EMF \u003d 0,34-(-0,76) \u003d 1,1 V
Potenciální rozdíl se tvoří nejen mezi různými, ale i mezi stejnojmennými kovy, naloženými do roztoků jejich solí o různých koncentracích. Takový galvanický článek se nazývá koncentrace. Například galvanický článek s koncentrací niklu.
(-) Ni | NiSO4 || NiSO4 | Ni(+)
0,01 mol 0,1 mol
Reakce, elektrony jsou přenášeny z jednoho druhu na druhý. Pokud je reakce spontánní, uvolňuje se energie, kterou lze následně využít k užitečné práci. Aby bylo možné využít tuto energii, musí být reakce rozdělena na dvě samostatné poloviny reakce: oxidační a redukční reakce. Reakce jsou umístěny ve dvou různých nádobách a drát se používá k pohánění elektronů z jedné strany na druhou.
Příklady řešení problémů
Když dojde k redoxní reakci, elektrony se přenášejí z jednoho druhu na druhý. Pokud je reakce spontánní, uvolňuje se energie, kterou lze využít k práci. Při této reakci se měděná elektroda umístí do roztoku obsahujícího ionty stříbra.
Zapišme si práci takového koncentračního galvanického článku.
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -2) \u003d -0,25 + (0,058 / 2) (-2) \u003d -0,308 V
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -1) \u003d -0,25 + (0,058 / 2) (-1) \u003d -0,28 V
EMF = -0,28 - (-0,308) = 0,028 V
Procesy na elektrodách:
A: Ni 0 - 2e - \u003d Ni 2+
K: Ni 2+ + 2e - \u003d Ni 0
KONTROLNÍ ÚKOLY
48. Vypočítejte EMP galvanického článku kadmium - stříbro, je-li koncentrace iontů stříbra v roztoku 0,1 mol/l a iontů kadmia 0,001 mol/l. Napište rovnice pro reakce probíhající na elektrodách.
Tato reakce uvolňuje energii. Když je však pevná měděná elektroda umístěna přímo do roztoku dusičnanu stříbrného, energie se ztrácí jako teplo a nelze ji použít pro práci. Abychom tuto energii využili a využili její užitečnou práci, musíme reakci rozdělit na dvě samostatné poloviny reakcí; Oxidační a redukční reakce. Drát spojuje obě reakce a umožňuje elektronům proudit z jedné strany na druhou.
Voltový článek je elektrochemický článek, který využívá spontánní redoxní reakce k výrobě elektřiny. Skládá se ze dvou samostatných poloprvků. Dva půlčlánky jsou navzájem spojeny drátem probíhajícím od jedné elektrody ke druhé. Solný můstek se také připojuje k polovičním článkům.
49. Vytvořte schéma dvou galvanických článků, z nichž jeden je katodou a druhým anodou. Napište rovnice reakcí probíhajících při provozu těchto prvků.
50. Počítejte EMF galvanické prvek složený ze železných a olověných plátů ponořených do 0,1M roztoků jejich solí. Napište reakční rovnice.
Funkce těchto částí jsou popsány níže. Elektroda je pás kovu, na kterém probíhá reakce. V napěťovém článku dochází k oxidaci a redukci kovů na elektrodách. Voltový článek má dvě elektrody, jednu v každém půlčlánku. Katoda je místo, kde dochází k redukci a oxidaci na anodě.
Prostřednictvím elektrochemie tyto reakce interagují s kovovými povrchy nebo elektrodami. Je ustavena rovnováha redukce oxidů mezi kovem a látkami v roztoku. Když jsou elektrody ponořeny do roztoku obsahujícího ionty stejného kovu, nazývá se to poloviční článek. Elektrolyty jsou ionty v roztoku, obvykle kapalině, které vedou elektřinu iontovým vedením. Mezi atomy kovu na elektrodě a iontovými roztoky mohou nastat dvě možné interakce.
51. Vypočítejte EMF koncentračního niklového galvanického článku. Koncentrace kovových iontů v roztocích je 1 mol/l a 0,0001 mol/l. Napište procesy probíhající na anodě a katodě.
52. Jaké procesy probíhají na elektrodách měděného koncentrovaného galvanického článku, jestliže jedna z elektrod má koncentraci kovových iontů rovnou 1 mol/l a druhá 0,001 mol/l. kterým směrem se pohybují elektrony ve vnějším obvodu. Co je EMF?
Procesy na anodě
To znamená, že iontů ubývá. . Když je elektroda oxidována v roztoku, nazývá se anoda a když je elektroda redukována v roztoku. nazývá se katoda.
- Anoda: Anoda je místem oxidační reakce.
- Jinými slovy, zde kov ztrácí elektrony.
- To je místo, kde kovová elektroda přijímá elektrony.
Pokud jde o redoxní reakce, je důležité pochopit, co pro kov znamená „oxidovat“ nebo „redukovat“. Solný můstek je důležitou součástí každého voltaického článku. Účelem solného můstku je udržet roztoky elektricky neutrální a umožnit volný tok iontů z jedné buňky do druhé. Bez solného můstku by se kolem elektrod hromadily kladné a záporné náboje, což by způsobilo zastavení reakce.
53. Proveďte schéma galvanického článku sestávajícího ze Zn a Fe desek ponořených v roztocích jejich solí. Napište rovnice pro procesy probíhající na iontech železa tak, aby EMF prvku bylo nulové při koncentraci iontů zinku 0,0001 mol/l.
54. Železné a stříbrné pláty jsou spojeny vnějším vodičem a ponořeny do roztoku kyseliny sírové. Vytvořte schéma tohoto galvanického článku, napište rovnice pro reakce probíhající na deskách.
Elektrony proudí vždy z anody na katodu, nebo z poloviny oxidačního článku do poloviny redukce. Schéma článku je znázorněním elektrochemického článku. Níže uvedený obrázek ukazuje schéma článku pro napětí zobrazené na obrázku 1 výše.
Obrázek níže ukazuje schéma článku pro napětí zobrazené na obrázku 1. Při konstrukci schématu článku se řídíme následujícími konvencemi. Anoda je vždy vlevo a katoda vpravo. Fázový rozdíl prvku je znázorněn jedinou svislou čarou a změny oxidačního stavu jsou znázorněny čárkami.
55. Nakreslete schéma galvanického článku sestávajícího ze stříbrné elektrody ponořené v 1M roztoku dusičnanu stříbrného a standardní vodíkové elektrody. Napište rovnice elektrodových procesů. Jaké je EMF prvku?
56. Jakým směrem se budou pohybovat elektrony ve vnějším obvodu následujících galvanických článků
Procesy na katodě
Až budete požádáni o vykreslení diagramu buněk, postupujte podle těchto jednoduchých pokynů. Zvažte následující reakci. Krok 1: Napište dvě poloviční reakce. Krok 2: Identifikujte katodu a anodu. \\ získává elektrony, proto klesá; redukce nastává na katodě. Krok 3: vytvořte diagram buněk.
Anoda jde vždy vlevo a katoda vpravo. Nepřítomnost koncentrací ukazuje, že roztoky jsou za standardních podmínek. Údaje z voltmetru udávají napětí odezvy na článek nebo potenciální rozdíl mezi dvěma dvěma půlčlánky. Napětí článku je také známé jako elektromotorická síla a zobrazuje se jako \\.
a) Mg | Mg2+ | | Pb 2+ | Pb
b) Pb | Pb 2+ | | Cu 2+ | Cu
c) Cu | Cu 2+ | | Ag 2+ | Ag
pokud jsou všechny roztoky elektrolytů unimolární? Který kov se v každém z těchto případů rozpustí.
57. Vytvořte schéma galvanického článku na základě reakce probíhající podle rovnice:
Ni + Pb (NO 3) 2 \u003d Ni (NO 3) 2 + Pb.
Napište elektronické rovnice anodových a katodových procesů, vypočítejte EMF tohoto prvku za standardních podmínek.
Tyto hodnoty se nazývají standardní redukční potenciály. Každá poloviční reakce má jiný redukční potenciál, rozdíl mezi oběma redukčními potenciály udává napětí elektrochemického článku. Zvažte následující dvě reakce. Rozdělte reakci na poloviční reakce a určete jejich standardní redukční potenciály.
- Určete, jaká bude anoda a katoda.
- Nakreslete buněčný diagram pro následující reakce.
- Definujte \\ pro voltaický článek vzniklý každou reakcí.
- Henral Chemistry: Principles and Modernity Applications 9th ed.
58. EMP galvanického článku tvořeného měděnou deskou ponořenou do roztoku jeho soli s koncentrací iontů mědi rovnou 0,001 mol/l a chrómu ponořeného do roztoku jeho soli je 1,05 V. Určete koncentraci iontů chrómu v roztoku jeho soli. Vytvořte schéma galvanického článku a napište elektronické rovnice elektrodových procesů.
Proto elektrony spontánně proudí ze zinkových iontů na měď a vytvářejí ionty zinku a kovová měď. Stejně jako voda samovolně teče z kopce, což lze uvést do činnosti nucením na vodní kolo, lze k práci využít i tok elektronů z vyšší potenciální energie do nižší.
Protože se potenciální energie valenčních elektronů u jednotlivých látek značně liší, závisí napětí galvanického článku částečně na identitě reagujících látek. Naměřený potenciál buňky také silně závisí na koncentracích reaktantů a teplotě systému. Abychom mohli vyvinout škálu relativních potenciálů, která nám umožní předpovědět směr elektrochemické reakce a velikost hnací síly reakce, musí být měřeny potenciály pro oxidaci a redukci různých látek za srovnatelných podmínek.
59. Vytvořte schéma, zapište rovnice elektrodových procesů a vypočítejte EMF galvanického článku sestávajícího z kadmiových a hořčíkových desek ponořených v roztocích jejich solí s koncentrací kovových iontů rovnou 1 mol/l. změní se EMF tohoto galvanického článku, pokud se koncentrace každého z iontů sníží na 0,01 mol/l.
Měření standardních elektrodových potenciálů
Naměřené redoxní potenciály závisí na potenciální energii valenčních elektronů, koncentracích látek v reakci a teplotě systému. Je fyzicky nemožné změřit potenciál jedné elektrody: lze měřit pouze potenciálový rozdíl dvou elektrod. To umožňuje měřit rozdíl potenciálů mezi dvěma odlišnými elektrodami. Ve skutečnosti je to přesně potenciál naměřený za standardních podmínek, pokud je článek konstruován s následujícím rozložením článku. Standardní buněčný potenciál je tedy rozdílem mezi uvedenými redukčními potenciály dvou polovičních reakcí, nikoli jejich součtem.
60. EMP galvanického článku sestávajícího ze standardní vodíkové elektrody a olověné elektrody ponořené do 1M roztoku olovnaté soli je 126 mV. Když je prvek uzavřen, elektrony ve vnějším obvodu se pohybují od přívodu k vodíkové elektrodě. Jaký je potenciál olověné elektrody. Nakreslete schéma galvanického článku a zapište procesy probíhající na elektrodách.
61. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení olověného akumulátoru.
62. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení kadmium-niklové baterie.
63. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení železo-niklové baterie.
64. Vytvořte schéma dvou galvanických článků, z nichž jeden by byl anodou a ve druhém katodou. Napište pro každý z těchto prvků elektronické rovnice reakcí probíhajících na elektrodách.
65. Nakreslete schéma galvanického článku sestávajícího z hliníková elektroda, ponořený do 1M roztoku dusičnanu hlinitého a standardní vodíkové elektrody. Napište rovnice elektrodových procesů a vypočítejte EMF galvanického článku.
66. Jakým směrem se budou pohybovat elektrony ve vnějším obvodu hliníkovo-zinkového galvanického článku. Koncentrace iontů v roztocích jsou 0,1 mol/l. Vytvořte schéma galvanického článku, napište rovnice pro procesy probíhající na elektrodách, vypočítejte EMF.
67. Ve stříbrno-zinkovém prvku používaném k napájení různých zařízení dochází k reakci
ELEKTROLÝZA
elektrolýzou nazývá se soubor procesů, ke kterým dochází, když stejnosměrný elektrický proud prochází systémem sestávajícím ze dvou elektrod a taveniny nebo roztoku elektrolytu. Během elektrolýzy se kladně nabité ionty pohybují ke katodě, která je připojena k zápornému pólu externího stejnosměrného zdroje, a záporně nabité ionty k anodě, která je připojena ke kladnému pólu stejnosměrného zdroje. Na povrchu katody probíhá proces redukce, na anodě - oxidace.
Uvažujme elektrolýzu taveniny chloridu sodného.
Když jsou dvě grafitové elektrody připojené ke zdroji proudu ponořeny do taveniny skládající se z iontů Na + a Cl -, začne v elektrolytu řízený pohyb iontů a na elektrodách proběhnou redoxní procesy.
Schéma elektrolýzy sodíkové taveniny:
NaCl \u003d Na + + Cl -
Katodová (-) (+) anoda
Na + + e- = Na02Cl - - 2e - = Cl2
Celková reakční rovnice:
2Na + + 2Cl - elektrolýza 2 Na + Cl 2
2NaCl elektrolýza 2Na + Cl 2
V elektrolýza vodných roztoků elektrolytů molekuly polární vody jsou přitahovány ke katodě i anodě a mohou se také účastnit procesů na elektrodách.
Procesy na katodě
Pořadí redukce iontů na katodě během elektrolýzy roztoků závisí na hodnotách standardních elektrodových potenciálů. Čím větší je hodnota elektrodového potenciálu prvku, tím snazší je jeho obnovení.
Jako první se na katodě redukují ionty těch kovů, jejichž potenciál je nejpozitivnější. Například roztok s ionty Ag + a H +. Ag se obnoví jako první:
Ag + + e - = Ag 0 e 0 = +0,8 B
Vodík se nezískává, protože jeho potenciál je menší.
Potenciály kovů a vodíku závisí na jejich koncentraci v elektrolytu. Proto není vždy možné usuzovat na snížení H+ iontů z hodnot standardního potenciálu. V neutrálním roztoku je koncentrace vodíkových iontů 10 -7 mol/l. a podle Nernstova vzorce:
V důsledku toho se vodík může uvolňovat z neutrálních roztoků pouze při potenciálu menším než -0,41 V a kovy na katodě se uvolní pouze ty, jejichž potenciál je kladnější než potenciál -0,41 V.
V praxi se z roztoků vodíku uvolňuje mnoho kovů (Zn, Fe, Cr aj.), jejichž hodnota elektrodových potenciálů je menší než –0,41V.
To je způsobeno vodíkovým přepětím, tzn. Na povrchu většiny kovů se vodík uvolňuje s obtížemi. Velikost vodíkového přepětí závisí na vlastnostech kovu, hustotě proudu a teplotě elektrolytu. přepětí– to je potenciální rozdíl mezi praktickým potenciálem vývoje vodíku a teoretickým potenciálem.
Příklad.
Potenciál uvolňování zinku v neutrálním elektrolytu –0,76V, vodíku –0,41V. vodíkové přepětí na zinku je asi –0,72V. Vodík se tedy na zinek bude uvolňovat pouze při potenciálu –0,41+(-0,72)=-1,13V. Pokud porovnáme potenciál výboje zinku (-0,76 V) s potenciálem výboje vodíku na zinku (-1,13 V), je jasné, že se zinek uvolní. Ve skutečnosti je to pravda, při elektrolýze neutrálního roztoku zinečnaté soli se uvolňuje zinek a malé množství vodíku.
Při zobecněném procesu na katodě se v závislosti na umístění kovu v sérii standardních elektrodových potenciálů rozlišují tři případy:
1) kovové ionty, jejichž elektrodový potenciál je menší než –1,18 V (od Li do Mn). Vodíkové ionty jsou obnoveny:
2 H + + 2e - \u003d H 2 PH< 7
2 H20 + 2e - \u003d H2 + 2OH - PH>= 7
2) kovové ionty, jejichž elektrodový potenciál je od –1,18 V do 0,00 V (od Mn do H). V tomto případě jsou současně redukovány ionty kovů i vodíkové ionty:
Me n+ + ne - = Me 0
2H++ 2e- = H2PH<7
2H20 + 2e- = H2 + 2OH - PH>=7
3) kovové ionty, jejichž elektrodový potenciál je větší než 0,0 V (od H do Au). V tomto případě se redukují pouze kovové ionty
Me n+ + ne - = Me 0
Procesy na anodě
Pro elektrolýzu se používají rozpustné (aktivní) a nerozpustné (inertní) anody. Při elektrolýze se rozpustné anody rozpouštějí a kovové ionty - anoda přecházejí do roztoku. Rozpustné anody jsou obvykle vyrobeny z kovu, jehož sůl je podrobena elektrolýze.
Nerozpustné anody se neúčastní redoxních reakcí. Obvykle se jedná o anody vyrobené z grafitu, zlata, platiny. Anionty s více negativními potenciály jsou na jejich povrchu oxidovány. Jedná se o ionty, které neobsahují kyslík, např. J - , Br - , Cl - , S 2- a další (kromě F -)
Pokud roztok obsahuje ionty Cl-, Br-, budou ionty Br- oxidovány na inertní anodě.
2Br-2e- = Br2
2H 2 0 - 4e - \u003d O 2 + 4H + (PH<=7)
4OH - 4e - \u003d 2H20 + O2 (PH> 7)
Uvažujme několik případů elektrolýzy vodných roztoků.
Příklad.
Schéma elektrolýzy vodného roztoku chloridu měďnatého s inertní anodou CuCl 2 \u003d Cu 2+ + 2Cl -
H2O \u003d H + \u003d OH -
Katoda (-) Cu 2+ H + (H 2 O) Cl -, OH - (H 2 O) (+) anoda
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
Měď má potenciál větší než 0, takže kov je redukován na katodě a zbytek kyseliny bez kyslíku je oxidován na anodě.
Příklad.
Schéma elektrolýzy roztoku síranu draselného s inertní anodou. K2SO4 \u003d 2K + + SO4 2
H2O \u003d H + + OH -
Katoda (-) 2K +, H + (H 2 O) SO 4 2-, OH (H 2 O) (+) anoda
2H20 + 2e - \u003d H2 + 2OH - 2H20 - 4e - \u003d O2 + 4H +
K + + OH - \u003d KOH 2H + + SO 4 2- \u003d H 2 SO 4
Protože draslík v sérii standardních elektrodových potenciálů je mnohem dříve než vodík, vodík se na katodě redukuje a ionty OH se akumulují -
Na anodě dojde k oxidaci molekul vody a akumulaci iontů H+. V katodovém prostoru tedy bude sekundárním produktem zásada a v anodovém prostoru kyselina.
Příklad.
Elektrolýza vodného roztoku síranu nikelnatého s aktivní anodou. Ni SO 4 \u003d Ni 2+ \u003d SO 4 2-
H 2 O H + + OH -
Katoda (-) Ni 2+, H + (H 2 O) SO 4 2-, OH - (H 2 O) (+) anoda
Ni2+ +2e- = NioNi-2e- = Ni2+
e 0 Ni \u003d -0,25 V je větší než potenciál pro redukci vodíkových iontů z vody (-0,41 V), proto je kov redukován a anoda-kov je oxidován na anodě, protože potenciál niklu je mnohem menší než oxidační potenciál vody (+1,23V).
Zákony elektrolýzy
Hmotnost elektrolytu podrobeného chemické přeměně, stejně jako hmotnosti látek uvolněných na elektrodách podle Faradayových zákonů, jsou přímo úměrné množství elektřiny prošlé elektrolytem a molárním hmotnostem ekvivalentů látek:
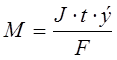 , kde
, kde
m je hmotnost elektrolytu podrobeného elektrolýze nebo hmotnost látek uvolněných na elektrodách, g;
J - síla proudu, A;
e-molární hmotnost látkových ekvivalentů, g/mol;
F-číslo Faradaye - 96500 C;
t je doba elektrolýzy, s;
KONTROLNÍ ÚKOLY
68. Vytvořte rovnice pro procesy probíhající při elektrolýze tavenin NaOH a NiCl 2 inertními elektrodami.
69. Proveďte schéma elektrolýzy vodných roztoků kyseliny sírové, chloridu měďnatého, dusičnanu olovnatého platinovými elektrodami.
70. Napište rovnice elektrodových procesů probíhajících při elektrolýze vodných roztoků chloridu barnatého a chloridu železitého uhlíkovými elektrodami.
71. Proveďte schéma elektrolýzy vodného roztoku chloridu zinečnatého, je-li a) anoda zinková; b) uhlíková anoda.
72. Jaký objem vodíku se uvolní při průchodu proudu 3 A vodným roztokem kyseliny sírové po dobu 1 hodiny.
73. Při elektrolýze vodného roztoku SnCl 2 se na anodě uvolnilo 4,48 litrů. chlór (normální podmínky). Jaká látka a v jakém množství se uvolnila na katodě.
74. V jakém pořadí se budou uvolňovat kovy při elektrolýze roztoku obsahujícího sírany niklu, stříbra a mědi ve stejné koncentraci. Napište rovnice procesů na elektrodách.
75. Udělejte diagram procesů probíhajících na měděných elektrodách při elektrolýze vodného roztoku dusičnanu draselného.
76. Nerafinovaná měď obsahuje nečistoty stříbra a zinku. Co se stane s těmito nečistotami během elektrolytické rafinace mědi. Napište rovnice procesů na elektrodách.
77. Jak dlouho bude trvat úplné rozložení 2 molů vody proudem 2A.
78. Po určitou dobu procházel roztoky kuchyňské soli a fosforečnanu sodného DC.. Změní to množství soli v obou případech. Motivujte svou odpověď sestavením elektronických rovnic procesů probíhajících na katodě a anodě.
79. Při elektrolýze roztoku síranu měďnatého se na anodě uvolnilo 0,168 litru plynu (normální podmínky), sestavte elektronické rovnice procesů a vypočítejte, kolik mědi se uvolní na katodě.
80. Sestavte elektronové rovnice procesů probíhajících při elektrolýze roztoku a taveniny KOH.
81. Jaké látky a v jakém množství se budou uvolňovat na uhlíkových elektrodách při elektrolýze roztoku NaI po dobu 2,5 hodiny při síle proudu 6A.
82. Kolik gramů kyseliny sírové vznikne v blízkosti anody při elektrolýze roztoku síranu sodného, pokud se na anodě uvolní 1,12 litru kyslíku (n.o.), vypočítejte hmotnost látky uvolněné na katodě.
83. Při elektrolýze roztoku dusičnanu stříbrného na anodě se uvolnilo 0,28 litru kyslíku. Kolik gramů stříbra vyniklo na katodě.
84. Soli hliníku, zinku a mědi jsou rozpuštěny ve vodě s koncentrací kationtů 1 mol/l. sestavte elektronické rovnice procesů na elektrodách a naznačte sled reakcí na katodě.
85. Jaké produkty lze získat elektrolýzou roztoku NaNO 3, jsou-li prostory anody a katody:
a) oddělené porézní přepážkou;
b) se neoddělují a roztok se míchá.
86. Jaké produkty se budou uvolňovat na katodě a anodě především při elektrolýze vodných roztoků grafitovými elektrodami, pokud elektrolyt obsahuje směs síranu měďnatého (II) a chloridu draselného.
87. Měděné a stříbrné desky se ponoří do vodného roztoku dusičnanu stříbrného. Ke kterému pólu zdroje proudu má být připojena měděná deska, aby byla pokryta stříbrem. Napište schéma procesu elektrolýzy.
KOROZE KOVŮ
Koroze tzv. spontánní destrukce kovu pod vlivem prostředí. Koroze je redoxní heterogenní proces probíhající na rozhraní. Podle mechanismu korozního procesu se rozlišuje chemická a elektrochemická koroze. Chemická koroze nazývaná oxidace kovu, která není doprovázena výskytem elektrického proudu v systému. Takový mechanismus je pozorován při interakci kovů s agresivními plyny při vysoká teplota(plynová koroze) a s organickými kapalinami - neelektrolyty (koroze v neelektrolytech).
elektrochemická koroze nazývané zničení kovu v prostředí elektrolytu, doprovázené výskytem elektrického proudu uvnitř systému.
Kovy používané ve strojírenství obsahují nečistoty jiných kovů, proto při kontaktu s roztokem elektrolytu vzniká na jejich povrchu velké množství nepřetržitě pracujících mikrovoltaických článků. Aktivnější kov, anoda, oxiduje za vzniku kovových kationtů nebo nerozpustných produktů, jako je rez. Uvolněné elektrony se přesunou ke katodě, kde se redukuje oxidační činidlo. Rozpuštěný kyslík a vodíkové ionty, nejdůležitější oxidační činidla způsobující korozi, se nazývají katodové depolarizátory. Jaký redukční proces bude na katodě probíhat, závisí na složení elektrolytu.
Příklad.
Když se železo a měď dostanou do kontaktu v roztoku kyseliny chlorovodíkové, vytvoří se mikrogalvanický článek:
AFe| HCl | Cu K
eo Fe/Fe2+ = -0,44B
eo Cu/Cu2+ = +0,34B
Železo - aktivnějším kovem bude anoda a měď - katoda. Reakce probíhající na anodě a katodě lze vyjádřit jako:
1 A: Fe -2e \u003d Fe 2+
1K: 2H++ 2e = H2
Shrneme-li anodické a katodické procesy, dostaneme redoxní reakci, jejíž spontánní výskyt způsobuje korozi kovu:
Fe + 2H+ = Fe2+ + H2
Fe + 2HCl \u003d FeCl2 + H2
Příklad.
S korozí uvnitř neutrální prostředí, v nepřítomnosti kyslíku rozpuštěného ve vodě dochází k depolarizaci katody vodíkem stejným způsobem jako v předchozím příkladu.
Zapišme si schéma galvanického článku a rovnice reakcí probíhajících v tomto galvanickém článku:
A Fe|H20| Cu K
1 A: Fe - 2e \u003d Fe 2+
1K: 2H20 + 2e \u003d H2 + 2OH -
Fe + 2H 2 0 \u003d Fe 2+ + H2 + 2OH -
Nebo v molekulární formě: Fe + 2H20 = Fe (OH)2 + H2
Příklad.
Při kontaktu železa s mědí ve vlhkém vzduchu vzniká galvanický článek.
AFe| H20 + O2 | Cu K
A proces koroze je vyjádřen následujícími rovnicemi:
A: Fe - 2e = Fe 2+
K: O2 + 2H20 + 4e \u003d 4OH -
2Fe + O 2 + 2H 2 O \u003d 2Fe (OH) 2
Vlivem vzdušného kyslíku se hydroxid železitý (2) dále oxiduje podle rovnice
4Fe(OH)2 + O2 + 2H20 = 4Fe(OH)3
Jak je vidět z příkladu, v tomto případě dochází k depolarizaci katody kyslíkem.
Možnost spontánního redoxního procesu se vypočítává z EMF
EMF = e redukční činidlo - e oxidační činidlo
Pokud je EMF procesu větší než nula, pak je proces možný.
LAB #9
Stanovení elektrodových potenciálů kovů a EMFgalvanické prvky.
jáSekce teoretický kurz pro opakování.
Vznik potenciálního skoku na rozhraní kov - voda, kov - roztok soli kovu. Standardní vodíková elektroda. Pojem galvanické články a procesy probíhající na elektrodách. Standardní elektrodové potenciály kovů. Řada standardních elektrodových potenciálů. Závěry z postavení kovu v řadě. Nernstova rovnice. Reverzibilní a nevratné elektrody. Kovové elektrody Druh I a II, redoxní elektrody, plynové elektrody. Referenční elektrody. Chemické a koncentrační galvanické prvky. Elektromotorická síla (EMF) galvanických článků. Procesy probíhající na elektrodách při provozu galvanického článku.
3. Otázky a cvičení.
1. Jaký potenciál má stříbrná elektroda ponořená do roztoku stříbrné soli o koncentraci
Cm = 10-2 mol/l?
2. Jak závisí hodnota potenciálu vodíkové elektrody na pH prostředí? Jaký je potenciál vodíkové elektrody při pH = I; pH = 7, pH = 10?
3. Vypočítejte potenciál standardní stříbrné elektrody s ohledem na:
a) nasycená kalomelová elektroda,
b) nasycená měď-síranová elektroda,
c) nasycená elektroda chloridu stříbrného?
4. Vytvořte schémata galvanických článků, ve kterých probíhají reakce:
a) 2Ag+ + Cu 0 → Ag 0 + Cu+2
b)CD 0 + CuSO4 → CdSO4 + Cu
5. Určete hodnotu EMF a označte procesy probíhající na elektrodách v následujících galvanických článcích:
A)Zn / ZnSO4 //CDSO4/Cd
b)Rb/ Rb(NEh)2) //AgNO3/Ag
6. Vypočítejte EMF následující koncentrace galvanického článku:
A)Zn/ ZnCI2 // ZnCI2 / Zn
0,01 mol/l 1,0 mol/l
Která elektroda je anoda a která katoda?
3. experimentální část
1. Stanovení hodnoty standardního elektrodového potenciálu zinku.
Sestavte zinkovou elektrodu (Zn/ ZnSO4 ) , ponořením dobře obroušené zinkové tyčinky do solného roztoku s koncentrací iontů zinku 1 mol/l.
Rýže.já. Schéma instalace pro stanovení hodnoty elektrodového potenciálu kovu.
1 - zkoumaná elektroda (zinek, měď atd.)
2 - referenční elektroda chloridu stříbrného
3 - potenciometr.
4 - sklenice nasyceného roztoku chloridu draselného
Podle obr. 1 sestavte galvanický článek ze zkoumané zinkové elektrody (Zn/ ZnSO4 ) a referenční elektrodu nasyceného chloridu stříbrného (KCl/ AgCl/ Ag) :
Podmíněný zápis tohoto galvanického článku:
(-) Zn/ZnS04//KCl/AgCl/Ag(+)
K tomu se výlevky elektrod ponoří do sklenice s roztokem chloridu draselného a samotné elektrody se připojí propojovacími vodiči k odpovídajícím svorkám potenciometru.
Potenciál nasycené referenční elektrody chloridu stříbrného vzhledem ke standardní vodíkové elektrodě je +0,201 V.
Exl. ser. nás.= +0,201V popř 201 mV.
V souladu s pokyny k postupu měření pomocí vhodného potenciometru určete EMF složeného galvanického článku a potenciál zinkové elektrody pomocí nasycené elektrody chloridu stříbrného.
Při znalosti hodnoty potenciálu referenční elektrody vypočítejte hodnotu potenciálu zinkové elektrody vzhledem ke standardní vodíkové elektrodě. Porovnejte výslednou hodnotu s hodnotou v tabulce:
E0 = - 0,76 B.
Zapište nalezené hodnoty:
Naměřená hodnota E.D.S. galvanický článek, složený ze standardní zinkové elektrody a referenční elektrody nasyceného chloridu stříbrného:
E.D.S. (Zn/ ZnSO4 // KCl/ AgCl/ Ag) =
Experimentální hodnota potenciálu standardní zinkové elektrody ve vztahu k referenční elektrodě nasyceného chloridu stříbrného:
E ( ) nasycením chlor - stříbro .. =
Experimentální hodnota potenciálu standardní zinkové elektrody ve vztahu ke standardní vodíkové referenční elektrodě:
E ( ) podle standardního vodíku. =
Pozornost! Vzhledem k vysoké toxicitě solí těžkých kovů nejsou všechny použité roztoky vypouštěny do dřezu, ale jsou předány laborantovi k následné likvidaci.
2. Stanovení hodnoty standardního elektrodového potenciálu mědi.
Stejně jako v kroku I sestavte měděnou elektrodu ponořením odizolované měděné tyče do roztoku IM síranu měďnatého.
Sestavte galvanický článek ze zkoumané měděné elektrody a referenční elektrody nasyceného chloridu stříbrného.
Určete EMF galvanického článku. Uveďte podmíněný zápis pro tento galvanický článek.
Jaký je potenciál měděné elektrody na nasycené elektrodě chloridu stříbrného?
Vypočítejte potenciál měděné elektrody vzhledem ke standardní vodíkové elektrodě a porovnejte jej s tabulkovou hodnotou potenciálu standardní měděné elektrody:
E0 = 0,34 B
Zapište nalezené hodnoty:
E.D.S. (Su/ CuSO4 // KCl/ AgCl/ Ag) =
E() nasycením chlor - stříbro .. =
E() standardní vodíkovou elektrodou =
3. Definice EMF chemikálie galvanický prvek. (Měď-zinkový galvanický prvek).
Sestavte galvanický článek ze standardních zinkových a standardních měděných elektrod (obr. 2).
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Porovnejte hodnotu získanou v experimentu s vypočítanou (teoretickou) Hodnota EMF pro měděno-zinkový galvanický článek:
Teorie EMF. =E katoda–E anoda =
= E0(Cu+2/Cu0) - E0(Zn+2/Zn0) = 0,34 –(- 0,76) = 1,1 B.
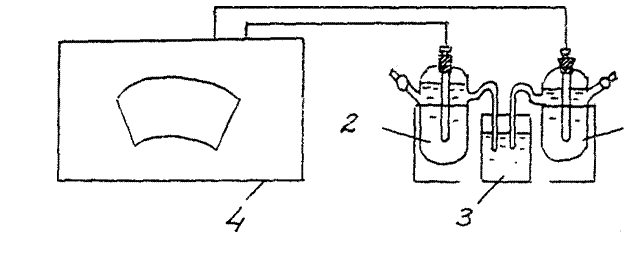 Obr. 2 Schéma zařízení pro stanovení EMF chemického galvanického článku: Obr.
Obr. 2 Schéma zařízení pro stanovení EMF chemického galvanického článku: Obr.
1 - měděná elektroda, 2 - zinková elektroda
3 - elektrolytický klíč (sklenice s roztokem chloridu draselného),
4 - potenciometr
Napište rovnice pro procesy probíhající na katodě a anodě daného galvanického článku při jeho provozu.
4. Stanovení EMF koncentračního galvanického článku.
Sestavte galvanický článek složený ze standardní zinkové elektrody (zinková elektroda ponořená v roztoku zinkové soli o koncentraci 1 mol/l) a zinkové elektrody ponořené v roztoku zinkové soli o koncentraci C = 10-2 mol/l (obr. 3).
Zn/ ZnSO4 // Zn/ ZnSO4
Cm = 10-2 mol/l Cm = 10-2 mol/l
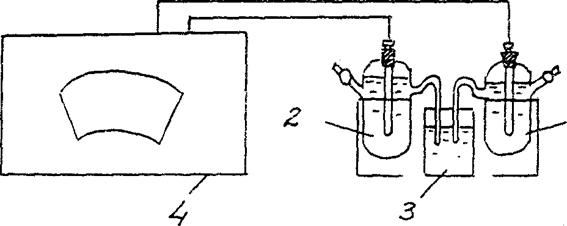
Obr.2 Schéma instalace pro stanovení EMF koncentračního galvanického článku:
1 - zinková elektroda v solném roztoku s Cm = 10-2 mol/l ,
2 - zinková elektroda v solném roztoku s Cm = 1 mol/l
3 - elektrolytický klíč (roztok chloridu draselného),
4 - potenciometr
V souladu s pokynem o pořadí měření pomocí příslušného potenciometru určete EMF tohoto galvanického článku.
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Porovnejte hodnotu získanou v experimentu s vypočítanou (teoretickou) hodnotou EMF pro danou koncentraci galvanického článku.




