Fenol vzniká vzájemným působením. Získání fenolu
1. Fenoly- deriváty aromatických uhlovodíků, v jejichž molekulách je hydroxylová skupina (-OH) přímo vázána na atomy uhlíku v benzenovém kruhu.
2. Klasifikace fenolů
V závislosti na počtu OH skupin v molekule existují jedno-, dvou-, tříatomové fenoly:
Podle počtu kondenzovaných aromatických cyklů v molekule se rozlišují samotné fenoly (jeden aromatický kruh - deriváty benzenu), naftoly (2 kondenzované kruhy - deriváty naftalenu), anthranoly (3 kondenzované kruhy - deriváty anthracenu) a fenantroly:
3. Izomerie a nomenklatura fenolů
Existují 2 typy izomerie:
- izomerie polohy substituentů v benzenovém kruhu
- izomerie postranního řetězce (struktura alkylového radikálu a počet radikálů)
Pro fenoly se hojně používají triviální názvy, které se vyvíjely historicky. Předpony se také používají v názvech substituovaných mononukleárních fenolů orto-,meta- a pár -, používá se v nomenklatuře aromatických sloučenin. U složitějších sloučenin jsou atomy, které tvoří aromatické kruhy, očíslovány a poloha substituentů je označena pomocí digitálních indexů.
4. Struktura molekuly
Fenylová skupina C 6 H 5 - a hydroxyl -OH se vzájemně ovlivňují
- osamocený elektronový pár atomu kyslíku je přitahován 6-elektronovým oblakem benzenového kruhu, díky čemuž je vazba O–H ještě více polarizovaná. Fenol je silnější kyselina než voda a alkoholy.
- V benzenovém kruhu je narušena symetrie elektronového mraku, hustota elektronů se zvyšuje v polohách 2, 4, 6. Díky tomu jsou vazby C-H v polohách 2, 4, 6 reaktivnější a - vazby benzenového kruhu.
5. Fyzikální vlastnosti
Většina jednoatomových fenolů jsou za normálních podmínek bezbarvé krystalické látky s nízkým bodem tání a charakteristickým zápachem. Fenoly jsou špatně rozpustné ve vodě, snadno rozpustné v organických rozpouštědlech, toxické a při skladování na vzduchu v důsledku oxidace postupně tmavnou.
Fenol C6H5OH (kyselina karbolová ) - bezbarvá krystalická látka na vzduchu oxiduje a zrůžoví, za běžných teplot je ve vodě málo rozpustná, nad 66 °C je mísitelná s vodou v jakémkoli poměru. Fenol je toxická látka, způsobuje popáleniny kůže, je antiseptikum.
6. Toxické vlastnosti
Fenol je jedovatý. Způsobuje dysfunkci nervového systému. Prach, páry a roztok fenolu dráždí sliznice očí, dýchací cesty a kůži. Jakmile se fenol dostane do těla, velmi rychle se vstřebává i neporušenou pokožkou a po několika minutách začne působit na mozkovou tkáň. Nejprve dochází ke krátkodobé excitaci a poté k paralýze dýchacího centra. I při vystavení minimálním dávkám fenolu je pozorováno kýchání, kašel, bolest hlavy, závratě, bledost, nevolnost a ztráta síly. Těžké otravy jsou charakterizovány bezvědomím, cyanózou, dušností, necitlivostí rohovky, rychlým, sotva znatelným tepem, studeným potem, často křečemi. Často je příčinou rakoviny fenol.
7. Aplikace fenolů
1. Výroba syntetických pryskyřic, plastů, polyamidů
2. Léky
3. Barviva
4. Povrchově aktivní látky
5. Antioxidanty
6. Antiseptika
7. Výbušniny
8. Získání fenolu v průmysl
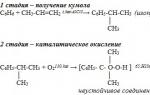
jeden). Kumenová metoda výroby fenolu (SSSR, Sergeev P.G., Udris R.Yu., Kruzhalov B.D., 1949). Výhody metody: bezodpadová technologie (výtěžnost užitných produktů > 99 %) a hospodárnost. V současné době je kumenová metoda používána jako hlavní ve světové výrobě fenolu.

2). Z černouhelného dehtu (jako vedlejší produkt – nízký výtěžek):
C 6H 5 ONa + H 2 SO 4 (razb) → C 6H 5 - OH + NaHS04
fenolát sodný
(obrázek produktupryskyřicové botylouh sodný)
3). Z halogenbenzenů :
Od 6 H5-Cl + NaOH t , p→ C 6H 5 - OH + NaCl
4). Fúze solí aromatických sulfonových kyselin s pevnými alkáliemi :
C6H5-SO3Na + NaOH t → Na2S03 + C6H5-OH
sodná sůl
benzensulfonové kyseliny
9. Chemické vlastnosti fenolu (kyseliny karbolové)
já . Vlastnosti hydroxylové skupiny
Vlastnosti kyselin- jsou výraznější než u nasycených alkoholů (barva indikátorů se nemění):
- s aktivními kovy-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
fenolát sodný
- S alkáliemi-
C6H5-OH + NaOH (vodný roztok)↔ C6H5-ONa + H20
! Fenoláty – soli slabé kyseliny karbolové, rozkládající se kyselinou uhličitou –
C6H5-ONa + H20+S02 -> C6H5-OH + NaHC03
Pokud jde o kyselé vlastnosti, fenol je 10krát lepší než ethanol. Zároveň je o stejné množství nižší než kyselina octová. Na rozdíl od karboxylových kyselin nemůže fenol ze svých solí vytěsnit kyselinu uhličitou.
C 6 H 5 - Ach + NaHCO 3 = reakce neprobíhá - protože je dokonale rozpustný ve vodných roztocích alkálií, ve skutečnosti se nerozpouští ve vodném roztoku hydrogenuhličitanu sodného.
Kyselé vlastnosti fenolu se zvyšují vlivem skupin přitahujících elektrony spojených s benzenovým kruhem ( NE 2 - , Br - )
2,4,6-trinitrofenol nebo kyselina pikrová je silnější než uhličitá
II . Vlastnosti benzenového kruhu
1). Vzájemné ovlivňování atomů v molekule fenolu se projevuje nejen v chování hydroxyskupiny (viz výše), ale i ve větší reaktivitě benzenového kruhu. Hydroxylová skupina zvyšuje elektronovou hustotu v benzenovém kruhu, zejména v orto- a pár- ustanovení (+ M-účinek OH-skupiny):
Proto je fenol mnohem aktivnější než benzen v elektrofilních substitučních reakcích v aromatickém kruhu.
- Nitrace. Působením 20% kyseliny dusičné HNO 3 se fenol snadno přemění na směs orto- a pár- nitrofenoly:
Při použití koncentrované HNO 3 vzniká 2,4,6-trinitrofenol ( kyselina pikrová):
- Halogenace. Fenol snadno interaguje s bromovou vodou při pokojové teplotě za vzniku bílé sraženiny 2,4,6-tribromfenolu (kvalitativní reakce pro fenol):
- Kondenzace s aldehydy. Například:
2). Hydrogenace fenolu
C6H5-OH + 3H 2 Ni, 170ºC→ C6Hn-OH cyklohexylalkohol (cyklohexanol)
fenoly - organické látky, jejichž molekuly obsahují fenylový radikál spojený s jednou nebo více hydroxoskupinami. Stejně jako alkoholy fenoly klasifikovat atomicitou, tzn. počtem hydroxylových skupin.
Monatomické fenoly obsahují jednu hydroxylovou skupinu v molekule:

Vícesytné fenoly obsahují více než jednu hydroxylovou skupinu v molekulách:

Existují také vícesytné fenoly obsahující tři nebo více hydroxylových skupin v benzenovém kruhu.
Pojďme se podrobněji seznámit se strukturou a vlastnostmi nejjednoduššího zástupce této třídy - fenolu C 6 H 5 OH. Název této látky tvořil základ pro název celé pokladny – fenoly.
Fyzikální vlastnosti fenolu
Fenol je tuhá, bezbarvá krystalická látka, bod tání=43°C, bod varu=181°C, s ostrým charakteristickým zápachem.Jedovatý.Fenol se při pokojové teplotě mírně rozpouští ve vodě. Vodný roztok fenolu se nazývá kyselina karbolová. Při kontaktu s pokožkou způsobuje popáleniny, proto je třeba s fenolem zacházet velmi opatrně!
Chemické vlastnosti fenolu
 Fenoly jsou aktivnější ve většině reakcí O–H vazeb, protože tato vazba je polárnější v důsledku posunu elektronové hustoty z atomu kyslíku směrem k benzenovému kruhu (účast osamělého elektronového páru atomu kyslíku v p-konjugaci Systém). Kyselost fenolů je mnohem vyšší než u alkoholů. Pro fenoly nejsou reakce přerušení vazby C-O typické, protože atom kyslíku je pevně vázán k atomu uhlíku benzenového kruhu díky účasti jeho osamoceného elektronového páru v konjugačním systému. Vzájemné ovlivňování atomů v molekule fenolu se projevuje nejen v chování hydroxyskupiny, ale i ve větší reaktivitě benzenového kruhu. Hydroxylová skupina zvyšuje elektronovou hustotu v benzenovém kruhu, zejména v ortho a para polohách (OH skupiny)
Fenoly jsou aktivnější ve většině reakcí O–H vazeb, protože tato vazba je polárnější v důsledku posunu elektronové hustoty z atomu kyslíku směrem k benzenovému kruhu (účast osamělého elektronového páru atomu kyslíku v p-konjugaci Systém). Kyselost fenolů je mnohem vyšší než u alkoholů. Pro fenoly nejsou reakce přerušení vazby C-O typické, protože atom kyslíku je pevně vázán k atomu uhlíku benzenového kruhu díky účasti jeho osamoceného elektronového páru v konjugačním systému. Vzájemné ovlivňování atomů v molekule fenolu se projevuje nejen v chování hydroxyskupiny, ale i ve větší reaktivitě benzenového kruhu. Hydroxylová skupina zvyšuje elektronovou hustotu v benzenovém kruhu, zejména v ortho a para polohách (OH skupiny)
Kyselé vlastnosti fenolu
Atom vodíku hydroxylové skupiny je kyselý. Protože Vzhledem k tomu, že kyselé vlastnosti fenolu jsou výraznější než vlastnosti vody a alkoholů, reaguje fenol nejen s alkalickými kovy, ale také s alkáliemi za vzniku fenolátů:

Kyselost fenolů závisí na povaze substituentů (donor nebo akceptor elektronové hustoty), poloze vzhledem k OH skupině a počtu substituentů. Největší vliv na OH-kyselost fenolů mají skupiny umístěné v orto- a para-poloze. Donory zvyšují sílu vazby O-H (a tím snižují pohyblivost vodíku a kyselé vlastnosti), akceptory snižují sílu vazby O-H, zatímco kyselost se zvyšuje:

Kyselé vlastnosti fenolu jsou však méně výrazné než vlastnosti anorganických a karboxylových kyselin. Takže například kyselé vlastnosti fenolu jsou asi 3000krát menší než vlastnosti kyseliny uhličité. Proto lze průchodem oxidu uhličitého vodným roztokem fenolátu sodného izolovat volný fenol.

Přidání kyseliny chlorovodíkové nebo sírové do vodného roztoku fenolátu sodného také vede k tvorbě fenolu:

Kvalitativní reakce na fenol
Fenol reaguje s chloridem železitým za vzniku intenzivně purpurové komplexní sloučeniny. Tato reakce umožňuje jeho detekci i ve velmi omezeném množství. Jiné fenoly obsahující jednu nebo více hydroxylových skupin v benzenovém kruhu také dávají jasně modrofialovou barvu v reakce s chloridem železitým.
Reakce benzenového kruhu fenolu
Přítomnost hydroxylového substituentu značně usnadňuje průběh elektrofilních substitučních reakcí v benzenovém kruhu.
- Bromace fenolu. Na rozdíl od benzenu bromace fenolu nevyžaduje přidání katalyzátoru (bromid železitý). Navíc interakce s fenolem probíhá selektivně (selektivně): atomy bromu jsou posílány do orto- a pár- pozice, nahrazující atomy vodíku tam umístěné. Selektivita substituce je vysvětlena výše uvedenými vlastnostmi elektronové struktury molekuly fenolu.
Takže když fenol interaguje s bromovou vodou, vytvoří se bílá sraženina 2,4,6-tribromfenolu:

Tato reakce, stejně jako reakce s chloridem železitým, slouží k tomu kvalitativní detekce fenolu.
2.Nitrace fenolu se také vyskytuje snadněji než nitrace benzenu. Reakce se zředěnou kyselinou dusičnou probíhá při teplotě místnosti. Výsledkem je směs orto- a paro izomery nitrofenolu:

Při použití koncentrované kyseliny dusičné, 2,4,6, trinitritfenol-kyselina pikrová, vzniká výbušnina:

3. Hydrogenace aromatického kruhu fenolu v přítomnosti katalyzátoru snadno prochází:

4.Polykondenzace fenolu s aldehydy, zejména u formaldehydu dochází ke vzniku reakčních produktů - fenolformaldehydových pryskyřic a pevných polymerů.
Interakce fenolu s formaldehydem může být popsána schématem:

„Pohyblivé“ atomy vodíku jsou zachovány v molekule dimeru, což znamená, že reakce může pokračovat dále s dostatečným množstvím činidel:

Reakce polykondenzace, ty. reakce výroby polymeru, probíhající s uvolňováním nízkomolekulárního vedlejšího produktu (vody), může pokračovat dále (dokud není jedno z činidel zcela spotřebováno) za vzniku obrovských makromolekul. Proces lze popsat celkovou rovnicí:

K tvorbě lineárních molekul dochází při běžné teplotě. Provedení stejné reakce při zahřívání vede k tomu, že výsledný produkt má rozvětvenou strukturu, je pevný a ve vodě nerozpustný.V důsledku zahřívání lineární fenolformaldehydové pryskyřice s přebytkem aldehydu vznikají pevné plastické hmoty s jedinečným vlastnosti jsou získány. Polymery na bázi fenolformaldehydových pryskyřic se používají k výrobě laků a barev, plastových výrobků, které jsou odolné vůči zahřívání, chlazení, vodě, zásadám, kyselinám.Mají vysoké dielektrické vlastnosti. Polymery na bázi fenolformaldehydových pryskyřic se používají k výrobě nejkritičtějších a nejdůležitějších částí elektrických spotřebičů, skříní pohonných jednotek a částí strojů, polymerního základu desek plošných spojů pro rádiová zařízení. Lepidla na bázi fenolformaldehydových pryskyřic jsou schopna spolehlivě spojovat díly různého charakteru, přičemž si zachovávají nejvyšší pevnost spoje ve velmi širokém teplotním rozsahu. Takové lepidlo se používá k připevnění kovové základny osvětlovacích lamp ke skleněné baňce.Takže fenol a výrobky na něm založené jsou široce používány.
Použití fenolů
Fenol je pevná látka s charakteristickým zápachem, která při kontaktu s pokožkou způsobuje popáleniny. Jedovatý. Rozpouští se ve vodě, její roztok se nazývá kyselina karbolová (antiseptikum). Byla prvním antiseptikem zavedeným do chirurgie. Hojně se používá k výrobě plastů, léčiv (kyselina salicylová a její deriváty), barviv, výbušnin.
fenol, chemická látka organického původu, patří do skupiny aromatických uhlovodíků.
V roce 1842 se francouzskému organickému Augustu Laurentovi podařilo odvodit vzorec fenolu (C6H5OH), který se skládá z benzenového kruhu a hydroxyskupiny OH. Fenol má několik názvů, které se používají jak ve vědecké literatuře, tak v hovorové řeči a vznikly ze složení této látky. Tak se často nazývá fenol oxybenzen nebo kyselina karbolová.
Fenol je jedovatý. Prach a roztok fenolu dráždí sliznice očí, dýchacích cest a kůži. Má mírně kyselé vlastnosti, působením zásad tvoří soli - fenoláty. Působením bromu vzniká tribromfenol, který se používá k získání antiseptika - xeroformu. Benzenové jádro a OH skupina spojené v molekule fenolu se vzájemně ovlivňují a výrazně zvyšují vzájemnou reaktivitu. Zvláště důležité jsou kondenzační reakce fenolů s aldehydy a ketony, v jejichž důsledku se získávají polymerní produkty.
Fyzikální vlastnosti fenolu
Chemické vlastnosti fenolu
Fenol je bílá krystalická látka s charakteristickým ostrým sladko-cukrovým zápachem, která na vzduchu snadno oxiduje, nejprve narůžověla a po nějaké době získala sytě hnědou barvu. Charakteristickým rysem fenolu je jeho vynikající rozpustnost nejen ve vodě, ale také v alkoholu, alkalickém prostředí, benzenu a acetonu. Kromě toho má fenol velmi nízký bod tání a snadno zkapalňuje při +42 °C a má také slabé kyselé vlastnosti. Proto při interakci s alkáliemi tvoří fenol soli zvané fenoláty.
V závislosti na technologii výroby a účelu se fenol vyrábí ve třech stupních: A, B a C podle GOST 23519-93. Níže jsou jeho technické specifikace.
Technické vlastnosti fenolu podle GOST 23519-93
|
Název indikátoru |
Význam | ||
| Známka A | Mark B | třída B | |
| Vzhled | Bílý krystalický látka |
Bílý krystal - chesky in-in. Povoleno narůžovělé popř nažloutlý nádech |
|
| Teplota krystalizace, °С, ne nižší | 40,7 | 40,6 | 40,4 |
| Hmotnostní podíl netěkavého zbytku, %, max | 0,001 | 0,008 | 0,01 |
| Optická hustota vodného roztoku fenolu (8,3 g značky A, 8,0 g značky B, 5,0 g značky C ve 100 cm3 vody) při 20 °C, ne více |
0,03 | 0,03 | 0,03 |
| Optická hustota sulfonovaného fenolu, ne více než | 0,05 | Nepřidělujte | |
| Barva taveniny fenolu podle platina-kobaltu stupnice, jednotky Hazen: |
|||
| od výrobce, více ne | 5 | Nepřidělujte | |
| u spotřebitele: | |||
| při potrubní přepravě a nerezové nádrže, nic víc |
10 | Stejný | |
| při přepravě v cisternách vyrobených z uhlíku ocel a pozink, nic víc |
20 | >> | |
| Hmotnostní zlomek vody, %, ne více | 0,03 | Nepřidělujte | |
| Hmotnostní podíl celkových organických nečistot, %, max | 0,01 | Nepřidělujte | |
| včetně mesityl oxidu, %, ne více | 0,0015 | 0,004 | Nepřidělujte |
| množství -methylstyrenu a isopropylbenzenu (kumenu), %, max | Nepřidělujte | 0,01 | Stejný |
Způsoby získávání fenolu
V čisté formě se fenol v přírodě nevyskytuje, jde o umělý produkt organické chemie. V současné době existují tři hlavní způsoby, jak získat fenol v průmyslovém měřítku. Hlavní podíl na jeho výrobě připadá na tzv. cumpolovou metodu, při které dochází k oxidaci aromatické organické sloučeniny isopropylbenzenu vzduchem. V důsledku chemické reakce se získá kumpol hydroperoxid, který se při interakci s kyselinou sírovou rozloží na aceton a následně se vysráží fenol ve formě krystalické sraženiny. K výrobě se používá i methylbenzen (toluen), jehož oxidací vzniká tato chemikálie a kyselina benzoová. V některých průmyslových odvětvích, jako je výroba hutního koksu, se navíc z černouhelného dehtu uvolňuje fenol. Tento způsob výroby je však nerentabilní kvůli zvýšené spotřebě energie. Mezi nejnovější úspěchy chemického průmyslu patří výroba fenolu interakcí benzenu a kyseliny octové a také oxidativní chlorace benzenu.
Poprvé v průmyslových objemech byl fenol získán německou společností BASF v roce 1899 sulfonací benzenu kyselinou sírovou. Technologie její výroby spočívala v tom, že následně byla kyselina sulfonová podrobena alkalickému tavení, v důsledku čehož vznikl fenol. Tato metoda se používá již více než 100 let, ale v druhé polovině 20. století byl chemický průmysl nucen ji opustit kvůli obrovskému množství odpadu siřičitanu sodného, který byl vedlejším produktem organické syntézy fenol.
V první polovině 20. století zavedla americká společnost Dow Chemical další způsob výroby fenolu, a to chlorací benzenu, který se nazýval Raschigův proces. Metoda se ukázala jako docela účinná, protože měrná hmotnost výsledné látky dosáhla 85%. Následně stejná firma zavedla metodu oxidace methylbenzolu s následným rozkladem kyseliny benzoové, nicméně vzhledem k problematické deaktivaci katalyzátoru ji dnes využívá cca 3-4 % chemického průmyslu.
Nejúčinnější je metoda cumpole pro výrobu fenolu, kterou vyvinul sovětský chemik Pjotr Sergeev a byla uvedena do výroby v roce 1942. První kupolovna, postavená v roce 1949 ve městě Dzeržinsk v Gorké oblasti, dokázala pokrýt třetinu poptávky SSSR po fenolu.
Rozsah fenolu
Zpočátku se fenol používal k výrobě různých druhů barviv, kvůli jeho vlastnosti měnit barvu během procesu oxidace ze světle růžového na hnědý odstín. Tato chemikálie se nachází v mnoha typech syntetických barev. Kromě toho byla vlastnost fenolu ničit bakterie a mikroorganismy přijata v kožedělném průmyslu při činění zvířecích kůží. Později se fenol úspěšně používal v lékařství jako jeden z prostředků dezinfekce a dezinfekce chirurgických nástrojů a prostor a jako 1,4% vodný roztok - jako analgetikum a antiseptikum pro vnitřní i vnější použití. Kromě toho je základem aspirinu kyselina salicylová, fenol a její derivát, kyselina para-aminosalicylová, se používá k léčbě pacientů s tuberkulózou. Fenol je také součástí silného laxativního léku – purgenu.
V současné době je hlavním účelem fenolu chemický průmysl, kde se tato látka používá k výrobě plastů, fenolformaldehydových pryskyřic, umělých vláken jako nylon a nylon a také různých antioxidantů. Kromě toho se fenol používá k výrobě změkčovadel, přísad do olejů a je jednou ze složek tvořících přípravky na ochranu rostlin. Fenol se také aktivně používá v genetickém inženýrství a molekulární biologii jako prostředek pro čištění a izolaci molekul DNA.
Škodlivé vlastnosti fenolu
Téměř okamžitě po získání fenolu vědci zjistili, že tato chemikálie má nejen užitečné vlastnosti, které jí umožňují použití v různých oblastech vědy a výroby, ale je také silným jedem. Krátkodobé vdechování fenolových par tedy může vést k podráždění nosohltanu, poleptání dýchacích cest a následnému plicnímu edému s fatálním koncem. Při kontaktu fenolového roztoku s kůží se vytvoří chemické popáleniny, které se následně přemění na vředy. Pokud je roztokem ošetřeno více než 25 procent kůže, může to způsobit smrt člověka. Požití fenolu do organismu pitnou vodou vede ke vzniku peptického vředu, svalové atrofii, zhoršené koordinaci pohybů a krvácení. Kromě toho vědci zjistili, že fenol je příčinou rakoviny, přispívá k rozvoji srdečního selhání a neplodnosti.
Díky vlastnosti oxidace se páry této chemikálie po cca 20-25 hodinách ve vzduchu úplně rozpustí. Po uvolnění do půdy si fenol zachovává své toxické vlastnosti po celý den. Ve vodě však jeho životaschopnost může dosáhnout 7-12 dní. Nejpravděpodobnější cestou, jak se tato toxická látka dostane do lidského těla a na kůži, je tedy kontaminovaná voda.
Ve složení plastů neztrácí fenol své těkavé vlastnosti, proto je dnes použití fenolických plastů v potravinářském průmyslu, výrobě domácích potřeb a dětských hraček přísně zakázáno. Jejich použití se také nedoporučuje pro dokončení obytných a kancelářských prostor, kde člověk tráví alespoň několik hodin denně. Zpravidla se fenol vyloučí z těla potem a močí do 24 hodin, ale během této doby stihne způsobit nenapravitelné poškození lidského zdraví. Vzhledem ke škodlivým vlastnostem v mnoha zemích světa existuje omezení pro použití této látky pro lékařské účely.
Podmínky přepravy a skladování
Existují mezinárodní normy pro přepravu fenolu, jejichž cílem je zabránit uvolnění látky do životního prostředí.
Fenol se přepravuje po železnici v souladu s pravidly pro přepravu zboží v cisternách vybavených topným zařízením. Nádrže musí být vyrobeny z nerezové chromniklové oceli, pozinkované uhlíkové oceli nebo uhlíkové oceli. Fenol, určený pro výrobu zdravotnických produktů, je přepravován v železničních cisternách vyrobených z nerezové chromniklové oceli a pozinkované uhlíkové oceli. Fenol je také dopravován vyhřívaným potrubím z nerezové chromniklové oceli.
Fenol v roztaveném i pevném stavu je skladován v uzavřených nádržích z nerezové chromniklové oceli, pozinkované uhlíkové oceli nebo uhlíkové oceli a dále v nádržích z masivního hliníku. Fenol je povoleno skladovat v roztaveném stavu pod dusíkem (objemový podíl kyslíku v dusíku by neměl překročit 2 %) při teplotě (60 ± 10) °C po dobu 2-3 dnů. při skladování v hliníkových nádobách musí být teplota přísně kontrolována, aby se zabránilo rozpouštění hliníku v produktu.
Sloučeniny s jednou nebo více hydroxylovými skupinami připojenými k benzenovému kruhu; se nazývají fenoly. Nejdůležitější z nich je samotný fenol:
Fenol byl objeven v roce 1834, kdy byl izolován z černouhelného dehtu. Nejprve se nazývala kyselina karbolová a tento název se dodnes používá pro kapalný fenol obsahující 5 % vody. Fenol získal svůj současný název v roce 1841.
Všechny nejjednodušší fenoly jsou za normálních podmínek pevné látky s nízkou teplotou tání. Fenol je bezbarvá krystalická látka s teplotou tání 43°C. Má charakteristickou vůni. Stejně jako alkoholy mají fenoly vyšší body varu, než by se dalo očekávat z jejich relativní molekulové hmotnosti. To je způsobeno tvorbou mezimolekulárních vodíkových vazeb ve fenolech. Již bylo uvedeno výše, že 2-nitrofenol má nižší bod varu než 4-nitrofenol. To se vysvětluje existencí intramolekulární vodíkové vazby v první z těchto sloučenin, zatímco druhá sloučenina má mezimolekulární vodíkové vazby, díky čemuž je méně těkavá (viz oddíl 2.2).
Fenoly jsou špatně rozpustné ve vodě, ale vysoce rozpustné v organických rozpouštědlech, zejména alkoholech a etherech. Fenol je omezeně mísitelný s vodou pouze při teplotách pod 66°C. Při teplotě nad 66 °C je fenol mísitelný s vodou v jakémkoli poměru (viz obrázek 6.22 a část 6.2).
Laboratorní metody pro získání
Pro získání fenolu v laboratorních podmínkách se bezvodá sodná sůl kyseliny benzensulfonové taví při 300-350 °C s pevným hydroxidem sodným a poté se ke směsi přidá zředěná kyselina chlorovodíková:

Kyselina benzensulfonová se připravuje sulfonací benzenu (viz oddíl 18.2). Neutralizací této kyseliny hydroxidem sodným vzniká její sodná sůl.
Fenol se také získává zahřátím vodného roztoku fenyldiazoniumchloridu nad 10 °C:

Fenyldiazoniumchlorid se získává diazotací fenylaminu (viz oddíl 19.4).
Chemické vlastnosti fenolů
Reakce hydroxylové skupiny. Kyselost. Fenol má konstantu kyselosti 9,95. Má tedy vlastnosti slabé kyseliny, i když silnější než methanol, ethanol a voda (viz tabulka 19.4). Fenolace vzniklá v důsledku štěpení iontů je stabilizována delokalizací
záporný náboj:

Lze ji považovat za hybrid uvedených rezonančních forem (viz sekce 2.1 a 18.2).
Stejně jako alkoholy, fenol reaguje s vysoce elektropozitivními kovy, jako je sodík, za uvolňování vodíku:

Na rozdíl od alkoholů však fenoly reagují s hydroxidem sodným:

Fenol není tak kyselý jako karboxylové kyseliny. Karboxylové kyseliny, jako je octová nebo benzoová, jsou schopny vytěsnit oxid uhličitý z hydrogenuhličitanu sodného nebo uhličitanu sodného, ale fenol nikoli. Tato reakce se používá pro analytické účely k rozlišení karboxylových kyselin od fenolů.
Tvorba esterů. Ačkoli fenol nereaguje s karboxylovými kyselinami za vzniku esterů, reaguje s chloridy karboxylových kyselin v alkalických roztocích:

Tento typ reakce se nazývá acylace.
Tvorba etherů. Fenol reaguje s halogenalkany v alkalickém prostředí za vzniku etherů:

Tato reakce je příkladem Williamsonovy syntézy (viz předchozí část).
Reakce s chloridem fosforečným. Na rozdíl od alkoholů nereaguje fenol s halogenovodíky a halogenidy fosforitými. Pomalu však reaguje s chloridem fosforečným za vzniku chlorbenzenu v nízkém výtěžku:

Reakce s chloridem železitým. Když se k fenolu přidá neutrální roztok chloridu železitého, vytvoří se komplex, který má fialovou barvu. Tato reakce se používá jako analytický test na fenol. Tato reakce je charakteristická pro sloučeniny obsahující enolovou skupinu.

Reakce v benzenovém kruhu. Benzenový kruh v molekule fenolu podléhá elektrofilní substituci snadněji než samotný benzen. To je způsobeno tím, že nevazebné elektrony na atomu kyslíku jsou vtahovány do benzenového kruhu a tím jej aktivují. Hydroxylová skupina fenolu má 2,4-směrový účinek na elektrofilní substituenty (viz část 18.2).
Halogenace. Halogenace fenolů se provádí za mnohem mírnějších podmínek než halogenace benzenu. Například, když se bromová voda přidá k vodnému roztoku fenolu, vytvoří se bílá sraženina 2,4,6-tribromfenolu:

V sec. 18.2 bylo uvedeno, že bromace benzenu vyžaduje přítomnost katalyzátoru.
Nitrace. Fenol lze nitrovat zředěnou kyselinou dusičnou. V tomto případě se vytvoří směs 2-nitrofenolu a 4-nitrofenolu:

Porovnejme opět tyto mírné podmínky s podmínkami pro odpovídající reakci benzenu. Nitraci benzenu je třeba provádět ve směsi koncentrované kyseliny dusičné a kyseliny sírové (viz oddíl 18.2).
2-nitrofenol a 4-nitrofenol jsou silnější kyseliny než fenol. Oba se vyznačují hodnotami přibližně rovnými 7,2. Zvýšená kyselost nitrofenolů se vysvětluje tím, že nitroskupina přitahuje elektrony k sobě. Výsledkem je, že benzenový kruh přitahuje elektrony silněji z atomu kyslíku hydroxylové skupiny.
Sulfonace. Reakce fenolu s koncentrovanou kyselinou sírovou vede ke vzniku směsi hydroxybenzensulfonových kyselin:

Kyselina hydroxybenzensulfonová (výtěžek 85 %)
Oba produkty této reakce reagují s koncentrovanou kyselinou dusičnou za vzniku 2,4,6-trinitrofenolu – žluté krystalické látky, známé pod triviálním názvem „kyselina pikrová“:

Díky společnému účinku tří nitroskupin při pohlcování elektronů je kyselina pikrová poměrně silná kyselina. Vyznačuje se konstantou kyselosti blízkou 1 a při interakci s roztokem uhličitanu sodného z něj vytlačuje oxid uhličitý.
Kombinační reakce. Alkalický roztok fenolu reaguje s roztokem fenyldiazoniumchloridu, což vede k vytvoření oranžové sraženiny 4-hydroxyfenylazobenzenu:

Tento produkt je azobarvivo. Reakce tohoto typu se nazývá kopulační reakce (v tomto případě azokopulace).
DEFINICE
Fenoly- deriváty aromatických uhlovodíků, v jejichž molekulách jsou hydroxylové skupiny přímo vázány na atomy uhlíku benzenového kruhu. Funkční skupina, stejně jako alkoholy, je OH.
Fenol je pevná bezbarvá krystalická látka s nízkou teplotou tání, velmi hygroskopická, s charakteristickým zápachem. Na vzduchu fenol oxiduje, takže jeho krystaly zpočátku získávají narůžovělý odstín (obr. 1), při dlouhodobém skladování tmavnou a červenají. Při pokojové teplotě je málo rozpustný ve vodě, ale rychle a dobře se rozpouští při 60 - 70 o C. Fenol je tavitelný, jeho bod tání je 43 o C. Jedovatý.
Rýže. 1. Fenol. Vzhled.
Získání fenolu
V průmyslovém měřítku se fenol získává z černouhelného dehtu. Mezi nejčastěji používané laboratorní metody patří:
– hydrolýza chlorbenzenu
C 6H 5 Cl + NaOH —» C 6H 5OH + NaCl (kat = Cu, t 0).
— alkalické tavení solí arenesulfonových kyselin
C6H5SO3Na + 2NaOH → C6H5OH + Na2S03 + H20 (t 0).
– kumenová metoda (oxidace isopropylbenzenu)
C 6H 5-C (CH 3) H-CH 3 + 02 -» C 6H 5OH + CH 3-C (0) -CH 3 (H+, t 0).
Chemické vlastnosti fenolu
Chemické přeměny fenolu probíhají hlavně štěpením:
1) O-N připojení
- interakce s kovy
2C6H5OH + 2Na→ 2C6H5ONa + H2.
- interakce s alkáliemi
C6H5OH + NaOH → C6H5ONa + H20.
— interakce s anhydridy karboxylových kyselin
C 6H 5-OH + Cl-C (O) -O-C (O) -CH 3 -» C 6H 5-O-C (O) -CH 3 + CH 3COOH (t 0).
- interakce s halogenidy karboxylových kyselin
C 6H 5-OH + Cl-C (O) -CH 3 -» C 6H 5-O-C (O) -CH 3 + HC1 (to).
- interakce s FeCl 3 (kvalitativní reakce na fenol - vzhled fialového zbarvení, které zmizí po přidání kyseliny)
6C6H5OH + FeCl3 -> (C6H5OH)3 + 3Cl-.
2) připojení C sp 2 -H převážně in o- a n-ustanovení
- bromace
C6H5-OH + 3Br2 (aq) ->Br3-C6H2-OH↓ + 3HBr.
- nitrace (tvorba kyseliny pikrové)
C6H5-OH + 3HON02 (konc) -» (N02)3-C6H2-OH + 3H20 (H+).
3) jediný 6π-elektronový oblak benzenového kruhu
– hydrogenace
C6H5OH + 3H2 → C6Hn-OH (kat \u003d Ni, to \u003d 130 - 150, p \u003d 5 - 20 atm).
Aplikace fenolu
Fenol se ve velkém množství používá k výrobě barviv, fenolformaldehydových plastů a léčivých látek.
Z dvojmocných fenolů se v lékařství používá resorcin jako antiseptikum a látka pro některé klinické testy, hydrochinon a další dvouatomové fenoly se používají jako vývojky při zpracování fotografických materiálů.
V lékařství se lysol, který obsahuje různé fenoly, používá k dezinfekci místností a nábytku.
Některé fenoly se používají jako antioxidanty – látky zabraňující kažení potravin při dlouhodobém skladování (tuky, oleje, potravinářské koncentráty).
Příklady řešení problémů
PŘÍKLAD 1
| Cvičení | Vodný roztok obsahující 32,9 g fenolu se zpracuje s přebytkem bromu. Vypočítejte hmotnost výsledného bromderivátu. |
| Rozhodnutí | Napište reakční rovnici pro interakci fenolu s bromem: C6H5OH + 3Br2 -> C6H2Br3OH + 3HBr. V důsledku této interakce vzniká 2,4,6-tribromfenol. Vypočítejte množství fenolové látky (molární hmotnost je 94 g / mol): n (C 6H 5OH) \u003d m (C 6H 5OH) / M (C 6H 5OH); n (C 6H 5OH) \u003d 32,9 / 94 \u003d 0,35 mol. Podle reakční rovnice n(C 6H 5OH) :n(C 6H 2 Br 3 OH) = 1:1, tzn. n (C6H2Br3OH) \u003d n (C6H5OH) \u003d 0,35 mol. Potom se hmotnost 2,4,6-tribromfenolu bude rovnat (molární hmotnost -331 g / mol): m (C6H2Br3OH) \u003d 0,35 x 331 \u003d 115,81 g. |
| Odpovědět | Hmotnost výsledného bromderivátu je 115,81 g. |
PŘÍKLAD 2
| Cvičení | Jak získat fenol z jodbenzenu? Vypočítejte hmotnost fenolu, kterou lze získat ze 45,9 g jodbenzenu. |
| Rozhodnutí | Napíšeme reakční rovnici pro výrobu fenolu z jodbenzenu: C 6H 5I + NaOH → C 6H 5OH + NaI (kat = Cu, t 0). |