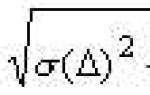Hodnota emf galvanického článku. Galvanické prvky. emf
Elektromotorická síla galvanického článku (EMF).
Elektrická práce získaná z galvanického článku bude maximální, když bude článek provozován za podmínek co nejblíže reverzibilním. Maximální potenciálový rozdíl elektrod daného galvanického článku, který je stanoven za rovnovážných podmínek, se běžně nazývá jeho elektromotorická síla (EMF). Je rovna rozdílu mezi rovnovážnými potenciály katody a anody prvku. Za standardních podmínek:
EMF 0 = D j0 = j0 katoda - j0 anoda . (7.3)
Příklad 10. Vypočítejte EMF galvanického článku složeného z hořčíkových a olověných elektrod, ve kterém = 0,1 M; = 0,001 mil.
Řešení. j 0 Mg2+ /Mg \u003d -2,37 V; jo Pb2+ / Pb = -0,13 B (tabulka 7.1); j 0 hořčíkové elektrody je menší, ᴛ.ᴇ. Mg je aktivnější kov, proto v galvanickém článku bude hořčík anodou a vede katodu.
Na elektrodách budou probíhat následující procesy:
A: Mg - 2e \u003d Mg 2+,
K: Pb 2+ + 2e = Pb 0.
Obvod galvanického článku je napsán následovně: Mg½Mg 2+ ║Pb 2+ ½Pb.
Pro výpočet EMF je extrémně důležité najít elektrodové potenciály. Podle rovnice (7.2):
J0+ ![]() -2,37 + 0,0295. log 0,1 = -2,4 V;
-2,37 + 0,0295. log 0,1 = -2,4 V;
0,13 + 0,0295. lg 0,001 \u003d -0,13 + 0,0295 (-3) \u003d -0,22 V.
EMF \u003d j cat - j an \u003d -0,25 - (-2,4) \u003d 2,15 V.
Příklad 11. Určete EMF galvanického článku tvořeného stříbrnými elektrodami ponořenými v 0,0001 M a 0,1 M roztoku AgNO 3 .
Řešení. Galvanický článek musí být složen nejen z různých, ale také ze stejných elektrod ponořených do roztoků stejného elektrolytu různých koncentrací ( koncentrační prvky). Pojďme najít elektrodové potenciály pomocí Nernstova vzorce (7.2):
j1 Ag+ / Ag = j0 + ×lg = 0,8 + 0,059 × lg0,001 = 0,8 + 0,059 × (-3) = 0,62 V,
j 2 Ag+ / Ag \u003d 0,8 + 0,059 × lg0,1 \u003d 0,8 - 0,059 \u003d 0,74 V.
Od j 1< j 2 , электрод, опущенный в 0,001 М раствор, будет являться анодом:
EMF \u003d j cat - j an \u003d 0,74 - 0,62 \u003d 0,12 V.
Schéma takového galvanického článku je napsáno takto:
(-) Ag½ AgN03 (0,001 M) ║ AgN03 (0,1 M) ½ Ag (+).
Jak již bylo ukázáno na příkladu vodíkové elektrody, elektrody, potažmo galvanické články, jsou vytvořeny nejen pro oxidačně-redukční reakci kovů, ale také pro jakékoli látky a redoxní reakce probíhající v roztocích nebo taveninách. Například pro reakci v roztoku
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
oxidační a redukční procesy lze rozdělit na poloviční reakce:
na anodě: 5 ½ SO 3 2 - + H 2 0 \u003d SO 4 2 - + 2H + + 2ē; (0,17 V),
na katodě: 2 ½ Mn04 - + 8H + + 5e = Mn2+ + 4H20(1,51 V).
Shrneme:
2Mn04- + 5S032- + 6H+ + 10' = 2Mn2+ + 5S042- + 3H20 + 10'.
Reakce generující proud:
2Mn04- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H20.
K provádění takových reakcí se obvykle používá katalyzátor, kterým je také elektronový vodič, například platina (obr. 7.3).
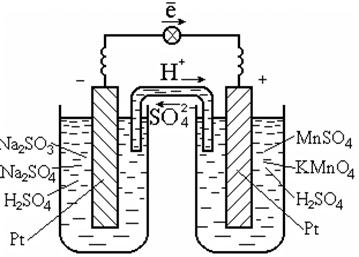
Rýže. 7.3. Galvanický článek na redox
reakce v roztoku
Schéma galvanického článku:
Pt | SO32-, SO42-, H+ || Mn04-, Mn2+, H+ | Pt.
Hodnoty standardních elektrodových potenciálů polovičních reakcí jsou uvedeny v referenčních knihách.
Emf takového prvku za standardních podmínek lze definovat jako potenciální rozdíl pro poloviční reakce redukce (oxidační činidlo) a oxidace (redukční činidlo).
EMF \u003d Dj 0 \u003d j 0 (MnO 4 - / Mn 2+) - j 0 (SO 4 2 - / SO 3 2 -) \u003d
1,51 - 0,17 = 1,34 V.
Pokud je současně EMF kladné, pak je reakce možná za standardních podmínek, protože DG reakce a elektrická práce (EMF) jsou ve vztahu:
kde F je Faradayova konstanta (náboj nesený jedním molem elementárních nábojů (F = 96485, nebo ʼʼ96500Cul/mol ekviv);
n je náboj nesený jednou částicí (pro Zn 2+ a Cu 2+ n = 2);
Dj \u003d j katoda - j anoda \u003d j ok-la - j obnovit.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, potenciálový rozdíl mezi elektrodami lze nejen přímo měřit, ale také vypočítat z čistě chemických experimentálních dat. V případě nestandardních podmínek se elektrodový potenciál a EMF prvku vypočítá pomocí Nernstova vzorce (7.1). Například pro danou reakci:
(n = 10). Protože koncentrace činidel jsou pod logaritmickým znaménkem, závislost Dj na nich je slabá.
Elektromotorická síla galvanického článku (EMF). - koncepce a typy. Klasifikace a vlastnosti kategorie "Elektromotorická síla galvanického článku (EMF)." 2014, 2015.
Pokud oddělíme procesy oxidace a redukce prostorově, pak lze redoxní reakci využít k výrobě elektrické energie.
Zařízení, ve kterém chemická energie promění v elektřinu galvanický prvek. Galvanický článek je vytvořen ze dvou kovů ponořených do roztoku elektrolytu. Pokud tyto kovy spojíte s vodičem prvního druhu (kovovým drátem), vytvoří se elektrický proud, který se objeví v důsledku výskytu redoxního procesu. V galvanickém článku je elektroda anodou. elektrodový potenciál který je v tomto řešení elektronegativnější. Oxidace probíhá na anodě. Katoda je elektroda vyrobená z méně aktivního kovu. Na katodě jsou redukovány kladné kovové ionty, vodíkové ionty nebo neutrální molekuly. V galvanickém článku je anoda označena znaménkem mínus a katoda znaménkem plus. Galvanický článek je znázorněn na obrázku.
Zinková deska je ponořena do roztoku síranu zinečnatého, měděná deska je ponořena do roztoku síranu měďnatého. Destičky jsou spojeny drátem, roztoky jsou odděleny porézní přepážkou, aby se zabránilo smíchání roztoků. Elektrony jdou po vnějším obvodu od anody ke katodě a po vnitřním obvodu se anionty SO 4 2- pohybují v roztoku z mědi na zinek a uzavírají elektrický obvod galvanického článku.
Galvanický článek je napsán jako elektrochemický obvod:
A(-) Zn | ZnSO 4 || CuSO4 | Cu(+)K
Protože elektrodový potenciál zinku je menší než elektrodový potenciál mědi, zinek bude anodou a měď bude katodou. Zinkový plech se oxiduje a měď se redukuje z roztoku na povrchu měděného plechu.
Měly by být zaznamenány procesy probíhající během provozu galvanického článku:
A Zn-2e = Zn2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Maximální potenciálový rozdíl elektrod, který lze získat při provozu galvanického článku, se nazývá elektromotorická síla (EMF) článku. Rovná se rozdílu mezi rovnovážnými potenciály katody a anody:
EMF = e K - e A
Pro měděno-zinkový elektrochemický článek za standardních podmínek:
EMF \u003d 0,34-(-0,76) \u003d 1,1 V
Potenciální rozdíl se tvoří nejen mezi různými, ale i mezi stejnojmennými kovy, naloženými do roztoků jejich solí o různých koncentracích. Takový galvanický článek se nazývá koncentrace. Například galvanický článek s koncentrací niklu.
(-) Ni | NiSO4 || NiSO4 | Ni(+)
0,01 mol 0,1 mol
Zapišme si práci takového koncentračního galvanického článku.
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -2) \u003d -0,25 + (0,058 / 2) (-2) \u003d -0,308 V
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -1) \u003d -0,25 + (0,058 / 2) (-1) \u003d -0,28 V
EMF = -0,28 - (-0,308) = 0,028 V
Procesy na elektrodách:
A: Ni 0 - 2e - \u003d Ni 2+
K: Ni 2+ + 2e - \u003d Ni 0
KONTROLNÍ ÚKOLY
48. Vypočítejte EMP galvanického článku kadmium - stříbro, je-li koncentrace iontů stříbra v roztoku 0,1 mol/l a iontů kadmia 0,001 mol/l. Napište rovnice pro reakce probíhající na elektrodách.
49. Vytvořte schéma dvou galvanických článků, z nichž jeden je katodou a druhým anodou. Napište rovnice reakcí probíhajících při provozu těchto prvků.
50. Vypočítejte EMP galvanického článku složeného ze železných a olověných plátů ponořených do 0,1M roztoků jejich solí. Napište reakční rovnice.
51. Vypočítejte EMF koncentračního niklového galvanického článku. Koncentrace kovových iontů v roztocích je 1 mol/l a 0,0001 mol/l. Napište procesy probíhající na anodě a katodě.
52. Jaké procesy probíhají na elektrodách měděného koncentrovaného galvanického článku, jestliže jedna z elektrod má koncentraci kovových iontů rovnou 1 mol/l a druhá 0,001 mol/l. kterým směrem se pohybují elektrony ve vnějším obvodu. Co je EMF?
53. Proveďte schéma galvanického článku sestávajícího ze Zn a Fe desek ponořených v roztocích jejich solí. Napište rovnice pro procesy probíhající na iontech železa tak, aby EMF prvku bylo nulové při koncentraci iontů zinku 0,0001 mol/l.
54. Železné a stříbrné pláty jsou spojeny vnějším vodičem a ponořeny do roztoku kyseliny sírové. Vytvořte schéma tohoto galvanického článku, napište rovnice pro reakce probíhající na deskách.
55. Nakreslete schéma galvanického článku sestávajícího ze stříbrné elektrody ponořené v 1M roztoku dusičnanu stříbrného a standardní vodíkové elektrody. Napište rovnice elektrodových procesů. Jaké je EMF prvku?
56. Jakým směrem se budou pohybovat elektrony ve vnějším obvodu následujících galvanických článků
a) Mg | Mg2+ | | Pb 2+ | Pb
b) Pb | Pb 2+ | | Cu 2+ | Cu
c) Cu | Cu 2+ | | Ag 2+ | Ag
pokud jsou všechny roztoky elektrolytů unimolární? Který kov se v každém z těchto případů rozpustí.
57. Vytvořte schéma galvanického článku na základě reakce probíhající podle rovnice:
Ni + Pb (NO 3) 2 \u003d Ni (NO 3) 2 + Pb.
Napište elektronické rovnice anodových a katodových procesů, vypočítejte EMF tohoto prvku za standardních podmínek.
58. EMP galvanického článku tvořeného měděnou deskou ponořenou do roztoku jeho soli s koncentrací iontů mědi rovnou 0,001 mol/l a chrómu ponořeného do roztoku jeho soli je 1,05 V. Určete koncentraci iontů chrómu v roztoku jeho soli. Vytvořte schéma galvanického článku a napište elektronické rovnice elektrodových procesů.
59. Vytvořte schéma, zapište rovnice elektrodových procesů a vypočítejte EMF galvanického článku sestávajícího z kadmiových a hořčíkových desek ponořených v roztocích jejich solí s koncentrací kovových iontů rovnou 1 mol/l. změní se EMF tohoto galvanického článku, pokud se koncentrace každého z iontů sníží na 0,01 mol/l.
60. EMP galvanického článku sestávajícího ze standardní vodíkové elektrody a olověné elektrody ponořené do 1M roztoku olovnaté soli je 126 mV. Když je prvek uzavřen, elektrony ve vnějším obvodu se pohybují od přívodu k vodíkové elektrodě. Jaký je potenciál olověné elektrody. Nakreslete schéma galvanického článku a zapište procesy probíhající na elektrodách.
61. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení olověného akumulátoru.
62. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení kadmium-niklové baterie.
63. Jaké procesy probíhají na elektrodách při nabíjení a vybíjení železo-niklové baterie.
64. Vytvořte schéma dvou galvanických článků, z nichž jeden by byl anodou a ve druhém katodou. Napište pro každý z těchto prvků elektronické rovnice reakcí probíhajících na elektrodách.
65. Nakreslete schéma galvanického článku sestávajícího z hliníková elektroda, ponořený do 1M roztoku dusičnanu hlinitého a standardní vodíkové elektrody. Napište rovnice elektrodových procesů a vypočítejte EMF galvanického článku.
66. Jakým směrem se budou pohybovat elektrony ve vnějším obvodu hliníkovo-zinkového galvanického článku. Koncentrace iontů v roztocích jsou 0,1 mol/l. Vytvořte schéma galvanického článku, napište rovnice pro procesy probíhající na elektrodách, vypočítejte EMF.
67. Ve stříbrno-zinkovém prvku používaném k napájení různých zařízení dochází k reakci
ELEKTROLÝZA
elektrolýzou nazývá se soubor procesů probíhajících během průchodu konstanty elektrický proud prostřednictvím systému sestávajícího ze dvou elektrod a taveniny nebo roztoku elektrolytu. Během elektrolýzy se kladně nabité ionty pohybují směrem ke katodě, která je připojena k zápornému pólu externího stejnosměrného zdroje, a záporně nabité ionty k anodě, která je připojena ke kladnému pólu stejnosměrného zdroje. Na povrchu katody probíhá proces redukce, na anodě - oxidace.
Uvažujme elektrolýzu taveniny chloridu sodného.
Když jsou dvě grafitové elektrody připojené ke zdroji proudu ponořeny do taveniny skládající se z iontů Na + a Cl -, začne v elektrolytu řízený pohyb iontů a na elektrodách proběhnou redoxní procesy.
Schéma elektrolýzy sodíkové taveniny:
NaCl \u003d Na + + Cl -
Katodová (-) (+) anoda
Na + + e- = Na02Cl - - 2e - = Cl2
Celková reakční rovnice:
2Na + + 2Cl - elektrolýza 2 Na + Cl 2
2NaCl elektrolýza 2Na + Cl 2
V elektrolýza vodných roztoků elektrolytů molekuly polární vody jsou přitahovány ke katodě i anodě a mohou se také účastnit procesů na elektrodách.
Procesy na katodě
Pořadí redukce iontů na katodě během elektrolýzy roztoků závisí na hodnotách standardních elektrodových potenciálů. Čím větší je hodnota elektrodového potenciálu prvku, tím snazší je jeho obnovení.
Jako první se na katodě redukují ionty těch kovů, jejichž potenciál je nejpozitivnější. Například roztok s ionty Ag + a H +. Ag se obnoví jako první:
Ag + + e - = Ag 0 e 0 = +0,8 B
Vodík se nezískává, protože jeho potenciál je menší.
Potenciály kovů a vodíku závisí na jejich koncentraci v elektrolytu. Proto není vždy možné usuzovat na snížení H+ iontů z hodnot standardního potenciálu. V neutrálním roztoku je koncentrace vodíkových iontů 10 -7 mol/l. a podle Nernstova vzorce:
V důsledku toho se vodík může uvolňovat z neutrálních roztoků pouze při potenciálu menším než -0,41 V a kovy na katodě se uvolní pouze ty, jejichž potenciál je kladnější než potenciál -0,41 V.
V praxi se z roztoků vodíku uvolňuje mnoho kovů (Zn, Fe, Cr aj.), jejichž hodnota elektrodových potenciálů je menší než –0,41V.
To je způsobeno vodíkovým přepětím, tzn. Na povrchu většiny kovů se vodík uvolňuje s obtížemi. Velikost vodíkového přepětí závisí na vlastnostech kovu, hustotě proudu a teplotě elektrolytu. přepětí– to je potenciální rozdíl mezi praktickým potenciálem vývoje vodíku a teoretickým potenciálem.
Příklad.
Potenciál uvolňování zinku v neutrálním elektrolytu –0,76V, vodíku –0,41V. vodíkové přepětí na zinku je asi –0,72V. Vodík se tedy na zinek bude uvolňovat pouze při potenciálu –0,41+(-0,72)=-1,13V. Pokud porovnáme potenciál výboje zinku (-0,76 V) s potenciálem výboje vodíku na zinku (-1,13 V), je jasné, že se zinek uvolní. Ve skutečnosti je to pravda, při elektrolýze neutrálního roztoku zinečnaté soli se uvolňuje zinek a malé množství vodíku.
Při zobecněném procesu na katodě se v závislosti na umístění kovu v sérii standardních elektrodových potenciálů rozlišují tři případy:
1) kovové ionty, jejichž elektrodový potenciál je menší než –1,18 V (od Li do Mn). Vodíkové ionty jsou obnoveny:
2 H + + 2e - \u003d H 2 PH< 7
2 H20 + 2e - \u003d H2 + 2OH - PH>= 7
2) kovové ionty, jejichž elektrodový potenciál je od –1,18 V do 0,00 V (od Mn do H). V tomto případě jsou současně redukovány ionty kovů i vodíkové ionty:
Me n+ + ne - = Me 0
2H++ 2e- = H2PH<7
2H20 + 2e- = H2 + 2OH - PH>=7
3) kovové ionty, jejichž elektrodový potenciál je větší než 0,0 V (od H do Au). V tomto případě se redukují pouze kovové ionty
Me n+ + ne - = Me 0
Procesy na anodě
Pro elektrolýzu se používají rozpustné (aktivní) a nerozpustné (inertní) anody. Při elektrolýze se rozpustné anody rozpouštějí a kovové ionty - anoda přecházejí do roztoku. Rozpustné anody jsou obvykle vyrobeny z kovu, jehož sůl je podrobena elektrolýze.
Nerozpustné anody se neúčastní redoxních reakcí. Obvykle se jedná o anody vyrobené z grafitu, zlata, platiny. Anionty s více negativními potenciály jsou na jejich povrchu oxidovány. Jedná se o ionty, které neobsahují kyslík, např. J - , Br - , Cl - , S 2- a další (kromě F -)
Pokud roztok obsahuje ionty Cl-, Br-, budou ionty Br- oxidovány na inertní anodě.
2Br-2e- = Br2
2H 2 0 - 4e - \u003d O 2 + 4H + (PH<=7)
4OH - 4e - \u003d 2H20 + O2 (PH> 7)
Uvažujme několik případů elektrolýzy vodných roztoků.
Příklad.
Schéma elektrolýzy vodného roztoku chloridu měďnatého s inertní anodou CuCl 2 \u003d Cu 2+ + 2Cl -
H2O \u003d H + \u003d OH -
Katoda (-) Cu 2+ H + (H 2 O) Cl -, OH - (H 2 O) (+) anoda
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
Měď má potenciál větší než 0, takže kov je redukován na katodě a zbytek kyseliny bez kyslíku je oxidován na anodě.
Příklad.
Schéma elektrolýzy roztoku síranu draselného s inertní anodou. K2SO4 \u003d 2K + + SO4 2
H2O \u003d H + + OH -
Katoda (-) 2K +, H + (H 2 O) SO 4 2-, OH (H 2 O) (+) anoda
2H20 + 2e - \u003d H2 + 2OH - 2H20 - 4e - \u003d O2 + 4H +
K + + OH - \u003d KOH 2H + + SO 4 2- \u003d H 2 SO 4
Protože draslík v sérii standardních elektrodových potenciálů je mnohem dříve než vodík, vodík se na katodě redukuje a ionty OH se akumulují -
Na anodě dojde k oxidaci molekul vody a akumulaci iontů H+. V katodovém prostoru tedy bude sekundárním produktem zásada a v anodovém prostoru kyselina.
Příklad.
Elektrolýza vodného roztoku síranu nikelnatého s aktivní anodou. Ni SO 4 \u003d Ni 2+ \u003d SO 4 2-
H 2 O H + + OH -
Katoda (-) Ni 2+, H + (H 2 O) SO 4 2-, OH - (H 2 O) (+) anoda
Ni2+ +2e- = NioNi-2e- = Ni2+
e 0 Ni \u003d -0,25 V je větší než potenciál pro redukci vodíkových iontů z vody (-0,41 V), proto je kov redukován a anoda-kov je oxidován na anodě, protože potenciál niklu je mnohem menší než oxidační potenciál vody (+1,23V).
Zákony elektrolýzy
Hmotnost elektrolytu podrobeného chemické přeměně, stejně jako hmotnosti látek uvolněných na elektrodách podle Faradayových zákonů, jsou přímo úměrné množství elektřiny prošlé elektrolytem a molárním hmotnostem ekvivalentů látek:
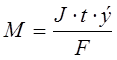 , kde
, kde
m je hmotnost elektrolytu podrobeného elektrolýze nebo hmotnost látek uvolněných na elektrodách, g;
J - síla proudu, A;
e-molární hmotnost látkových ekvivalentů, g/mol;
F-číslo Faradaye - 96500 C;
t je doba elektrolýzy, s;
KONTROLNÍ ÚKOLY
68. Vytvořte rovnice pro procesy probíhající při elektrolýze tavenin NaOH a NiCl 2 inertními elektrodami.
69. Proveďte schéma elektrolýzy vodných roztoků kyseliny sírové, chloridu měďnatého, dusičnanu olovnatého platinovými elektrodami.
70. Napište rovnice elektrodových procesů probíhajících při elektrolýze vodných roztoků chloridu barnatého a chloridu železitého uhlíkovými elektrodami.
71. Proveďte schéma elektrolýzy vodného roztoku chloridu zinečnatého, je-li a) anoda zinková; b) uhlíková anoda.
72. Jaký objem vodíku se uvolní při průchodu proudu 3 A vodným roztokem kyseliny sírové po dobu 1 hodiny.
73. Při elektrolýze vodného roztoku SnCl 2 se na anodě uvolnilo 4,48 litrů. chlór (normální podmínky). Jaká látka a v jakém množství se uvolnila na katodě.
74. V jakém pořadí se budou uvolňovat kovy při elektrolýze roztoku obsahujícího sírany niklu, stříbra, mědi ve stejné koncentraci. Napište rovnice procesů na elektrodách.
75. Vytvořte diagram procesů probíhajících na měděných elektrodách při elektrolýze vodného roztoku dusičnanu draselného.
76. Nerafinovaná měď obsahuje nečistoty stříbra a zinku. Co se stane s těmito nečistotami během elektrolytické rafinace mědi. Napište rovnice procesů na elektrodách.
77. Jak dlouho bude trvat úplné rozložení 2 molů vody proudem 2A.
78. Po určitou dobu procházel roztoky kuchyňské soli a fosforečnanu sodného DC.. Změní to množství soli v obou případech. Motivujte svou odpověď sestavením elektronických rovnic procesů probíhajících na katodě a anodě.
79. Při elektrolýze roztoku síranu měďnatého se na anodě uvolnilo 0,168 litru plynu (normální podmínky), sestavte elektronické rovnice procesů a vypočítejte, kolik mědi se uvolní na katodě.
80. Sestavte elektronové rovnice procesů probíhajících při elektrolýze roztoku a taveniny KOH.
81. Jaké látky a v jakém množství se budou uvolňovat na uhlíkových elektrodách při elektrolýze roztoku NaI po dobu 2,5 hodiny při síle proudu 6A.
82. Kolik gramů kyseliny sírové vznikne v blízkosti anody při elektrolýze roztoku síranu sodného, pokud se na anodě uvolní 1,12 litru kyslíku (n.o.), vypočítejte hmotnost látky uvolněné na katodě.
83. Při elektrolýze roztoku dusičnanu stříbrného na anodě se uvolnilo 0,28 litru kyslíku. Kolik gramů stříbra vyniklo na katodě.
84. Soli hliníku, zinku a mědi jsou rozpuštěny ve vodě s koncentrací kationtů 1 mol/l. sestavte elektronové rovnice procesů na elektrodách a naznačte sled reakcí na katodě.
85. Jaké produkty lze získat elektrolýzou roztoku NaNO 3, jsou-li prostory anody a katody:
a) oddělené porézní přepážkou;
b) se neoddělují a roztok se míchá.
86. Jaké produkty se budou uvolňovat na katodě a anodě především při elektrolýze vodných roztoků grafitovými elektrodami, obsahuje-li elektrolyt směs síranu měďnatého (II) a chloridu draselného.
87. Měděné a stříbrné desky se ponoří do vodného roztoku dusičnanu stříbrného. Ke kterému pólu zdroje proudu má být připojena měděná deska, aby byla pokryta stříbrem. Napište schéma procesu elektrolýzy.
KOROZE KOVŮ
Koroze tzv. spontánní destrukce kovu pod vlivem prostředí. Koroze je redoxní heterogenní proces probíhající na rozhraní. Podle mechanismu korozního procesu se rozlišuje chemická a elektrochemická koroze. Chemická koroze nazývaná oxidace kovu, která není doprovázena výskytem elektrického proudu v systému. Takový mechanismus je pozorován při interakci kovů s agresivními plyny při vysoká teplota(plynová koroze) a s organickými kapalinami - neelektrolyty (koroze v neelektrolytech).
elektrochemická koroze nazývaná destrukce kovu v prostředí elektrolytu, doprovázená výskytem elektrického proudu uvnitř systému.
Kovy používané ve strojírenství obsahují nečistoty jiných kovů, proto při kontaktu s roztokem elektrolytu vzniká na jejich povrchu velké množství nepřetržitě pracujících mikrovoltaických článků. Aktivnější kov, anoda, oxiduje za vzniku kovových kationtů nebo nerozpustných produktů, jako je rez. Uvolněné elektrony se přesunou ke katodě, kde se redukuje oxidační činidlo. Rozpuštěný kyslík a vodíkové ionty, nejdůležitější oxidační činidla způsobující korozi, se nazývají katodové depolarizátory. Jaký redukční proces bude na katodě probíhat, závisí na složení elektrolytu.
Příklad.
Když se železo a měď dostanou do kontaktu v roztoku kyseliny chlorovodíkové, vytvoří se mikrogalvanický článek:
AFe| HCl | Cu K
eo Fe/Fe2+ = -0,44B
eo Cu/Cu2+ = +0,34B
Železo - aktivnějším kovem bude anoda a měď - katoda. Reakce probíhající na anodě a katodě lze vyjádřit jako:
1 A: Fe -2e \u003d Fe 2+
1K: 2H++ 2e = H2
Shrneme-li anodické a katodické procesy, dostaneme redoxní reakci, jejíž spontánní výskyt způsobuje korozi kovu:
Fe + 2H+ = Fe2+ + H2
Fe + 2HCl \u003d FeCl2 + H2
Příklad.
S korozí uvnitř neutrální prostředí, v nepřítomnosti kyslíku rozpuštěného ve vodě dochází k depolarizaci katody vodíkem stejným způsobem jako v předchozím příkladu.
Zapišme si schéma galvanického článku a rovnice reakcí probíhajících v tomto galvanickém článku:
A Fe|H20| Cu K
1 A: Fe - 2e \u003d Fe 2+
1K: 2H20 + 2e \u003d H2 + 2OH -
Fe + 2H 2 0 \u003d Fe 2+ + H2 + 2OH -
Nebo v molekulární formě: Fe + 2H20 = Fe (OH)2 + H2
Příklad.
Při kontaktu železa s mědí ve vlhkém vzduchu vzniká galvanický článek.
AFe| H20 + O 2 | Cu K
A proces koroze je vyjádřen následujícími rovnicemi:
A: Fe - 2e = Fe 2+
K: O2 + 2H20 + 4e \u003d 4OH -
2Fe + O 2 + 2H 2 O \u003d 2Fe (OH) 2
Vlivem vzdušného kyslíku se hydroxid železitý (2) dále oxiduje podle rovnice
4Fe(OH)2 + O2 + 2H20 = 4Fe(OH)3
Jak je vidět z příkladu, v tomto případě dochází k depolarizaci katody kyslíkem.
Možnost spontánního redoxního procesu se vypočítává z EMF
EMF = e redukční činidlo - e oxidační činidlo
Pokud je EMF procesu větší než nula, pak je proces možný.
7ZÁKLADY ELEKTROCHEMIE
7.1 GALVANICKÉ ČLÁNKY. SMĚR REDOXNÍCH REAKCÍ
Zvažte reakci:
Zn+ CuSO4 → ZnSO4+ Cu
Podstata této vytěsňovací reakce je redukována na redukci druhého iontu o jeden kov. Například v řadě kovů Zn, Fe, Cu, Ag každý předchozí vytěsňuje další ze svých solí, přičemž není pozorováno žádné obrácené vytěsňování.
Proces interakce zinku s iontem mědi podle výše uvedeného schématu lze rozdělit do dvou polovičních reakcí:
Zn- 2e → Zn2+
Cu 2+ + 2e → Cu
Je zřejmé, že pokud by bylo možné přenášet elektrony ne přímo, ale přes kovový vodič, pak by proud elektronů proudil ze zinku na měď, tzn. elektřina. Na obrázku 6.1 je schéma galvanického článku, tzn. zařízení, které takový přenos elektronů po drátu umožňuje. V galvanickém článku se energie chemické reakce přímo přeměňuje na elektrickou energii.
Obrázek 6.1 - Návrh měděno-zinkového galvanického článku (Daniel-Jacobiho článek)
Plavidlo A a trubka C spojující obě nádoby se naplní roztokem ZnSO 4 , nádoba B roztokem CuSO 4 . Do prvního z nich je spuštěn zinkový plech, do druhého měděný. Pokud obě desky spojíte drátem, začnou se po něm pohybovat elektrony ve směru naznačeném šipkou (poteče elektrický proud). Trubice B zajišťuje uzavření okruhu, pohybují se po ní ionty SO 4 2-. Elektroda, na které proces obnovy (na obrázku 6.1 - měď) se nazývá katoda a elektroda, na které se provádí oxidace (v uvažovaném příkladu - zinek), se nazývá anoda V elektrotechnice se přejímá opačný systém značení elektrod: záporný pól zdroje proudu se nazývá katoda, tzn. elektroda, která přenáší elektrony do vnějšího obvodu (v tomto případě zinek). V studijní průvodce elektrody jsou pojmenovány jak je obvyklé v elektrochemii..
V tomto případě jsou elektrodové procesy heterogenní, protože oxidované a redukované formy jsou v různých fázích. V obecnější formě lze proces heterogenní elektrody zapsat jako:
Mě(WF, tv fáze) - n e - já n+ (aq ) (RP, roztok)
Na fázovém rozhraní se objevuje dvojitá elektrická vrstva skládající se z kationtů Me n+ (v roztoku) a elektrony (v kovu), což vede ke vzniku potenciálu E(Mě n+ /Já). Jeho absolutní hodnotu nelze určit, ale lze snadno změřit potenciálový rozdíl mezi katodou a anodou, který se nazývá elektromotorická síla (EMF) galvanického článkuΔ E=E na-E a Pokud je v takových zařízeních podmíněno uvažovat potenciál nějaké elektrody rovný nule, pak Měření EMF je možné získat relativní hodnoty jiných elektrodových potenciálů, což je důležité pro srovnávací kvantitativní charakteristiky elektrod.
Konvenčně se za nulový považuje potenciál standardní vodíkové elektrody, která se skládá z platinové desky potažené platinovou černí a částečně ponořené do kyselého roztoku s aktivní koncentrací vodíkových iontů rovnou 1 mol/l. Elektroda se promyje plynným vodíkem při tlaku 1,013· 10 5 Pa (1 atmosféra), což vede k vytvoření systému:
2H++ 2eH 2
Pro měření elektrodových potenciálů kovů, jako je měď, tvoří galvanický článek, ve kterém jako druhá elektroda slouží standardní vodíková elektroda. Činnost složeného galvanického článku je založena na reakci
Cu2+ + H2 → 2H++ Cu
Ve schématu galvanického článku jsou fázové hranice znázorněny jednou svislou čarou a elektrody jsou od sebe odděleny dvěma svislými čarami. Anoda ve schématu je označena vlevo a katoda vpravo:
ALE (-) Pt(H2)| 2H+ || Cu2+ | Cu(+) K
Katodou je v tomto případě měděná elektroda. Elektromotorická síla galvanického článku, měřená při koncentraci (aktivitě) iontů mědi 1 mol/l, je 0,34 V a lze ji vyjádřit jakoΔ E=E(Cu 2+ / Cu)- E(2H+/H2). Protože E(2H+/H2) se tedy považuje za nulu E(Cu2+ /Cu)=Δ E=0,34Za standardních podmínek. Pokud je měď nahrazena zinkem, pak vodíková elektroda bude katodou. Pak E(Zn 2+ /Zn) \u003d -Δ E= -0,76 V.
Elektrodové potenciály kovů měřené vzhledem k vodíkové elektrodě za standardních podmínek, tzn. aktivní koncentrace kovových iontů v roztoku rovna 1 mol/l a teplotě 25° Z(298 K), tzv Standard a označují E ° . Tak, E ° (Cu 2+ / Cu) = 0,34 V, E ° (Zn 2+ / Zn) \u003d -0,76V. Nazývá se řada kovů uspořádaných ve vzestupném pořadí jejich standardních elektrodových potenciálů blízké napětí. V zásadě to vypadá takto:
K, Ca , Na , Mg , Al , Zn , Fe , Ni , Sn , Pb , H, Cu , Hg , Ag , Pt , Au
Níže jsou uvedeny hlavní důsledky řady stresů:
a) Každý kov vytěsňuje ze solí všechny ostatní umístěné v řadě napětí napravo od něj.
b) Všechny kovy umístěné nalevo od vodíku jej vytěsňují z kyselin, umístěné napravo – nevytlačujte jej.
Hodnota potenciálu elektrody závisí na koncentrace V tomto případě máme na mysli molární koncentraci (mol / l). kovové ionty v roztoku jeho soli, jejich náboj ( n) a teplotu ( T), který je vyjádřen Nernstova rovnice :
![]() ;
;
tady F- Faradayovo číslo ( F=96485 96500 C/mol).
V T\u003d 298 K, můžete použít zjednodušenou formu Nernstovy rovnice:
![]()
Elektrochemický obvod může být složen ze dvou elektrod - galvanického článku, ve kterém se díky toku elektrochemických reakcí na elektrodách vytváří elektrická energie. Přenos náboje přes fázové rozhraní (elektrický proud) v takovém systému probíhá v důsledku elektrochemické reakce, ke které dochází spontánně. Elektroda, na které probíhá elektroredukce, se nazývá katoda a elektroda, na které dochází k elektrooxidaci, se nazývá anoda.
Jedna elektroda v galvanickém článku se někdy nazývá poloviční článek. Hlavní elektrickou charakteristikou elektrochemického obvodu je rozdíl v elektrických potenciálech mezi elektrodami. Spojení elektrod s vnějším vodičem vede ke vzniku elektrického proudu v obvodu.
Správně otevřený elektrochemický obvod, na jehož koncích je možné měřit rozdíl elektrického potenciálu, musí končit vždy stejně. chemické složení kovy . Toho se obvykle dosáhne jednoduchým připojením měděných drátů ke kovům M 1 a M 2 . Zařazení třetího kovového vodiče mezi dva kovové vodiče podle Voltova zákona nemění potenciálový rozdíl na koncích obvodu.
Elektrochemický obvod je v rovnováze za předpokladu, že elektrochemická rovnováha je pozorována na každé fázové hranici a rozdíl potenciálů na koncích obvodu E kompenzován rozdílem potenciálu z externího zdroje proudu.
Při schematickém záznamu elektrochemického obvodu:
1. Levá elektroda je napsána v obráceném pořadí (látky v roztoku jsou označeny vpravo od svislého pruhu, látky tvořící jinou fázi nebo materiál elektrody jsou označeny vlevo). Pravá elektroda se zaznamenává obvyklým způsobem podle pravidel pro schematický záznam elektrod;
2. Roztoky obou elektrod jsou odděleny svislou tečkovanou čarou, jsou-li ve vzájemném kontaktu (není eliminován difúzní potenciál), nebo dvěma tečkovanými svislými čarami, je-li eliminován difúzní potenciál mezi roztoky (např. solný můstek).
Ve správně otevřeném obvodu je na koncích podmíněného zápisu prvku v přírodě zaznamenán stejný kov. Pro zjednodušení se často v řetězcovém zápisu vynechává.
Podle pravidla pro zápis elektrodové reakce se oxidovaná forma látky a elektrony zapisují vlevo. , je rozdíl mezi reakcemi na pravé a levé elektrodě. Pak, pokud je potenciálový rozdíl celého prvku kladný, pak celková reakce a elektrický proud v galvanickém článku teče zleva doprava, pokud je záporný, pak v opačném směru.
Vzhledem k tomu, že elektroredukce nastává na katodě a elektrooxidace na anodě, pak v galvanickém článku (když dojde ke spontánním procesům), bude katoda elektropozitivnější elektrodou a anoda elektronegativnější. Pokud je prvek připojen k externímu zdroji proudu a způsobuje vynucené elektrochemické procesy (elektrolýzu), pak bude katoda elektronegativnější elektrodou a anoda bude elektropozitivnější. Aby nedocházelo k záměně, při zvažování elektrolýzy se častěji používají termíny katoda a anoda a při zvažování galvanických článků se pro označení katody a anody častěji používají termíny „plus“ a „mínus“.
Vezměme si jako příklad tři případy.
1. Obě elektrody mají společné řešení:
Pt, H2 (d) | HCl(aq) | AgCl | Ag
(1) AgCl + e Ag + Cl – (aq);
(2) 2H+ (aq) + 2e H2 (d).
Celková reakce probíhající v prvku
AgCl + 0,5H2 (d) Ag + HCl (vod.).
Pokud je EMF tohoto prvku kladné, bude celková reakce probíhat v dopředném směru, pravá elektroda bude kladnější - plus (katoda) a levá elektroda - více negativní - mínus (anoda).
2. Roztoky elektrod jsou různé a mají vzájemný kontakt přes membránu (není eliminován difúzní potenciál);
CD | Cd(NO 3) 2 (aq) ¦ NaCl(aq) | AgCl | Ag
Na elektrodách probíhají následující reakce:
(1) AgCl + e – Ag + Cl – (aq);
(2) Cd2+ (aq) + 2e Cd.
AgCl + 1/2Cd Ag + 1/2Cd 2+ (aq) + Cl – (aq).
3. Roztoky elektrod jsou různé a jsou propojeny solným můstkem (odpadá difúzní potenciál).
Pt | H 2 (d) | HCl(aq) || NaCl(aq) | AgCl | Ag
Na elektrodách probíhají následující reakce:
(1) AgCl + e Ag + Cl – (aq);
(2) 2H+ (aq) + 2e – H2(d).
Celková reakce, která v živlu formálně probíhá
AgCl + 1/2H2 (d) Ag + H+ (aq) + Cl - (aq).
Mezní hodnota rozdílu elektrických potenciálů, když proud skrz prvek má tendenci k nule, se nazývá elektromotorická síla (EMF) a označuje se E.
EMF galvanického článku je tvořeno potenciálními skoky na rozhraní všech fází, které tvoří článek (obr. 4).
Rozdíl potenciálů na koncích tohoto obvodu je součtem tří galvanických potenciálů:
![]() . (3.32)
. (3.32)
Obecně se na vzniku EMF galvanického článku podílejí nejen potenciálové skoky mezi fázemi elektrod, ale také rozdíl potenciálů mezi kovy, které tvoří elektronově vodivou fázi elektrod - tzv. kontaktní potenciál, stejně jako potenciálový rozdíl mezi fázemi elektrodových roztoků - difúzní potenciál.
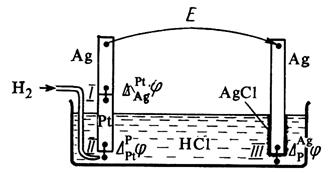
Rýže. 4. Galvanický článek složený z vodíku
a elektrody chloridu stříbrného.
Difúzní potenciál vzniká na hranici dvou roztoků v důsledku rozdílné pohyblivosti iontů obsažených v roztocích elektrod a/nebo jejich koncentrací. Galvanický článek může mít společný roztok elektrolytu pro obě elektrody. V tomto případě nebude difúzní potenciál chybět. V ostatních případech se při provádění elektrochemických měření snaží co nejvíce zbavit difúzního potenciálu. Existuje několik způsobů, jak eliminovat difúzní potenciál. Nejjednodušší je použití solného můstku naplněného solným roztokem pro spojení roztoků dvou elektrod, jejichž kationty a anionty mají přibližně stejnou pohyblivost (KCl, KNO 3).
Kontaktní potenciál nastává, když jsou elektrony vodivé fáze elektrod vyrobeny z různých kovů. Vzhledem k tomu, že v současné době neexistují přímé experimentální a výpočtové metody pro stanovení galvanických potenciálů na fázovém rozhraní v galvanickém článku, je hodnota elektromotorické síly galvanického článku vypočítána jako rozdíl dvou podmíněných potenciálů elektrody:
E=E P - E l, (3,33)
kde E p je potenciál pravé elektrody, E Já jsem potenciál levice.
Chemické řetězce
Galvanické články první typ - chemické obvody jsou prvky tvořené elektrodami, na kterých jsou různé el chemické reakce.
Činnost jakéhokoli elektrochemického prvku je založena na spontánních redoxních reakcích, které probíhají odděleně: na zápornější elektrodě (anodě) - oxidace, na kladnější (katodě) - redukce.
Spojení elektrod s vnějším vodičem vede ke vzniku elektrického proudu v obvodu. Například Daniel-Jacobiho prvek je složen ze dvou elektrod prvního druhu, zinku a mědi. Pořadí jejich připojení je znázorněno na schématu:
Cu | Zn | ZnSO 4 (aq) ¦ CuSO 4 (aq) | Cu.
(1) Cu2+ (aq) + 2e – Cu;
(2) Zn 2+ (aq) + 2e – Zn.
Celková reakce probíhající v prvku
Zn + Cu 2+ (aq) Cu + Zn 2+ (aq).
EMF tohoto prvku
kde ![]() .
.
Existují chemické řetězce se dvěma a jedním elektrolytem. Elektrochemické články se dvěma elektrolyty zahrnují Daniel-Jacobiho prvek diskutovaný výše.
Chemické obvody s jedním elektrolytem mohou být dvojího typu.
V řetězcích prvního typu je jedna elektroda reverzibilní vzhledem k kationtu, druhá vzhledem k aniontu. Například prvek
CD | CdCl2 (aq) | AgCl | Ag
Používá se ke stanovení průměrného koeficientu aktivity elektrolytu CdCl 2. Vypočítejte EMF tohoto prvku.
kde je průměrná aktivita roztoku CdCl2.
U galvanických článků druhého typu (s jedním elektrolytem) jsou obě elektrody reverzibilní vzhledem k jednomu z iontů. Příkladem může být prvek
hg | Hg 2 Cl 2 | KCl(aq) | Cl2 (g) | Pt
Výraz pro EMF tohoto prvku je:
Pokud vytvoříte podmínky, za kterých se EMF tohoto prvku bude rovnat standardní emf. Tento typ galvanických článků se používá k přesnému stanovení standardu elektromotorická síla(Eº) prvek.
Příklady řešení problémů
Příklad 1 Uveďte znaky elektrod a jejich typ, napište rovnice anodových a katodových procesů, celkové iontově-molekulární a molekulární rovnice procesů probíhajících v galvanickém článku, jejichž schéma je:
Ni½NiSO 4 aq║ CoSO 4 aq½Co.
Vypočítejte emf tohoto prvku, pokud a = 0,001 M, a \u003d 1 M. Standardní potenciály elektrod se rovnají: \u003d - 0,25 V; = - 0,28 V. Bude takový prvek fungovat samovolně?
1. Protože standardní potenciál elektrody je kladnější než potenciál elektrody, znaky elektrod jsou:
(+) Ni½NiSO 4 aq║ CoSO 4 aq½Co (–).
Jedná se o elektrody prvního druhu.
2. Na elektrodě, která má kladnější potenciál (), se uvolňují elektrony, tedy oxidační proces. Tato elektroda se nazývá anoda.
Na elektrodě, která má zápornější potenciál (), jsou přijímány elektrony, to znamená proces obnovy. Tato elektroda se nazývá katoda.
Procesy probíhající na elektrodách v galvanickém článku:
_______________________________
Molekulární rovnice: .
3. EMF prvku je:
E \u003d E + - E- \u003d -.
= + = - 0,28 + (0,059/2) lg1= - 0,28 V.
= + = - 0,25 + (0,059/2) lg0,001 = - 0,34 V.
E \u003d - 0,28 - (- 0,34) \u003d 0,06 V.
Protože EMF prvku je kladná hodnota, prvek funguje spontánně, od.
Příklad 2. M Může reakce nastat spontánně?
Nakreslete schéma galvanického článku, ve kterém tato reakce probíhá. Napište rovnice pro anodické a katodické procesy a také celkové iontově-molekulární a molekulární rovnice. Určete EMF tohoto prvku, když je aktivita iontů v roztoku rovna 1.
1. Udělejme galvanický článek ze dvou elektrod prvního druhu a. Podle údajů z literatury = +0,22 V, a = -0,40 V tedy obvod galvanického článku vypadá takto:
Cd½ CdCl2 (aq) || BiCl2 (aq) Bi.
2. V galvanickém článku probíhá na záporné elektrodě () oxidační reakce kadmia a na kladné elektrodě () proces redukce vizmutového iontu:
Ionto-molekulární rovnice: .
Molekulární rovnice: .
3. Protože aktivity iontů jsou rovné jedné, elektrodové potenciály se budou rovnat standardním elektrodovým potenciálům. EMF prvku je:
E \u003d - \u003d + 0,22 - (-0,40) \u003d + 0,62 V\u003e 0.
D r G = – zFE. Proto D r G> 0 a uvažovanou reakci
může dojít spontánně.
Příklad 3 Vypočítejte při 298 K EMF následujícího prvku:
Zn ½ZnCl 2 aq ║ СdCl 2 aq ½ Cd
C¢ \u003d 0,005 M С² \u003d 2 M
Standardní potenciály elektrod Cd 2+ ½Cd a Zn 2+ ½Zn jsou v tomto pořadí (-0,402) a (-0,763) V. Průměrné koeficienty aktivity CdCl2 a ZnCl2 v roztocích uvedených koncentrací jsou 0,044 a 0,789. Je možné změnit směr proudu v článku změnou koncentrace iontů kadmia a zinku v roztocích?
Řešení Existuje elektrochemický článek složený ze dvou různých elektrod prvního druhu. Porovnáním hodnot standardních elektrodových potenciálů těchto elektrod vidíme, že zinková elektroda v tomto obvodu je záporná (E 0 \u003d - 0,763 V) a kadmiová elektroda je kladná (E 0 \u003d - 0,402 V) .
Na elektrodách probíhají následující reakce:
(–) Zn \u003d Zn 2+ +2,
(+) Cd2+ +2 = Cd.
Celková reakce, ke které dochází během provozu elektrochemického prvku:
Zn + Cd 2+ = Zn 2+ + Cd.
Hodnoty potenciálu každé elektrody se rovnají:
![]() ;
;
![]() .
.
Hodnota EMF prvku je:
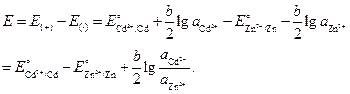
Dosadíme číselné hodnoty, vezmeme-li v úvahu, že aktivity iontů se rovnají průměrné aktivitě e odpovídajících elektrolytů
kde .
Pro změnu směru proudu v prvku je nutné, aby E (-) bylo větší než E (+), tj. E se stal negativním. Nejprve spočítejme, při jakém poměru aktivit iontů kadmia a zinku v roztoku se vyrovnají potenciály elektrod. V tomto případě bude EMF nabývat hodnoty rovné nule.
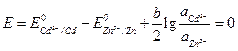 .
.
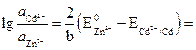
![]() .
.
Tudíž:
 nebo .
nebo .
Výsledek výpočtu ukazuje, že změnou koncentrací nelze dosáhnout ani potenciální rovnosti, protože aktivita iontů zinku musí být více než 10 12krát větší než aktivita iontů kadmia v roztoku. Takové podmínky je téměř nemožné realizovat.
Příklad 4 Zředěný roztok FeCl 3 v 0,5 M HC1 (f ± HCl = +0,757) se protřepe se rtutí (při 298 K) a reakce pokračuje
Fe 3+ + Hg + Cl - = Fe 2+ + 1/2 Hg 2 Cl 2
Určete poměr aktivit / po ustavení rovnováhy v této reakci, jsou-li standardní elektrodové potenciály Cl - / Hg 2 Cl 2, Hg a
Fe3+, Fe2+/Pt vzhledem ke standardní vodíkové elektrodě jsou 0,268 a 0,771 V.
Řešení. Sestavme elektrochemický prvek, ve kterém by probíhala reakce požadovaná podmínkou. Zvolme kalomelové a redoxní železné elektrody. Podle číselných hodnot standardních elektrodových potenciálů usuzujeme, že kalomelová elektroda bude záporná a železná redoxní elektroda kladná. Napíšeme řetězec:
(–) Hg, Hg 2 CI 2 | Cl – || Fe 3+, Fe 2+ | Pt (+)
Elektrodové reakce probíhající v tomto elektrochemickém prvku
(–) Hg + Cl - \u003d 1/2 Hg 2 Cl 2 + e -
(+) Fe 3+ + e - \u003d Fe 2+
a celkovou reakci, ke které dochází během provozu námi sestaveného elektrochemického prvku,
Hg + Fe 3+ + Cl - \u003d Fe 2+ + ½ Hg 2 Cl 2.
Porovnáním této reakce s reakcí indikovanou stavem problému a probíhající v baňce při protřepávání FeCl3 v HC1 se rtutí docházíme k závěru, že reakce jsou totožné.
Napišme výrazy pro elektrodové potenciály a EMF prvku:
![]()
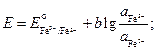
 .
.
Podle stavu problému je potřeba najít poměr aktivit iontů železa po ustavení rovnováhy. Bereme v úvahu, že elektrochemický prvek funguje, dokud není dosaženo rovnováhy, zatímco EMF se rovná nule:

Vyjádřeme odtud poměry aktivit iontů železa:

Vzhledem k tomu, že aktivita chloridových iontů se rovná průměrné aktivitě chlorovodíku
kde pro HCl. Odtud

Otázky pro sebeovládání
1. Definujte pojem standardní elektrodový potenciál a vysvětlete důvod rozdílu potenciálu mezi kovem a roztokem jedné z jeho solí.
2. V chemickém zdroji proudu
Pt½Fe +2, Fe +3 ║ Ag + ½ Ag
reakce probíhá:
Fe +2 (sol.) + Ag + (sol.) = Fe +3 (sol.) + Ag (tv).
Jaký vliv (zvýšení, snížení nebo žádný vliv) by měly mít následující změny na napětí zdroje proudu:
a) zvýšení koncentrace Fe +3 (sol);
b) současné zvýšení koncentrace Fe +3 (sol.) a Fe +2 (sol.) v stejné číslo jednou;
c) přidání pevného stříbra;
d) přidání určitého množství NaCl do roztoku obsahujícího ionty stříbra.
3. Jak určit směr spontánní chemické přeměny v průběhu dějů v elektrochemickém prvku? Uveďte rozumnou odpověď, kterým směrem bude reakce spontánně probíhat:
4. Vysvětlete význam oddělovacích znaků (½ a ║) ve schematickém znázornění chemického zdroje proudu:
Zn ½ZnSO 4 aq ║ CuSO 4 aq ½ Cu
Kde je v tomto obvodu anoda a kde katoda? Vysvětlete význam pojmů anoda a katoda a na diagramu naznačte směr toku elektronů ve vnějším obvodu.
5. Co by se mělo stát, když se ionty (ve formě solí) zavedou do roztoku obsahujícího přebytek zředěné kyseliny sírové? Pro vysvětlení použijte hodnoty standardních redoxních potenciálů elektrod: = 0,76 V; \u003d 1,52 V.
koncentrační řetězce
Galvanické články druhého typu - koncentrační obvody jsou prvky tvořené elektrodami, na kterých probíhají stejné chemické reakce, ale koncentrace reaktantů na elektrodách jsou různé. Elektrická energie v koncentračních článcích vzniká vyrovnáváním koncentrací látek.
Existují koncentrační řetězce bez přenosu a s přenosem. Následující prvky se nazývají koncentrační řetězce bez přenosu:
a) se stejnými elektrodami, ale s různými koncentracemi elektrolytů bez přímého kontaktu mezi roztoky;
b) s elektrodami vyrobenými ze dvou slitin (amalgámů), stejných povahou, ale různé koncentrace, ponořených do jednoho roztoku elektrolytu;
c) s plynovými elektrodami, identické povahy, ale s různým tlakem plynu (s jedním roztokem elektrolytu).
Příkladem koncentračního řetězce bez přenosu je koncentrační řetězec amalgámu:
kde a1 a a2 jsou aktivity kadmia v amalgámu.
Na elektrodách tohoto koncentračního prvku probíhají následující elektrochemické reakce:
Celková reakce v prvku - ![]() .
.
Emf tohoto prvku je generován vyrovnáním aktivity kadmia v amalgámech ():
Koncentrační řetězce s přenosem jsou takové koncentrační prvky, ve kterých existuje přímá kontaktní hranice mezi roztoky. Na rozhraní mezi roztoky dvou stejných elektrolytů o různých koncentracích vzniká v důsledku rozdílné pohyblivosti kationtů a aniontů tzv. difúzní potenciál
Například,
Cu | CuSO 4 ¦ CuSO 4 | Cu
kde a jsou různé aktivity měděných iontů na elektrodách, j D je difúzní potenciál, který se vyskytuje na hranici roztoků.
Zapišme potenciály obou elektrod:
![]() . (3.38)
. (3.38)
Pak bude emf prvku
Rozdíl v koncentracích látek na různých elektrodách koncentračních prvků je zpravidla malý, takže difúzní potenciál významně přispívá k celkovému EMP. Existuje několik vztahů pro výpočet EMF galvanického článku, přičemž se bere v úvahu difúzní potenciál.
1. Pokud jsou elektrody reverzibilní vzhledem k kationtu, pak bude elektromotorická síla galvanického článku rovna:
![]() , (3.40)
, (3.40)
kde t je číslo transportu aniontu, n je celkové E počet částic vzorce, které tvoří daný elektrolyt (celkový počet iontů, na které se elektrolyt rozkládá), n + je počet částic vzorce kationtů (počet kationtů, na které se elektrolyt disociuje), které tvoří tento elektrolyt .
Difúzní potenciál se v tomto případě vypočítá vztahem: .

Odkud 1 \u003d 0,68 M.
Otázky pro sebeovládání
1. Kolik elektrod může být součástí koncentračního prvku?
2. Jaký je rozdíl mezi koncentračními prvky s iontovým transportem a koncentračními prvky bez iontového transportu?
3. Prvek koncentrace vypadá takto:
K(Hg)|KCl(aq)|AgCl,Ag,AgCl|KCl(aq)|K(Hg)
Kolik galvanických článků obsahuje? Vyhodnoťte znaky prvků, které zajišťují samovolný chod prvku. Jak vypočítat emf tohoto prvku?
4. Prvek koncentrace vypadá takto:
Hg, HgO|KOH(aq)|KOHaq)|HgO,Hg.
Jaký typ je tento koncentrační prvek? Vyhodnoťte známky elektrod, které zajišťují samovolnou činnost prvku. Jak vypočítat emf tohoto prvku?
5. Jak souvisí EMF prvku s disociačními konstantami elektrolytů CH 3 COOH a HCOOH?. Do jakého typu galvanických prvků tento prvek patří a proč?
H2,Pt |CH3COOH(aq)|HCOOH(aq)| Pt, H2,