Jak napsat příklad emf rovnice chemie. Měření EMF galvanických článků
Galvanický článek Zařízení, které přeměňuje chemickou energii na elektrickou energii. Jedním z takových prvků je prvek Daniel-Jacobi. Tento prvek se skládá ze dvou elektrod: zinku a mědi, ponořených do odpovídajících síranových roztoků, mezi nimiž je porézní přepážka:
Když je vnější obvod uzavřen, elektrony přecházejí ze Zn do Cu a zinek difunduje do mědi:
Tvoříme elektrochemický obvod:
Anoda - záporná elektroda (vlevo). Katoda je kladná elektroda.
Chcete-li určit EMF tohoto prvku, musíte porovnat standard elektrodové potenciály obě elektrody. Při záznamu elektrodových reakcí se předpokládá, že oxidovaná forma je na levé straně a redukovaná forma je na pravé straně rovnice.
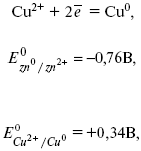
kde E 0 – elektromotorická síla(EMF) galvanického článku, když jsou všechna činidla ve standardním stavu.
element emf se vypočítá odečtením anodového potenciálu od katodového potenciálu.
EMF prvku je +0,34 - (-0,76) \u003d 1,1 V; čím více se od sebe elektrodové potenciály liší, tím větší je EMF. Pokud je kov ponořen do solného roztoku o vyšší koncentraci, pak je potenciál nestandardní. To znamená, že koncentrace a teplota ovlivňují velikost potenciálu elektrody. Tato závislost je vyjádřena V. Nernstova rovnice.
kde P - počet iontů;
R je univerzální plynová konstanta;
T - teplota;
S - koncentrace aktivních iontů v roztoku;
F- Faradayovo číslo = 96500 V.
HITY- zařízení, která slouží k přímé přeměně energie chemické reakce na elektrickou energii. Hity se používají v různých oblastech techniky. V komunikačních prostředcích: rozhlas, telefon, telegraf; v elektrických měřicích zařízeních; slouží jako zdroje energie pro automobily, letadla, traktory; slouží k pohonu startérů atd.
Nevýhody HIT:
1) náklady na látky nezbytné pro práci: Pb, Cd, jsou vysoké;
2) poměr množství energie, kterou může prvek dát své hmotnosti, je malý.
Výhody HIT:
1) Hity se dělí do dvou hlavních skupin: vratné (baterie), nevratné (galvanické články). Baterie lze použít opakovaně, protože jejich výkon lze obnovit průchodem proudu v opačném směru z externího zdroje a v galvanických článcích je lze použít pouze jednou, protože jedna z elektrod (Zn v článku Daniel-Jacobi) je nevratně spotřebováno;
2) používají se elektrolyty absorbované porézními materiály, mají větší vnitřní odpor;
3) vytvoření palivových článků, při jejichž provozu by se spotřebovávaly levné látky s nízkou hustotou ( zemní plyn vodík);
4) pohodlný provoz, spolehlivost, vysoké a stabilní napětí.
Zvažte technologický proces založený na olověných bateriích s obalenými elektrodami.
Obecné schéma: (–) účinná látka | elektrolyt | účinná látka (+).
Aktivní látkou záporné elektrody je redukční činidlo darování elektronů. Při vybíjení je zápornou elektrodou anoda, tedy elektroda, na které probíhají oxidační procesy. Aktivní látkou kladné elektrody je oxidační činidlo. Aktivní látky - oxidační činidlo a redukční činidlo - se účastní elektrochemické reakce.
Elektrochemické schéma olověného akumulátoru
Aktivními látkami olověného akumulátoru jsou houbovité olovo a PbO 2 . Tvorba aktivních hmot v elektrodách je následující: na elektricky vodivý rám konstrukce se nanese pasta nebo směs oxidů Pb; při následné tvorbě plátů dochází k přeměně oxidů Pb na účinné látky. Formace– přeměna nenabité hmoty na nabitou hmotu. Tyto desky se dělí v závislosti na typu rámu na rozpěrné a příhradové. Většina baterií je sestavena z omítnutých desek. Při jejich výrobě se do buněk profilových mřížek o tloušťce 1–7 mm, odlévaných ze slitiny Pb–Sb, vtírá pasta oxidů olova. Po vytvrzení pasta drží na mřížce, záruka na takovou baterii je 2-3 roky. Při volbě materiálů pro sběrače proudu kladných elektrod baterie je důležité zajistit jejich praktickou pasivitu (při zachování elektrické vodivosti) za podmínek nabíjení (až do velmi vysokých potenciálů s anodickou polarizací). K tomuto účelu se v roztocích H 2 SO 4 používá Pb nebo jeho slitiny. Pouzdro a kryt HIT mohou být vyrobeny z oceli nebo různých dielektrik, ale u olověných baterií je pouzdro vyrobeno z ebonitu, polypropylenu a skla. Elektrolyt v olověném akumulátoru se může podílet na celkové proudotvorné reakci. Pro proudové odbočky záporné elektrody se používají Cu, Ti, Al.
3. Regenerace a likvidace HIT
Život galvanické články končí (CHIT výboj) po úplném nebo částečném použití aktivních materiálů, jejichž výkon po vybití lze obnovit nabíjením, tedy průchodem proudu v opačném směru, než je směr proudu při vybíjení: takové galvanické články jsou volala akumulátory. Záporná elektroda, která byla anodou při vybíjení baterie, se při nabíjení stává katodou. podmínky nejlepší využití aktivní materiály mají nízkou proudovou hustotu, vysoké teploty až do normy. Obvykle je důvodem špatné funkce HIT pasivace elektrod– prudké snížení rychlosti elektrochemického procesu při výboji, způsobené změnou stavu povrchu elektrody při výboji v důsledku tvorby oxidových vrstev nebo solných filmů. Způsob, jak bojovat s pasivací, je snížit skutečnou hustotu výbojového proudu pomocí elektrod s vyvinutým povrchem. Výroba HIT se vyznačuje použitím různých toxických látek (silná oxidační činidla, sloučeniny Pb, Hg, Zn, Cd, Ni používané v jemně rozptýleném stavu; kyseliny, zásady, organická rozpouštědla). Pro zajištění běžných pracovních podmínek je plánována automatizace výrobních procesů, racionální ventilační systémy včetně využití lokálního odsávání ze zařízení s toxickými emisemi, utěsňovací zařízení, nahrazení suchých metod zpracování prašných materiálů mokrými, čištění znečištěného vzduchu a plynů z aerosoly a čištění průmyslových odpadních vod. HIT má masivní využití národní ekonomika spojené s problémy životního prostředí. Zatímco olovo z baterií mohou spotřebitelé většinou vrátit do recyklačních závodů, likvidace malých primárních CPS pro domácnost není ekonomicky životaschopná.
Každá Hg-Zn baterie poskytuje 5-7 dní provozu sluchadla.
Elektromobily jsou vyvíjeny pomocí HIT namísto spalovacích motorů, které otravují atmosféru měst výfukovými plyny. Z hlediska míry negativního vlivu na životní prostředí je galvanická výroba na prvním místě. Důvodem extrémně negativního dopadu výroby galvanického pokovování je to, že naprostá většina podniků v technologických postupů pouze 10 - 30 % solí těžkých kovů je smysluplně využito při nanášení nátěrů, zatímco zbytek se při neuspokojivé práci dostává do prostředí. Cesta ven je minimalizovat ztráty solí neželezných kovů, to znamená snížit odstraňování elektrolytů částmi z galvanické lázně. To povede ke snížení koncentrací a objemů odpadních vod a tím ke vzniku potřebné podmínky pro nízkoodpadové (LWT) a bezodpadové (LWT) aplikační technologie galvanicky pokovené povlaky. Nejprve musíte vybrat správný elektrolyt. Základním principem ILO a BOT je snížit vstupní chemikálie a dodat méně jedů na výstupu procesu.
proměna chemická energie na elektrickou energii se vyskytuje v elektrochemických systémech, které se nazývají galvanické články.
Galvanický článek je uzavřený elektrochemický systém sestávající ze dvou elektrod.
Vezměme si Jacobi-Danielův galvanický článek. Skládá se z měděné desky ponořené do roztoku CuSC4 a zinkové desky ponořené do roztoku ZnSC4. Aby se zabránilo přímé interakci mezi oxidačním činidlem a redukčním činidlem, jsou elektrody od sebe odděleny porézní přepážkou.
Schéma galvanického článku:
Zn | ZnSO4| | CuS04| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
Na povrchu zinkové desky se objeví dvojitá elektrická vrstva a ustaví se rovnováha:
V důsledku tohoto procesu vzniká elektrodový potenciál zinku.
Na povrchu měděné desky se také objeví dvojitá elektrická vrstva a ustaví se rovnováha:
Сu2+ + 2е « Сu, proto vzniká elektrodový potenciál mědi.
Potenciál zinkové elektrody má zápornější hodnotu než potenciál měděné elektrody, proto, když je vnější obvod uzavřen, tj. když je zinek spojen s mědí kovovým vodičem, elektrony přejdou ze zinku na měď.
Když je tedy vnější okruh uzavřen, dochází k samovolným procesům rozpouštění zinku na zinkové elektrodě a precipitaci mědi na měděné elektrodě. Tyto procesy budou pokračovat, dokud se potenciály elektrod nevyrovnají nebo dokud se veškerý zinek nerozpustí (nebo se všechna měď neuloží na měděnou elektrodu).
Takže během provozu prvku Jacobi-Daniel probíhají následující procesy:
1) oxidační reakce zinku: Zn - 2е ® Zn2+.
Oxidační procesy v elektrochemii se nazývají anodové procesy a elektrody, na kterých probíhají oxidační procesy, se nazývají anody;
2) redukční reakce iontů mědi: Сu2+ + 2е « Сu.
Redukční procesy v elektrochemii se nazývají katodické procesy a elektrody, na kterých redukční procesy probíhají, se nazývají katody;
pohyb elektronů ve vnějším obvodu;
pohyb iontů v roztoku: anionty (SO4-2) na anodu, kationty (Cu2+, Zn2+) na katodu. Pohyb iontů v roztoku uzavírá elektrický obvod galvanického článku. Sečtením elektrodových reakcí získáme:
Zn + Cu2+ = Zn2+ + Сu.
V důsledku této chemické reakce v galvanickém článku dochází k pohybu elektronů ve vnějším obvodu a iontů uvnitř článku, tj. vzniká uzavřený elektrický systém a v něm vzniká elektrický proud. Celkový chemická reakce, proudící v galvanickém článku, se nazývá proudotvorný.
Elektrický proud, který se vyskytuje v daném elektrochemickém systému, je číselně charakterizován velikostí elektromotorické síly (EMF) prvku. Rovná se rozdílu mezi elektrodovými potenciály katody a anody:
Za standardních podmínek je spontánní chemická reakce možná, když se maximální užitečná práce vykonaná v důsledku této reakce rovná záporné hodnotě změny volné energie:
V galvanickém článku se maximální elektrická práce vykonaná za standardních podmínek rovná EMF článku vynásobeném množstvím elektřiny (nF), tzn.
A = nFE0, (7,5)
kde n je počet elektronů zapojených do reakce;
F je Faradayova konstanta, rovna 96500 C/mol;
E0 - standardní elektromotorická síla galvanického článku (T= 298 K, molární koncentrace elektrolytů je 1 mol/dm3). Maximální práce galvanického článku se tedy rovná:
A \u003d -DG0 \u003d nFE0. (7,6)
Standardní emf galvanický článek se rovná:
Galvanické články se podle charakteru elektrod a koncentrace elektrolytů dělí na chemické a koncentrační.
Chemické galvanické články jsou takové články, kde se liší elektrody a elektrolyty. Příkladem chemického galvanického článku je Jacobi-Danielův článek.
Koncentrační galvanické články jsou takové články, které se skládají ze stejných elektrod, ale koncentrace elektrolytu se liší, například stříbrné elektrody ponořené do roztoků dusičnanu stříbrného různých koncentrací:
Ag | AgNO3 (0,01 mol/dm3) | | AgNO3 (0,1 mol/dm3) | Ag.
Příklad 1. Galvanický článek se skládá z kovového zinku ponořeného v roztoku dusičnanu zinečnatého o molární koncentraci 0,1 mol/dm3 a kovového olova ponořeného v roztoku dusičnanu olovnatého o molární koncentraci 0,02 mol/dm3 diagram prvku.
Rozhodnutí. Pro určení EMF prvku je nutné vypočítat elektrodové potenciály pomocí Nernstovy rovnice (7.2):
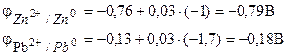
EMF prvku zjistíme podle vzorce (7.3).
Při studiu této části se doporučuje vypracovat následující otázky: koncept elektrodových potenciálů; galvanické články (GE); elektromotorická síla galvanického článku (EMF) a její měření; standardní vodíková elektroda a stupnice vodíkového potenciálu; Nernstova rovnice; potenciály kovových, plynových a redoxních elektrod; kinetika elektrodových procesů; elektrochemická a koncentrační polarizace.
Galvanický článek je elektrochemický systém sestávající z elektrod ponořených v roztoku elektrolytu a vzájemně propojených kovovým vodičem, který tvoří vnější obvod článku.
Činnost galvanického článku je založena na procesech probíhajících na rozhraní mezi kovovou elektrodou a elektrolytem, v jejichž důsledku se vytváří dvojitá elektrická vrstva. Díky dvojité elektrické vrstvě dochází k potenciálovému skoku, nazývanému elektrodový potenciál. Hodnota elektrodového potenciálu kovu je kvantitativní charakteristikou jeho aktivity. Aby bylo možné porovnat aktivitu různých kovů, je zaveden koncept standardního elektrodového potenciálu j o. Čím negativnější je potenciál kovu, tím silnější je redukční schopnost tohoto kovu. Naopak, čím kladnější je potenciál kovové elektrody, tím silnější jsou oxidační schopnosti iontů.
Hodnota potenciálu kovové elektrody závisí na teplotě, aktivitě iontů a vypočítává se pomocí Nernstovy rovnice
kde je standardní elektrodový potenciál měřený vzhledem k vodíkové elektrodě za standardních podmínek ( T= 298 K; = 1 mol/l, R= 1 atm) (tabulka 9 v příloze);
R je univerzální plynová konstanta;
T je absolutní teplota, K;
n je počet elektronů zapojených do procesu;
F- Faradayova konstanta, rovna 96 548 C / mol;
je aktivita kovových iontů v roztoku, mol/l.
Po dosazení hodnot konstant a převedení přirozeného logaritmu na desítkový má Nernstův vzorec tvar:
Potenciály vodíkových a kyslíkových elektrod, které jsou plynovými elektrodami, závisí na pH roztoku a parciálním tlaku. Potenciály těchto elektrod jsou uvedeny v tabulce. deset.
Příklad 1 Vypočítejte elektrodový potenciál vodíkové elektrody v neutrálním prostředí při = 1 atm.
Rozhodnutí. Elektrodový potenciál vodíkové elektrody je určen Nernstovou rovnicí na základě schématu elektrodového procesu:
oxidovaný redukovaný
formulář formuláře
Aktivita vodíkových iontů v neutrálním prostředí A= 10 –7 a = 0,
pak 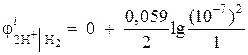 = -0,418 V.
= -0,418 V.
Získanou hodnotu porovnejte s tabulkovou (tabulka 10 v příloze).
Příklad 2 Stříbrná elektroda je ponořena do roztoku dusičnanu stříbrného AgNO 3 s iontovou aktivitou = 1·10 -2 mol/l. Vypočítejte potenciál elektrody.
Rozhodnutí. Proces elektrody:
oxidovaný redukovaný
formulář formuláře
Elektrodový potenciál stříbra se vypočítá pomocí Nernstovy rovnice:
 \u003d 0,8 + 0,059 × lg10 -2 \u003d 0,682 V.
\u003d 0,8 + 0,059 × lg10 -2 \u003d 0,682 V.
Příklad 3 Nakreslete schéma galvanického článku sestávajícího z železných a měděných elektrod ponořených do roztoků vlastních solí. Napište iontově-elektronické rovnice elektrodových procesů a vypočítejte EMF tohoto HE, jsou-li aktivity iontů v odpovídajících roztocích následující: = 1 · 10 –2 mol/l, a = 1,0 mol/l.
Rozhodnutí. Ionto-elektronické rovnice elektrodových procesů:
A: Fe - 2 ® Fe 2+
K: Cu 2+ + 2 ® Cu
Železná elektroda je anoda, protože jeho standardní elektrodový potenciál ( = - 0,44 V) je menší než standardní potenciál měděné elektrody ( = + 0,34 V) (Tabulka 9 v Dodatku).
Schéma galvanického článku uvedené v podmínce má tvar:
(–) Fe | Fe 2+ || Cu 2+ | Cu (+)
Určete EMF prvku:
Elektrodový potenciál anody je určen Nernstovou rovnicí a katodový potenciál je standardní hodnota:
EMF \u003d 0,34 - (- 0,499) \u003d 0,839 V.
Příklad 4 Obvod galvanického článku má tvar:
(–) Zn |ZnCl 2 || ZnCl2 |Zn (+). Vypočítejte EMF tohoto prvku, jestliže aktivita iontů zinku je 0,001 mol/l v jedné poločlánku a 0,01 mol/l ve druhé. Napište rovnice pro anodické a katodické procesy.
Rozhodnutí. Ve stavu problému je uveden koncentrační galvanický článek. V takovém prvku bude katodou zinek, spuštěný do solného roztoku s vyšší aktivitou iontů Zn 2+ = 0,01 mol/l.
Rovnice elektrodových procesů:
A: Zn - 2 ® Zn 2+
K: Zn 2+ + 2 ® Zn
Určete EMF prvku:
Potenciály elektrod najdeme pomocí Nernstovy rovnice:
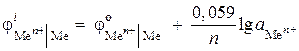 ,
,
EMF \u003d - 0,819 - (- 0,848) \u003d 0,029 V.
Příklad 5 Pro galvanický článek:
(–) Mn | Mn 2+ || 2H + | H2, Ni (+)
napište rovnice elektrodových procesů a vypočítejte skutečné EMF s přihlédnutím k přepětí vývoje vodíku, je-li aktivita manganových iontů 1 10–2 mol/l, a vodíkových iontů 1,0 mol/l (at = 1 atm) .
Rozhodnutí. Elektrodové procesní rovnice:
A: Mn-2® Mn2+
K: 2H + + 2 ® H 2 (v kyselém prostředí probíhá na katodě proces depolarizace vodíku)
Během provozu galvanického článku se EMF a proud snižují. To je způsobeno změnami elektrodových potenciálů anody a katody. Změna potenciálu elektrody, vedoucí ke snížení EMF a síly proudu, se nazývá polarizace.
Existují tři typy polarizace: plynová, koncentrační a elektrochemická. Rozdíl mezi rovnovážným potenciálem elektrody a jejím potenciálem ve stejném roztoku při průchodu elektrický proud, se nazývá přepětí (tabulka 11 v příloze).
Za podmínek tohoto problému je přepětí vývinu vodíku na katodě = 0,30 V (tabulka 11 v příloze) a elektrodový potenciál vodíkové elektrody v kyselém prostředí při tlaku vodíku 1 atm se rovná nule. : = 0. Katodový potenciál s přihlédnutím k přepětí se určí:
Elektrodový potenciál anody je určen vzorcem. Vzhledem k tomu, že přepětí kovu na kovu se podmíněně rovná nule, pak .
EMF \u003d - 0,30 - (-1,239) \u003d 0,939 V.
Příklad 6 Vypočítejte hodnotu potenciálu redoxní elektrody Pt | Sn4+, Sn2+. Redukční reakce Sn 4+ + 2 ® Sn 2+ probíhá v roztoku s iontovými aktivitami = 0,1 mol/l, = 0,001 mol/l. ![]() .
.
Rozhodnutí. Potenciál redoxní elektrody je určen rovnicí:
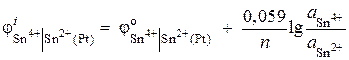 .
.
Příklad 7Železná elektroda v roztoku její soli má elektrodový potenciál ![]() . Vypočítejte aktivitu iontů v roztoku, mol/l.
. Vypočítejte aktivitu iontů v roztoku, mol/l.
Rozhodnutí. Aktivitu iontů železa určíme pomocí Nernstovy rovnice:
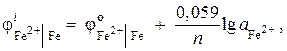
od \u003d - 0,44 V (tabulka 9 aplikace) a n= 2 tedy
![]() ;
;
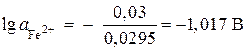 ,
, ![]() mol/l.
mol/l.
Příklad 8. Vypočítejte standardní emf galvanického článku, ve kterém byla ustavena rovnováha:
Zn + 2Ag + « Zn 2+ + 2Ag,
-li ![]() = -146,5 kJ/mol, a = 77,2 kJ/mol.
= -146,5 kJ/mol, a = 77,2 kJ/mol.
Rozhodnutí. Standardní EMF galvanického článku je určeno rovnicí:
–  ,
,
kde nF- množství elektřiny, které lze teoreticky získat elektrochemickou přeměnou jednoho molu látky;
F je Faradayova konstanta ( F\u003d 96,548 kJ / V mol), nebo F» 96 500 C/mol,
n je počet elektronů zapojených do procesu pro náš GE n = 2;
– standardní Gibbsova energie této reakce je rovna:
Vzhledem k tomu, že standardní Gibbsovy energie tvorby jednoduchých látek zinku a stříbra jsou rovné nule, dosazením číselných hodnot množství zjistíme:
= - 146,5 - 2 77,2 = - 300,9 kJ.
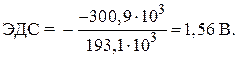
KONTROLNÍ ÚKOLY
201. Vytvořte diagram, napište iontově-elektronické rovnice elektrodových procesů a vypočítejte EMF zinko-hořčíkového galvanického článku, ve kterém je aktivita iontů zinku = 1 10 -1 mol / l a iontů hořčíku = 1,0 mol / l.
Odpověď: 1,571 V.
202. Pro galvanický článek (-) Cr | Cr 3+ || 2H + | H2, Fe (+)
napište rovnice elektrodových procesů a vypočítejte skutečné EMF s přihlédnutím k přepětí vývoje vodíku, je-li aktivita iontů chrómu = 1 10 -2 mol/l, a iontů vodíku = 1,0 mol/l (at = 1 atm) .
Odpověď: 0,419 V.
203. Hliníkové a měděné desky jsou spojeny vnějším vodičem a spuštěny do roztoku kyseliny sírové. Vytvořte schéma galvanického článku a napište iontově-elektronické rovnice elektrodových procesů probíhajících na anodě a na katodě.
204. Vypočítejte elektrodový potenciál vodíkové elektrody v kyselém prostředí při tlaku = 2 atm a [H + ] = 1 mol/l.
Odpověď: - 9 × 10 -3 V.
205. Udělejte diagram, napište iontově-elektronické rovnice elektrodových procesů a vypočítejte EMF železo-rtuťového galvanického článku, ve kterém aktivita iontů železa = 1 10 -3 mol / l, a iontů rtuti = 1 10 - 2 mol/l.
Odpověď: 1,319 V.
206. Vytvořte schéma galvanického článku, který je založen na chemické reakci, která probíhá podle rovnice:
Mg + 2AgN03® Mg (NO 3) 2 + 2Ag.
Napište iontově-elektronickou rovnici pro elektrodové procesy a vypočítejte EMF tohoto prvku, pokud aktivita iontů hořčíku = 0,01 mol/l a iontů stříbra = 0,001 mol/l.
Odpověď: 3,043 V.
207. Vytvořte schéma galvanického článku, který je založen na chemické reakci, která probíhá podle rovnice:
Zn + Pb(NO 3) 2 ® Zn(NO 3) 2 + Pb.
Napište iontově-elektronickou rovnici pro elektrodové procesy a vypočítejte EMF tohoto prvku, pokud aktivita iontů zinku = 0,001 mol/l a iontů olova = 0,01 mol/l.
Odpověď: 0,659 V.
208. Vypočítejte hodnotu potenciálu redoxní elektrody Pt | Fe 3+, Fe 2+, pokud = + 0,77 V, a aktivity iontů železa v roztoku jsou = 0,001 mol/la = 0,1 mol/l.
Odpověď: 0,652 V.
209. hliníková elektroda v solném roztoku má elektrodový potenciál ![]() . Vypočítejte aktivitu iontů Al 3+, mol/l.
. Vypočítejte aktivitu iontů Al 3+, mol/l.
Odpověď: 0,095 mol/l.
210. Který galvanický prvek se nazývá koncentrace? Vytvořte diagram, napište iontově-elektronické rovnice elektrodových procesů a vypočítejte EMF galvanického článku sestávajícího ze dvou měděných elektrod ponořených v roztocích síranu měďnatého CuSO 4 s aktivitou iontů mědi v prvním roztoku = 0,01 mol/l a c = 0,001 mol/l ve druhém.
Odpověď: 0,029 V.
211. Vytvořte schéma dvou galvanických článků, z nichž jeden by byl katodou zinek a druhým anodou. Napište pro každý z těchto prvků iontově-elektronické rovnice reakcí probíhajících na katodě a anodě.
212. Při jaké aktivitě iontů Mn 2+ (mol / l) bude potenciál manganové elektrody o 0,018 V menší než její standardní elektrodový potenciál?
Odpověď: 0,25 mol/l.
213. Potenciál měděné elektrody v roztoku chloridu měďnatého CuCl 2 byl 97 % hodnoty jejího standardního elektrodového potenciálu. Jaká je aktivita iontů, (mol / l)?
Odpověď: 0,46 mol/l.
214. Pro galvanický článek
(–) Mg | Mg2+ || 2H + | H2, Cu (+)
napište rovnice elektrodových procesů a vypočítejte skutečné EMF s přihlédnutím k přepětí vývoje vodíku, je-li aktivita hořčíkových iontů = 1 10 -3 mol/l, a vodíkových iontů = 1,0 mol/l (at = 1 atm) .
Odpověď: 1,968 V.
215. Vypočítejte EMF galvanického článku, ve kterém byla ustavena rovnováha při 298 K: Mg + Cd 2+ « Mg 2+ + Cd, je-li aktivita iontů hořčíku = 0,01 mol / l a iontů kadmia = 10 -2 mol / l. Napište rovnice elektrodových procesů.
Odpověď: 0,709 V.
219. Vypočítejte EMF galvanického článku, ve kterém byla ustavena rovnováha při 298 K: 2Na + H 2 O (g) + 1 / 2O 2 "2NaOH (k),
if = - 228,76 kJ/mol a ![]() = - 380,46 kJ/mol.
= - 380,46 kJ/mol.
Odpověď: 2,76 V.
220. Vypočítejte hodnotu potenciálu redoxní elektrody Pt | Co 3+ , Co 2+ s aktivitami kobaltových iontů = 1 mol/l a = 0,001 mol/l, pokud ![]() .
.
3.5.1 Elektrické potenciály na fázových rozhraních
Když se vodič prvního druhu (elektroda) dostane do kontaktu s polárním rozpouštědlem (vodou) nebo roztokem elektrolytu na rozhraní elektroda-kapalina, dojde k tzv. elektrická dvouvrstva (DES). Jako příklad uvažujme měděnou elektrodu ponořenou do vody nebo do roztoku síranu měďnatého.
Když je měděná elektroda ponořena do vody, část iontů mědi umístěných v uzlech krystalové mřížky v důsledku interakce s vodními dipóly přejde do roztoku. Záporný náboj vznikající současně na elektrodě udrží ionty, které prošly do roztoku, v blízkém elektrodovém prostoru - vznikne dvojitá elektrická vrstva (obr. 3.12a; modely struktury DEL viz část 4.2 .4). Záporný náboj na elektrodě zabrání dalšímu přechodu iontů mědi do roztoku a po nějaké době se ustaví dynamická rovnováha, kterou lze jednoznačně charakterizovat potenciálem elektrického pole DEL Φ v závislosti na náboji na elektrodě. elektrodou, nebo nějakou rovnovážnou koncentrací iontů v blízké elektrodové vrstvě C o . Když je měděná elektroda ponořena do roztoku CuSO 4 obsahujícího ionty mědi o koncentraci C, jsou možné tři případy:
Rýže. 3.12 Schéma dvojité elektrické vrstvy na rozhraní elektroda-roztok
1. C< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в povrchová vrstva roztok kationtů bude více než aniontů (obr. 3.9a).
2. C > Co. Protože koncentrace iontů mědi v povrchové vrstvě je větší než rovnovážná, začne přechod iontů z roztoku na elektrodu; na elektrodě vzniká kladný náboj a v povrchové vrstvě převládají anionty SO 4 2- (obr. 3.12b).
3. C \u003d C o. Protože koncentrace iontů mědi v povrchové vrstvě je rovna rovnovážné (takové roztoky se nazývají nulové roztoky), nevzniká na elektrodě žádný náboj a nevzniká dvojitá elektrická vrstva.
3.5.2 Galvanický článek. EMF galvanického článku
Uvažujme nejjednodušší galvanický článek Daniel-Jacobi, skládající se ze dvou poločlánků - zinkových a měděných plátů, umístěných v roztocích síranů zinečnatých, respektive měďnatých, které jsou vzájemně propojeny pomocí elektrolytického klíče - například pruhem navlhčeného papíru roztokem nějakého elektrolytu. Schematicky je tento prvek znázorněn následovně:
Zn / Zn2+ // Cu2+ / Cu
Na povrchu každé z elektrod je dynamická rovnováha přechodu kovových iontů z elektrody do roztoku a naopak, charakterizovaná potenciálem EDL (náboj elektrody q). Pokud propojíte měděné a zinkové elektrody s kovovým vodičem, okamžitě dojde k redistribuci nábojů - elektrony se začnou přesouvat z elektrody s zápornějším nábojem (v našem případě zinku) na elektrodu s kladnějším nábojem (měď ), tj. ve vodiči poteče elektrický proud. Změna hodnoty náboje každé z elektrod naruší rovnováhu - na zinkové elektrodě začne proces přechodu iontů z elektrody do roztoku (oxidace kovu), na měděné elektrodě - z roztoku na elektrodu (kovová redukce); v tomto případě průběh procesu na jedné elektrodě způsobí současný výskyt opačného procesu na druhé:
Zn o ––> Zn 2+ + 2е -
Cu 2+ + 2e - ––> Cu o
Elektroda, na které dochází při provozu galvanického článku k procesu oxidace, se nazývá anoda, elektroda, na které probíhá proces obnovy - katoda. Ve schematickém znázornění galvanických článků je vlevo napsána anoda, vpravo katoda (standardní vodíková elektroda je vždy napsána vlevo). Celkový redoxní proces probíhající v galvanickém článku je vyjádřen následující rovnicí:
Cu 2+ + Zn o ––> Cu o + Zn 2+
Galvanický článek lze tedy definovat jako zařízení pro přeměnu chemické energie redoxní reakce na elektrickou energii díky prostorovému oddělení oxidačních a redukčních procesů. Práce, kterou může vykonat elektrický proud generovaný galvanickým článkem, je určena rozdílem elektrických potenciálů mezi elektrodami (obvykle nazývanými jednoduše rozdíl potenciálů) ΔΦ a množstvím elektřiny prošlé obvodem q:
Práce proudu galvanického článku (a následně i potenciálový rozdíl) bude maximální při jeho vratném provozu, kdy procesy na elektrodách probíhají nekonečně pomalu a síla proudu v obvodu je nekonečně malá. Maximální rozdíl potenciálů, ke kterému dochází při reverzibilním provozu galvanického článku, je elektromotorická síla (EMF) galvanického článku .
3.5.3 Elektrodový potenciál. Nernstova rovnice
EMF galvanického článku E je vhodně reprezentováno jako rozdíl některých veličin charakterizujících každou z elektrod - elektrodové potenciály; k přesnému určení těchto hodnot je však zapotřebí referenční bod – přesně známý elektrodový potenciál jakékoli elektrody. Elektrodový potenciál ε e se nazývá EMF prvku složeného z dané elektrody a standardní vodíkové elektrody (viz níže), jejíž elektrodový potenciál se předpokládá nulový. V tomto případě se znaménko potenciálu elektrody považuje za kladné, pokud je testovanou elektrodou v takovém galvanickém článku katoda, a za záporné, pokud je testovanou elektrodou anoda. Je třeba poznamenat, že někdy je elektrodový potenciál definován jako "potenciální rozdíl na rozhraní elektroda-roztok", tzn. považujte jej za shodný s potenciálem DEL, což není zcela správné (ačkoli tyto veličiny spolu souvisí).
Hodnota elektrodového potenciálu kovové elektrody závisí na teplotě a aktivitě (koncentraci) kovového iontu v roztoku, do kterého je elektroda ponořena; matematicky je tato závislost vyjádřena Nernstova rovnice (zde F je Faradayova konstanta, z je iontový náboj):
V Nernstově rovnici ε ° – standardní elektrodový potenciál , rovný potenciálu elektrody při aktivitě kovového iontu, rovný 1 mol/l. Standardní elektrodové potenciály elektrod ve vodných roztocích jsou série napětí. Hodnota ε ° je mírou schopnosti oxidované formy prvku nebo iontu přijímat elektrony, tzn. obnovit. Někdy je rozdíl mezi koncentrací a aktivitou iontu v roztoku zanedbáván a koncentrace iontů v roztoku se v Nernstově rovnici objevuje pod znaménkem logaritmu. Velikost elektrodového potenciálu určuje směr procesu probíhajícího na elektrodě během provozu galvanického článku. Na poločlánku, jehož elektrodový potenciál má větší (někdy se říká - kladnější) hodnotu, bude probíhat proces obnovy, tzn. tato elektroda bude katodou.
Zvažte výpočet EMF prvku Daniel - Jacobi pomocí Nernstovy rovnice. EMF je vždy kladná hodnota a rovná se rozdílu mezi potenciály elektrody katody a anody:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
Jak je patrné z rovnice (III.45), EMF prvku Daniel - Jacobi závisí na koncentraci (přesněji aktivitě) iontů mědi a zinku; při jejich stejných koncentracích se EMF prvku bude rovnat rozdílu standardních elektrodových potenciálů:
![]() (III.46)
(III.46)
Analýzou rovnice (III.45) lze určit mez nevratné práce galvanického článku. Protože zinek je na anodě oxidován, koncentrace iontů zinku se během nevratného provozu galvanického článku neustále zvyšuje; koncentrace iontů mědi naopak klesá. Poměr koncentrací iontů mědi a zinku neustále klesá a logaritmus tohoto poměru při [Сu 2+ ]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Rovnice (III.45) také vysvětluje výkon tzv. koncentrační řetězce – galvanické články sestávající ze dvou stejných kovových elektrod ponořených do solných roztoků tohoto kovu s různou aktivitou a 1 > a 2 . V tomto případě bude katodou elektroda s vyšší koncentrací, protože standardní elektrodové potenciály obou elektrod jsou stejné; pro EMF koncentračního galvanického článku získáme:
![]() (III.47)
(III.47)
Jediným výsledkem práce koncentračního prvku je přenos kovových iontů z koncentrovanějšího roztoku do méně koncentrovaného. Práce elektrického proudu v koncentračním galvanickém článku je tedy dílem difúzního procesu, který probíhá reverzibilně v důsledku jeho prostorového oddělení na dva reverzibilní elektrodové procesy opačného směru.
Copyright © S. I. Levčenkov, 1996 - 2005.




