Edsův vzorec chemické reakce. Galvanické články a emf
3.5.1 Elektrické potenciály na fázových rozhraních
Když se vodič prvního druhu (elektroda) dostane do kontaktu s polárním rozpouštědlem (vodou) nebo roztokem elektrolytu na rozhraní elektroda-kapalina, dojde k tzv. elektrická dvouvrstva (DES). Jako příklad uvažujme měděnou elektrodu ponořenou do vody nebo do roztoku síranu měďnatého.
Když je měděná elektroda ponořena do vody, část iontů mědi umístěných v uzlech krystalové mřížky v důsledku interakce s vodními dipóly přejde do roztoku. Záporný náboj vznikající současně na elektrodě udrží ionty, které prošly do roztoku, v blízkém elektrodovém prostoru - vznikne dvojitá elektrická vrstva (obr. 3.12a; modely struktury DEL viz část 4.2 .4). Záporný náboj na elektrodě zabrání dalšímu přechodu iontů mědi do roztoku a po nějaké době se ustaví dynamická rovnováha, kterou lze jednoznačně charakterizovat potenciálem elektrického pole DEL Φ v závislosti na náboji na elektrodě. elektrodou, nebo nějakou rovnovážnou koncentrací iontů v blízké elektrodové vrstvě C o . Když je měděná elektroda ponořena do roztoku CuSO 4 obsahujícího ionty mědi o koncentraci C, jsou možné tři případy:
Rýže. 3.12 Schéma dvojité elektrické vrstvy na rozhraní elektroda-roztok
1. C< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в povrchová vrstva roztok kationtů bude více než aniontů (obr. 3.9a).
2. C > Co. Protože koncentrace iontů mědi v povrchové vrstvě je větší než rovnovážná, začne přechod iontů z roztoku na elektrodu; na elektrodě vzniká kladný náboj a v povrchové vrstvě převládají anionty SO 4 2- (obr. 3.12b).
3. C \u003d C o. Protože koncentrace iontů mědi v povrchové vrstvě je rovna rovnovážné (takové roztoky se nazývají nulové roztoky), nevzniká na elektrodě žádný náboj a nevzniká dvojitá elektrická vrstva.
3.5.2 Galvanický článek. EMF galvanického článku
Uvažujme nejjednodušší galvanický článek Daniel-Jacobi, skládající se ze dvou poločlánků - zinkových a měděných plátů, umístěných v roztocích síranů zinečnatých, respektive měďnatých, které jsou vzájemně propojeny pomocí elektrolytického klíče - například pruhem navlhčeného papíru roztokem nějakého elektrolytu. Schematicky je tento prvek znázorněn následovně:
Zn / Zn2+ // Cu2+ / Cu
Na povrchu každé z elektrod je dynamická rovnováha přechodu kovových iontů z elektrody do roztoku a naopak, charakterizovaná potenciálem EDL (náboj elektrody q). Pokud propojíte měděné a zinkové elektrody s kovovým vodičem, okamžitě dojde k redistribuci nábojů - elektrony se začnou přesouvat z elektrody s zápornějším nábojem (v našem případě zinku) na elektrodu s kladnějším nábojem (měď ), tj. ve vodiči poteče elektrický proud. Změna hodnoty náboje každé z elektrod naruší rovnováhu - na zinkové elektrodě začne proces přechodu iontů z elektrody do roztoku (oxidace kovu), na měděné elektrodě - z roztoku na elektrodu (kovová redukce); v tomto případě průběh procesu na jedné elektrodě způsobí současný výskyt opačného procesu na druhé:
Zn o ––> Zn 2+ + 2е -
Cu 2+ + 2e - ––> Cu o
Elektroda, na které dochází při provozu galvanického článku k procesu oxidace, se nazývá anoda, elektroda, na které probíhá proces obnovy - katoda. Se schematickým znázorněním galvanické články anoda je napsána vlevo, katoda je napsána vpravo (standardní vodíková elektroda je vždy napsána vlevo). Celkový redoxní proces probíhající v galvanickém článku je vyjádřen následující rovnicí:
Cu 2+ + Zn o ––> Cu o + Zn 2+
Galvanický článek lze tedy definovat jako zařízení pro přeměnu chemické energie redoxní reakce na elektrickou energii díky prostorovému oddělení oxidačních a redukčních procesů. Práce, kterou může vykonat elektrický proud generovaný galvanickým článkem, je určena rozdílem elektrických potenciálů mezi elektrodami (obvykle nazývanými jednoduše rozdíl potenciálů) ΔΦ a množstvím elektřiny prošlé obvodem q:
Práce proudu galvanického článku (a následně i potenciálový rozdíl) bude maximální při jeho vratném provozu, kdy procesy na elektrodách probíhají nekonečně pomalu a síla proudu v obvodu je nekonečně malá. Maximální rozdíl potenciálů, ke kterému dochází při reverzibilním provozu galvanického článku, je elektromotorická síla(EMF) galvanického článku .
3.5.3 Elektrodový potenciál. Nernstova rovnice
EMF galvanického článku E je vhodně reprezentováno jako rozdíl některých veličin charakterizujících každou z elektrod - elektrodové potenciály; k přesnému určení těchto hodnot je však zapotřebí referenční bod – přesně známý elektrodový potenciál jakékoli elektrody. Elektrodový potenciál ε e se nazývá element emf, složený z této elektrody a standardní vodíkové elektrody (viz níže), jejíž elektrodový potenciál je považován za nulový. V tomto případě se znaménko potenciálu elektrody považuje za kladné, pokud je testovanou elektrodou v takovém galvanickém článku katoda, a za záporné, pokud je testovanou elektrodou anoda. Je třeba poznamenat, že někdy je elektrodový potenciál definován jako "potenciální rozdíl na rozhraní elektroda-roztok", tzn. považujte jej za shodný s potenciálem DEL, což není zcela správné (ačkoli tyto veličiny spolu souvisí).
Hodnota elektrodový potenciál kovové elektrody závisí na teplotě a aktivitě (koncentraci) kovového iontu v roztoku, do kterého je elektroda ponořena; matematicky je tato závislost vyjádřena Nernstova rovnice (zde F je Faradayova konstanta, z je iontový náboj):
V Nernstově rovnici ε ° – standardní elektrodový potenciál , rovný potenciálu elektrody při aktivitě kovového iontu, rovný 1 mol/l. Standardní elektrodové potenciály elektrod ve vodných roztocích jsou série napětí. Hodnota ε ° je mírou schopnosti oxidované formy prvku nebo iontu přijímat elektrony, tzn. obnovit. Někdy se rozdíl mezi koncentrací a aktivitou iontu v roztoku zanedbává a koncentrace iontů v roztoku se v Nernstově rovnici objevuje pod logaritmem. Velikost elektrodového potenciálu určuje směr procesu probíhajícího na elektrodě během provozu galvanického článku. Na poločlánku, jehož elektrodový potenciál má větší (někdy se říká - kladnější) hodnotu, bude probíhat proces obnovy, tzn. tato elektroda bude katodou.
Zvažte výpočet EMF prvku Daniel - Jacobi pomocí Nernstovy rovnice. EMF je vždy kladná hodnota a rovná se rozdílu mezi potenciály elektrody katody a anody:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
Jak je patrné z rovnice (III.45), EMF prvku Daniel - Jacobi závisí na koncentraci (přesněji aktivitě) iontů mědi a zinku; při jejich stejných koncentracích se EMF prvku bude rovnat rozdílu standardních elektrodových potenciálů:
![]() (III.46)
(III.46)
Analýzou rovnice (III.45) lze určit mez nevratné práce galvanického článku. Protože zinek je na anodě oxidován, koncentrace iontů zinku se během nevratného provozu galvanického článku neustále zvyšuje; koncentrace iontů mědi naopak klesá. Poměr koncentrací iontů mědi a zinku neustále klesá a logaritmus tohoto poměru při [Сu 2+ ]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Rovnice (III.45) také vysvětluje výkon tzv. koncentrační řetězce – galvanické články sestávající ze dvou stejných kovových elektrod ponořených do solných roztoků tohoto kovu s různou aktivitou a 1 > a 2 . V tomto případě bude katodou elektroda s vyšší koncentrací, protože standardní elektrodové potenciály obou elektrod jsou stejné; pro EMF koncentračního galvanického článku získáme:
![]() (III.47)
(III.47)
Jediným výsledkem práce koncentračního prvku je přenos kovových iontů z koncentrovanějšího roztoku do méně koncentrovaného. Práce elektrického proudu v koncentračním galvanickém článku je tedy dílem difúzního procesu, který probíhá reverzibilně v důsledku jeho prostorového oddělení na dva reverzibilní elektrodové procesy opačného směru.
Copyright © S. I. Levčenkov, 1996 - 2005.
TERMODYNAMIKA
GALVANICKÝ ČLÁNEK
do laboratorní práce č. 18
Samara 2010
Sestavil: Yu.P. Kovriga, B. M. STIFATOV, V. V. SLEPUSHKIN
Termodynamika galvanického článku: Metoda. dekret. do laboratoře. práce. /Moje maličkost. Stát tech. un-t; Srov.: Yu.P.Kovriga, B.M. Stifatov, V.V. Slepuškin.- Samara, 2010. 16 s.
Jsou uvažovány teoretické základy a experimentální stanovení termodynamických charakteristik elektrochemických reakcí probíhajících při provozu galvanického článku.
Návod je určen pro studenty chemie a dalších oborů studujících elektrochemii v předmětu fyzikální chemie.
Tab. 1. Nemocný. 2. Bibliografie: 6 titulů.
Vydáno rozhodnutím redakční a vydavatelské rady SamSTU.
Objektivní– studium teorie a praxe termodynamických výpočtů elektrochemických reakcí probíhajících při provozu reverzibilních galvanických článků na základě výsledků měření elektromotorické síly.
1. TEORETICKÝ ÚVOD
Termodynamické charakteristiky
Galvanický článek
galvanický článek tzv. soustava dvou elektrod, ve které se energie chemické reakce samovolně přeměňuje na elektrickou energii. Skládá se ze dvou elektrody (půlčlánky), ponořených do roztoků elektrolytů. Mezi těmito roztoky je navázán kontakt pomocí porézní přepážky popř elektrolytický můstek, tj. sifonová trubice naplněná nasyceným roztokem KCl nebo NH 4 NO 3 . Porézní přepážka nebo elektrolytický můstek zajišťuje elektrickou vodivost mezi roztoky elektrod, ale brání jejich vzájemné difúzi. V některých případech jsou obě elektrody ponořeny do stejného roztoku.
Pokud elektrody spojíte kovovým vodičem, dojde na jedné z nich k reakci oxidace, a je záporně nabitý a nazývá se anoda a na druhé straně - reakce zotavení, je kladně nabitý a nazývá se katoda.
Temodynamika je vědní obor, který studuje vzájemné přeměny tepla na práci a naopak. Chemická termodynamika je obor fyzikální chemie, který studuje fyzikální a chemické procesy doprovázené uvolňováním nebo absorpcí energie. Galvanický článek patří k fyzikálně-chemickým systémům. Proto je provoz galvanického článku, stejně jako jakýkoli jiný termodynamický systém, charakterizován termodynamickými hodnotami změny Gibbsovy energie Δ G, entalpie Δ H, entropie Δ S a rovnovážná konstanta K a pro elektrochemické reakce probíhající při provozu reverzibilních galvanických článků.
Čím větší je odpor vodiče spojujícího elektrody, tím pomaleji probíhají reakce na elektrodách. V zásadě je možné uzavřít elektrody vodičem nekonečného odporu a reakce bude probíhat nekonečně pomalu, tzn. reverzibilní.
Když chemická reakce probíhá izotermicky a reverzibilně, je práce největší: v tomto případě se největší část reakčního tepla přemění na elektrickou práci. Potenciální rozdíl mezi elektrodami měřenými v tomto případě se nazývá elektromotorická síla(krátce - EMF) galvanického článku.
elektrikářské práce galvanický článek ( ALE) se rovná jeho EMF ( E) vynásobený převedeným poplatkem ( q). Pokud během reakce dojde k redukci nebo oxidaci z molové ekvivalenty látky, pak podle Faradayova zákona budou převedeny q = zF coulombové (A . c) elektřina, kde F- Faradayovo číslo (96500 C/mol). Proto maximální práce ( A" max) převodem zF coulomby elektřiny prostřednictvím rozdílu potenciálů ( ∆φ = E) elektrod galvanického článku se rovná
kde E je EMF galvanického článku, V; E 0 - standardní emf galvanický článek s jednotlivými aktivitami účastníků reakce; a(OX 1),a(Červená 1),a(OX 2),a(Červená 2) - aktivní koncentrace (aktivity) redoxně konjugovaných párů OX 1 / Červená 1 a OX 2 / Červená 2 vytvořená jako výsledek reakce v roztoku.
Měření EMF galvanického článku E a jeho změny s teplotou dE/dT umožňuje vypočítat nejdůležitější termodynamické veličiny pro chemickou redoxní reakci probíhající v prvku.
Z Gibbs-Helmholtzovy rovnice
Rovnice (8) to naznačuje
Hodnota d E/ d T se nazývá teplotní koeficient elektromotorické síly galvanického článku.Teplotní koeficient d E/ d T lze určit ze závislosti elektromotorické síly galvanického článku na teplotě. Hodnota d E/ d T může být kladné, záporné nebo nulové v závislosti na povaze buňky.
V d E/ d T \u003d 0, tj. když EMF prvku nezávisí na teplotě, E \u003d - ΔU/zF. V tomto případě k práci prvku dochází výhradně kvůli poklesu vnitřní energie systému bez uvolňování nebo absorpce tepla.
V d E/ d T<0, т.е. когда ЭДС элемента уменьшается с повышением температуры, работа элемента совершается тоже за счет убыли внутренней энергии системы, но сопровождается выделением теплоты. В этом случае работа элемента и расход энергии на нагревание окружающей среды осуществляется за счет убыли внутренней энергии системы.
V d E/ d T > 0, tzn. když se EMF prvku zvyšuje s rostoucí teplotou, prvek funguje tak, že absorbuje teplo. V tomto případě poměr mezi E a T . d E/ d T určuje povahu práce a směr změny vnitřní energie systému:
1) kdy E = Td E/ d T, vnitřní energie pracovního prvku se při konstantní teplotě nemění: ΔU= 0. Práce prvku je vykonávána výhradně díky teplu absorbovanému z prostředí;
2) kdy E > T . d E/ d T , vnitřní energie prvku během jeho práce klesá, ΔU <0, и работа совершается частично за счет убыли внутренней энергий и частично за счет поглощения теплоты извне;
3) kdy E< Т . d E/ d T se vnitřní energie prvku během jeho provozu zvyšuje, ΔU> 0, tzn. prvek absorbuje teplo v množství přesahujícím práci, kterou vykonal. Přebytek absorbovaného tepla se využívá ke zvýšení vnitřní energie systému. Zde je práce hotová a proces probíhá spontánně, navzdory endotermické povaze chemické reakce.
Hodnota d E/ d T lze přibližně vypočítat podle vzorce
| | (11) |
kde E 1 a E 2 -– Hodnoty EMF galvanického článku při teplotách T 1 a T 2. Výpočet bude přesnější, čím méně se od sebe liší. T 1 a T 2, protože závislost E \u003d f (T) blízko lineární pouze pro malé teplotní intervaly.
Rovnovážná konstanta chemické reakce K a lze vypočítat z rovnic izotermy chemické reakce za standardních podmínek. Podle rovnice van't Hoffovy izotermy hodnota maximální užitečné práce pro chemickou reakci se vypočítá jako
| , | (14) |
kde E 0 \u003d E 0 2 - E 0 1- standardní EMF, rovné rozdílu standardních elektrodových potenciálů.
Výpočet rovnovážné konstanty se provádí pomocí referenčních údajů o hodnotách standardních elektrodových potenciálů odpovídajících elektrod uvedených v referenční knize fyzikálně-chemických veličin.
Měření EMF galvanických článků
Změnu termodynamických hodnot elektrochemických reakcí lze velmi přesně určit měřením elektromotorických sil galvanických článků, ve kterých k těmto reakcím dochází. Přesnost této metody je vysvětlena vysokou přesností měření EMF galvanického článku potenciometrem typu R-307, pracujícím podle kompenzační Poggendorfova metoda. Poskytuje měření EMF galvanického článku za podmínek, kdy článkem protéká nekonečně malý proud, který odpovídá reverzibilnímu galvanickému článku. Při měření EMF pomocí běžného voltmetru proud generovaný prvkem protéká elektrodami, což vede k posunu potenciálů elektrod od rovnovážných hodnot, kterým odpovídá Nernstova rovnice.
Měření EMF prvku v rovnovážných podmínkách, redoxní reakce probíhající na jeho elektrodách, je dosaženo použitím kompenzační metoda Poggendorf, realizované pomocí elektrického obvodu znázorněného na Obr. 2.
normální) Westonova cela
Θ Сd(Hg) | CdSO4 8/3H20 (nas.), Hg2S04 (t) | hg,
mající konstantní a reprodukovatelnou hodnotu EMF. Zde je anodou amalgám kadmia a katodou je kovová rtuť. Když je okruh uzavřen, probíhají poloviční reakce:
Při 25 0 C je EMF Westonova prvku 1,0183 V.
Měření začíná dělením stupnice reochordu, což je pravítko dělené v mm, přes které je natažen nichromový drát konstantního průřezu.
K obvodu je připojena baterie, která zajišťuje konstantní elektrický proud v obvodu. Spínač "P" zavádí do obvodu standardní prvek a pohybuje pohyblivým kontaktem "C" po drátu reochordu. Periodicky krátkým stisknutím klávesy „K“ uzavírají obvod, přičemž pomocí galvanometru kontrolují přítomnost proudu v obvodu, tzn. kompenzace. V době kompenzace segment AC drát rheochordu odpovídá odporu, jehož součin a proud baterie se rovná napětí, které kompenzuje EMF prvku Weston. Znát délku segmentu AC(Například, l N), na kterém úbytek napětí baterie kompenzuje EMF (EN) Westonova článku, můžete vypočítat úbytek napětí na 1 mm reochord jako E N /l N, V/mm.
Poté je do obvodu zařazen zkoumaný galvanický článek s neznámou hodnotou EMF E X a opakujte výše uvedené měřicí operace, přičemž v okamžiku kompenzace změřte délku drátového segmentu reochordu l X. Ze vztahu
najít neznámé Hodnota EMF.
Pro přesné měření EMF galvanického článku použijte vysokoodporový potenciometr R-307, jehož horní panel je znázorněn na Obr. 2.
Činnost zařízení je založena na principu kompenzace, kdy v okamžiku měření EMF má proud v obvodu zkoumaného galvanického článku nekonečně malou hodnotu (nula na nulovém přístroji (galvanometru)). Při sestavování měřicího obvodu se na svorky „B“ připojí 2,5 - 3,5 V baterie nebo usměrňovač, na svorky „NE“ běžný Westonův článek a na svorky X 1 nebo X 2 se připojí zkoumaný galvanický článek. V tomto případě ve všech případech vezměte v úvahu znaky polarity "+" a "-" na přístrojové desce a připojeném zdroji stejnosměrný proud. Galvanometr je připojen k odpovídajícím svorkám "G". Poté je potenciometr připojen přes usměrňovač k elektrické síti.
Práce začíná kalibrací zařízení podle standardního Westonova prvku.
Přepínač druhu práce (3) je nastaven do polohy „NE“. Odporové knoflíky (2) vytvářejí "hrubou" a poté "jemnou" kompenzaci EMF prvku Weston, periodicky uzavírají měřicí obvod tlačítkem 430 kOhm a poté tlačítkem "0". Správné nastavení odpovídá nepřítomnosti proudu v obvodu galvanometru při zkratu (1-2 s) tlačítkem „0“.
V důsledku toho je do měřicích knoflíků (5) potenciometru z usměrňovače přiváděn pracovní proud, který poskytuje napětí rovné EMF Westonova prvku, tzn. 1,0186 V.
|
||||
| Rýže. obr. 2. Pohled na horní panel potenciometru R-308: 1 - zdířky "X 1" a "X 2" pro připojení elektrod galvanického článku; 2 - odporové knoflíky "hrubé" "jemné" pro kalibraci potenciometru; 3 - přepínač pro provoz potenciometru na normální (NE) nebo zkoumaného prvku "NE" nebo "X 2"; 4 - zásuvky "G" pro připojení galvanometru; 5 - odporové knoflíky (dekády) s okny pro měření číselných hodnot EMF; 6 - zásuvky "X 1" pro připojení běžného prvku Weston; 7 - zásuvky "B" a pro připojení baterie; 8 - normální prvek Westona; 9 - usměrňovač střídavý proud; 10 - galvanometr; 11 - okna digitálních hodnot EMF; 12 - tlačítka pro uzavření měřicího okruhu "430" a "0" a klid vibrací šipky galvanometru "Usp". |
Měřicí pera jsou tzv dekády, protože každý z nich má 10 pozic. Každá z poloh první dekády (I) poskytuje odpor, který po vynásobení provozním proudem dává hodnotu kompenzace EMF 0,1 V. Proto knoflík (I) umožňuje kompenzaci od 0,1 do 1 V. Dekáda (II) umožňuje kompenzovat od 0,01 do 0,1 V atd. Naměřená digitální hodnota EMF uvedená v poli pro první desetiletí by proto měla být vynásobena 0,1, za druhou - 0,01 atd.
Po zkalibrování přístroje se přepínač typu práce (2) nastaví do polohy X 1 nebo X 2 (podle toho, na jakou svorku je připojen zkoumaný galvanický článek) a rukojeti dekád spínačů I - VI vyvažují. měřené EMF s konzistentním zvýšením citlivosti, dosažení nepřítomnosti proudu v obvodu se zkratem pomocí tlačítka "0".
Hodnota naměřené hodnoty se počítá čísly v políčkách s příslušnými násobiteli.
2. EXPERIMENTÁLNÍ
Pracovní plán
1. Seznámit se s teoretickými základy termodynamiky galvanického článku.
2. Seberte zkoumaný galvanický článek a vložte jej do objímek v krytu termostatu.
3. Připojte zkoumaný galvanický článek propojovacími vodiči k potenciometru R-308.
4. Kalibrujte potenciometr P-308 pomocí standardního Westonova prvku.
5. Změřte EMF studovaného galvanického článku v teplotním rozsahu uvedeném v úloze při změně teploty termostatu.
7. Připravte zprávu o provedené práci a vyvodte závěr o shodě hodnot vypočtených hodnot s procesy probíhajícími v galvanickém článku.
8. Zkontrolujte výsledky práce učitele a uveďte pracoviště do pořádku.
Nástroje a činidla
1. Platinové elektrody s propojovacími vodiči (2 ks).
2. Skleněné zkumavky se širokým hrdlem (2 ks).
3. Termostat.
4. Potenciometr R-308.
5. Usměrňovač střídavého proudu.
6. Standardní Westonův prvek.
7. Roztoky pro přípravu galvanického článku.
8. Solný můstek ze skleněné trubice.
9. Nasycený roztok KCl.
10. Filtrační papír pro výrobu solných můstkových zátek.
Pracovní postup
1. Sestavte galvanický článek specifikovaný v zadání zakázky. K tomu nalijte příslušné roztoky dané koncentrace do dvou velkých širokohrdlých zkumavek.
2. Ponořte platinové elektrody do příslušných elektrolytů.
3. Vložte zkumavky s roztoky do štěrbin v krytu termostatu.
4. Vytvořte solný můstek naplněním skleněné zkumavky ve tvaru U nasyceným roztokem KCl a ucpejte otvory tak, aby v solném můstku nebyly žádné vzduchové bubliny.
5. Spojte zkumavky solným můstkem.
6. Zkalibrujte potenciometr P-308 pomocí Westonova prvku.
7. Změřte EMF sestaveného galvanického článku v teplotním rozsahu specifikovaném v zadání zakázky a zvyšte teplotu vody v termostatu. Teplota v termostatu je přesně měřena samostatným teploměrem. Zaznamenejte naměřenou hodnotu EMF a odpovídající teplotu.
9. Z referenční knihy určete standardní potenciály elektrod zkoumaného galvanického článku a sestavte jeho obvod. Napište rovnici pro poloviční reakce probíhající na elektrodách a obecnou rovnici pro redoxní reakci. Vypočítejte standardní hodnotu EMF prvku a najděte rovnovážnou konstantu K a podle vzorce (14).
10. Zadejte výsledky experimentu a vypočtené hodnoty do tabulky.
testové otázky
1. Vztah mezi Gibbsovou energií elektrochemické reakce a EMF galvanického článku.
2. Odvození vzorců pro výpočet ΔG, ΔH, ΔS elektrochemická reakce.
3. Závislost EMF galvanických článků na teplotě.
4. Pojem "teplotní koeficient EMF" a metody jeho stanovení.
5. Vztah mezi znaménkem teplotního koeficientu a povahou elektrochemické reakce.
6. Princip činnosti potenciometru R-307.
7. Metodika provádění práce.
REFERENCE
1. Semchenko D.P., Stromberg A.G.. Fyzikální chemie.- M.: Vyssh. škola, 2000. - 512 s.
2. Workshop z fyzikální chemie / Ed. I.V. Kudrjašov. - M.: Vyšší. škola., 1999.- 400 s.
3. Workshop z fyzikální chemie / Ed. V.V. Budanov,
N.K. Vorobjov. - M.: Chemie, 2000. - 387 s.
4. Praktická práce z fyzikální chemie: Proc. příspěvek pro vysoké školy / Ed. K.P. Mishchenko, A.A. Ravdel, A.M. Ponomareva - Petrohrad, nakladatelství "Profese", 2002. - 384 s.
5. Stručná referenční kniha fyzikálních a chemických veličin / Ed. A.A. Ravdel, A. M. Ponomareva. - M.: Chemie, 2002. - 327 s.
6. Kiseleva E. V., Karetnikov G. S., Kudrjašov I. V. Sbírka příkladů a úloh z fyzikální chemie. - M.: Vyšší. škola, 2001. - 389 s.
K přeměně chemické energie na elektrickou dochází v elektrochemických systémech, které se nazývají galvanické články.
Galvanický článek je uzavřený elektrochemický systém sestávající ze dvou elektrod.
Vezměme si Jacobi-Danielův galvanický článek. Skládá se z měděné desky ponořené do roztoku CuSC4 a zinkové desky ponořené do roztoku ZnSC4. Aby se zabránilo přímé interakci mezi oxidačním činidlem a redukčním činidlem, jsou elektrody od sebe odděleny porézní přepážkou.
Schéma galvanického článku:
Zn | ZnSO4| | CuS04| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
Na povrchu zinkové desky se objeví dvojitá elektrická vrstva a ustaví se rovnováha:
V důsledku tohoto procesu vzniká elektrodový potenciál zinku.
Na povrchu měděné desky se také objeví dvojitá elektrická vrstva a ustaví se rovnováha:
Сu2+ + 2е « Сu, proto vzniká elektrodový potenciál mědi.
Potenciál zinkové elektrody má zápornější hodnotu než potenciál měděné elektrody, proto, když je vnější obvod uzavřen, tj. když je zinek spojen s mědí kovovým vodičem, elektrony přejdou ze zinku na měď.
Když je tedy vnější okruh uzavřen, dochází k samovolným procesům rozpouštění zinku na zinkové elektrodě a precipitaci mědi na měděné elektrodě. Tyto procesy budou pokračovat, dokud se potenciály elektrod nevyrovnají nebo dokud se veškerý zinek nerozpustí (nebo se všechna měď neuloží na měděnou elektrodu).
Takže během provozu prvku Jacobi-Daniel probíhají následující procesy:
1) oxidační reakce zinku: Zn - 2е ® Zn2+.
Oxidační procesy v elektrochemii se nazývají anodové procesy a elektrody, na kterých probíhají oxidační procesy, se nazývají anody;
2) redukční reakce iontů mědi: Сu2+ + 2е « Сu.
Redukční procesy v elektrochemii se nazývají katodické procesy a elektrody, na kterých redukční procesy probíhají, se nazývají katody;
pohyb elektronů ve vnějším obvodu;
pohyb iontů v roztoku: anionty (SO4-2) na anodu, kationty (Cu2+, Zn2+) na katodu. Pohyb iontů v roztoku uzavírá elektrický obvod galvanického článku. Sečtením elektrodových reakcí získáme:
Zn + Cu2+ = Zn2+ + Сu.
V důsledku této chemické reakce v galvanickém článku dochází k pohybu elektronů ve vnějším obvodu a iontů uvnitř článku, tj. vzniká uzavřený elektrický systém a v něm vzniká elektrický proud. Celková chemická reakce probíhající v galvanickém článku se nazývá proud generující.
Elektrický proud, který se vyskytuje v daném elektrochemickém systému, je číselně charakterizován velikostí elektromotorické síly (EMF) prvku. Rovná se rozdílu mezi elektrodovými potenciály katody a anody:
Za standardních podmínek je spontánní chemická reakce možná, když se maximální užitečná práce vykonaná v důsledku této reakce rovná záporné hodnotě změny volné energie:
V galvanickém článku se maximální elektrická práce vykonaná za standardních podmínek rovná EMF článku vynásobeném množstvím elektřiny (nF), tzn.
A = nFE0, (7,5)
kde n je počet elektronů zapojených do reakce;
F je Faradayova konstanta, rovna 96500 C/mol;
E0 - standardní elektromotorická síla galvanického článku (T= 298 K, molární koncentrace elektrolytů je 1 mol/dm3). Maximální práce galvanického článku se tedy rovná:
A \u003d -DG0 \u003d nFE0. (7,6)
Standardní EMF galvanického článku je:
Galvanické články se podle charakteru elektrod a koncentrace elektrolytů dělí na chemické a koncentrační.
Chemické galvanické články jsou takové články, kde se liší elektrody a elektrolyty. Příkladem chemického galvanického článku je Jacobi-Danielův článek.
Koncentrační galvanické články jsou takové články, které se skládají ze stejných elektrod, ale koncentrace elektrolytu se liší, například stříbrné elektrody ponořené do roztoků dusičnanu stříbrného různých koncentrací:
Ag | AgNO3 (0,01 mol/dm3) | | AgNO3 (0,1 mol/dm3) | Ag.
Příklad 1. Galvanický článek se skládá z kovového zinku ponořeného v roztoku dusičnanu zinečnatého o molární koncentraci 0,1 mol/dm3 a kovového olova ponořeného v roztoku dusičnanu olovnatého o molární koncentraci 0,02 mol/dm3 diagram prvku.
Rozhodnutí. Pro určení EMF prvku je nutné vypočítat elektrodové potenciály pomocí Nernstovy rovnice (7.2):
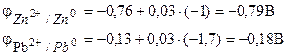
EMF prvku zjistíme podle vzorce (7.3).
Galvanický článek- zařízení, které převádí chemická energie do elektriky. Jedním z takových prvků je prvek Daniel-Jacobi. Tento prvek se skládá ze dvou elektrod: zinku a mědi, ponořených do odpovídajících síranových roztoků, mezi nimiž je porézní přepážka:
Když je vnější obvod uzavřen, elektrony přecházejí ze Zn do Cu a zinek difunduje do mědi:
Tvoříme elektrochemický obvod:
Anoda - záporná elektroda (vlevo). Katoda je kladná elektroda.
Chcete-li určit EMF tohoto prvku, musíte porovnat standardní elektrodové potenciály obou elektrod. Při záznamu elektrodových reakcí se předpokládá, že oxidovaná forma je na levé straně a redukovaná forma je na pravé straně rovnice.
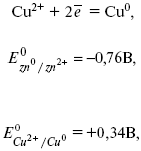
kde E 0 - elektromotorická síla (EMF) galvanického článku, když jsou všechna činidla ve standardním stavu.
Emf článku se vypočítá odečtením anodového potenciálu od katodového potenciálu.
EMF prvku je +0,34 - (-0,76) \u003d 1,1 V; čím více se od sebe elektrodové potenciály liší, tím větší je EMF. Pokud je kov ponořen do solného roztoku o vyšší koncentraci, pak je potenciál nestandardní. To znamená, že koncentrace a teplota ovlivňují velikost potenciálu elektrody. Tato závislost je vyjádřena V. Nernstova rovnice.
kde P - počet iontů;
R je univerzální plynová konstanta;
T - teplota;
S - koncentrace aktivních iontů v roztoku;
F- Faradayovo číslo = 96500 V.
HITY- zařízení, která slouží k přímé přeměně energie chemické reakce na elektrickou energii. Hity se používají v různých oblastech techniky. V komunikačních prostředcích: rozhlas, telefon, telegraf; v elektrických měřicích zařízeních; slouží jako zdroje energie pro automobily, letadla, traktory; slouží k pohonu startérů atd.
Nevýhody HIT:
1) náklady na látky nezbytné pro práci: Pb, Cd, jsou vysoké;
2) poměr množství energie, kterou může prvek dát své hmotnosti, je malý.
Výhody HIT:
1) Hity se dělí do dvou hlavních skupin: vratné (baterie), nevratné (galvanické články). Baterie lze použít opakovaně, protože jejich výkon lze obnovit průchodem proudu v opačném směru z externího zdroje a v galvanických článcích je lze použít pouze jednou, protože jedna z elektrod (Zn v článku Daniel-Jacobi) je nevratně spotřebováno;
2) používají se elektrolyty absorbované porézními materiály, mají větší vnitřní odpor;
3) vytvoření palivových článků, při jejichž provozu by se spotřebovávaly levné látky s nízkou hustotou ( zemní plyn vodík);
4) pohodlný provoz, spolehlivost, vysoké a stabilní napětí.
Zvažte technologický proces založený na olověných bateriích s obalenými elektrodami.
Obecné schéma: (–) účinná látka | elektrolyt | účinná látka (+).
Aktivní látkou záporné elektrody je redukční činidlo darování elektronů. Při vybíjení je zápornou elektrodou anoda, tedy elektroda, na které probíhají oxidační procesy. Aktivní látkou kladné elektrody je oxidační činidlo. Aktivní látky - oxidační činidlo a redukční činidlo - se účastní elektrochemické reakce.
Elektrochemické schéma olověného akumulátoru
Aktivními látkami olověného akumulátoru jsou houbovité olovo a PbO 2 . Tvorba aktivních hmot v elektrodách je následující: na elektricky vodivý rám konstrukce se nanese pasta nebo směs oxidů Pb; při následné tvorbě plátů dochází k přeměně oxidů Pb na účinné látky. Formace– přeměna nenabité hmoty na nabitou hmotu. Tyto desky se dělí v závislosti na typu rámu na rozpěrné a příhradové. Většina baterií je sestavena z omítnutých desek. Při jejich výrobě se do buněk profilových mřížek o tloušťce 1–7 mm, odlévaných ze slitiny Pb–Sb, vtírá pasta oxidů olova. Po vytvrzení pasta drží na mřížce, záruka na takovou baterii je 2-3 roky. Při volbě materiálů pro sběrače proudu kladných elektrod baterie je důležité zajistit jejich praktickou pasivitu (při zachování elektrické vodivosti) za podmínek nabíjení (až do velmi vysokých potenciálů s anodickou polarizací). K tomuto účelu se v roztocích H 2 SO 4 používá Pb nebo jeho slitiny. Pouzdro a kryt HIT mohou být vyrobeny z oceli nebo různých dielektrik, ale u olověných baterií je pouzdro vyrobeno z ebonitu, polypropylenu a skla. Elektrolyt v olověném akumulátoru se může podílet na celkové proudotvorné reakci. Pro proudové odbočky záporné elektrody se používají Cu, Ti, Al.
3. Regenerace a likvidace HIT
Životnost galvanických článků (vybití HIT) končí po úplném nebo částečném použití aktivních materiálů, jejichž výkon po vybití lze obnovit nabíjením, tedy průchodem proudu ve směru opačném, než je směr proudu při výboj: takové galvanické články se nazývají akumulátory. Záporná elektroda, která byla anodou při vybíjení baterie, se při nabíjení stává katodou. podmínky nejlepší využití aktivní materiály mají nízkou proudovou hustotu, vysoké teploty až do normy. Obvykle je důvodem nefunkčnosti HIT pasivace elektrod– prudké snížení rychlosti elektrochemického procesu při výboji, způsobené změnou stavu povrchu elektrody při výboji v důsledku tvorby oxidových vrstev nebo solných filmů. Způsob, jak bojovat s pasivací, je snížit skutečnou hustotu výbojového proudu pomocí elektrod s vyvinutým povrchem. Výroba HIT se vyznačuje použitím různých toxických látek (silná oxidační činidla, sloučeniny Pb, Hg, Zn, Cd, Ni používané v jemně rozptýleném stavu; kyseliny, zásady, organická rozpouštědla). Pro zajištění běžných pracovních podmínek je plánována automatizace výrobních procesů, racionální ventilační systémy včetně využití lokálního odsávání ze zařízení s toxickými emisemi, utěsňovací zařízení, nahrazení suchých metod zpracování prašných materiálů mokrými, čištění znečištěného vzduchu a plynů z aerosoly a čištění průmyslových odpadních vod. HIT má masivní využití národní ekonomika spojené s problémy životního prostředí. Zatímco olovo z baterií mohou spotřebitelé většinou vracet do recyklačních závodů, likvidace malých primárních CIT v domácnostech není ekonomicky životaschopná.
Každá Hg-Zn baterie poskytuje 5-7 dní provozu sluchadla.
Elektromobily jsou vyvíjeny pomocí HIT namísto spalovacích motorů, které otravují atmosféru měst výfukovými plyny. Z hlediska míry negativního vlivu na životní prostředí je galvanická výroba na prvním místě. Důvodem extrémně negativního dopadu výroby galvanického pokovování je to, že naprostá většina podniků v technologických postupů nanášení nátěru se užitečně spotřebuje pouze 10 - 30 % solí těžkých kovů, zatímco zbytek se při neuspokojivé práci dostává do životního prostředí. Cesta ven je minimalizovat ztráty solí neželezných kovů, to znamená snížit odstraňování elektrolytů částmi z galvanické lázně. To povede ke snížení koncentrací a objemů odpadních vod a tím ke vzniku potřebné podmínky pro nízkoodpadové (LWT) a bezodpadové (LWT) aplikační technologie galvanicky pokovené povlaky. Nejprve musíte vybrat správný elektrolyt. Základním principem ILO a BOT je snížit vstupní chemikálie a dodat méně jedů na výstupu procesu.