FEM a unei celule galvanice se calculează prin formula. Celulă galvanică. Conceptul de EMF. element Daniel-Jacobi
Forta electromotoare celulă galvanică (EMF).
Lucrul electric produs de o celulă galvanică va fi maxim atunci când celula este operată în condiții cât mai apropiate de reversibile. Diferența maximă de potențial a electrozilor unei celule galvanice date, care este determinată în condiții de echilibru, se numește forța sa electromotoare (EMF). Este egal cu diferența dintre potențialele de echilibru ale catodului și anodul elementului. În condiții standard:
EMF 0 =D j0 = j0 catod - j0 anod . (7.3)
Exemplul 10. Calculați EMF al unei celule galvanice compuse din electrozi de magneziu și plumb, în care = 0,1 M; = 0,001 M.
Soluţie. j 0 Mg 2+ /Mg \u003d -2,37 V; j 0 Pb 2+ / Pb = -0,13 B (Tabelul 7.1); j 0 al electrodului de magneziu este mai mic, adică. Mg este un metal mai activ, așa că într-o celulă galvanică, magneziul va fi anodul și va conduce catodul.
Pe electrozi vor avea loc următoarele procese:
A: Mg - 2e \u003d Mg 2+,
K: Pb 2+ + 2e = Pb 0.
Circuitul unei celule galvanice se scrie astfel: Mg½Mg 2+ ║Pb 2+ ½Pb.
Pentru a calcula EMF, este necesar să găsiți potențialele electrodului. Conform ecuației (7.2):
J0+ ![]() -2,37 + 0,0295 . log 0,1 = -2,4 V;
-2,37 + 0,0295 . log 0,1 = -2,4 V;
0,13 + 0,0295. lg 0,001 \u003d -0,13 + 0,0295 (-3) \u003d -0,22 V.
EMF \u003d j cat - j an \u003d -0,25 - (-2,4) \u003d 2,15 V.
Exemplul 11. Determinați EMF-ul unei celule galvanice compuse din electrozi de argint scufundați în soluții de AgNO 3 0,0001 M și 0,1 M.
Soluţie. Celulă galvanică poate fi compus nu numai din diferiți, ci și din aceiași electrozi scufundați în soluții ale aceluiași electrolit de concentrații diferite ( elemente de concentrare). Să găsim potențialele electrodului folosind formula Nernst (7.2):
j 1 Ag+ / Ag = j 0 + ×lg = 0,8 + 0,059 × lg0,001 = 0,8 + 0,059 × (-3) = 0,62 V,
j 2 Ag+ / Ag \u003d 0,8 + 0,059 × lg0,1 \u003d 0,8 - 0,059 \u003d 0,74 V.
Din moment ce j 1< j 2 , электрод, опущенный в 0,001 М раствор, будет являться анодом:
EMF \u003d j cat - j an \u003d 0,74 - 0,62 \u003d 0,12 V.
Schema unei astfel de celule galvanice este scrisă după cum urmează:
(-) Ag½ AgN03 (0,001 M) = AgN03 (0,1 M) ½ Ag (+).
După cum sa arătat deja în exemplul unui electrod de hidrogen, electrozii și, prin urmare, celulele galvanice, pot fi creați nu numai pentru reacția de oxidare-reducere a metalelor, ci și pentru orice substanțe și reacții redox care apar în soluții sau topituri. De exemplu, pentru o reacție în soluție
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
procesele de oxidare și reducere pot fi împărțite în semireacții:
la anod: 5 ½ SO 3 2 - + H 2 0 \u003d SO 4 2 - + 2H + + 2ē; (0,17 V),
la catod: 2 ½ MnO 4 - + 8H + + 5e = Mn 2+ + 4H 2 O(1,51 V).
Rezumăm:
2MnO4 - + 5SO32- + 6H + + 10' = 2Mn2+ + 5SO42- + 3H2O + 10'.
Reacție generatoare de curent:
2MnO4-+5SO32-+6H+ = 2Mn2+ + 5SO42-+3H2O.
Pentru a efectua astfel de reacții, se folosește de obicei un catalizator, care este și un conductor de electroni, cum ar fi platina (Fig. 7.3).
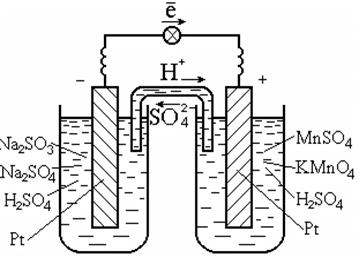
Orez. 7.3. Celulă galvanică pe redox
reactii in solutie
Diagrama unei celule galvanice:
Pt | S032-, S042-, H + || Mn04-, Mn2+, H+ | Pt.
Valorile potențialelor standard ale electrodului semireacțiilor sunt date în cărțile de referință.
FEM a unui astfel de element în condiții standard poate fi definită ca diferența de potențial pentru semireacțiile de reducere (oxidant) și oxidare (reductor).
EMF \u003d Dj 0 \u003d j 0 (MnO 4 - / Mn 2+) - j 0 (SO 4 2 - / SO 3 2 -) \u003d
1,51 - 0,17 = 1,34 V.
Dacă în același timp EMF este pozitivă, atunci reacția este posibilă în condiții standard, deoarece DG reacției și lucrul electric (EMF) sunt legate prin relația:
unde F este constanta lui Faraday (sarcina purtată de un mol de sarcini elementare (F = 96485, sau „96500 Cul/mol echiv);
n este sarcina purtată de o particulă (pentru Zn 2+ și Cu 2+ n = 2);
Dj \u003d j catod - j anod \u003d j ok-la - j restaurare.
Astfel, diferența de potențial între electrozi nu poate fi doar măsurată direct, ci și calculată din date experimentale pur chimice. În cazul condițiilor nestandard, potențialul electrodului și EMF-ul elementului sunt calculate folosind formula Nernst (7.1). De exemplu, pentru reacția considerată:
(n = 10). Deoarece concentrațiile reactivilor sunt sub semnul logaritmului, dependența lui Dj de ei este slabă.
Sarcina 251.
În ce condiții va funcționa o celulă galvanică, ai cărei electrozi sunt fabricați din același metal? Faceți o diagramă, scrieți ecuațiile electronice ale proceselor electrozilor și calculați EMF-ul unei celule galvanice în care un electrod de nichel este într-o soluție de 0,001 M, iar celălalt este același electrod într-o soluție de sulfat de nichel 0,01 M. Răspuns: 0,0295 V.
Soluţie:
Celulă galvanică, ai căror electrozi sunt din același metal, vor funcționa, cu condiția ca electrozii să fie scufundați în soluții de sare cu concentrații diferite. Schema unei celule galvanice în care un electrod de nichel este într-o soluție de 0,001 M, iar celălalt într-o soluție de sulfat de nichel 0,01 M are forma:
Potențialul electrod al metalului(E) depinde de concentrația ionilor săi în soluție. Această dependență este exprimată prin ecuația Nernst:
![]()
E 0 - ; n este numărul de electroni implicați în proces; c este concentrația ionilor metalici într-o soluție de sare (cu calcule precise, activitate). Să determinăm potențialele electrozilor electrozilor de argint la diferite concentrații de ioni de argint Ag +, obținem:
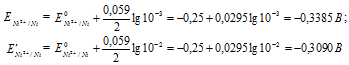
Pentru a determina EMF-ul unei celule galvanice, potențialul anodic ar trebui să fie scăzut din potențialul catodic, obținem:
Răspuns: 0,0295 V.
Sarcina 252.
Realizați o diagramă, scrieți ecuațiile electronice ale proceselor cu electrozi și calculați EMF-ul unei celule galvanice formată din plăci de plumb și magneziu scufundate în soluții ale sărurilor acestora cu o concentrație de [Рb 2+ ] = [Mg 2+ ] = 0,01 mol / l. Se va schimba EMF-ul acestui element dacă concentrația fiecărui ioni crește de același număr de ori? Răspuns: 2.244 V.
Soluţie:
Diagrama acestei celule galvanice
Mg 0 - 2 = Mg 2+ (1)
Plumbul, al cărui potențial este -0,127 V este catodul, adică electrod pe care are loc procesul de reducere:
Pb 2+ + 2 = Pb 0 (2)
Mg0 + Pb2+ = Mg2+ + Pb0
Potențialul electrodului unui metal (E) depinde de concentrația ionilor săi în soluție. Această dependență este exprimată prin ecuația Nernst:
![]()
E 0 - potențialul electrod standard al unui metal; n este numărul de electroni implicați în proces; din este concentrația ionilor metalici într-o soluție de sare (cu calcule precise, activitate). Să determinăm potențialele electrodului cadmiului și cuprului la concentrații date:
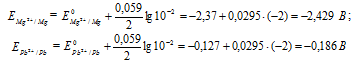
Pentru determinare EMF Celula galvanică din potențialul catodului ar trebui să scadă potențialul anodului, obținem:
Dacă concentrația fiecăruia dintre ionii de Mg 2+ și Pb 2+ este crescută de același număr de ori, atunci EMF-ul celulei galvanice nu se va modifica, deoarece în acest caz valorile numerice ale potențialelor metalice vor scădea în consecință, iar diferența dintre valorile lor nu se va schimba. De exemplu, cu o creștere a concentrației de ioni cu un factor de 100, concentrația lor va lua valori de 1 mol / l, iar potențialele electrozilor vor deveni egale. potențiale standard metale, atunci EMF \u003d -0,127 - (-2,37) \u003d 2,243 V.
Răspuns: 2.243 V.
Sarcina 253.
Desenați o diagramă a două celule galvanice, în una dintre care nichelul este catodul, iar în cealaltă - anodul. Scrieți pentru fiecare dintre aceste elemente ecuațiile electronice ale reacțiilor care au loc la catod și la anod.
Soluţie:
a) Schema unei celule galvanice în care nichelul este catodul:
![]()
Rigla verticală indică interfața dintre metal și soluție, iar cele două rigle indică interfața dintre două faze lichide - o partiție poroasă (sau un tub de legătură umplut cu o soluție de electrolit). Magneziul are un potential mai mic (-2,37 V) si este anodul pe care are loc procesul de oxidare:
Mg 0 - 2 = Mg 2+ (1)
Nichelul, al cărui potențial este de -0,25 V este catodul, adică electrod pe care are loc procesul de reducere:
Ni 2+ + 2 = Ni 0 (2)
Ecuația reacției redox care caracterizează funcționarea unei anumite celule galvanice poate fi obținută prin adăugarea ecuațiilor electronice ale proceselor anod (1) și catod (2):
Mg 0 + Ni 2+ = Mg 2+ + Ni 0
b) Schema unei celule galvanice în care anodul este nichelul:
![]()
Nichelul are un potențial mai mic (-0,25 V) și este anodul pe care are loc procesul de oxidare:
Ni 0 - 2 = Ni 2+ (1)
Cuprul, al cărui potențial (+0,34 V) este catodul, adică electrod pe care are loc procesul de reducere:
Сu 2+ + 2 = Сu 0 (2)
Ecuația reacției redox care caracterizează funcționarea unei anumite celule galvanice poate fi obținută prin adăugarea ecuațiilor electronice ale proceselor anod (1) și catod (2):
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Sarcina 254.
Plăcile de fier și argint sunt conectate printr-un conductor extern și scufundate într-o soluție de acid sulfuric. Desenați o diagramă a acestei celule galvanice și scrieți ecuațiile electronice pentru procesele care au loc la anod și la catod.
Soluţie:
Potențialele standard ale electrodului fierului și argintului sunt, respectiv, -0,44 V și respectiv +0,80 V. Pe baza faptului că fierul are un potențial electronegativ mai mare decât hidrogenul de 0,00 V, are loc o reacție între fier și o soluție de acid sulfuric (fierul înlocuiește hidrogen din acid), iar placa de fier va scădea în masă:
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Pe baza faptului că argintul are un potențial electropozitiv mai mare decât hidrogenul, nu există nicio reacție între argint și o soluție de acid sulfuric. Dar, deoarece plăcile de fier și argint sunt legate printr-un conductor extern și scufundate într-o soluție de acid sulfuric, între ele va avea loc un proces redox, în care placa de fier va fi anodul, iar cea de argint va fi catodul.
Procesul la anod este:
Fe 0 → Fe 2+ + 2
Ionii de hidrogen vor fi descărcați la catodul unei plăci de argint:
2Н + + 2 → Н 2 0
Circuitul celulei galvanice are forma:
(-) Fe | Fe 2+ || 2H + | H2, Ag (+)
Sarcina 255.
Realizați o diagramă, scrieți ecuațiile electronice ale proceselor cu electrozi și calculați EMF-ul unei celule galvanice formată din plăci de cadmiu și magneziu scufundate în soluții ale sărurilor acestora cu o concentrație de [Mg 2+ ] = = 1 mol/l. Se va schimba valoarea emf dacă concentrația fiecărui ioni este scăzută la 0,01 mol/l? Răspuns: 1.967 V.
Soluţie:
Magneziul are un potential mai mic (-2,37 V) si este anodul pe care are loc procesul de oxidare.
Celulă galvanică- aceasta este o sursă de curent chimic în care energia eliberată în timpul unei reacții redox pe electrozi este direct transformată în energie electrică .
Principiul de funcționare al unei celule galvanice poate fi luat în considerare folosind elementul Daniel-Jacobi ca exemplu (Fig. 9.2).
Orez. 9.2. Schema unei celule galvanice Daniel–Jacobi
Aici I este un pahar care conține o soluție de ZnSO 4 în apă cu o placă de zinc scufundată în el; II - un pahar care conține o soluție de CuSO 4 în apă cu o placă de cupru scufundată în el; III - punte de sare (cheie electrolitică), care asigură deplasarea cationilor și anionilor între soluții; IV - voltmetru (necesar pentru Măsurarea EMF, dar nu este inclus în compoziția celulei galvanice).
Potențialul electrodului standard al electrodului de zinc ![]() . Potențialul electrodului standard al electrodului de cupru
. Potențialul electrodului standard al electrodului de cupru ![]() . pentru că
. pentru că ![]() , atunci atomii de zinc vor fi oxidați:
, atunci atomii de zinc vor fi oxidați:
Se numește electrodul la care are loc reacția de reducere sau care acceptă cationi din electrolit catod.
Prin cheia electrolitică are loc mișcarea ionilor în soluție: SO 4 2– anioni la anod, cationii Zn 2+ la catod. Mișcarea ionilor în soluție închide circuitul electric al celulei galvanice.
Reacțiile (a) și (b) se numesc reacții cu electrozi.
Adunând ecuațiile proceselor care au loc pe electrozi, obținem ecuația totală a reacției redox care are loc în celula galvanică:
În cazul general, ecuația generală a reacției redox care are loc într-o celulă galvanică arbitrară poate fi reprezentată ca:
Circuitul celulelor galvanice Daniel-Jacobi are forma:
Zn | ZnSO 4 || CuSO4 | Cu
Se numește diferența maximă de potențial a electrozilor care poate fi obținută în timpul funcționării unei celule galvanice forta electromotoare(emf) element E. Se calculează după formula;
Unde n este numărul de electroni într-un act redox elementar, F este numărul Faraday.
Mărimea modificării potențialului izobar-izoterm al reacției generatoare de curent în condiții standard ∆ G 0 este legat de constanta de echilibru a acestei reacții LA este egal cu raportul
| (9.6) |
Celulele galvanice sunt surse primare (de unică folosință) de curent chimic (CSS). HIT secundare (reutilizabile) sunt bateriile. Procesele care au loc în timpul descărcării și încărcării bateriilor sunt reciproc inverse.
Celulele galvanice în care electrozii sunt fabricați din același metal și cufundați în soluții ale sărurilor lor de diferite concentrații se numesc concentraţie. Funcția anodului în astfel de elemente este îndeplinită de un metal scufundat într-o soluție de sare cu o concentrație mai mică, de exemplu:
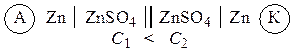
Exemplul 1 Realizați o diagramă a unei celule galvanice pe baza reacției: Mg + ZnSO 4 = MgSO 4 + Zn. Care este catodul și anodul din acest element? Scrieți ecuațiile pentru procesele care au loc pe acești electrozi. Calculați EMF-ul elementului în condiții standard. Calculați constanta de echilibru pentru reacția de formare a curentului.
Soluţie
În tabel găsim valorile potențialelor standard ale electrodului sistemelor Zn/Zn 2+ și Mg/Mg 2+:
![]()
![]()
În măsura în care ![]() , apoi electrodul de magneziu acționează ca anod, iar electrodul de zinc ca catod. Circuitul celulei galvanice are forma:
, apoi electrodul de magneziu acționează ca anod, iar electrodul de zinc ca catod. Circuitul celulei galvanice are forma:
Oxidarea are loc la anod
![]()
La catod - reducerea cationilor mediului:
![]()
Emf standard celulă galvanică
E\u003d φ 0 k - φ 0 a \u003d -0,763 - (-2,37) \u003d 1,607 V.
Folosind ecuațiile (9.5) și (9.6), calculăm constanta de echilibru a reacției generatoare de curent:
Prin potențare, găsim LA egal = 3,5 ∙10 54 .
În măsura în care LA>>1, atunci reacția de formare a curentului este practic ireversibilă.
Exemplul 2 Desenați o diagramă a unei celule galvanice formată din electrozi de zinc și argint scufundați în soluții de săruri ale acestora. Concentrațiile ionilor în soluții: C Zn 2+ \u003d 0,1 mol / l, C Ag+ = 0,01 mol/l. Indicați care electrod este catodul și care este anodul. Scrieți ecuațiile reacțiilor care au loc pe electrozi, precum și ecuația totală a reacției generatoare de curent într-o celulă galvanică. Calculați emf-ul acestui element.
Soluţie
Deoarece concentrațiile ionilor nu sunt egale cu unitatea, mai întâi calculăm potențialele electrozilor folosind formula Nernst. Dacă nu există o valoare a temperaturii în starea problemei, atunci aceasta este considerată egală cu temperatura standard T= 298 K. Prin urmare, vom folosi ecuația (9.2):
![]()
Inlocuim valoarea numerica a concentratiei in formula Nernst folosind datele din tabelul 9.1:
Din calcul reiese clar că ![]() . Prin urmare, electrodul de zinc acționează ca anod, iar electrodul de argint acționează ca catod.
. Prin urmare, electrodul de zinc acționează ca anod, iar electrodul de argint acționează ca catod.
Diagrama unei celule galvanice:
Să calculăm EMF-ul elementului folosind formula (9.4):
E\u003d φ k - φ a \u003d 0,741 - (-0,789) \u003d 1,530 V.
Acum să scriem reacțiile electrodului. Procesul de oxidare are loc la anod:
![]()
iar la catod - procesul de recuperare:
![]()
Adunând ecuațiile proceselor cu electrozi (ținând cont de egalitatea numărului de electroni primiți și eliberați), obținem ecuația totală a reacției de formare a curentului: Zn + 2Ag + = Zn 2+ + 2Ag.
Sarcini
221–226 Scrieți ecuațiile pentru procesele catodice și anodice și întocmește diagrama unei celule galvanice, în timpul căreia are loc următoarea reacție (vezi tabel). Pe baza valorilor potențialelor standard ale electrodului, calculați constanta de echilibru a acestei reacții și EMF-ul elementului.
| numărul sarcinii | Reacţie | Răspuns |
| Sn + PbCl2 = SnCl2 + Pb | LA p=2,0; E= 9∙10 – 3 B | |
| Zn + Pb(NO3)2 = Zn(NO3)2 + Pb | LA p \u003d 3,5 10 21; E= 0,633V | |
| Zn + 2AgNO 3 \u003d Zn (NO 3) 2 + 2Ag | LA p \u003d 8,7 10 52; E= 1,56 V | |
| Ni + 2AgNO 3 \u003d Ni (NO 3) 2 + 2Ag | LA p \u003d 3,8 10 35; E= 1,05 V | |
| Zn + CdS04 = ZnS04 + Cd | LA p \u003d 1,56 10 12; E= 0,36 V | |
| Mg + Ni(N03)2 = Mg(N03)2 + Ni | LA p \u003d 1,7 10 8; E= 8,23V |
227–233 Calculați valorile potențialelor electrodului metalului, care este anodul, la diferite concentrații ale soluției: 10; 0,1; 0,01; 0,001 mol/l. Concentrația soluției în care este scufundat catodul este constantă și egală cu 1 mol/L. Determinați emf.
Reprezentați grafic dependența forței electromotoare a unei celule galvanice de logaritmul concentrației soluției în care este scufundat anodul. Scrieți o ecuație pentru o reacție de formare a curentului care are loc într-o celulă galvanică.
234–236 Unul dintre electrozii unei celule galvanice este un metal (vezi tabel) scufundat într-o soluție de sare cu o concentrație de ioni de 0,01 mol/l, iar celălalt este un electrod de hidrogen. FEM-ul acestui element este E, V. Scrieți ecuațiile reacțiilor catodice și anodice, dați o diagramă a unei celule galvanice. Calculați potențialul electrodului de hidrogen și concentrația ionilor de hidrogen din soluție. T= 298K.
237–240 Notați ecuațiile reacțiilor electrodului și întocmește o diagramă a unei celule galvanice, a cărei funcționare este exprimată prin ecuația prezentată în tabel. Indicați care electrod este catodul și anodul. Calculați valorile potențialelor electrodului la concentrațiile soluțiilor anodice DIN 1 și catod DIN 2 (vezi tabel). Determinați emf-ul acestui element.
241–244 Desenați o diagramă a unei celule galvanice formată din două metale Me 1 și Me 2, scufundate într-o soluție de săruri proprii cu o concentrație de ioni DIN 1 și DIN 2 (vezi tabel). Indicați care electrod este catodul și anodul. Scrieți ecuațiile reacțiilor care au loc pe acești electrozi, precum și ecuația totală a reacției generatoare de curent în celula galvanică. Calculați emf-ul acestui element.
245 –247 Calculați valorile potențialelor de electrozi ale metalelor date în starea problemei, la concentrațiile soluțiilor DIN 1 (pentru metalul 1) și DIN 2 (pentru al 2-lea metal). Identificați anodul și catodul. Calculați EMF-ul elementului.
Efectuați calcule similare pentru concentrațiile soluțiilor reduse de 10 ori. Se va schimba EMF?
Dați ecuațiile reacțiilor electrodului.
248 Ce element galvanic se numește concentrație? Schițați-l. Scrieți ecuațiile proceselor anodului și catodic, calculați fem. Celula galvanică este formată din electrozi de argint scufundați: primul în 0,01 M, iar al doilea în soluții de AgNO 3 0,1 M.
Răspuns: 0,059 V.
249 Desenați o diagramă a două celule galvanice, în una dintre care nichelul ar fi anodul, în cealaltă - catodul. Scrieți pentru fiecare dintre ele ecuațiile reacțiilor care au loc la anod și la catod și calculați EMF galvanic elemente în condiții standard. Se va modifica EMF-ul acestui element dacă concentrația fiecărui ioni este redusă de 10 ori?
250 Plăcile de fier și argint sunt conectate printr-un conductor extern și scufundate într-o soluție de acid sulfuric. Faceți o diagramă a acestei celule galvanice și scrieți ecuațiile electronice pentru procesele care au loc pe catod și anod.
COROZIUNEA METALELOR
Coroziune– distrugerea spontană a metalelor ca urmare a interacțiunii cu agenții de oxidare a mediului.
Acesta este un proces redox în care metalul acționează ca un agent reducător. Cauza principală a coroziunii este instabilitatea termodinamică a metalului în mediu și posibilitatea trecerii acestuia la o stare mai stabilă (oxidată).
Uneori, coroziunea se numește rugină. Ruginirea - coroziunea fierului și a aliajelor acestuia cu formarea de produse de coroziune, constând în principal din hidroxizi de fier grade diferite hidratare, galben-brun. Metalele neferoase se corodează, dar nu ruginesc. În funcție de natura distrugerii, coroziunea este împărțită în electoral, continuu(uni și inegale) local(pătat, cu sâmburi sau ulcerativ), fisurare prin coroziune de tensiuneȘi coroziunea intercristalină. După tipul de mediu în care se desfășoară procesul, coroziunea poate fi solului, atmosferică, electrolitică, gazoasă, sub acțiunea curenților vagabonzi. În funcție de mecanismul de curgere și de condițiile externe, coroziunea este împărțită în chimică și electrochimică.
Coroziunea chimică curge înăuntru mediu gazos la temperaturi ridicate (în absenţa umidităţii) sau în neelectroliţi lichizi. Esența acestui tip de procese de coroziune se reduce la o reacție redox efectuată cu transferul direct al electronilor metalici la agentul de oxidare. Gaze precum O, SO, Cl, HCl etc. pot actiona ca agent de oxidare.H 2 S, CO contribuie de asemenea la coroziune. În urma reacției, pe suprafața metalului se formează pelicule de oxizi, sulfuri, cloruri etc.
Dezvoltarea coroziunii are loc din cauza transferului de cationi metalici, particule de oxidant sau electroni prin filmul format. Dacă filmul este dens, continuu, bine aderat de metal, atunci oxidarea ulterioară a metalului are loc foarte lent. Astfel de filme pot fi folosite pentru a proteja metalele împotriva coroziunii. Dimpotrivă, o peliculă liberă nu este capabilă să protejeze metalul de interacțiunea redox ulterioară cu mediul. Proprietățile de protecție ale produselor de coroziune formate sunt determinate pe baza calculului factorului de slăbiciune F:
| | (10.1) |
Unde V este volumul molar (molar) al produselor de coroziune (oxid, clorură, sulfură etc.);
V este volumul molar (molar) al metalului folosit pentru a forma oxidul;
M este masa molară a produselor de coroziune;
r este densitatea metalului;
n este numărul de atomi de metal din produsul de coroziune;
DAR este masa atomică a metalului;
r este densitatea produsului de coroziune.
Dacă f< 1, то образуется пленка, частично покрывающая поверхность металла (рыхлая пленка). Сплошная пленка, обладающая защитным действием, получается лишь при условии 1< Ф < 2,5. Если фактор рыхлости Ф >2.5, apoi apar tensiuni în film, distrugându-l și încălcând continuitatea (filmul se umflă și crapă).
Exemplul 1În timpul coroziunii chimice a fierului într-o atmosferă de aer uscat care conține H2S și O2 gazos, se formează pelicule de FeS și FeO. Scrieți ecuațiile pentru formarea acestor compuși. Calculați factorul de slăbiciune Ф și trageți o concluzie despre proprietățile de protecție ale foliilor. Densitatea r = 7,87; r=4,7; r = 5,7 g/cm.
Soluţie
Filmele se formează atunci când un metal interacționează cu un mediu agresiv ca urmare a următoarelor reacții:
2Fe + 2H2S + O = 2FeS + 2H2O;
2Fe + O 2 \u003d 2FeO.
Înlocuind valorile numerice din (10.1), găsim factorul de slăbiciune:
![]() ,
,
![]() .
.
Deoarece f > 2,5 pentru o peliculă de sulfură, fisurarea și discontinuitatea acestuia sunt posibile.
Criteriul Ф pentru pelicula de oxid se află în intervalul 1< Ф < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами.
Coroziunea electrochimică- distrugerea spontană a metalelor în prezența unui electrolit ca urmare a formării perechilor galvanice la contactul cu metale diferite, cum ar fi supape și conducte, sau o multitudine de celule microgalvanice pe suprafața unui aliaj metalic. Dintre cele mai importante tipuri coroziunea electrochimică include atmosferice, subterane, marine și apa dulce, hidrogen sulfurat, acid, alcalin, în săruri topite, în apă-medii organice și organice. Principala diferență între coroziunea electrochimică și coroziunea chimică constă în separarea spațială a reacțiilor de oxidare a metalelor și reducerea oxidantului care apar în secțiunile catodului și anodului. În timpul coroziunii electrochimice, procesele de oxidare și reducere au loc în zone cu diferite structura chimica sau starea fizică a suprafeței, adică neomogenitatea chimică și energetică. Această neomogenitate poate apărea atunci când faza și compoziție chimică metal și aliaj, în prezența impurităților în metal, cu tratament chimic inegal, cu concentrații inegale ale electrolitului din jur, cu eterogenitate și grosimi diferite ale peliculelor de produse de coroziune etc.
Activitatea cantitativ diferită a suprafețelor poate fi caracterizată prin mărimea potențialului electrodului φ, care apare la limita „metal-soluție” (Tabelul 9.1). Zonele mai active ale suprafeței au o valoare mai mică a potențialului electrodului (mai negativă) și sunt numite zonele anodice. Se numesc zone cu activitate mai mică catodic.
Pe locurile anodului, metalul este oxidat, adică distrugerea lui:
Eu - nē → Eu,
unde Me sunt cationi metalici care trec în soluție;
Eu 0 - metal.
Electronii rămân în interiorul metalului și se deplasează de la anod în zonele catodice, cu care sunt în contact direct și unde are loc reducerea. ionii și moleculele unui agent oxidant într-un mediu corosiv. În funcție de compoziția mediului, au loc următoarele procese:
- în mediu acid:
2H + 2ē \u003d H;
– într-un mediu neutru sau ușor alcalin:
2Н 2 O + 2ē \u003d H + 2OH.
Cel mai probabil proces catodic într-un mediu neutru în prezența aerului dizolvat în apă (atmosferică, coroziune a solului, aer umed) este următorul:
O 2 + 2H 2 O + 4ē \u003d 4OH.
Exemplul 2 Compuneți ecuațiile electronice pentru procesele de coroziune catodică și anodică a unui aliaj de fier cu nichel în acid clorhidric și în aer umed. Care este compoziția produsului de coroziune?
Soluţie
Să scriem din tabelul 9.1 valorile potențialelor electrodului standard ale metalelor: φ 0 = -0,44 V, φ 0 = -0,25 V. Deoarece φ 0< φ 0 , то железо будет выполнять функцию анода, а никель – катода.
Într-un mediu acid ecuațiile electronice ale proceselor au forma:
- reacție anodică: Fe 0 - 2ē \u003d Fe 2+;
- reacție catodică: 2H + + 2ē \u003d H 0 2.
Produsele de coroziune sunt clorură de fier FeCl și hidrogen.
În aer umed Următoarele reacții apar la secțiunile catodului și anodului:
– reacție anodică: Fe – 2ē = Fe;
- reactie catodica: 2Н O + O + 4ē = 4OH.
Produși de coroziune Fe + 2OH = Fe(OH).
În prezența umidității și a oxigenului, fierul este oxidat în continuare la starea trivalentă:
4Fe(OH) + 2H O + O = 4Fe(OH).
Pentru a cuantifica rezistența la coroziune a metalelor, masa ( j) și indicatori de adâncime (P).
Viteză reactie chimica se determină din raportul:
unde ∆ m este modificarea masei probei, g;
– timpul de coroziune, oră sau an;
S este suprafața de coroziune, m2.
Indicele de coroziune profundă P este egal cu:
| P = , mm/an, | (10.3) |
unde ∆ h este grosimea metalului distrus în timpul t.
P și j corelate prin raportul:
Dacă j măsurată în g/m2. an,
Dacă j măsurată în g / m 2. h,
unde r este densitatea metalului, g / cm 3.
Conform indicatorilor de mai sus, de regulă, se estimează coroziunea globală a sistemului.
Protectie anticoroziva
Deoarece, după cum sa menționat mai sus, procesul de coroziune electrochimică constă în apariția reacțiilor catodice și anodice interdependente, încetinirea uneia dintre ele duce la o scădere a vitezei procesului de coroziune în ansamblu.
Metodele de protecție împotriva coroziunii pot fi împărțite în trei grupuri:
– impact asupra metalului;
– impact asupra mediului agresiv;
– metode combinate de protecție.
LA primul grup raporta:
a) dopajul metalelor - crearea unui strat de suprafață de ecranare sau introducerea de elemente care reduc activitatea catodică sau anodica a aliajului;
b) tratarea suprafețelor metalice - tratament termic, pulverizare, prelucrare (călire etc.), modificarea ruginii la suprafață;
c) aplicarea de straturi de protectie;
d) selectarea materialelor rezistente la coroziune;
e) proiectare rațională - retragerea componentelor individuale ale structurii din mediile agresive.
A doua grupă metodele de protecție includ:
a) utilizarea inhibitorilor de coroziune;
b) dezaerarea mediului;
c) crearea de medii artificiale (tratarea mediilor de apă, utilizarea unor medii neutre, dezumidificarea aerului).
A treia grupă metodele de protecție utilizează o combinație a metodelor de mai sus.
Acoperiri de protecție poate fi subdivizată în organic(bitum, vopsele, emailuri, lacuri), anorganic(oxid, fosfat, nitrură și alte filme) și galvanic(metal, obținut prin electroliză).
Anorganic acoperirile (chimice) sunt obținute prin tratarea metalului cu anumite substanțe chimice. Când această substanță interacționează cu suprafața metalului, se formează o peliculă dintr-un compus anorganic puternic, care protejează metalul de distrugere.
Galvanic acoperirile sunt împărțite în catodice și anodice (Fig. 10.1) în funcție de raportul dintre potențialele standard ale electrodului materialului protejat j 0 și acoperirea j 0. Dacă j 0 > j 0, atunci în caz de încălcare a integrității acoperirii de protecție, anodul va fi metalul de acoperire ( acoperire anodica), catodul este metalul protejat.
Învelișul anodic este foarte eficient, deoarece, atunci când este distrus, protejează metalul protejat de distrugere. Un exemplu de acoperire anodică în ceea ce privește fierul sunt acoperirile cu zinc și magneziu ale oțelurilor. Dacă j 0< j 0 , то при нарушении целостности покрытия защищаемый металл будет анодом, а металл покрытия – катодом (acoperire catodica). Acoperirile catodice protejează metalul atâta timp cât aceste acoperiri sunt continue.
miercuri miercuri
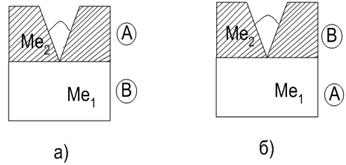
Orez. 10.1. Galvanizarea: a) acoperire anodica j 0 1 > j 0 2 ; b) acoperire catodică j 0 1< j 0 2 . Ме 1 – защищаемый металл, Ме 2 – металл покрытия (А – анод, В – катод)
Protecție electrochimică subdivizat în catodic, sacrificial și anodic. Primele două tipuri protectie electrochimica se realizează prin crearea unei celule galvanice în care rolul catodului este jucat de metalul protejat. Acest lucru se realizează prin contactul cu un metal mai activ - un protector (care are o valoare mai mică a potențialului electrodului standard) sau prin conectarea produsului la polul negativ al unei surse externe de curent (protecție catodică).
Protecția anodului apare atunci când un metal este conectat la polul pozitiv al unei surse de curent și se formează un strat de oxid puternic pe suprafața sa din cauza oxidării anodice sub acțiunea electrolizei (și potențialul său de electrod este deplasat în regiunea unei stări pasive).
Inhibitori Substanțele adăugate în cantități mici într-un mediu agresiv sunt numite substanțe care se acumulează la interfața metal-electrolit și reduc viteza de coroziune. Eficacitatea acțiunii inhibitorilor este estimată prin valorile coeficientului de inhibiție LA si gradul de protectie Z:
![]()
Unde ј este viteza de coroziune în soluție fără inhibitor;
ј este viteza de coroziune în soluție cu un inhibitor.
Valoare LA arată de câte ori scade viteza de coroziune a metalului odată cu introducerea unui inhibitor. Valoare Z caracterizează scăderea relativă a vitezei de coroziune. Efectul protector al inhibitorilor este afectat semnificativ de o serie de factori de coroziune externi și interni: aciditatea mediului, temperatura, natura acidului și a materialului protejat, natura solventului și a inhibitorului în sine, concentrația inhibitorului, amestecarea etc.
Exemplul 3 Se poate folosi stratul de zinc pentru a proteja un produs din oțel împotriva coroziunii în aerul umed? Scrieți ecuațiile electronice pentru procesele de coroziune catodică și anodică observate atunci când această acoperire este deteriorată. Care este compoziția produselor de coroziune? Care ar trebui să fie grosimea stratului pentru ca acesta să reziste 5 ani dacă valoarea indicelui de adâncime P este de 0,16 mm/an? Acoperirea este considerată invalidă dacă grosimea sa reziduală este de 18% din valoarea inițială.
Soluţie
Comparând potențialele electrodului j 0 Zn / Zn 2+ = -0,76 V și j 0 Fe / Fe 2+ = -0,44 V, vedem că j 0 Zn< j 0 Fe .Следовательно, цинк по отношению к железу является анодом. Цинковое покрытие – анодное покрытие. На аноде идет процесс окисления:
Zn - 2ē \u003d Zn 2+.
La catod (Fe) - procesul de reducere a particulelor din mediu (în aer umed, acestea sunt oxigen și apă):
2Н O + O + 4ē = 4OH.
Produși de coroziune: Zn 2+ + 2OH - = Zn(OH) 2.
Dacă învelișul este rupt, oțelul nu se dizolvă, prin urmare, se poate folosi stratul de zinc.
Grosimea stratului ∆ h poate fi găsit din ecuația:
de unde ∆ h\u003d P × t \u003d 0,16. 5 = 0,8 mm.
Dar 82% din grosimea originală este supusă coroziunii. Apoi, întreaga grosime a acoperirii ar trebui să fie egală cu 100%:
![]()
Sarcini
251 –255 Compuneți ecuațiile electronice ale proceselor de coroziune anodică și catodică a unei conducte de oțel (componenta principală a oțelului este fierul) care conține impurități de metal A în solul umed (apa și oxigenul sunt prezente). Care este compoziția produselor de coroziune? Calculați grosimea peretelui conductei (mm) care urmează să fie τ ani dacă rata sa de coroziune este j. Grosimea peretelui rămasă a conductei trebuie să fie de cel puțin 25% din valoarea inițială. Densitatea fierului r \u003d 7,87 g / cm 3.
256–259 Materialul propus poate fi folosit ca protector pentru a proteja un produs din oțel împotriva coroziunii în apa naturală saturată cu oxigen (componenta principală a oțelului este fierul)? Scrieți ecuațiile electronice pentru procesele de coroziune anodică și catodică. Care este compoziția produselor de coroziune? Determinați durata de viață posibilă a secțiunii benzii de rulare " a × b " dacă viteza sa de coroziune j, g / m 2 × an și masa m, G.
260–262 Învelișul dorit poate fi utilizat pentru a proteja eficient un produs din oțel împotriva coroziunii în aerul umed? (Componenta principală a oțelului este fierul.)
Compuneți ecuațiile electronice ale proceselor de coroziune anodică și catodică care apar atunci când integritatea stratului este încălcată. Care este compoziția produselor de coroziune? Care ar trebui să fie grosimea stratului de acoperire pentru ca acesta să reziste τ ani, dacă valoarea indicelui său de adâncime este P, mm/an? Acoperirea este considerată valabilă până când grosimea sa reziduală este de 15% din valoarea inițială.
263–266 În timpul coroziunii chimice a metalelor Me într-o atmosferă de aer uscat care conține O 2 gazos; Acid clorhidric; H 2 S, sub influenta temperaturi mari se formează pelicule de produse de coroziune. Scrieți ecuațiile pentru formarea compușilor. Cunoscând densitatea metalelor, oxizii, clorurile, sulfurile acestora, determinați care dintre pelicule va avea efect protector.
| numărul sarcinii | Metal, eu | r, g/cm3 | Produși de coroziune și densitatea lor, g / cm 3 |
| Fe | 7,87 | FeO -5,7; Fe203 -5,25; FeCI2 - 2,9; FeS2 - 5,03; Fe304 - 5,18 | |
| Cu | 8,94 | CuO - 6,46; Cu20 - 3,7; CuCI2 - 3,05; Cu2S - 5,4; CuS - 4,68 | |
| Mn | 7,74 | MnO -5,18; Mn203 - 4,3; Mn304 - 7,42; MnCI2 - 2,98; Mn02 - 5,03 | |
| Ni | 8,91 | NiO - 7,45; Ni2S3 - 5,82; NiCI2 - 3,51; NiS - 4,12 |
267–270 produs metalic, care conțin incluziuni de impurități A (vezi tabel), corodează puternic într-o soluție de HCl. Inhibitorii sunt utilizați pentru a încetini procesul în soluții acide. Determinați coeficientul de inhibare a coroziunii LA si gradul de protectie Z, pe care inhibitorul îl oferă, dacă pt t ore de pierdere în greutate a produsului S constitui m 0 grame în absenţa inhibitorului şi m grame, dacă sunt disponibile. Alcătuiți ecuațiile electronice ale proceselor de coroziune anodică și catodică a produsului în acid. Care este compoziția produselor de coroziune?
Răspuns: 267) 3,5; 71,2%; 268) 8,0; 87,6%; 269) 8,0; 87,6%; 270) 2,6; 61,6%.
ELECTROLIZĂ
electroliza -un set de procese redox care au loc pe electrozi atunci când un curent electric direct trece printr-o soluție de electrolit sau topitură.
Anodul (A) este electrodul în care are loc procesul de oxidare. Catod (K) - electrodul pe care are loc procesul de reducere. În timpul electrolizei, catodul este conectat la polul negativ al sursei de curent, iar anodul la cel pozitiv.
Luați în considerare esența procesului pe exemplul electrolizei topi NaOH cu electrozi de carbon. În topituri, ca și în soluții, moleculele de electroliți se disociază în ioni:
NaOH Á Na + + OH – .
Trecerea unui curent electric determină o mișcare direcționată a ionilor. Cationii de sodiu Na + se deplasează spre catod și acceptă electroni din acesta:
Anionii OH - se apropie de anod și donează electroni:
Reacția totală de electroliză a topiturii substanței NaOH este reprezentată de suma a doi procese cu electrozi și este exprimată prin ecuația:
Electroliza sărurilor sau oxizilor topiți este utilizată în tehnologie pentru obținerea metalelor active (Li, Na, K, Ca, Al).
ÎN solutii apoase Pe lângă ionii electrolitului în sine, există molecule de apă, care pot participa și la procesele de oxidare și reducere a electrozilor.
Pentru a determina rezultatele electrolizei solutii puteți folosi următoarele reguli.
procese catodice
La catod, cationii cu un potențial electrod standard mai mare φ 0 sunt mai ușor de redus.
Deci, dacă potențialul standard al electrodului unui metal este mai mare de –0,41 V, atunci ionii acestui metal sunt de obicei redusi la catod. Dacă potențialul metalului este în intervalul , atunci atât ionii metalici, cât și apa sunt reduse simultan la catod. Dacă potențialul metalului este mai mic de -1,4 V, atunci doar apa este redusă la catod. Cele de mai sus pot fi reprezentate prin următoarea diagramă:
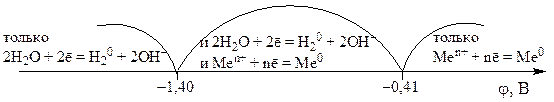
Procese anodice
Anozii utilizați în electroliză sunt împărțiți în inert(grafit, cărbune, platină, aur, iridiu) și activ(alte metale).
La anod, sistemul cu potențialul redox mai scăzut este mai întâi oxidat. Dar, în unele cazuri, din cauza complexității descărcării ionilor care conțin oxigen (NO - 3, SO 2 - 4, PO 3 - 4, CO 2 - 3 etc.), această regulă nu este îndeplinită. Tipul de reacție anodică este în general determinat de natura particulei de descărcare.
În caz de utilizare activ (solubil) al anodului, metalul anodului este oxidat:
Eu 0 - nē \u003d Eu n +.
Când este electrolizat cu inert anodul oxidează cu ușurință anioni simpli ai acizilor anoxici prezenți în soluție (I - , Br - , Cl -).
Ionii complecși de acizi care conțin oxigen (SO, CO, PO etc.) în soluții apoase, de regulă, nu sunt oxidați - apa este oxidată în schimb:
2H 2 O - 4ē \u003d O 2 + 4H +.
Secvența proceselor de oxidare la anod poate fi reprezentată prin următoarea schemă:
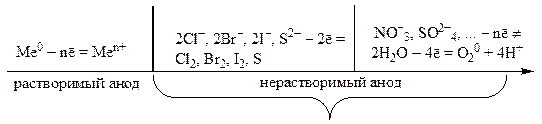
Exemplul 1 Alcătuiți ecuații ale proceselor catodice și anodice care au loc în timpul electrolizei unei soluții apoase de K 2 SO 4 pe electrozi de carbon.
Soluţie
Într-o soluție apoasă, sarea K 2 SO 4 se disociază: K 2 SO 4 Á 2K + + SO 2– 4.
Catodul se apropie cationii K + și moleculele de H 2 O, ionii SO 2– 4 și moleculele de H 2 O se apropie de anod, deoarece potențialul sistemului ![]() (vezi Tabelul 9.1) mai puțin de -1,4 V, moleculele de apă vor fi reduse la catod (vezi diagrama de mai sus).
(vezi Tabelul 9.1) mai puțin de -1,4 V, moleculele de apă vor fi reduse la catod (vezi diagrama de mai sus).
Anionii SO 2-4 sunt ioni complecși; nu sunt oxidați în soluții apoase. Prin urmare, moleculele de apă sunt oxidate la anod.
Soluția la catod devine alcalină (apar ioni OH -), la anod devine mai acidă (apar ioni H +). Ecuația moleculară globală pentru reacția de electroliză este:
KOH şi H2S04 se formează din K+ şi OH-, H+ şi SO2-4 în soluţie.
Exemplul 2 Compuneți ecuații pentru procesele catodice și anodice care au loc în timpul electrolizei unei soluții de CuCl 2 cu un anod de cupru.
Soluţie
Într-o soluție apoasă, sarea CuCl 2 se disociază: CuCl 2 Á Сu 2+ + 2Cl - .
Cationii Cu2+ și H20 sunt adecvați pentru catod; la anod - ionii Cl - și H 2 O. Anodul de cupru este solubil, participă la reacția electrodului. Potențialul φ 0 С u/Cu2+ = 0,34 V, iar Cu 2+ va fi restabilit pe catod, în conformitate cu schema de mai sus. Metalul anodic este implicat în procesul anodului (anod solubil în Cu):
Ca urmare a electrolizei, cuprul este transferat de la anod la catod, iar sarea nu este afectată de acest proces și oferă doar conductivitate electrică.
Este dată caracteristica cantitativă a proceselor de electroliză legile lui Faraday. Li se poate da următoarea formulare generală:
masa electrolitului care a suferit transformare în timpul electrolizei, precum și masele de substanțe formate pe electrozi, sunt direct proporționale cu cantitatea de electricitate care a trecut prin soluția sau topitura de electrolit și cu masele echivalente ale substanțelor corespunzătoare. .
Legea Faraday combinată este exprimată prin următoarea ecuație:
Unde DAR este masa atomică a unei substanțe simple eliberată la electrod;
n este sarcina ionului sau numărul de electroni implicați în procesul de electroliză;
eu- puterea curentului în amperi, A;
t– timpul de trecere curent în secunde, s;
F– Numărul Faraday (F = 96 500 C/mol).
Masa echivalentă a unei substanțe.
Deoarece există de obicei procese concurente, legile lui Faraday trebuie modificate.
Raportul dintre masa substanței eliberată efectiv pe electrod m etc. la masa substanței, care ar fi trebuit să fie eliberată în conformitate cu legea lui Faraday, se numește ieșirea curentă h:
![]() .
.
Exemplul 3. Cu trecerea unui curent electric de 1 A printr-o soluție de FeCl 2 (electrozii sunt inerți) timp de 1 oră, s-au eliberat 0,90 g de fier. Determinați ieșirea curentă. Ce procese consumă restul curentului?
Soluţie
Deoarece masa atomică a Fe este de 56 g/mol, atunci, în conformitate cu legea lui Faraday, valoarea teoretică a masei de fier eliberată la catod este:
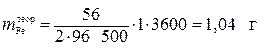 .
.
ieșire curentă:
Să ne întoarcem la schema proceselor la catod. Din moment ce valoarea ![]() se află în regiunea -1,4 V< φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
se află în regiunea -1,4 V< φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
Fe 2+ + 2ē \u003d Fe
și, parțial, molecule de apă:
2H 2 O + 2ē \u003d H 2 + 2OH – .
Astfel, o parte din curentul care curge prin electrolit este cheltuită pentru reducerea apei.
Exemplul 4 Electricitate o forţă de 1 A trece timp de 1 oră printr-o soluţie de ZnCl 2 (electrozii sunt inerţi). Determinați cantitatea de zinc eliberată pe catod în timpul specificat, dacă eficiența curentului h este de 64%. Explicați ce procese consumă restul curentului.
Soluţie
Potenţial ![]() B (vezi Tabelul 9.1) și se află în zonă
B (vezi Tabelul 9.1) și se află în zonă
-1,4 V< j < -0,41 В. Следовательно, на катоде будет идти совместное восстановление катионов Zn 2+ и, частично, молекул воды:
Zn 2+ + 2ē = Zn
2H 2 O + 2ē \u003d 2OH - + H 2 (parțial, proces secundar)
Pentru a determina cantitatea teoretică de zinc eliberată pe catod, folosim ecuația legii Faraday:
Ieșirea curentă este calculată prin formula
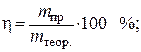
prin urmare
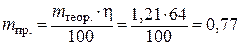 G.
G.
Pentru a obține zinc la catod, 64% din curentul total care trece prin electrolit este cheltuit, restul curentului este cheltuit pentru reducerea apei.
Sarcini
271–277
Masa unei substanțe solide eliberată pe catod în timpul electrolizei unei soluții de substanță B în timpul trecerii unui curent eu(A) în timpul τ (h), este m(G). Calculați puterea curentă. Explicați de ce, în unele cazuri, nu tot curentul este cheltuit pentru precipitarea metalelor.
| numărul sarcinii | Conexiuni | Anod solubil | eu, DAR | τ, oră | m, G | ||
| DAR | B | ÎN | |||||
| KCl | SnCl 2 | ZnSO4 | Zn | 8,5 | 36,6 | ||
| FeCl2 | ZnSO4 | MgCl2 | mg | 1,5 | 11,3 | ||
| NaOH | FeCl2 | MnSO 4 | Mn | 0,5 | 4,2 | ||
| PbCl2 | Cu(NO 3) 2 | FeCl2 | Fe | 7,1 | |||
| Ca(OH)2 | NiCl2 | AlCl 3 | Al | 9,3 | 18,8 | ||
| LiBr | MnSO 4 | CoCl2 | co | 10,5 | 0,5 | 3,0 | |
| SnCl 2 | FeSO4 | Pb(NO 3) 2 | Pb | 8,8 | 14,2 |
Răspuns :
271) 97 %; 272) 62 %; 273) 67 %; 274) 99 %; 275) 91,9 %;
276) 55,8 %; 277) 77,3 %.
278–284. Alcătuiți ecuațiile electronice ale proceselor care au loc pe catod și anod în timpul electrolizei:
1) topirea substanței A cu electrozi de grafit;
2) o soluție de substanță B cu electrozi de grafit;
3) o soluție de substanță B cu un anod (activ) solubil.
Calculați timpul necesar pentru pregătirea practică a 100 g de metal dintr-o soluție de substanță B la puterea curentă eu, dacă ieșirea curentă h.
| numărul sarcinii | Substanțe | Anod solubil | eu, A | h, % | ||
| DAR | B | ÎN | ||||
| SnCl 2 | Fe(NO 3) 2 | NiSO4 | Ni | 66,7 | ||
| Ni(OH)2 | CoCl2 | Pb(NO 3) 2 | Pb | 9,5 | ||
| MgCl2 | ZnSO4 | NiSO4 | Zn | 6,4 | ||
| ZnCl 2 | AgNO3 | CuCl 2 | Cu | 14,8 | ||
| CuBr 2 | Cd(NO 3) 2 | AgNO3 | Ag | 8,7 | ||
| NaOH | Pb(NO 3) 2 | NiCl2 | Ni | 5,9 | ||
| PbCl2 | CoSO 4 | Mg(NO3)2 | mg |
Raspuns: 278) 12 ore; 279) 10 ore; 280) 17,3 h; 281) 1,7 ore; 282) 6,4 ore; 283) 4,7 ore; 284) 12,3 ore
285–291 Alcătuiți ecuațiile electronice ale proceselor care au loc pe catod și anod în timpul electrolizei:
1) topirea substanței A cu electrozi de grafit;
2) o soluție de substanță B cu electrozi de grafit;
3) o soluție de substanță B cu un anod (activ) solubil.
Cum se va schimba masa anodului după trecerea unui curent de putere I (A) pentru un timp τ (h) prin soluția B?
| numărul sarcinii | Substanțe | Anod solubil | eu, A | τ , ora | ||
| DAR | B | ÎN | ||||
| NaI | MgSO4 | ZnCl 2 | Zn | 8,5 | ||
| CaCl2 | Cu(NO 3) 2 | FeCl2 | Fe | |||
| RbCl | AgNO3 | CuSO4 | Cu | 7,5 | 2,5 | |
| KOH | ZnCl 2 | CoCl2 | co | 3,7 | ||
| CuCl 2 | NaNO 3 | Pb(NO 3) 2 | Pb | 2,5 | ||
| NaOH | Bi(NO 3) 3 | NiCl2 | Ni | 2,0 | 2,5 | |
| CaI 2 | H2SO4 | Cd(NO 3) 2 | CD | 6,8 | 0,8 |
Răspuns :
285) 20,6 g; 286) 31,3 g; 287) 22,4 g; 288) 4,1 g; 289) 38,6 g;
290) 5,5 g; 291) 7,1 g
292–300 Alcătuiți ecuațiile electronice ale proceselor care au loc pe catod și anod în timpul electrolizei:
1) topirea substanței A cu electrozi de grafit;
2) o soluție de substanță B cu electrozi de grafit;
3) o soluție de substanță B cu un anod (activ) solubil.
Grafică modificarea masei anodului solubil m din puterea actuală eu la un timp de electroliză de 0,5 h. Puterea curentului eu egal cu 0,5; unu; 2; 3 și 5 A.
| numărul sarcinii | Conexiuni | Anod solubil | ||
| DAR | B | ÎN | ||
| KOH | Na2SO4 | NiCl2 | Ni | |
| RbCl | Li2SO4 | Pb(NO 3) 2 | Pb | |
| NaCl | Ni(NO 3) 2 | AgNO3 | Ag | |
| AlCl 3 | Fe2 (SO4) 3 | CuSO4 | Cu | |
| NaI | Cu(NO 3) 2 | ZnCl 2 | Zn | |
| SnCl 2 | CoSO4 | CuSO4 | Cu | |
| CoCl2 | BiCl 3 | AgNO3 | Ag | |
| numărul sarcinii | Conexiuni | Anod solubil | ||
| DAR | B | ÎN | ||
| KCl | SnCl 2 | ZnSO4 | Zn | |
| NaI | Cu(NO 3) 2 | PbCl2 |
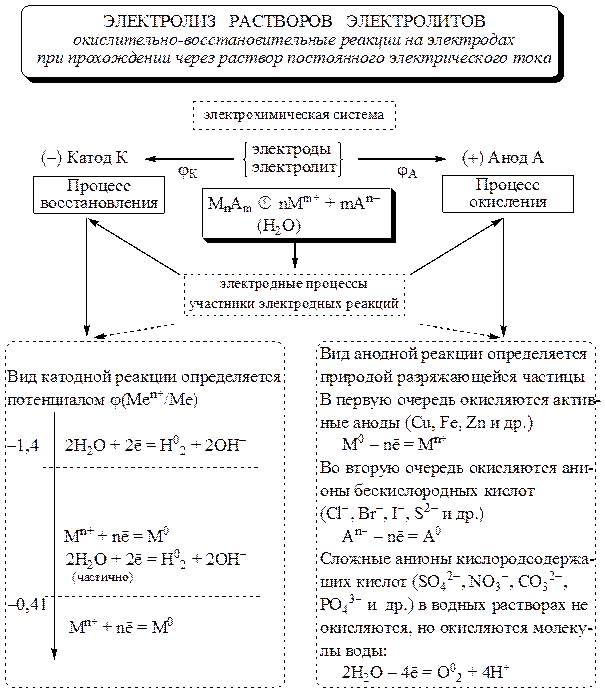
Orez. 11.1. Diagrama structural-logică a relației dintre procesele electrozilor în timpul electrolizei




