Cum se scrie un exemplu de chimie de ecuație emf. Măsurarea EMF a celulelor galvanice
Celulă galvanică Un dispozitiv care transformă energia chimică în energie electrică. Un astfel de element este elementul Daniel-Jacobi. Acest element este format din doi electrozi: zinc și cupru, cufundați în soluțiile de sulfat corespunzătoare, între care există o partiție poroasă:
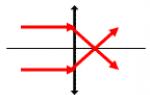
Când circuitul extern este închis, electronii trec de la Zn la Cu, iar zincul difuzează în cupru:
Formăm un circuit electrochimic:
Anod - electrod negativ (stânga). Catodul este electrodul pozitiv.
Pentru a determina EMF-ul acestui element, trebuie să comparați standardul potențialele electrodului ambii electrozi. Când se înregistrează reacțiile electrodului, se presupune că forma oxidată este în partea stângă, iar forma redusă este în partea dreaptă a ecuației.
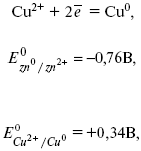
Unde E 0 – forta electromotoare(EMF) a unei celule galvanice atunci când toți reactivii sunt în starea standard.
element emf se calculează prin scăderea potenţialului anodic din potenţialul catodic.
EMF-ul elementului este +0,34 - (-0,76) \u003d 1,1 V; cu cât potenţialele electrodului diferă între ele, cu atât EMF este mai mare. Dacă un metal este scufundat într-o soluție de sare cu o concentrație mai mare, atunci potențialul este nestandard. Aceasta înseamnă că concentrația și temperatura afectează mărimea potențialului electrodului. Această dependență este exprimată V. Ecuația Nernst.
Unde P - numărul de ioni;
R este constanta universală a gazului;
T - temperatura;
CU - concentrația ionilor activi în soluție;
F- Numărul Faraday = 96500 V.
HITURI- dispozitive care sunt folosite pentru a transforma direct energia unei reacții chimice în energie electrică. Hiturile sunt folosite în diferite domenii ale tehnologiei. În mijloacele de comunicare: radio, telefon, telegraf; în echipamente electrice de măsură; servesc ca surse de energie pentru mașini, avioane, tractoare; folosit pentru a conduce demaroare etc.
Dezavantaje HIT:
1) costul substanțelor necesare muncii: Pb, Cd, este ridicat;
2) raportul dintre cantitatea de energie pe care o poate da un element și masa sa este mic.
Beneficii HIT:
1) Hiturile sunt împărțite în două grupuri principale: reversibil (baterii), ireversibil (celule galvanice). Bateriile pot fi folosite în mod repetat, deoarece performanța lor poate fi restabilită prin trecerea curentului în sens opus față de o sursă externă, iar în celulele galvanice pot fi utilizate o singură dată, deoarece unul dintre electrozi (Zn în celula Daniel-Jacobi) este consumat ireversibil;
2) se folosesc electroliti absorbiti de materiale poroase, au o rezistenta interna mai mare;
3) crearea pilelor de combustie, în timpul cărora s-ar consuma substanțe ieftine cu densitate redusă ( gaz natural, hidrogen);
4) funcționare convenabilă, fiabilitate, tensiune ridicată și stabilă.
Luați în considerare procesul de tehnologie bazat pe o baterie plumb-acid cu electrozi acoperiți.
Schemă generală: (–) substanță activă | electrolit | substanță activă (+).
Substanța activă a electrodului negativ este agent de reducere donând electroni. În timpul descărcării, electrodul negativ este un anod, adică un electrod pe care au loc procesele oxidative. Substanța activă a electrodului pozitiv este agent oxidant. Substanțele active - un agent oxidant și un agent reducător - participă la o reacție electrochimică.
Schema electrochimică a unei baterii plumb-acid
Substanțele active ale unei baterii cu plumb sunt plumbul spongios și PbO 2 . Crearea de mase active în electrozi este următoarea: pe cadrul conductiv electric al structurii se aplică o pastă sau un amestec de oxizi de Pb; în timpul formării ulterioare a plăcilor, oxizii de Pb sunt transformați în substanțe active. Formare– conversia masei neîncărcate în masă încărcată. Astfel de plăci sunt împărțite în funcție de tipul de cadru în împrăștiere și zăbrele. Majoritatea bateriilor sunt asamblate din plăci tencuite. La fabricarea lor, o pastă de oxizi de plumb este unsă în celulele grătarelor profilate de 1–7 mm grosime, turnate dintr-un aliaj Pb–Sb. După întărire, pasta este ținută pe rețea, garanția unei astfel de baterii este de 2-3 ani. La alegerea materialelor pentru colectoarele de curent ai electrozilor pozitivi ai bateriei, este important să se asigure pasivitatea lor practică (în același timp menținând conductivitatea electrică) în condiții de încărcare (până la potențiale foarte mari cu polarizare anodică). În acest scop, Pb sau aliajele sale sunt utilizate în soluții de H 2 SO 4. Carcasa și capacul HIT-ului pot fi din oțel sau dielectrici diverși, dar în cazul bateriilor plumb-acid, carcasa este din ebonită, polipropilenă și sticlă. Electrolitul dintr-o baterie plumb-acid poate participa la reacția generală de generare a curentului. Pentru prizele purtătoare de curent ale electrodului negativ, se folosesc Cu, Ti, Al.
3. Regenerarea și eliminarea HIT-urilor
Durata de viață celule galvanice se încheie (descărcare CHIT) după utilizarea totală sau parțială a materialelor active, a căror performanță după descărcare poate fi restabilită prin încărcare, adică prin trecerea curentului în direcția opusă direcției curentului în timpul descărcării: astfel de celule galvanice sunt numit acumulatoare. Electrodul negativ, care era anodul când bateria se descarca, devine catod când este încărcat. conditii cea mai bună utilizare materialele active au densități de curent scăzute, temperaturi mari pana la norma. De obicei, motivul pentru funcționarea defectuoasă a HIT-urilor este pasivarea electrozilor– o scădere bruscă a vitezei procesului electrochimic în timpul descărcării, cauzată de o modificare a stării suprafeței electrodului în timpul descărcării datorită formării de straturi de oxid sau pelicule de sare. Modul de combatere a pasivării este reducerea densităților reale de curent de descărcare prin utilizarea electrozilor cu suprafețe dezvoltate. Producerea HIT se distinge prin utilizarea diferitelor substanțe toxice (agenți oxidanți puternici, compuși Pb, Hg, Zn, Cd, Ni utilizați în stare fin dispersată; acizi, alcaline, solvenți organici). Pentru a asigura condiții normale de lucru, se preconizează automatizarea proceselor de producție, a sistemelor de ventilație raționale, inclusiv utilizarea aspirației locale de la dispozitive cu emisii toxice, echipamente de etanșare, înlocuirea metodelor uscate de prelucrare a materialelor prăfuite cu cele umede, curățarea aerului și gazelor poluate din aerosoli și tratarea apelor uzate industriale. Utilizarea masivă a HIT economie nationala asociate cu problemele de mediu. În timp ce plumbul de la baterii poate fi returnat în mare parte la fabricile de reciclare de către consumatori, eliminarea CIT primară de mici dimensiuni nu este viabilă din punct de vedere economic.
Fiecare baterie Hg-Zn asigură 5-7 zile de funcționare a aparatului auditiv.
Vehiculele electrice sunt dezvoltate folosind HIT în loc de motoare cu ardere internă, care otrăvește atmosfera orașelor cu gaze de eșapament. În ceea ce privește gradul de impact negativ asupra mediului, producția galvanică se află pe primul loc. Motivul pentru impactul extrem de negativ al producției de galvanizare este că marea majoritate a întreprinderilor în procese tehnologice aplicarea acoperirii, doar 10 - 30% din sarurile metalelor grele sunt consumate util, in timp ce restul, cu munca nesatisfacatoare, intra in mediu. Calea de ieșire este de a minimiza pierderea de săruri de metale neferoase, adică de a reduce eliminarea electroliților de către piesele din băi galvanice. Acest lucru va duce la o scădere a concentrațiilor și volumelor de apă uzată și, prin urmare, va crea conditiile necesare pentru tehnologii de aplicare cu deșeuri reduse (LWT) și fără deșeuri (LWT). acoperiri galvanizate. Mai întâi trebuie să alegeți electrolitul potrivit. Un principiu fundamental al OIM și BOT este de a reduce substanțele chimice de intrare și de a furniza mai puține otrăvuri la ieșirea procesului.
transformare energie chimicaîn energie electrică apare în sistemele electrochimice, care sunt numite celule galvanice.
O celulă galvanică este un sistem electrochimic închis format din doi electrozi.
Luați în considerare o celulă galvanică Jacobi-Daniel. Se compune dintr-o placă de cupru scufundată într-o soluție de CuSC4 și o placă de zinc scufundată într-o soluție de ZnSC4. Pentru a preveni interacțiunea directă între agentul de oxidare și agentul de reducere, electrozii sunt separați unul de celălalt printr-o partiție poroasă.
Diagrama unei celule galvanice:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
Pe suprafața plăcii de zinc apare un strat electric dublu și se stabilește echilibrul:
Ca rezultat al acestui proces, apare potențialul electrod al zincului.
Pe suprafața plăcii de cupru apare și un strat electric dublu și se stabilește echilibrul:
Сu2+ + 2е « Сu, prin urmare, apare un potențial electrod de cupru.
Potențialul electrodului de zinc are o valoare mai negativă decât potențialul electrodului de cupru, prin urmare, atunci când circuitul extern este închis, adică atunci când zincul este conectat la cupru cu un conductor metalic, electronii se vor transfera de la zinc la cupru.
Astfel, atunci când circuitul extern este închis, au loc procese spontane de dizolvare a zincului pe electrodul de zinc și precipitare a cuprului pe electrodul de cupru. Aceste procese vor continua până când potențialele electrozilor sunt egalizate sau tot zincul este dizolvat (sau tot cuprul este depus pe electrodul de cupru).
Deci, în timpul funcționării elementului Jacobi-Daniel, au loc următoarele procese:
1) reacție de oxidare a zincului: Zn - 2е ® Zn2+.
Procesele de oxidare din electrochimie se numesc procese anodice, iar electrozii pe care au loc procesele de oxidare se numesc anozi;
2) reacția de reducere a ionilor de cupru: Сu2+ + 2е « Сu.
Procesele de reducere din electrochimie se numesc procese catodice, iar electrozii pe care au loc procesele de reducere se numesc catozi;
mișcarea electronilor în circuitul extern;
mișcarea ionilor în soluție: anioni (SO4-2) către anod, cationi (Cu2+, Zn2+) către catod. Mișcarea ionilor în soluție închide circuitul electric al celulei galvanice. Însumând reacțiile electrodului, obținem:
Zn + Cu2+ = Zn2+ + Сu.
Ca rezultat al acestei reacții chimice într-o celulă galvanică, are loc mișcarea electronilor în circuitul extern și a ionilor în interiorul celulei, adică se formează un sistem electric închis și în acesta ia naștere un curent electric. Total reactie chimica, care curge într-o celulă galvanică, se numește generatoare de curent.
Curentul electric care apare într-un sistem electrochimic dat este caracterizat numeric de mărimea forței electromotoare (EMF) a elementului. Este egal cu diferența dintre potențialele electrodului catodului și anodului:
În condiții standard, o reacție chimică spontană este posibilă atunci când munca utilă maximă efectuată ca urmare a acestei reacții este egală cu valoarea negativă a modificării energiei libere:
Într-o celulă galvanică, lucrul electric maxim efectuat în condiții standard este egal cu EMF al celulei înmulțit cu cantitatea de energie electrică (nF), adică.
A = nFE0, (7,5)
unde n este numărul de electroni implicați în reacție;
F este constanta Faraday, egală cu 96500 C/mol;
E0 - forța electromotoare standard a unei celule galvanice (T= 298 K, concentrația molară a electroliților este de 1 mol/dm3). Astfel, lucrul maxim al unei celule galvanice este egal cu:
A \u003d -DG0 \u003d nFE0. (7,6)
Emf standard celula galvanică este egală cu:
Celulele galvanice, în funcție de natura electrozilor și de concentrația electroliților, sunt împărțite în chimice și concentrație.
Celulele galvanice chimice sunt astfel de celule în care electrozii și electroliții sunt diferiți. Un exemplu de celulă galvanică chimică este celula Jacobi-Daniel.
Celulele galvanice de concentrație sunt astfel de celule care constau din aceiași electrozi, dar concentrațiile de electroliți sunt diferite, de exemplu, electrozii de argint scufundați în soluții de nitrat de argint de diferite concentrații:
Ag | AgNO3 (0,01 mol/dm3) | | AgNO3 (0,1 mol/dm3) | Ag.
Exemplul 1. O celulă galvanică este formată din zinc metalic scufundat într-o soluție de azotat de zinc cu o concentrație molară de 0,1 mol/dm3 și plumb metalic scufundat într-o soluție de azotat de plumb cu o concentrație molară de 0,02 mol/dm3 diagramă element.
Decizie. Pentru a determina EMF al unui element, este necesar să se calculeze potențialele electrodului folosind ecuația Nernst (7.2):
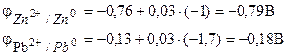
Găsim EMF al elementului conform formulei (7.3).
Când studiem această secțiune, se recomandă să se rezolve următoarele întrebări: conceptul de potențial electrod; celule galvanice (GE); forța electromotoare a unei celule galvanice (EMF) și măsurarea acesteia; electrod standard de hidrogen și scară de potențial de hidrogen; ecuația Nernst; potențialele electrozilor de metal, gaz și redox; cinetica proceselor cu electrozi; polarizare electrochimică și concentrație.
O celulă galvanică este un sistem electrochimic format din electrozi cufundați într-o soluție de electrolit și interconectați printr-un conductor metalic care formează circuitul exterior al celulei.
Funcționarea unei celule galvanice se bazează pe procese care au loc la interfața dintre un electrod metalic și un electrolit, în urma cărora se formează un strat electric dublu. Datorită stratului electric dublu, are loc un salt de potențial, numit potențial electrod. Valoarea potențialului electrod al unui metal este o caracteristică cantitativă a activității acestuia. Pentru a putea compara activitatea diferitelor metale se introduce conceptul de potenţial standard j o de electrod. Cu cât potențialul metalului este mai negativ, cu atât capacitatea de reducere a acestui metal este mai puternică. În schimb, cu cât potențialul electrodului metalic este mai pozitiv, cu atât abilitățile de oxidare ale ionilor sunt mai puternice.
Valoarea potențialului unui electrod metalic depinde de temperatură, activitatea ionilor și este calculată folosind ecuația Nernst
unde este potențialul electrodului standard măsurat în raport cu electrodul de hidrogen în condiții standard ( T= 298K; = 1 mol/l, R= 1 atm) (Tabelul 9 din anexa);
R este constanta universală a gazului;
T este temperatura absolută, K;
n este numărul de electroni implicați în proces;
F- constanta lui Faraday, egală cu 96 548 C/mol;
este activitatea ionilor metalici în soluție, mol/l.
După înlocuirea valorilor constantelor și convertirea logaritmului natural într-unul zecimal, formula Nernst ia forma:
Potențialele electrozilor de hidrogen și oxigen, care sunt electrozi de gaz, depind de pH-ul soluției și de presiunea parțială. Potențialele acestor electrozi sunt date în tabel. zece.
Exemplul 1 Calculați potențialul electrodului electrodului de hidrogen într-un mediu neutru la = 1 atm.
Decizie. Potențialul electrodului electrodului de hidrogen este determinat de ecuația Nernst, pe baza schemei procesului electrodului:
oxidat redus
formă formă
Activitatea ionilor de hidrogen într-un mediu neutru A= 10 –7 și = 0,
apoi 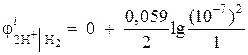 = - 0,418 V.
= - 0,418 V.
Comparați valoarea obținută cu cea tabelară (Tabelul 10 din anexa).
Exemplul 2 Electrodul de argint este scufundat într-o soluţie de azotat de argint AgNO 3 cu activitate ionică = 1·10 -2 mol/l. Calculați potențialul electrodului.
Decizie. Procesul cu electrozi:
oxidat redus
formă formă
Potențialul electrodului argintului este calculat folosind ecuația Nernst:
 \u003d 0,8 + 0,059 × lg10 -2 \u003d 0,682 V.
\u003d 0,8 + 0,059 × lg10 -2 \u003d 0,682 V.
Exemplul 3 Desenați o diagramă a unei celule galvanice formată din electrozi de fier și cupru scufundați în soluții de săruri proprii. Scrieți ecuațiile ion-electronice ale proceselor cu electrozi și calculați EMF-ul acestui HE, dacă activitățile ionilor din soluțiile corespunzătoare sunt următoarele: = 1 · 10 –2 mol/l, a = 1,0 mol/l.
Decizie. Ecuații ion-electronice ale proceselor cu electrozi:
A: Fe - 2® Fe 2+
K: Cu2+ + 2® Cu
Electrodul de fier este anod, deoarece potențialul standard al electrodului său ( = - 0,44 V) este mai mic decât potențialul standard al electrodului de cupru ( = + 0,34 V) (Tabelul 9 din Anexă).
Schema celulei galvanice dată în condiție are forma:
(–) Fe | Fe 2+ || Cu 2+ | Cu (+)
Determinați EMF-ul elementului:
Potențialul electrodului anodului este determinat de ecuația Nernst, iar potențialul catodului este o valoare standard:
EMF \u003d 0,34 - (- 0,499) \u003d 0,839 V.
Exemplul 4 Circuitul celulei galvanice are forma:
(–) Zn |ZnCl 2 || ZnCI2 |Zn (+). Calculați EMF-ul acestui element dacă activitatea ionilor de zinc este de 0,001 mol/l într-o semicelulă și de 0,01 mol/l în cealaltă. Scrieți ecuațiile pentru procesele anodice și catodice.
Decizie. În starea problemei, este dată o celulă galvanică de concentrare. Într-un astfel de element, zincul va fi catodul, coborât într-o soluție de sare cu o activitate mai mare a ionilor de Zn 2+ = 0,01 mol/l.
Ecuația proceselor cu electrozi:
A: Zn-2® Zn2+
K: Zn2+ + 2® Zn
Determinați EMF-ul elementului:
Găsim potențialele electrodului folosind ecuația Nernst:
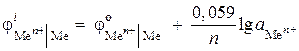 ,
,
EMF \u003d - 0,819 - (- 0,848) \u003d 0,029 V.
Exemplul 5 Pentru o celulă galvanică:
(–) Mn | Mn 2+ || 2H + | H2, Ni (+)
scrieți ecuațiile proceselor electrozilor și calculați EMF reală, ținând cont de supratensiunea de degajare a hidrogenului, dacă activitatea ionilor de mangan este de 1 10–2 mol/l, iar ionii de hidrogen este de 1,0 mol/l (la = 1 atm) .
Decizie. Ecuațiile procesului electrodului:
A: Mn-2® Mn2+
K: 2H + + 2 ® H 2 (în mediu acid, procesul de depolarizare a hidrogenului are loc la catod)
În timpul funcționării celulei galvanice, EMF și curentul scad. Acest lucru se datorează modificărilor potențialelor electrodului anodului și catodului. O modificare a potențialelor electrodului, care duce la o scădere a EMF și a intensității curentului, se numește polarizare.
Există trei tipuri de polarizare: gaz, concentrație și electrochimică. Diferența dintre potențialul de echilibru al electrodului și potențialul acestuia în aceeași soluție în timpul trecerii curent electric, se numește supratensiune (Tabelul 11 din Anexă).
În condițiile acestei probleme, supratensiunea degajării hidrogenului la catod = 0,30 V (Tabelul 11 din Anexă), iar potențialul electrodului electrodului de hidrogen într-un mediu acid la o presiune a hidrogenului de 1 atm este considerat egal cu zero. : = 0. Potențialul catodic, ținând cont de supratensiune, se determină:
Potențialul electrodului anodului este determinat de formula. Deoarece supratensiunea metalului pe metal este considerată condiționat egală cu zero, atunci .
EMF \u003d - 0,30 - (-1,239) \u003d 0,939 V.
Exemplul 6 Calculați valoarea potențială a electrodului redox Pt | Sn4+, Sn2+. Reacția de reducere Sn 4+ + 2 ® Sn 2+ se desfășoară în soluție cu activități ionice = 0,1 mol/l, = 0,001 mol/l. ![]() .
.
Decizie. Potențialul electrodului redox este determinat de ecuația:
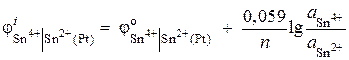 .
.
Exemplul 7 Un electrod de fier într-o soluție de sare are un potențial de electrod ![]() . Calculați activitatea ionilor în soluție, mol/l.
. Calculați activitatea ionilor în soluție, mol/l.
Decizie. Determinăm activitatea ionilor de fier folosind ecuația Nernst:
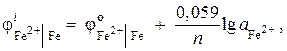
deoarece \u003d - 0,44 V (Tabelul 9 al aplicației) și n= 2, atunci
![]() ;
;
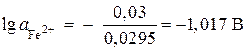 ,
, ![]() mol/l.
mol/l.
Exemplul 8. Calculați emf standard al celulei galvanice în care sa stabilit echilibrul:
Zn + 2Ag + « Zn 2+ + 2Ag,
dacă ![]() = - 146,5 kJ/mol, a = 77,2 kJ/mol.
= - 146,5 kJ/mol, a = 77,2 kJ/mol.
Decizie. EMF standard al unei celule galvanice este determinat de ecuația:
–  ,
,
Unde nF- cantitatea de energie electrică care poate fi obţinută teoretic prin transformarea electrochimică a unui mol dintr-o substanţă;
F este constanta Faraday ( F\u003d 96,548 kJ / V mol), sau F» 96 500 C/mol,
n este numărul de electroni implicați în procesul pentru GE-ul nostru n = 2;
– energia Gibbs standard a acestei reacții este egală cu:
Deoarece energiile Gibbs standard de formare a substanțelor simple de zinc și argint sunt egale cu zero, înlocuind valorile numerice ale cantităților, găsim:
= - 146,5 - 2 77,2 = - 300,9 kJ.
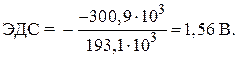
SARCINI DE CONTROL
201. Realizați o diagramă, scrieți ecuațiile ion-electronice ale proceselor cu electrozi și calculați EMF-ul unei celule galvanice zinc-magneziu, în care activitatea ionilor de zinc = 1 10 -1 mol / l, iar ionilor de magneziu = 1,0 mol / l.
Răspuns: 1.571 V.
202. Pentru o celulă galvanică (-) Cr | Cr 3+ || 2H + | H2, Fe (+)
scrieți ecuațiile proceselor electrozilor și calculați EMF reală, ținând cont de supratensiunea degajării hidrogenului, dacă activitatea ionilor de crom = 1 10 -2 mol/l, iar ionilor de hidrogen = 1,0 mol/l (la = 1 atm) .
Răspuns: 0,419 V.
203. Plăcile de aluminiu și cupru sunt legate printr-un conductor extern și coborâte într-o soluție de acid sulfuric. Realizați o diagramă a unei celule galvanice și scrieți ecuațiile ion-electronice ale proceselor electrodului care au loc la anod și la catod.
204. Calculați potențialul de electrod al unui electrod de hidrogen într-un mediu acid la at = 2 atm și [H + ] = 1 mol/l.
Răspuns: - 9 × 10 -3 V.
205. Realizați o diagramă, scrieți ecuațiile ion-electronice ale proceselor cu electrozi și calculați EMF-ul unei celule galvanice fier-mercur, în care activitatea ionilor de fier = 1 10 -3 mol / l, iar ionilor de mercur = 1 10 - 2 mol/l.
Răspuns: 1.319 V.
206. Realizați o diagramă a unei celule galvanice, care se bazează pe o reacție chimică care se desfășoară conform ecuației:
Mg + 2AgN03® Mg (N03)2 + 2Ag.
Scrieți o ecuație ion-electronică pentru procesele cu electrozi și calculați EMF-ul acestui element dacă activitatea ionilor de magneziu = 0,01 mol/l și a ionilor de argint = 0,001 mol/l.
Răspuns: 3.043 V.
207. Realizați o diagramă a unei celule galvanice, care se bazează pe o reacție chimică care se desfășoară conform ecuației:
Zn + Pb(NO3)2® Zn(NO3)2 + Pb.
Scrieți o ecuație ion-electronică pentru procesele cu electrozi și calculați EMF-ul acestui element dacă activitatea ionilor de zinc = 0,001 mol/l și ionilor de plumb = 0,01 mol/l.
Răspuns: 0,659 V.
208. Calculați valoarea potențială a electrodului redox Pt | Fe 3+, Fe 2+ dacă = + 0,77 V, iar activitățile ionilor de fier în soluție sunt, respectiv, = 0,001 mol/l și = 0,1 mol/l.
Răspuns: 0,652 V.
209. electrod de aluminiuîn soluție de sare are un potențial de electrod ![]() . Calculați activitatea ionilor de Al 3+, mol/l.
. Calculați activitatea ionilor de Al 3+, mol/l.
Raspuns: 0,095 mol/l.
210. Ce element galvanic se numește concentrație? Realizați o diagramă, scrieți ecuațiile ion-electronice ale proceselor cu electrozi și calculați EMF-ul unei celule galvanice formată din doi electrozi de cupru scufundați în soluții de sulfat de cupru CuSO 4 cu activitatea ionilor de cupru în prima soluție = 0,01 mol/l și c = 0,001 mol/l în secunda.
Răspuns: 0,029 V.
211. Faceți o diagramă a două celule galvanice, în una dintre care zincul ar fi catodul, iar în cealaltă - anodul. Scrieți pentru fiecare dintre aceste elemente ecuațiile ion-electronice ale reacțiilor care au loc la catod și anod.
212. La ce activitate a ionilor Mn 2+ (mol/l) va fi potențialul electrodului de mangan cu 0,018 V mai mic decât potențialul standard al electrodului?
Răspuns: 0,25 mol/l.
213. Potențialul unui electrod de cupru într-o soluție de clorură de cupru CuCl 2 a fost de 97% din valoarea potențialului său standard de electrod. Care este activitatea ionilor, (mol/l)?
Raspuns: 0,46 mol/l.
214. Pentru o celulă galvanică
(–) Mg | Mg2+ || 2H + | H2, Cu (+)
scrieți ecuațiile proceselor electrozilor și calculați EMF real, ținând cont de supratensiunea de degajare a hidrogenului, dacă activitatea ionilor de magneziu = 1 10 -3 mol/l, iar ionilor de hidrogen = 1,0 mol/l (la = 1 atm) .
Răspuns: 1.968 V.
215. Calculați EMF al unei celule galvanice în care echilibrul a fost stabilit la 298 K: Mg + Cd 2+ « Mg 2+ + Cd, dacă activitatea ionilor de magneziu este de 0,01 mol/l, iar ionilor de cadmiu = 10 -2 mol/l. Scrieți ecuațiile proceselor cu electrozi.
Răspuns: 0,709 V.
219. Calculați EMF al unei celule galvanice în care echilibrul a fost stabilit la 298 K: 2Na + H 2 O (g) + 1 / 2O 2 "2NaOH (k),
dacă = - 228,76 kJ/mol și ![]() = - 380,46 kJ/mol.
= - 380,46 kJ/mol.
Răspuns: 2,76 V.
220. Calculați valoarea potențială a electrodului redox Pt | Co 3+ , Co 2+ cu activități ale ionilor de cobalt = 1 mol/l și = 0,001 mol/l, dacă ![]() .
.
3.5.1 Potențiale electrice la limitele de fază
Când un conductor de primul fel (electrod) vine în contact cu un solvent polar (apă) sau cu o soluție de electrolit la interfața electrod-lichid, așa-numitul dublu strat electric (DES). Ca exemplu, luați în considerare un electrod de cupru scufundat în apă sau într-o soluție de sulfat de cupru.
Când un electrod de cupru este scufundat în apă, o parte din ionii de cupru situati la nodurile rețelei cristaline, ca urmare a interacțiunii cu dipolii de apă, vor intra în soluție. Sarcina negativă care apare în același timp pe electrod va menține ionii care au trecut în soluție în spațiul apropiat de electrod - se formează un strat electric dublu (Fig. 3.12a; pentru modele ale structurii DEL, vezi Secțiunea 4.2). .4). Sarcina negativă de pe electrod va împiedica tranziția ulterioară a ionilor de cupru în soluție, iar după un timp se va stabili un echilibru dinamic, care poate fi caracterizat fără ambiguitate prin potențialul câmpului electric DEL Φ, în funcție de sarcina de pe electrod. electrod, sau printr-o concentrație de echilibru a ionilor în stratul apropiat de electrod C o . Când un electrod de cupru este scufundat într-o soluție de CuSO4 care conține ioni de cupru la o concentrație de C, sunt posibile trei cazuri:
Orez. 3.12 Schema unui dublu strat electric la interfața electrod-soluție
1. C< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в Strat de suprafață o soluție de cationi va fi mai mult decât anioni (Fig. 3.9a).
2. C > C o . Deoarece concentrația ionilor de cupru în stratul de suprafață este mai mare decât cea de echilibru, va începe trecerea ionilor de la soluție la electrod; pe electrod ia naştere o sarcină pozitivă şi anionii SO 4 2- predomină în stratul de suprafaţă (Fig. 3.12b).
3. C \u003d C o. Deoarece concentrația ionilor de cupru din stratul de suprafață este egală cu cea de echilibru (astfel de soluții se numesc zero), nu apare nicio sarcină pe electrod și nu se formează un strat electric dublu.
3.5.2 Celulă galvanică. EMF a unei celule galvanice
Luați în considerare cea mai simplă celulă galvanică Daniel-Jacobi, constând din două semicelule - plăci de zinc și cupru, plasate în soluții de sulfați de zinc și, respectiv, de cupru, care sunt interconectate prin intermediul unei chei electrolitice - de exemplu, o bandă de hârtie umezită. cu o soluție de electrolit. Schematic, acest element este reprezentat după cum urmează:
Zn / Zn2+ // Cu2+ / Cu
Pe suprafața fiecăruia dintre electrozi există un echilibru dinamic al tranziției ionilor metalici de la electrod la soluție și invers, caracterizat prin potențialul EDL (sarcina electrodului q). Dacă conectați electrozi de cupru și zinc cu un conductor metalic, va avea loc imediat o redistribuire a sarcinilor - electronii vor începe să se miște de la un electrod cu o sarcină mai negativă (în cazul nostru, zinc) la un electrod cu o sarcină mai pozitivă (cuprul). ), adică în conductor va curge un curent electric. O modificare a valorii de încărcare a fiecărui electrozi deranjează echilibrul - pe electrodul de zinc va începe procesul de tranziție a ionilor de la electrod la soluție (oxidarea metalului), pe electrodul de cupru - de la soluție la electrod (reducere de metal); în acest caz, cursul procesului pe un electrod determină apariția simultană a procesului opus pe celălalt:
Zn o ––> Zn 2+ + 2е -
Cu 2+ + 2e - ––> Cu o
Se numește electrodul pe care are loc procesul de oxidare în timpul funcționării unei celule galvanice anod, electrodul pe care are loc procesul de recuperare - catod. Într-o reprezentare schematică a celulelor galvanice, anodul este scris în stânga, catodul este scris în dreapta (electrodul standard de hidrogen este întotdeauna scris în stânga). Procesul redox total care are loc într-o celulă galvanică este exprimat prin următoarea ecuație:
Cu 2+ + Zn o ––> Cu o + Zn 2+
Astfel, o celulă galvanică poate fi definită ca un dispozitiv pentru transformarea energiei chimice a unei reacții redox în energie electrică datorită separării spațiale a proceselor de oxidare și reducere. Munca pe care o poate face un curent electric generat de o celulă galvanică este determinată de diferența de potențiale electrice dintre electrozi (denumită de obicei pur și simplu diferența de potențial) ΔΦ și cantitatea de electricitate trecută prin circuitul q:
Lucrarea curentului unei celule galvanice (și, în consecință, diferența de potențial) va fi maximă în timpul funcționării sale reversibile, când procesele de pe electrozi decurg infinit lent și puterea curentului în circuit este infinit de mică. Diferența maximă de potențial care apare în timpul funcționării reversibile a unei celule galvanice este forța electromotoare (EMF) a celulei galvanice. .
3.5.3 Potențialul electrodului. Ecuația Nernst
EMF a unei celule galvanice E este convenabil reprezentată ca o diferență a unor cantități care caracterizează fiecare dintre electrozi - potențialele electrodului; cu toate acestea, pentru a determina cu precizie aceste valori, este necesar un punct de referință - un potențial de electrod cunoscut cu precizie al oricărui electrod. Potențialul electrodului ε e se numește EMF al unui element compus dintr-un electrod dat și un electrod standard de hidrogen (vezi mai jos), al cărui potențial electrod se presupune a fi zero. În acest caz, semnul potențialului electrodului este considerat pozitiv dacă electrodul testat într-o astfel de celulă galvanică este catodul și negativ dacă electrodul testat este anodul. Trebuie remarcat că uneori potențialul electrodului este definit ca „diferența de potențial la interfața electrod-soluție”, adică. consideră-l identic cu potențialul DEL, care nu este în întregime corect (deși aceste cantități sunt interdependente).
Valoarea potențialului electrodului unui electrod metalic depinde de temperatura și activitatea (concentrația) ionului metalic din soluția în care este scufundat electrodul; matematic se exprimă această dependenţă Ecuația Nernst (aici F este constanta Faraday, z este sarcina ionică):
În ecuația Nernst ε ° – potenţial standard al electrodului , egal cu potenţialul electrodului la activitatea ionului metalic, egal cu 1 mol/l. Potențialele electrozilor standard ale electrozilor în soluții apoase sunt o serie de tensiuni. Valoarea lui ε ° este o măsură a capacității formei oxidate a unui element sau ion de a accepta electroni, i.e. restabili. Uneori, diferența dintre concentrația și activitatea unui ion într-o soluție este neglijată, iar concentrația ionilor din soluție apare sub semnul logaritmului în ecuația Nernst. Mărimea potențialului electrodului determină direcția procesului care are loc pe electrod în timpul funcționării celulei galvanice. Pe o semicelulă, al cărei potențial electrod are o valoare mai mare (uneori se spune - mai pozitivă), procesul de recuperare va continua, adică. acest electrod va fi catodul.
Luați în considerare calculul EMF al elementului Daniel - Jacobi folosind ecuația Nernst. EMF este întotdeauna o valoare pozitivă și este egală cu diferența dintre potențialele electrodului catodului și anodului:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
După cum se poate observa din ecuația (III.45), EMF-ul elementului Daniel - Jacobi depinde de concentrația (mai precis, activitatea) ionilor de cupru și zinc; la concentrațiile lor egale, EMF-ul elementului va fi egal cu diferența de potențiale standard ale electrodului:
![]() (III.46)
(III.46)
Analizând ecuația (III.45), se poate determina limita de lucru ireversibilă a unei celule galvanice. Deoarece zincul este oxidat la anod, concentrația ionilor de zinc crește constant în timpul funcționării ireversibile a celulei galvanice; concentrația ionilor de cupru, dimpotrivă, scade. Raportul dintre concentrațiile ionilor de cupru și zinc este în scădere constantă, iar logaritmul acestui raport la [Сu 2+ ]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Ecuația (III.45) explică și performanța așa-numitului. lanțuri de concentrare – celule galvanice formate din doi electrozi metalici identici scufundati in solutii sarate ale acestui metal cu activitati diferite a 1 > a 2 . În acest caz, catodul va fi un electrod cu o concentrație mai mare, deoarece potențialele electrozilor standard ale ambilor electrozi sunt egale; pentru EMF al unei celule galvanice de concentrație, obținem:
![]() (III.47)
(III.47)
Singurul rezultat al muncii elementului de concentrare este transferul ionilor metalici dintr-o soluție mai concentrată într-una mai puțin concentrată. Astfel, lucrul curentului electric într-o celulă galvanică de concentrare este opera unui proces de difuzie, care se desfășoară reversibil ca urmare a separării sale spațiale în două procese reversibile de electrozi opuse în direcție.
Copyright © S. I. Levchenkov, 1996 - 2005.