Conceptul emf standard al unei celule galvanice. Fundamentele electrochimiei
Când un curent electric trece prin electrolit, curentul electric circulă pe suprafața electrozilor. reacții chimice. Fluxul reacțiilor electrochimice poate fi generat de o sursă externă de curent. Este posibil și fenomenul invers: reacțiile electrochimice care au loc pe doi electrozi scufundați într-un electrolit generează un curent electric, iar reacțiile au loc numai când circuitul este închis (cu trecerea curentului).
Element electrochimic (sau galvanic). numit dispozitiv de generare a curentului electric datorită reacțiilor electrochimice. Cea mai simplă celulă electrochimică este formată din doi electrozi metalici (conductori de primul fel) cufundați într-un electrolit (conductor de al doilea fel) și interconectați printr-un contact metalic. Mai multe celule electrochimice conectate în serie circuit electrochimic .
Cea mai importantă caracteristică cantitativă a unui element electrochimic este forța electromotoare(EMF, E), care este egal cu diferența de potențial element deschis corect (una în care la electrozii de capăt ai elementului sunt atașați conductori de primul fel din același material).
Dacă, atunci când un curent electric trece în direcții diferite, aceeași reacție are loc pe suprafața electrodului, dar în direcții opuse, atunci astfel de electrozi, precum și elementul sau circuitul alcătuit din ei, se numesc reversibil . EMF-ul elementelor reversibile este proprietatea lor termodinamică, adică. depinde doar de T, P, natura substanțelor care alcătuiesc electrozii și soluțiile și concentrația acestor soluții. Un exemplu de element reversibil - element Daniel-Jacobi :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
în care fiecare electrod este reversibil. În timpul funcționării elementului au loc următoarele reacții: Zn ® Zn 2+ + 2 e, Cu 2+ + 2 e® Cu. Când un curent infinit mic este transmis de la o sursă externă, pe electrozi au loc reacții inverse.
Un exemplu de element ireversibil - Element Volta :
(-) Zn ç H 2 SO 4 çCu (+)
În timpul funcționării elementului, au loc reacții: Zn ® Zn 2+ + 2 e, 2H++ 2 e® H2. Când curentul este transmis de la o sursă externă, reacțiile electrodului vor fi: 2H + + 2 e® H2, Cu® Cu 2+ + 2 e .
EMF-ul unui element electrochimic este o valoare pozitivă, deoarece corespunde unui anumit proces spontan care produce muncă pozitivă. Procesul invers, care nu poate proceda independent, ar primi răspunsul printr-un emf negativ. La alcătuirea unui lanț de elemente electrochimice, procesul dintr-unul dintre elemente poate fi direcționat astfel încât să fie însoțit de cheltuirea muncii din exterior (proces nespontan), folosind pentru aceasta lucrul unui alt element al circuitului din care are loc un proces spontan. EMF total al oricărui circuit este egal cu suma algebrică a valorilor pozitive și negative. Prin urmare, este foarte important atunci când scrieți o diagramă de circuit să țineți cont de semnele EMF, folosind regulile acceptate.
EMF a unui circuit electrochimic este considerat pozitiv dacă, atunci când este scris circuitul, electrodul din dreapta este încărcat pozitiv față de cel din stânga (în timpul funcționării circuitului, cationii trec în soluție de la electrodul scris în stânga către electrodul scris în dreapta, iar electronii se deplasează în același direcție în circuitul extern). Exemplu.
TERMODINAMICA CELULEI GALVANICE.
Lasă următoarea reacție să se desfășoare reversibil și izotermic într-un sistem electrochimic:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Energia electrică generată de element este egală cu munca utilă A¢ a procesului total. Lucrul util A¢ al procesului reversibil este maxim si la P, T = const este egal cu scaderea potentialului izobar al sistemului:
DG P,T = nFE P,T
E P , T - EMF reversibil al sistemului.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Astfel, după ce am măsurat element emfși coeficientul său de temperatură, se pot găsi valorile DG și DS pentru întregul proces care are loc în celula galvanică. Acest proces este spontan, deci DG< 0.
Folosind ecuația Gibbs-Helmholtz, puteți calcula modificarea entalpiei procesului:
DH=DG-T=-nFE P+TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Din ecuații rezultă că raportul dintre energia electrică generată sau absorbită reversibil într-un sistem electrochimic și efectul termic al reacției care are loc în acesta depinde de semnul și mărimea coeficientului de temperatură al EMF. dE/dT :
1. În cazul în care undE/dT > 0 , apoi nFE > (DG > DH) și sistemul va transforma în energie electrică nu numai cantitatea de căldură care corespunde efectului termic al reacției, ci și căldură suplimentară - căldura lui Peletier Q P \u003d nFT dE/dTîmprumutat din mediu. În condiții adiabatice (în condiții de izolare termică, când schimbul cu mediul este imposibil), T-ul sistemului scade. Răcirea sistemului este vizibilă mai ales dacă, la dE/dT > 0 < 0 (реакция эндотермична).
2. În cazul în care undE/dT < 0 , apoi nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. În cazul în care undE/dT = 0 , atunci DG = DH și nFE = - energia electrică produsă reversibil de sistem este echivalentă cu efectul termic al unei reacții chimice. Acest raport este cunoscut ca principiul (regula) lui Thomson .
Pentru calcul Ecuații EMF poate fi rescris ca:
Când folosiți ecuații, amintiți-vă că acestea valabil numai pentru sisteme electrochimice reversibile prin urmare, atunci când se studiază dependența EMF de T, este necesar să se evite utilizarea sistemelor electrochimice cu limite lichide, deoarece potențialele de difuziune care apar pe ele nu sunt echilibrate.
Să conectăm EMF-ul elementului cu constanta de echilibru a reacției care are loc în element. Ecuația izotermei reacției chimice:
DG=RT ln K A-RT
E=-= ln K A-
Primul termen din partea dreaptă a ecuației pentru P dat, T este o valoare constantă, poate fi notat cu E o. E o - fem standard a unui element (sistem electrochimic) , adică EMF deloc un i= 0.
E \u003d E o + ln= Eo + 2,303 lg
Astfel, EMF al unui sistem electrochimic este o funcție a activităților participanților la reacția electrochimică. Ecuațiile de mai sus fac posibilă calcularea cantităților DG și K A pe valori experimentale E și, invers, calculați E, cunoscând caracteristicile termodinamice ale reacției chimice.
MĂSURARE EMF.
Pentru a măsura valoarea de echilibru (reversibilă) a EMF a unui element electrochimic, este necesar ca procesul să decurgă infinit lent, adică. astfel încât elementul funcționează la o putere de curent infinit de mică. Această condiție este îndeplinită în metoda de compensare, care se bazează pe faptul că elementul este conectat în serie față de diferența de potențial externă, iar aceasta din urmă este aleasă astfel încât să nu existe curent în circuit. Atunci diferența de potențial extern este egală cu EMF al circuitului.
Folosind metoda de compensare, puteți măsura direct valoarea EMF, dar aceasta este o operație destul de complicată, prin urmare, în practica de laborator, ei preferă să compare EMF-ul elementului studiat cu EMF-ul așa-numitului standard ( normal), care se măsoară cu atenție la diferite T. Această metodă comparativă este și compensatorie.
Elementul normal de bază este element Weston saturat .
(Schema de măsurare a EMF - independent).
STRUCTURA DEFINIȚII ELECTROD-SOLUȚIE. DUBLU STRAT ELECTRIC.
Când un conductor de primul fel intră în contact cu un electrolit, a dublu strat electric . Ca exemplu, luați în considerare un electrod de cupru scufundat într-o soluție de CuSO4. Potențialul chimic al ionilor de cupru din metal la un T dat poate fi considerat constant, în timp ce potențialul chimic al ionilor de cupru în soluție depinde de concentrația de sare; în general, aceste potențiale chimice nu sunt aceleași.
Fie concentrația de CuSO 4 astfel încât > . Apoi, când metalul este scufundat în soluție, unii dintre ionii de Cu 2+ din soluție se deshidratează și se transferă în metal, creând o sarcină pozitivă asupra acestuia. Această sarcină va împiedica tranziția ulterioară a ionilor de Cu 2+ din soluție la metal și va duce la formarea în apropierea electrodului a unui strat de anioni SO 4 2- atrași de acesta. Asa numitul echilibru electrochimic , la care potențialele chimice ale ionilor din metal și din soluție vor diferi prin valoarea diferenței de potențial a stratului dublu electric rezultat (DEL):
Diferența de potențiale electrice și diferența de potențiale chimice sunt compensate la echilibrul electrochimic.
Fie ca concentrația de CuSO 4 să fie atât de scăzută încât< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Puteți alege o astfel de concentrație de electrolit la care potențialele chimice ale ionilor din metal și soluție sunt aceleași. Soluțiile acestei concentrații se numesc soluții zero . Când un metal este scufundat în soluția sa zero, DES nu apare pe suprafața electrodului, totuși, în acest caz, diferența de potențial dintre metal și soluție nu este egală cu zero.
Potrivit lui Nernst, singura sursă de EMF într-o celulă electrochimică este DES de pe suprafața electrozilor. Potențialul metalelor într-o soluție zero a fost definit de Nernst ca zero absolut al potențialelor. În lucrările lui A.N. Frumkin s-a arătat că ideile lui Nernst sunt incorecte. S-a stabilit experimental că EMF al unui element compus din doi electrozi diferiți scufundați în soluțiile lor zero este foarte semnificativ diferit de zero (poate mai mult de 1 V). Potențialul unui metal în soluție zero, numit potențial de încărcare zero , nu poate fi privit ca potențial zero absolut.
TEORIA HELMHOLTZ CONDENSĂ DUBLUL STRATULUI. Prima teorie cantitativă a structurii DEL la interfața metal-soluție a fost creată de Helmholtz (1853). Potrivit lui Helmholtz, DES poate fi asemănat cu un condensator plat, una dintre plăcile căruia coincide cu planul care trece prin sarcinile de suprafață din metal, cealaltă cu planul care leagă centrele de sarcină ale ionilor în soluție atrași de suprafața metalului. prin forţe electrostatice. Grosimea stratului dublu l egală cu raza ionului r. În funcție de starea de neutralitate electrică, numărul de ioni atrași de suprafața metalului ar trebui să fie astfel încât sarcinile lor să compenseze sarcinile de suprafață ale metalului, de exemplu.
Teoria unui strat dublu condensat face posibilă obținerea unor valori de capacitate DEL în concordanță cu experiența și o grosime DEL plauzibilă din punct de vedere fizic. Cu toate acestea, nu poate interpreta multe modele experimentale: valorile găsite experimental ale potențialului electrocinetic (potențialul x) și dependența lor de concentrația de electrolit, modificarea semnului sarcinii suprafeței metalului în prezența agenților tensioactivi.
TEORIA DUBLULUI STRAT DIFUSIV AL GOOEY-CHAPMAN. Teoria Helmholtz nu ține cont de faptul că proprietățile DEL se modifică odată cu concentrația electrolitului, iar T. Gouy (1910) și Chapman (1913) au încercat să coreleze densitatea de sarcină din DEL cu compoziția soluției. Ei au ținut cont de faptul că, pe lângă forțele electrostatice care apar între metal și ioni, ionii sunt afectați și de forțele mișcării moleculare termice. Când se aplică aceste două forțe, ionii din soluție ar trebui să fie distribuiți difuz în raport cu suprafața metalului - cu densitatea de sarcină în volum scăzând odată cu distanța de la aceasta.
Gouy și Chapman credeau că ionii pot fi considerați puncte materiale care nu au propriul volum, dar au o sarcină și că distribuția lor în câmpul de încărcare a electrodului se supune distribuției Boltzmann.
Teoria Gouy-Chapman este mai bună decât teoria Helmholtz în acord cu legile fenomenelor electrocinetice. Dacă presupunem că pornind de la o anumită distanţă l 1, ionii nu mai sunt legați ferm de suprafața electrodului în timpul mișcării relative a fazelor solide și lichide, atunci potențialul corespunzător acestei distanțe poate fi considerat potențialul x (x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Astfel, teoria Gouy-Chapman este cel mai bine justificată acolo unde teoria Helmholtz este inaplicabilă și, invers, cea din urmă oferă cea mai bună convergență cu experiența în cazurile în care prima dă rezultate incorecte. În consecință, structura DES ar trebui să corespundă unei combinații de modele propuse de Helmholtz și Gouy-Chapman. O astfel de presupunere a fost făcută de Stern (1924) în teoria sa de adsorbție DEL.
TEORIA ȘTERNĂ A ADsorbției. Stern credea că o anumită parte a ionilor este reținută în apropierea interfeței metal-electrolit, formând o placă Helmholtz sau condensată dintr-un strat dublu cu o grosime corespunzătoare razei medii a ionilor electrolit. Ionii rămași incluși în DEL sunt distribuiți difuz cu o densitate de sarcină care scade treptat. Pentru partea difuză a DEL, Stern, ca și Gouy, a neglijat dimensiunile intrinseci ale ionilor. În plus, Stern a sugerat că ionii sunt reținuți în partea densă a DEL datorită nu numai forțelor electrostatice, ci și forțelor specifice de adsorbție, de exemplu. forțe de origine non-coulombiană. Prin urmare, în soluțiile care conțin ioni activi la suprafață, numărul lor în partea densă a EDL poate depăși sarcina suprafeței metalice cu o anumită valoare, în funcție de proprietățile ionilor și de sarcina metalului. Astfel, potrivit lui Stern, ar trebui să se distingă două modele DES, dintre care unul se referă la soluții de electroliți inactivi la suprafață, celălalt la soluții care conțin ioni adsorbiți în mod specific.
Teoria adsorbției păstrează, de asemenea, egalitatea:
Q M = q L = q 1 + q 2
Densitatea de sarcină pe partea soluției q L constă din două părți: densitatea de sarcină în stratul Helmholtz q 1 și densitatea de sarcină în stratul difuz q 2 .
Teoria Stern face posibilă definirea potențialului x ca scăderea potențialului în partea difuză a DEL, unde legătura puternică dintre metal și ioni a fost deja pierdută. Cu această definiție, potențialul x nu ar trebui să coincidă cu potențialul Nerst, așa cum se observă experimental. Teoria lui Stern a putut explica, de asemenea, reîncărcarea suprafeței unui corp solid.
La o concentrație infinitezimală, toate sarcinile din soluție sunt distribuite difuz, iar structura DEL este descrisă de teoria Gouy-Chapman. Dimpotrivă, în soluțiile concentrate structura DEL se apropie de modelul propus de Helmholtz. În intervalul de concentrații medii, unde x este comparabil ca valoare cu RT/F, dependența sa de concentrație poate fi exprimată prin ecuații aproximative:
pentru valori pozitive x: x = B - ln cu
pentru valori negative x: x = B¢ + ln cu
Teoria lui Stern oferă o imagine corectă calitativ a DES. Determinarea capacității folosind modelul Stern este în concordanță cu experiența atât în ceea ce privește valorile capacității, cât și în natura dependenței sale de potențialul electrodului și concentrația soluției. Dar teoria lui Stern nu este lipsită de neajunsuri. Printre acestea se numără și imposibilitatea unei descrieri cantitative a curbelor de capacitate, mai ales atunci când se îndepărtează de potențialul de sarcină zero.
DEZVOLTAREA ULTERIORĂ A TEORIEI DES STATION. Au fost făcute multe încercări de a dezvolta o teorie DEL care este în concordanță cantitativ cu datele experimentale (Rice, Frumkin și colab., Bockris, Devanathan, Esin, Muller, Parsons, Ershler și alții). Modelul lui Graham (1947) a primit cea mai mare recunoaștere. Potrivit lui Graham, căptușeala DEL, care este în soluție, nu constă din două, ci din trei părți. Primul, numărând de la suprafața metalului, se numește planul Helmholtz intern; conţine numai ioni tensioactivi (sarcina planului este q 1) sau, dacă nu sunt în soluţie, molecule de solvent (q 1 = 0); potențialul său, raportat la soluție, este notat cu y 1 . Următorul, îndepărtat de suprafața metalică la o distanță de care ionii (centrii sarcinii lor) se pot apropia, se numește planul Helmholtz exterior; sarcina sa totală este egală cu q 2 , iar potențialul planului y 2 . În spatele planului exterior Helmholtz există un strat difuz cu un potențial variind de la y 2 la zero și cu o densitate de sarcină care coincide cu q 2 .
Modelul lui Graham reflectă principalele caracteristici și caracteristici structurale ale electrolitului metalic DEL. Permite să se calculeze curbele de capacitate diferențială pentru orice concentrație a unui electrolit dat, dacă există o curbă experimentală pentru cel puțin una dintre soluțiile sale. Cu toate acestea, acest model nu acoperă toate aspectele problemei.
Lucrul electric este egal cu produsul dintre tensiune (diferența de potențial) și cantitatea de electricitate transmisă. În condiții izobaric-izoterme (la temperatură și presiune constante), lucrul electric maxim celulă galvanică se poate obţine la diferenţa maximă de potenţial a electrozilor. Diferența maximă de potențial ΔE, egală cu diferența dintre potențialele electrodului de echilibru ale catodului (E la ) și anod (E A ) elementul se numește EMF al celulei galvanice
ΔE = E la - E A
Dacă electrozii sunt în condiții standard, atunci
ΔE 0 = E la 0 - E A 0 ,
UndeΔЕ 0 – fem standard al elementului, A E la 0 și E a 0 – potențialele standard ale electrodului catod și, respectiv, anod.
Dacă un mol dintr-o substanță suferă o transformare la electrod, atunci, conform legii lui Faraday, o cantitate de electricitate curge prin sistem egală cu nF, unde neste numărul de moli de echivalenți dintr-un mol de substanță. Astfel, lucrul electric maxim al unei celule galvanice în timpul transformării unui mol dintr-o substanță este:
A max.electrice = nF  ΔE (1)
ΔE (1)
În același timp, muncă utilă maximăDAR max. OVR , pe care sistemul o poate realiza atunci când reacția se desfășoară la temperatură și presiune constante, este egală cu energia Gibbs a reacției:
A max. OVR \u003d - ΔG P (2)
Deoarece A max. OVR = A max. , apoi:
ΔE= - ΔG P / nF. (3)
În condiții standard
ΔE 0 = - ΔGР 0 /nF , (4)
Unde ΔE 0 și Δ G o - EMF standard și energia Gibbs a reacției.
Prin urmare, cu valori cunoscute ale energiei Gibbs a reacției, este posibil să se calculeze EMF-ul elementului și invers. Ecuația (4.3) arată relația dintre energia chimică și cea electrică. Energia Gibbs a reacției depinde de activități . De exemplu, pentru o reacție:
aA (d) + bB (d) 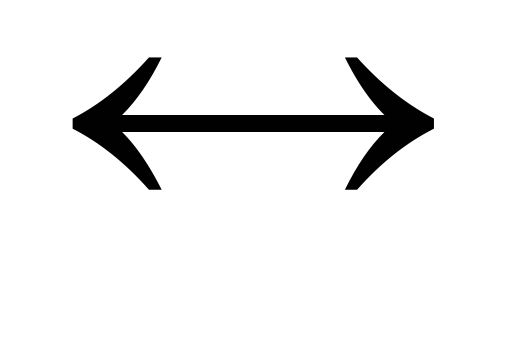 cC (d) + dD (d)
cC (d) + dD (d)
 G=
G=  G o + RT
G o + RT
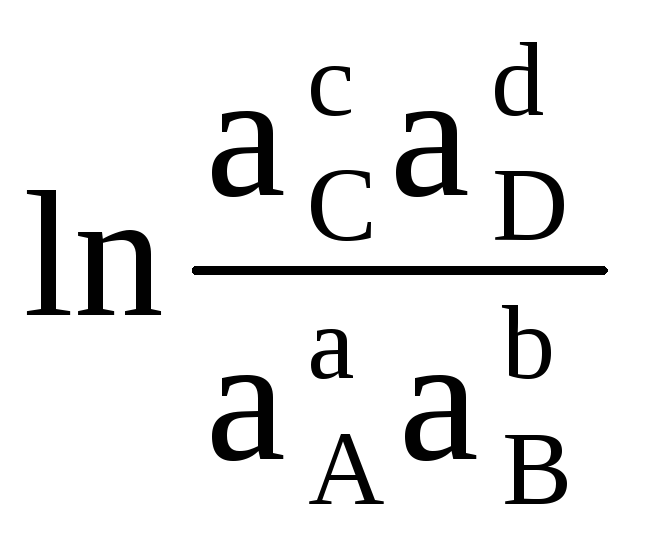 =
=
 Merge
-
RT
Merge
-
RT
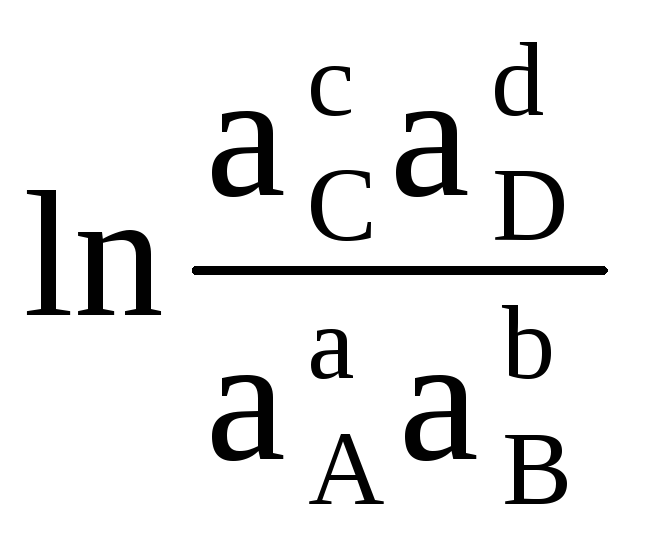 (5)
(5)
 G=
G=  G o + RT
G o + RT
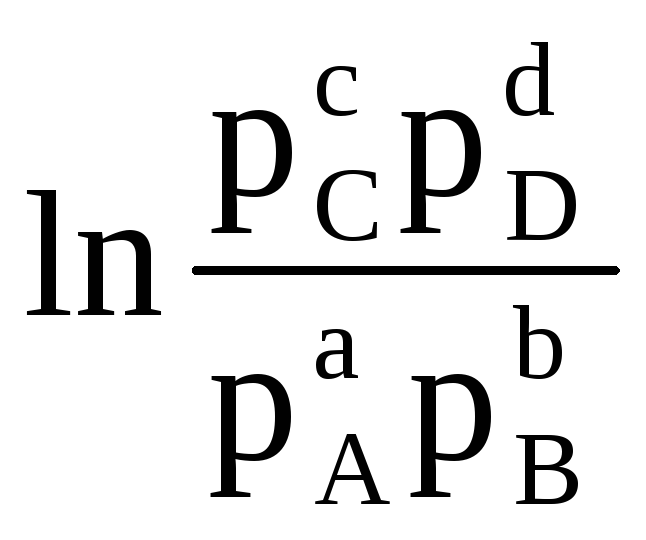 =
=
 Du-te-RT
Du-te-RT 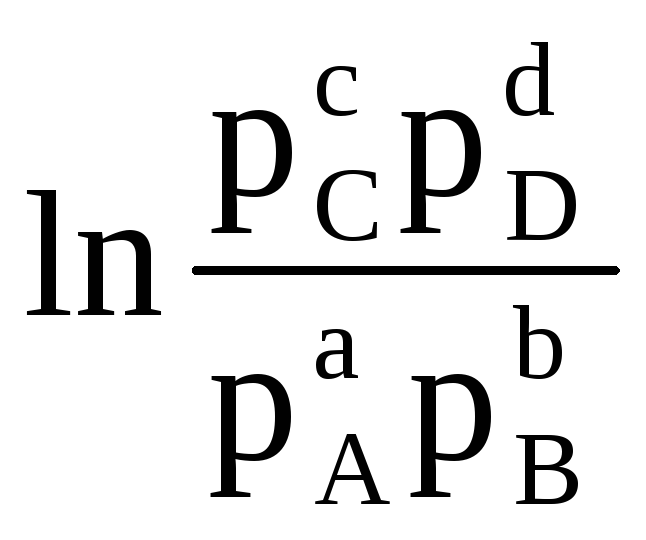 (6)
(6)
Înlocuind ecuația (4.5) în ecuația (4.3), obținem:
ΔE
=
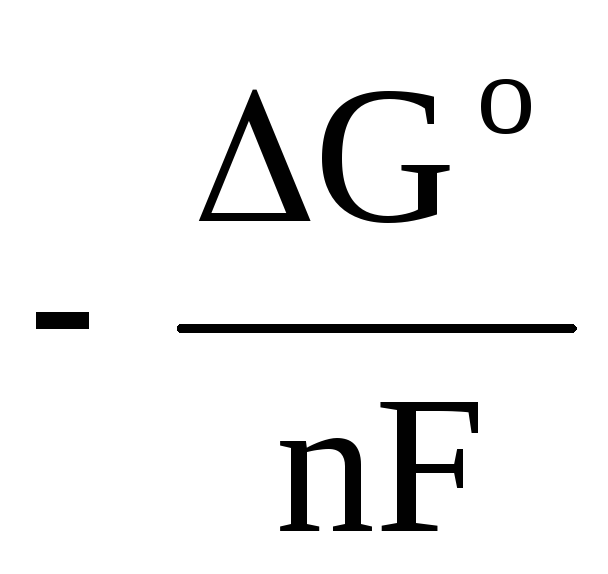 +
+
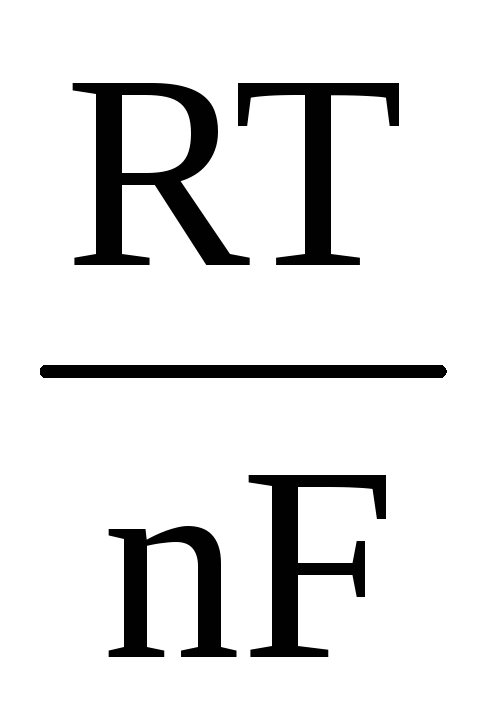
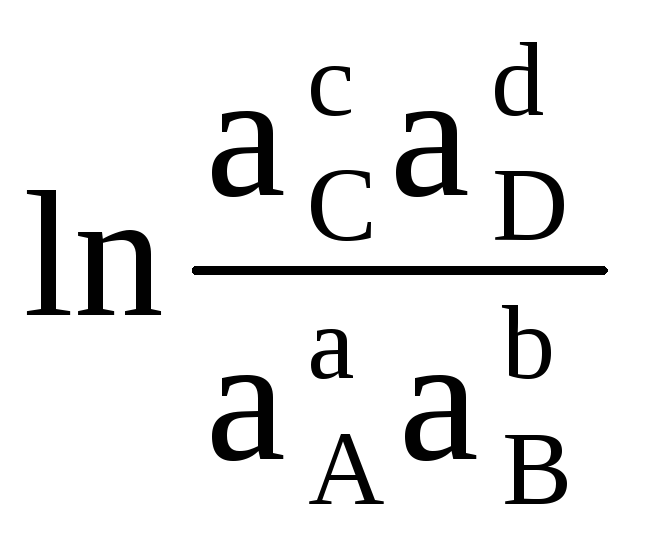 (7)
(7)
(în condiții standard, adică cu activitățile tuturor participanților la reacție egale cu unul, ΔE = ΔE 0 ). Dacă substanțele gazoase participă la reacție, atunci în ecuația (4.7) activitățile sunt înlocuite cu presiuni parțiale ale substanțelor corespunzătoare.
Prin urmare, se numește standard EMF element dacă activitățile (sau presiunile parțiale) ale materiilor prime și ale produselor de reacție sunt egale cu unu. Valoarea emf standard ( ΔE 0 ) a unei celule galvanice poate fi calculată prin ecuația (4.4) dacă se cunoaște valoarea energiei Gibbs standard a reacției. Acesta din urmă este ușor de calculat, cunoscând energia Gibbs de formare a produselor de reacție și a materiilor prime.
Ca exemplu, să scriem ecuația pentru calcularea EMF al elementului Daniel-Jacobi:
ΔE = ΔE 0
+
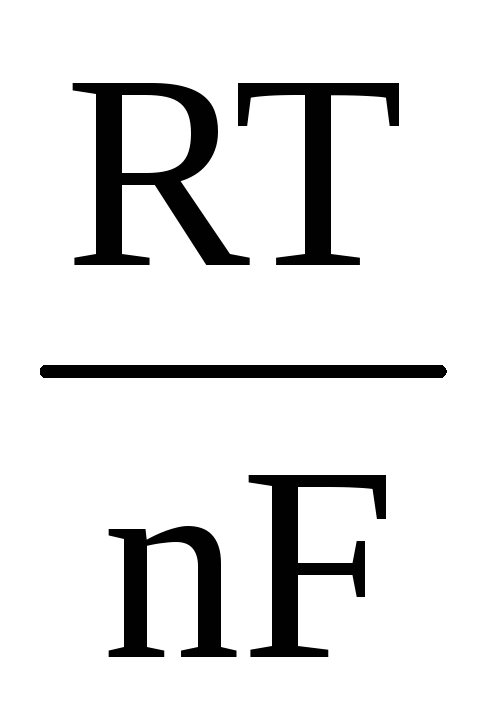
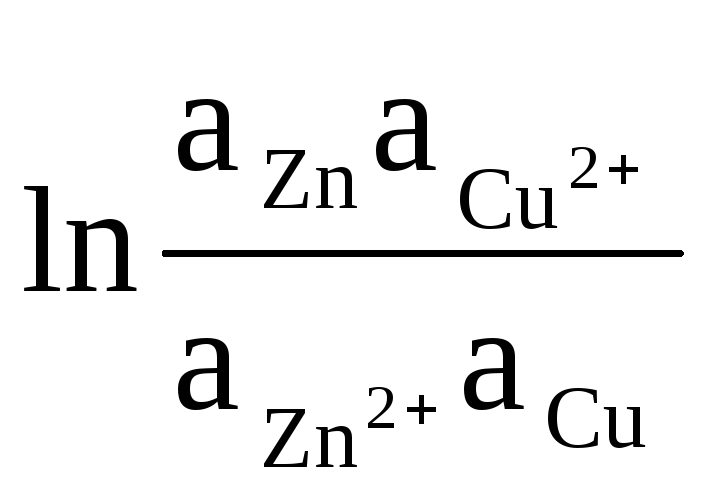 (8)
(8)
Activitățile solide de Zn și Cu sunt egale cu unitatea (reacțiile care au loc la electrozi sunt eterogene). Prin urmare obținem:
ΔE = ΔE 0
+
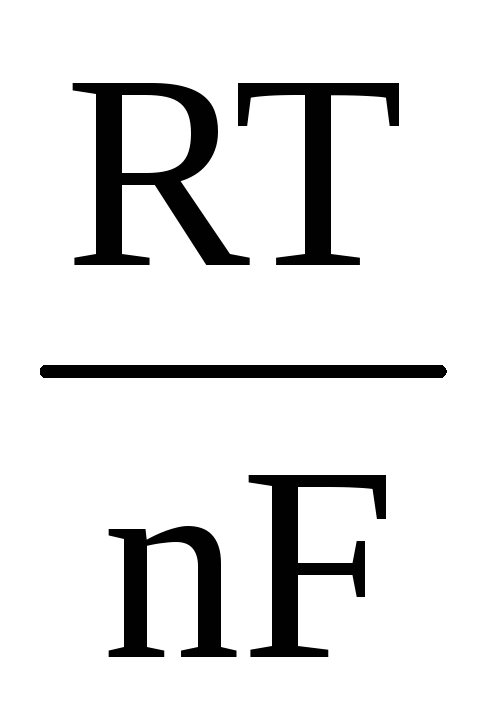
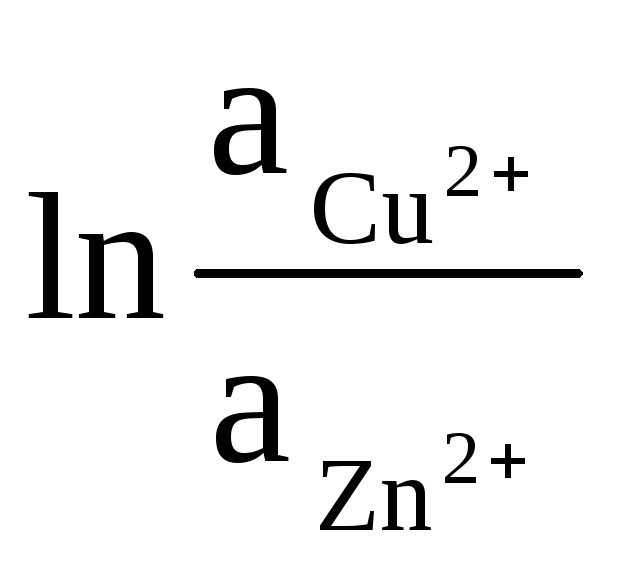 (9)
(9)
Când se înlocuiește logaritmul natural cu unul zecimal și se înlocuiesc valorile concentrației corespunzătoare (a Me 
 ), precum și valorile numerice ale lui R, F
iar temperatura standard 298K, ecuația (4.9) devine și mai simplă:
), precum și valorile numerice ale lui R, F
iar temperatura standard 298K, ecuația (4.9) devine și mai simplă:
ΔE = ΔE 0
+
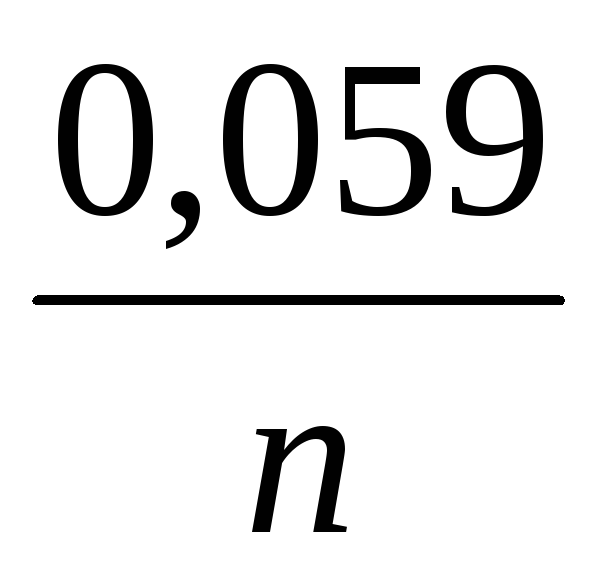
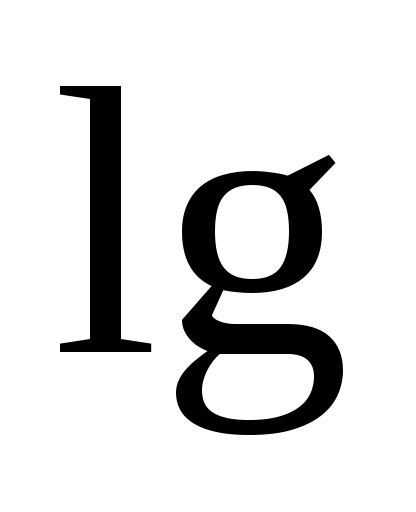
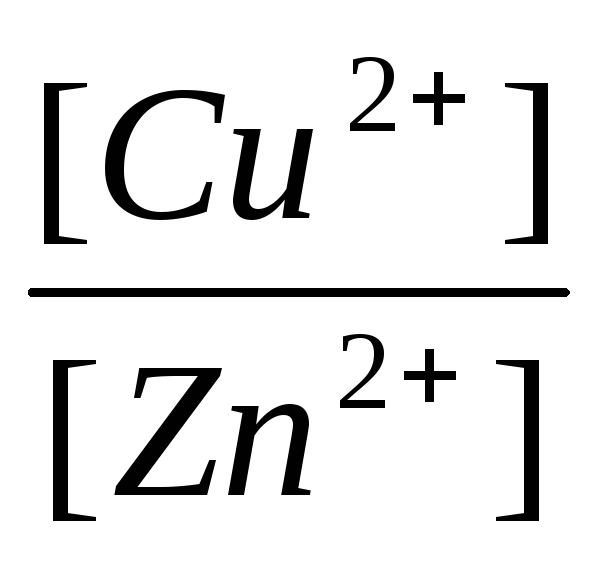 (10)
(10)
ΔE = ΔE 0
Cu+2 / Cu- ΔE 0
Zn+2 / Zn+ 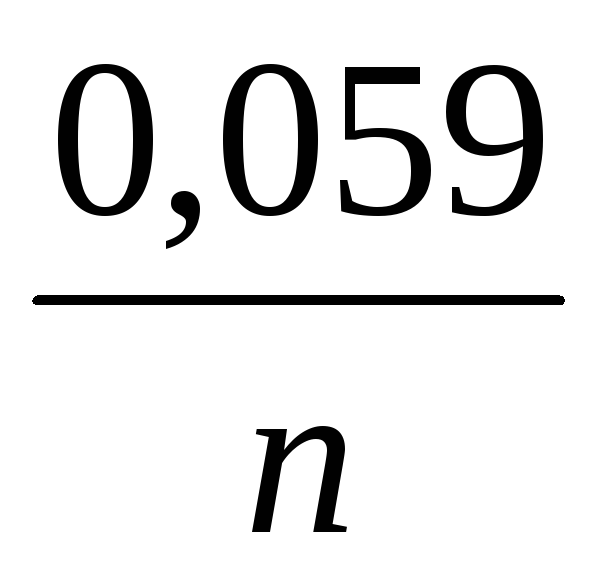
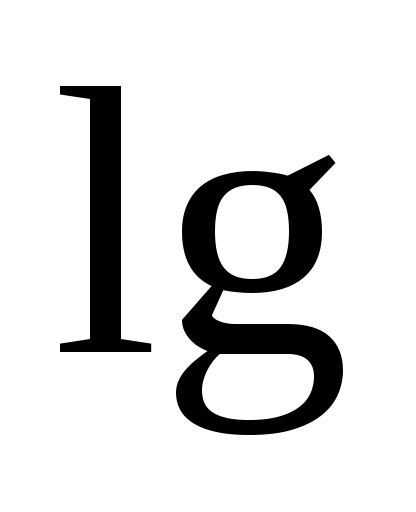
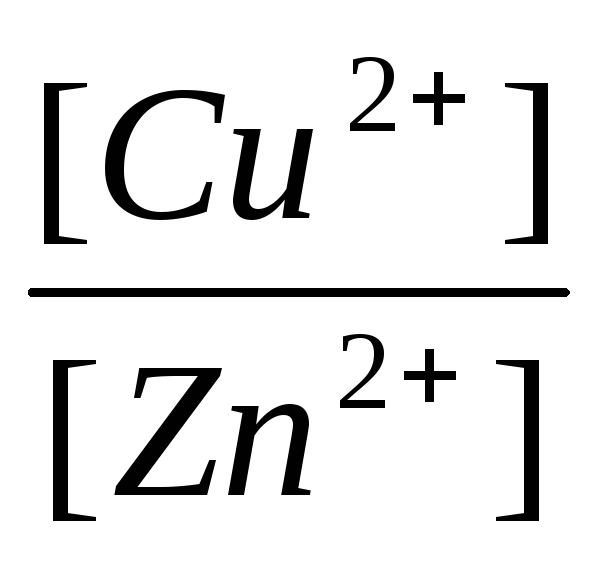 , (11)
, (11)
Unde n- numarul de electroni implicati in procesul de oxidare-reducere;
ΔE 0 Cu +2 / Cu și ΔE 0 Zn +2 / Zn - potențiale standard ale electrodului în volți (V);
ΔE 0 Cu +2 / Cu - ΔE 0 Zn +2 / Zn = ΔE 0 - EMF standard al unei celule galvanice;
Și - concentrațiile, respectiv, ale ionilor de cupru și zinc în soluții de CuSO 4 și ZnSO 4, în mol/l.
Măsurarea EMF a elementelor galvanice. Prin măsurarea directă a diferenței de potențial la bornele unei celule galvanice folosind un voltmetru convențional, puteți obține valoarea tensiunii U, care nu este egală cu EMF-ul celulei, adică. U< ЭДС. Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока и другими эффектами. Поэтому Măsurarea EMF de obicei efectuată prin metoda de compensare, în care curentul care circulă prin element este zero. Pentru a face acest lucru, un EMF cu semnul opus este furnizat elementului de la o sursă de curent externă. Circuitul de măsurare include și un galvanometru pentru măsurarea curentului și un voltmetru pentru măsurarea tensiunii. În momentul în care tensiunea de ieșire a sursei externe de curent este egală cu EMF al celulei galvanice (momentul de compensare EMF), curentul din circuit este zero (acul galvanometrului nu deviază). Tensiunea măsurată în acest moment de un voltmetru la bornele celulei galvanice este egală cu EMF a acesteia.
Dacă separăm spațial procesele de oxidare și de reducere, atunci reacția redox poate fi folosită pentru a genera energie electrică.
Dispozitivul în care energie chimica se transformă în electricitate celulă galvanică. O celulă galvanică este formată din două metale scufundate într-o soluție de electrolit. Dacă conectați aceste metale cu un conductor de primul fel (un fir metalic), atunci se va forma un curent electric, care apare ca urmare a apariției unui proces redox. Într-o celulă galvanică, anodul este un electrod al cărui potențial electrod într-o soluție dată este mai electronegativ. Oxidarea are loc la anod. Catodul este un electrod realizat dintr-un metal mai puțin activ. Ionii metalici pozitivi, ionii de hidrogen sau moleculele neutre sunt reduse la catod. Într-o celulă galvanică, anodul este indicat cu un semn minus, iar catodul cu un semn plus. Celula galvanică este prezentată în figură.
O placă de zinc este scufundată într-o soluție de sulfat de zinc, o placă de cupru este scufundată într-o soluție de sulfat de cupru. Plăcile sunt conectate printr-un fir, soluțiile sunt separate printr-un perete poros pentru a preveni amestecarea soluțiilor. Electronii merg de-a lungul circuitului extern de la anod la catod, iar de-a lungul circuitului intern SO 4 2- anionii se deplasează în soluție din cupru în zinc, închizând circuitul electric al celulei galvanice.
O celulă galvanică este scrisă ca un circuit electrochimic:
A(-) Zn | ZnSO 4 || CuSO4 | Cu(+)K
Deoarece potențialul electrodului zincului este mai mic decât potențialul electrodului cuprului, zincul va fi anodul, iar cuprul va fi catodul. Placa de zinc este oxidată, iar cuprul este redus din soluția de pe suprafața plăcii de cupru.
Procesele care au loc în timpul funcționării unei celule galvanice trebuie înregistrate:
A Zn - 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Se numește diferența maximă de potențial a electrozilor care poate fi obținută în timpul funcționării unei celule galvanice forta electromotoare(emf) al elementului. Este egal cu diferența dintre potențialele de echilibru ale catodului și anodului:
EMF= e K - e A
Pentru o celulă electrochimică cupru-zinc în condiții standard:
EMF \u003d 0,34-(-0,76) \u003d 1,1 V
Diferența de potențial se formează nu numai între diferite, ci și între metale cu același nume, încărcate în soluții ale sărurilor lor cu concentrații diferite. O astfel de celulă galvanică se numește concentraţie. De exemplu, o celulă galvanică cu concentrație de nichel.
(-) Ni | NiSO4 || NiSO4 | Ni(+)
0,01 mol 0,1 mol
Să notăm munca unei astfel de celule galvanice de concentrare.
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -2) \u003d -0,25 + (0,058 / 2) (-2) \u003d -0,308 V
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -1) \u003d -0,25 + (0,058 / 2) (-1) \u003d -0,28 V
EMF = -0,28 - (-0,308) = 0,028 V
Procese pe electrozi:
A: Ni 0 - 2e - \u003d Ni 2+
K: Ni 2+ + 2e - \u003d Ni 0
SARCINI DE CONTROL
48. Calculați EMF al unei celule galvanice cadmiu - argint, dacă concentrația ionilor de argint în soluție este de 0,1 mol / l, iar ionii de cadmiu 0,001 mol / l. Scrieți ecuațiile pentru reacțiile care au loc pe electrozi.
49. Realizați o diagramă a două celule galvanice în una dintre care nichelul este catodul, iar în cealaltă anodul. Scrieți ecuațiile reacțiilor care au loc în timpul funcționării acestor elemente.
50. Calculați EMF al unei celule galvanice compuse din plăci de fier și plumb scufundate în soluții 0,1M de săruri ale acestora. Scrieți ecuațiile de reacție.
51. Calculați EMF al unei celule galvanice cu concentrație de nichel. Concentrația ionilor metalici în soluții este de 1 mol/l și 0,0001 mol/l. Scrieți procesele care au loc la anod și catod.
52. Ce procese au loc la electrozii unei celule galvanice concentrate de cupru, dacă unul dintre electrozi are o concentrație de ioni metalici egală cu 1 mol/l, iar celălalt 0,001 mol/l. în ce direcție se mișcă electronii în circuitul extern. Ce este EMF?
53. Realizați schema unei celule galvanice formată din plăci de Zn și Fe scufundate în soluții ale sărurilor acestora. Scrieți ecuațiile pentru procesele care au loc pe ionii de fier, astfel încât EMF-ul elementului să devină zero la o concentrație de ioni de zinc de 0,0001 mol/l.
54. Plăcile de fier și argint sunt legate printr-un conductor extern și scufundate într-o soluție de acid sulfuric. Faceți o diagramă a acestei celule galvanice, scrieți ecuațiile reacțiilor care au loc pe plăci.
55. Desenați diagrama unei celule galvanice formată dintr-un electrod de argint scufundat într-o soluție 1M de azotat de argint și un electrod standard de hidrogen. Scrieți ecuațiile proceselor cu electrozi. Care este EMF-ul elementului?
56. În ce direcție se vor mișca electronii în circuitul extern al următoarelor celule galvanice
a) Mg | Mg2+ | | Pb 2+ | Pb
b) Pb | Pb 2+ | | Cu 2+ | Cu
c) Cu | Cu 2+ | | Ag 2+ | Ag
dacă toate soluțiile de electroliți sunt unimolare? Ce metal se va dizolva în fiecare dintre aceste cazuri.
57. Realizați o diagramă a unei celule galvanice pe baza reacției care se desfășoară conform ecuației:
Ni + Pb (NO 3) 2 \u003d Ni (NO 3) 2 + Pb.
Scrieți ecuațiile electronice ale proceselor anodului și catodic, calculați EMF-ul acestui element în condiții standard.
58. EMF al unei celule galvanice formată dintr-o placă de cupru scufundată într-o soluție de sare a acesteia cu o concentrație de ioni de cupru egală cu 0,001 mol/l și cromul scufundat într-o soluție a sării sale este de 1,05 V. Determinați concentrația ionilor de crom într-o soluție de sare a acesteia. Realizați o diagramă a unei celule galvanice și scrieți ecuațiile electronice ale proceselor electrozilor.
59. Realizați o diagramă, scrieți ecuațiile proceselor cu electrozi și calculați EMF-ul unei celule galvanice formată din plăci de cadmiu și magneziu scufundate în soluții ale sărurilor acestora cu o concentrație de ioni metalici egală cu 1 mol/l. se va modifica EMF-ul acestei celule galvanice dacă concentrația fiecărui ioni se reduce la 0,01 mol/l.
60. EMF al unei celule galvanice constând dintr-un electrod standard de hidrogen și un electrod cu plumb scufundat într-o soluție de sare de plumb 1M este de 126 mV. Când elementul este închis, electronii din circuitul extern se deplasează de la plumb la electrodul de hidrogen. Care este potențialul electrodului plumb. Desenați o diagramă a unei celule galvanice și scrieți procesele care au loc pe electrozi.
61. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii cu plumb.
62. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii cadmiu-nichel.
63. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii fier-nichel.
64. Faceți o diagramă a două celule galvanice în una dintre care cromul ar fi anodul, iar în cealaltă - catodul. Scrieți pentru fiecare dintre aceste elemente ecuațiile electronice ale reacțiilor care au loc pe electrozi.
65. Desenați o diagramă a unei celule galvanice formată din electrod de aluminiu, scufundat într-o soluție 1M de azotat de aluminiu și un electrod standard de hidrogen. Scrieți ecuațiile proceselor electrodului și calculați EMF-ul celulei galvanice.
66. În ce direcție se vor mișca electronii în circuitul extern al unei celule galvanice din aluminiu-zinc. Concentrațiile ionilor în soluții sunt de 0,1 mol/l. Faceți o diagramă a unei celule galvanice, scrieți ecuațiile pentru procesele care au loc pe electrozi, calculați EMF.
67. Într-un element argint-zinc folosit pentru alimentarea diferitelor echipamente are loc o reacție
ELECTROLIZĂ
prin electroliză numit ansamblu de procese care au loc atunci când un curent electric continuu trece printr-un sistem format din doi electrozi și o soluție de topitură sau electrolit. În timpul electrolizei, ionii încărcați pozitiv se deplasează către catod, care este conectat la polul negativ al unei surse externe de CC, iar ionii încărcați negativ se deplasează către anod, care este conectat la polul pozitiv al sursei de curent continuu. Pe suprafața catodului are loc un proces de reducere, pe anod - oxidare.
Luați în considerare electroliza unei topituri de clorură de sodiu.
Când doi electrozi de grafit conectați la o sursă de curent sunt scufundați într-o topitură constând din ioni Na + și Cl -, o mișcare direcționată a ionilor va începe în electrolit, iar pe electrozi vor avea loc procese redox.
Schema electrolizei topiturii de sodiu:
NaCl \u003d Na + + Cl -
Catod (-) (+) anod
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
Ecuația generală a reacției:
2Na + + 2Cl - electroliza 2 Na + Cl 2
Electroliza 2NaCl 2Na + Cl 2
La electroliza soluțiilor apoase de electroliți moleculele de apă polară sunt atrase atât de catod, cât și de anod și pot participa, de asemenea, la procesele de la electrozi.
Procese la catod
Secvența de reducere a ionilor la catod în timpul electrolizei soluțiilor depinde de valorile potențialelor standard ale electrodului. Cu cât valoarea potențialului electrodului elementului este mai mare, cu atât recuperarea acestuia este mai ușoară.
Primii care se reduc la catod sunt ionii acelor metale al caror potential este cel mai pozitiv. De exemplu, o soluție cu ioni Ag + și H +. Ag este restaurat mai întâi:
Ag + + e - = Ag 0 e 0 = +0,8 B
Hidrogenul nu este recuperat, deoarece potențialul său este mai mic.
Potențialele metalelor și hidrogenului depind de concentrația lor în electrolit. Prin urmare, nu este întotdeauna posibil să se judece reducerea ionilor H+ din valorile potențialului standard. Într-o soluție neutră, concentrația ionilor de hidrogen este de 10 -7 mol/l. și după formula Nernst:
În consecință, hidrogenul poate fi eliberat din soluții neutre doar la un potențial mai mic de -0,41V, iar metalele de pe catod vor fi eliberate doar acelea al căror potențial este mai pozitiv decât potențialul -0,41V.
În practică, multe metale (Zn, Fe, Cr etc.) sunt eliberate din soluțiile de hidrogen, a căror valoare potențialelor electrodului este mai mică de –0,41V.
Acest lucru se datorează supratensiunii hidrogenului, adică. Pe suprafața majorității metalelor, hidrogenul este eliberat cu dificultate. Mărimea supratensiunii hidrogenului depinde de proprietățile metalului, de densitatea curentului și de temperatura electrolitului. supratensiune– aceasta este diferența de potențial dintre potențialul practic al degajării hidrogenului și cel teoretic.
Exemplu.
Potențial de eliberare a zincului în electrolit neutru –0,76V, hidrogen –0,41V. supratensiunea de hidrogen pe zinc este de aproximativ –0,72V. Astfel, hidrogenul va fi eliberat pe zinc doar la un potențial de –0,41+(-0,72)=-1,13V. Dacă comparăm potențialul de descărcare a zincului (-0,76 V) cu potențialul de descărcare a hidrogenului pe zinc (-1,13 V), este clar că zincul va fi eliberat. De fapt, acest lucru este adevărat, în timpul electrolizei unei soluții neutre de sare de zinc, se eliberează zinc și o cantitate mică de hidrogen.
Cu un proces generalizat la catod, în funcție de locația metalului în seria potențialelor standard ale electrodului, se disting trei cazuri:
1) ioni metalici, al căror potențial electrod este mai mic de –1,18 V (de la Li la Mn). Ionii de hidrogen sunt restaurați:
2 H ++ 2e - \u003d H 2 PH< 7
2 H 2 O + 2e - \u003d H 2 + 2OH - PH>= 7
2) ioni metalici, al căror potențial de electrod este de la –1,18 V la 0,00 V (de la Mn la H). În acest caz, atât ionii metalici, cât și ionii de hidrogen sunt reduse simultan:
Me n+ + ne - = Me 0
2H + + 2e- = H2PH<7
2H2O + 2e - = H2 + 2OH - PH>=7
3) ioni metalici, al căror potențial electrod este mai mare de 0,0 V (de la H la Au). În acest caz, doar ionii metalici sunt redusi
Me n+ + ne - = Me 0
Procese la anod
Pentru electroliză se folosesc anozi solubili (activi) și insolubili (inerți). În timpul electrolizei, anozii solubili se dizolvă și ionii metalici - anodul trece în soluție. Anozii solubili sunt de obicei fabricați din metalul a cărui sare este supusă electrolizei.
Anozii insolubili nu participă la reacțiile redox. De obicei, aceștia sunt anozi din grafit, aur, platină. Anionii cu potențiale mai negative sunt oxidați la suprafața lor. Aceștia sunt ioni care nu conțin oxigen, cum ar fi J - , Br - , Cl - , S 2- și alții (cu excepția F -)
Dacă soluția conține ioni Cl - , Br -, atunci ionii Br - vor fi oxidați pe un anod inert.
2Br - - 2e - = Br 2
2H 2 0 - 4e - \u003d O 2 + 4H + (PH<=7)
4OH - 4e - \u003d 2H 2 O + O 2 (PH> 7)
Să luăm în considerare câteva cazuri de electroliză a soluțiilor apoase.
Exemplu.
Schema de electroliză a unei soluții apoase de clorură de cupru cu un anod inert CuCl 2 \u003d Cu 2+ + 2Cl -
H 2 O \u003d H + \u003d OH -
Catod (-) Cu 2+ H + (H 2 O) Cl -, OH - (H 2 O) (+) anod
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
Cuprul are un potențial mai mare de 0, astfel încât metalul este redus la catod, iar un reziduu de acid fără oxigen este oxidat la anod.
Exemplu.
Schema de electroliză a unei soluții de sulfat de potasiu cu un anod inert. K 2 SO 4 \u003d 2K + + SO 4 2
H 2 O \u003d H + + OH -
Catod (-) 2K +, H + (H 2 O) SO 4 2-, OH (H 2 O) (+) anod
2H 2 O + 2e - \u003d H 2 + 2OH - 2H 2 O - 4e - \u003d O 2 + 4H +
K + + OH - \u003d KOH 2H + + SO 4 2- \u003d H 2 SO 4
Deoarece potasiul din seria potențialelor standard ale electrodului este mult mai devreme decât hidrogenul, hidrogenul este redus la catod și se acumulează ionii OH -
La anod, moleculele de apă vor fi oxidate și se vor acumula ionii de H+. Astfel, în spațiul catodic, produsul secundar va fi alcalin, iar în spațiul anodic, acid.
Exemplu.
Electroliza unei soluții apoase de sulfat de nichel cu un anod activ. Ni SO 4 \u003d Ni 2+ \u003d SO 4 2-
H2O H + + OH -
Catod (-) Ni 2+, H + (H 2 O) SO 4 2-, OH - (H 2 O) (+) anod
Ni 2+ +2e - = Ni 0 Ni - 2e - = Ni 2+
e 0 Ni \u003d -0,25V este mai mare decât potențialul de reducere a ionilor de hidrogen din apă (-0,41V), prin urmare, metalul este redus, iar anodul-metal este oxidat la anod, deoarece potențialul de nichel este mult mai mic decât potențialul de oxidare al apei (+1,23V).
Legile electrolizei
Masa electrolitului supus transformării chimice, precum și masele de substanțe eliberate pe electrozi conform legilor lui Faraday, sunt direct proporționale cu cantitatea de electricitate trecută prin electrolit și cu masele molare ale echivalenților de substanțe:
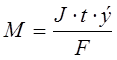 , Unde
, Unde
m este masa electrolitului supus electrolizei sau masa substanțelor eliberate pe electrozi, g;
J - puterea curentului, A;
e-masa molară a echivalenților de substanță, g/mol;
F-numărul lui Faraday - 96500 C;
t este timpul de electroliză, s;
SARCINI DE CONTROL
68. Faceți ecuații pentru procesele care au loc în timpul electrolizei topiturii de NaOH și NiCl 2 cu electrozi inerți.
69. Realizați o diagramă a electrolizei soluțiilor apoase de acid sulfuric, clorură de cupru, azotat de plumb cu electrozi de platină.
70. Scrieți ecuațiile proceselor electrozilor care au loc în timpul electrolizei soluțiilor apoase de clorură de bariu și clorură de fier (II) cu electrozi de carbon.
71. Realizați o diagramă a electrolizei unei soluții apoase de clorură de zinc, dacă a) anodul este zinc; b) anod de carbon.
72. Ce volum de hidrogen va fi eliberat când un curent de 3 A este trecut printr-o soluție apoasă de acid sulfuric timp de 1 oră.
73. În timpul electrolizei unei soluții apoase de SnCl 2 s-au eliberat la anod 4,48 litri. clor (condiții normale). Ce substanță și în ce cantitate a fost eliberată la catod.
74. În ce secvență vor fi eliberate metalele în timpul electrolizei unei soluții care conține sulfați de nichel, argint, cupru în aceeași concentrație. Scrieți ecuațiile proceselor pe electrozi.
75. Realizați o diagramă a proceselor care au loc pe electrozii de cupru în timpul electrolizei unei soluții apoase de azotat de potasiu.
76. Cuprul nerafinat conține impurități de argint și zinc. Ce se întâmplă cu aceste impurități în timpul rafinării electrolitice a cuprului. Scrieți ecuațiile proceselor pe electrozi.
77. Cât timp va dura descompunerea completă a 2 moli de apă cu un curent de 2A.
78. Trecut prin soluții de sare de masă și fosfat de sodiu pentru ceva timp DC.. Va schimba acest lucru cantitatea de sare în ambele cazuri. Motivați-vă răspunsul prin compilarea ecuațiilor electronice ale proceselor care au loc pe catod și anod.
79. În timpul electrolizei unei soluții de sulfat de cupru (II) s-au eliberat la anod 0,168 litri de gaz (condiții normale), se alcătuiesc ecuațiile electronice ale proceselor și se calculează cât de mult cupru va fi eliberat la catod.
80. Compuneți ecuațiile electronice ale proceselor care au loc în timpul electrolizei unei soluții și topituri de KOH.
81. Ce substanțe și în ce cantitate vor fi eliberate pe electrozii de carbon în timpul electrolizei unei soluții de NaI timp de 2,5 ore dacă puterea curentului este de 6 A.
82. Câte grame de acid sulfuric se formează lângă anod în timpul electrolizei unei soluții de sulfat de sodiu, dacă la anod se eliberează 1,12 litri de oxigen (n.o.), se calculează masa substanței eliberate la catod.
83. În timpul electrolizei unei soluții de azotat de argint la anod s-au eliberat 0,28 litri de oxigen. Câte grame de argint au ieșit în evidență la catod.
84. Sărurile de aluminiu, zinc și cupru se dizolvă în apă cu o concentrație de cationi de 1 mol/l. alcătuiți ecuațiile electronice ale proceselor de pe electrozi și indicați succesiunea reacțiilor pe catod.
85. Ce produse pot fi obținute prin electroliza soluției de NaNO 3, dacă spațiile anodului și catodic:
a) separate printr-un compartiment poros;
b) nu se separă și soluția se agită.
86. Ce produse vor fi eliberate pe catod și anod în primul rând în timpul electrolizei soluțiilor apoase cu electrozi de grafit, dacă electrolitul conține un amestec de sulfat de cupru (II) și clorură de potasiu.
87. Plăcile de cupru și argint sunt scufundate într-o soluție apoasă de azotat de argint. La ce pol al sursei de curent trebuie conectată o placă de cupru pentru a o acoperi cu argint. Scrieți o diagramă a procesului de electroliză.
COROZIUNEA METALELOR
Coroziune numită distrugere spontană a metalului sub influența mediului. Coroziunea este un proces eterogen redox care are loc la interfață. După mecanismul procesului de coroziune, se disting coroziunea chimică și electrochimică. Coroziunea chimică numită oxidarea metalului, neînsoțită de apariția unui curent electric în sistem. Un astfel de mecanism se observă în interacțiunea metalelor cu gazele agresive la temperatura ridicata(coroziune gazoasă) și cu lichide organice - non-electrolites (coroziune în non-electrolites).
coroziunea electrochimică numită distrugerea metalului din mediul electrolitic, însoțită de apariția unui curent electric în interiorul sistemului.
Metalele folosite în inginerie conțin impurități ale altor metale, prin urmare, atunci când sunt în contact cu o soluție de electrolit, pe suprafața lor se obține un număr mare de celule microvoltaice care funcționează continuu. Metalul mai activ, anodul, se oxidează pentru a forma cationi metalici sau produse insolubile precum rugina. Electronii eliberați se deplasează la catod, unde agentul de oxidare este redus. Oxigenul dizolvat și ionii de hidrogen, cei mai importanți agenți oxidanți care provoacă coroziune, sunt numiți depolarizatori catodici. Ce fel de proces de reducere va avea loc pe catod depinde de compoziția electrolitului.
Exemplu.
Când fierul și cuprul intră în contact într-o soluție de acid clorhidric, se formează o celulă microgalvanică:
AFe| HCI | Cu K
e 0 Fe/Fe2+ = -0,44B
e 0 Cu/Cu2+ = +0,34B
Fierul - un metal mai activ va fi anodul, iar cuprul - catodul. Reacțiile care apar la anod și catod pot fi exprimate astfel:
1 A: Fe -2e \u003d Fe 2+
1 K: 2H + + 2e = H2
Rezumând procesele anodice și catodice, obținem o reacție redox, a cărei apariție spontană provoacă coroziunea metalului:
Fe + 2H + = Fe 2+ + H2
Fe + 2HCl \u003d FeCl 2 + H 2
Exemplu.
Cu coroziune înăuntru mediu neutru,în absența oxigenului dizolvat în apă, depolarizarea cu hidrogen a catodului are loc în același mod ca în exemplul anterior.
Să notăm schema celulei galvanice și ecuațiile reacțiilor care au loc în această celulă galvanică:
A Fe|H2O| Cu K
1 A: Fe - 2e \u003d Fe 2+
1 K: 2H 2 O + 2e \u003d H 2 + 2OH -
Fe + 2H 2 0 \u003d Fe 2+ + H 2 + 2OH -
Sau sub formă moleculară: Fe + 2H 2 O = Fe (OH) 2 + H 2
Exemplu.
Când fierul intră în contact cu cuprul în aer umed, se formează o celulă galvanică.
AFe| H2O + O2 | Cu K
Și procesul de coroziune este exprimat prin următoarele ecuații:
A: Fe - 2e = Fe 2+
K: O 2 + 2H 2 O + 4e \u003d 4OH -
2Fe + O 2 + 2H 2 O \u003d 2Fe (OH) 2
Sub influența oxigenului atmosferic, hidroxidul de fier (2) este oxidat în continuare conform ecuației
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
După cum se poate observa din exemplu, în acest caz are loc depolarizarea oxigenului a catodului.
Posibilitatea unui proces redox spontan este calculată din EMF
EMF = e agent reducător - e agent de oxidare
Dacă EMF-ul procesului este mai mare decât zero, atunci procesul este posibil.
Un circuit electrochimic poate fi compus din doi electrozi - o celulă galvanică în care se generează energie electrică datorită fluxului de reacții electrochimice pe electrozi. Transferul de sarcină prin limita de fază (curent electric) într-un astfel de sistem se realizează datorită unei reacții electrochimice care are loc spontan. Electrodul la care are loc electroreducerea se numește catod, iar electrodul la care are loc electrooxidarea se numește anod.
Un singur electrod dintr-o celulă galvanică este uneori numit jumătate de celulă. Principala caracteristică electrică a unui circuit electrochimic este diferența de potențiale electrice dintre electrozi. Conectarea electrozilor cu un conductor extern duce la apariția unui curent electric în circuit.
Un circuit electrochimic corect deschis, la capete ale căruia se poate măsura diferența de potențial electric, trebuie să se termine întotdeauna în același mod. compoziție chimică metale . Acest lucru se realizează de obicei prin simpla conectare a firelor de cupru la metalele M 1 și M 2 . Includerea unui al treilea conductor metalic între doi conductori metalici, conform legii lui Volta, nu modifică diferența de potențial la capetele circuitului.
Circuitul electrochimic este în echilibru cu condiția ca echilibrul electrochimic să fie observat la fiecare graniță de fază și diferența de potențial la capetele circuitului. E compensată de diferența de potențial de la o sursă externă de curent.
Când se înregistrează schematic un circuit electrochimic:
1. Electrodul din stânga este scris în ordine inversă (substanțele în soluție sunt indicate în dreapta barei verticale, substanțele care formează o fază diferită sau materialul electrodului sunt indicate în stânga). Electrodul drept este înregistrat în mod obișnuit, conform regulilor pentru înregistrarea schematică a electrozilor;
2. Soluțiile ambilor electrozi sunt separate printr-o linie punctată verticală dacă sunt în contact între ele (potențialul de difuzie nu este eliminat) sau prin două linii verticale punctate dacă se elimină potențialul de difuzie dintre soluții (de exemplu, folosind un pod de sare).
Într-un circuit deschis corect, la capetele notației condiționate ale elementului, același metal este înregistrat în natură. Pentru simplitate, este adesea omis din notația în lanț.
Conform regulii de scriere a reacției electrodului, în stânga sunt scrise forma oxidată a unei substanțe și electronii. , este diferența dintre reacțiile de pe electrozii din dreapta și din stânga. Apoi, dacă diferența de potențial a întregului element este pozitivă, atunci reacția totală și curentul electric din celula galvanică curge de la stânga la dreapta, dacă este negativă, atunci în sens opus.
Având în vedere că electroreducerea are loc la catod, iar electrooxidarea are loc la anod, atunci într-o celulă galvanică (când apar procese spontane), catodul va fi un electrod mai electropozitiv, iar anodul mai electronegativ. Dacă elementul este conectat la o sursă externă de curent și provoacă procese electrochimice forțate (electroliza), atunci catodul va fi un electrod mai electronegativ, iar anodul va fi mai electropozitiv. Pentru a evita confuzia, termenii catod și anod sunt folosiți mai des atunci când se ia în considerare electroliza, iar atunci când se iau în considerare celulele galvanice, termenii „plus” și „minus” sunt mai frecvent folosiți pentru a desemna catodul și, respectiv, anodul.
Să luăm ca exemplu trei cazuri.
1. Ambii electrozi au o soluție comună:
Pt, H2 (d) | HCI(aq) | AgCl | Ag
(1) AgCl + e Ag + CI – (aq);
(2) 2H + (aq) + 2 e H2 (d).
Reacția totală care are loc în element
AgCI + 0,5H2 (d) Ag + HCI(aq).
Dacă EMF-ul acestui element este pozitiv, atunci reacția totală va avea loc în direcția înainte, electrodul drept va fi mai pozitiv - plus (catod), iar electrodul stâng - mai negativ - minus (anod).
2. Soluțiile de electrozi sunt diferite și au contact între ele prin membrană (potențialul de difuzie nu este eliminat);
CD | Cd(NO3)2(aq) ¦ NaCl(aq) | AgCl | Ag
Pe electrozi au loc următoarele reacții:
(1) AgCl + e – Ag + Cl – (aq);
(2) Cd 2+ (aq) + 2 e Cd.
AgCl + 1/2Cd Ag + 1/2Cd 2+ (aq) + Cl – (aq).
3. Soluțiile electrozilor sunt diferite și sunt interconectate printr-o punte de sare (se elimină potențialul de difuzie).
Pt | H2 (d) | HCl(aq) || NaCl(aq) | AgCl | Ag
Pe electrozi au loc următoarele reacții:
(1) AgCl + e Ag + CI – (aq);
(2) 2H + (aq) + 2e – H2(d).
Reacția generală care are loc formal în element
AgCl + 1/2H2 (d) Ag + H + (aq) + CI – (aq).
Valoarea limită a diferenței de potențiale electrice atunci când curentul prin element tinde spre zero se numește forță electromotoare (EMF) și se notează cu E.
EMF-ul unei celule galvanice este alcătuit din salturi de potențial la limita tuturor fazelor care formează celula (Fig. 4).
Diferența de potențial la capetele acestui circuit constă din trei potențiale galvanice:
![]() . (3.32)
. (3.32)
În general, în formarea EMF a unei celule galvanice sunt implicate nu numai salturile de potențial dintre fazele electrozilor, ci și diferența de potențial dintre metalele care formează faza electroconductoare a electrozilor - așa-numita potențialul de contact, precum și diferența de potențial dintre fazele soluțiilor electrodului - potențialul de difuzie.
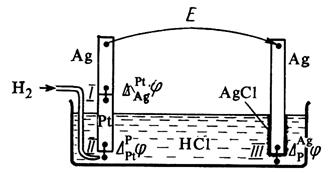
Orez. 4. O celulă galvanică compusă din hidrogen
și electrozi de clorură de argint.
Potențialul de difuzie apare la limita a două soluții datorită mobilităților diferite ale ionilor conținute în soluțiile de electrozi și/sau concentrațiilor acestora. Celula galvanică poate avea o soluție de electrolit comună pentru ambii electrozi. În acest caz, potențialul de difuzie va fi absent. În alte cazuri, atunci când efectuează măsurători electrochimice, ei încearcă să scape pe cât posibil de potențialul de difuzie. Există mai multe modalități de a elimina potențialul de difuzie. Cea mai simplă este utilizarea unei punți de sare umplută cu o soluție de sare pentru conectarea soluțiilor a doi electrozi, ai căror cationi și anioni au aproximativ aceleași mobilități (KCl, KNO 3).
Potențialul de contact apare atunci când fazele electron-conductoare ale electrozilor sunt realizate din diferite metale. Datorită faptului că în prezent nu există metode directe experimentale și de calcul pentru determinarea potențialelor galvanice la limita de fază într-o celulă galvanică, valoarea forței electromotoare a unei celule galvanice este calculată ca diferență între două potențiale de electrod condiționat:
E=E P - E l, (3,33)
Unde E p este potențialul electrodului drept, E I este potențialul stângii.
Lanțuri chimice
Celulele galvanice de primul tip - circuitele chimice sunt elemente formate din electrozi pe care au loc diverse reacții electrochimice.
Funcționarea oricărui element electrochimic se bazează pe reacții redox spontane care apar separat: pe electrodul mai negativ (anod) - oxidare, pe cel mai pozitiv (catod) - reducerea.
Conectarea electrozilor cu un conductor extern duce la apariția unui curent electric în circuit. De exemplu, elementul Daniel-Jacobi este compus din doi electrozi de primul fel, zinc și cupru. Secvența conexiunii lor este reprezentată de diagramă:
Cu | Zn | ZnSO 4 (aq) ¦ CuSO 4 (aq) | Cu.
(1) Cu 2+ (aq) + 2e – Cu;
(2) Zn 2+ (aq) + 2e – Zn.
Reacția totală care are loc în element
Zn + Cu 2+ (aq) Cu + Zn 2+ (aq).
EMF a acestui element
Unde ![]() .
.
Există lanțuri chimice cu doi și unul electrolit. Celulele electrochimice cu doi electroliți includ elementul Daniel-Jacobi discutat mai sus.
Circuitele chimice cu un electrolit pot fi de două tipuri.
În lanțurile de primul tip, un electrod este reversibil în raport cu cationul, celălalt în raport cu anionul. De exemplu, element
CD | CdCI2 (aq) | AgCl | Ag
Este utilizat pentru a determina coeficientul mediu de activitate al electrolitului CdCl2. Calculați EMF-ul acestui element.
unde este activitatea medie a soluției de CdCl2.
În celulele galvanice de al doilea tip (cu un electrolit), ambii electrozi sunt reversibile față de unul dintre ioni. Un exemplu ar fi elementul
hg | Hg2Cl2 | KCl(aq) | CI2 (g) | Pt
Expresia pentru EMF a acestui element este:
Dacă creați condiții în care, atunci EMF-ul acestui element va fi egal cu EMF standard. Acest tip de celule galvanice sunt utilizate pentru a determina cu precizie forța electromotoare standard (Eº) a celulei.
Exemple de rezolvare a problemelor
Exemplul 1 Indicați semnele electrozilor și tipul acestora, scrieți ecuațiile proceselor anodice și catodice, ecuațiile ion-moleculare și moleculare totale ale proceselor care au loc într-o celulă galvanică, a căror schemă este:
Ni½NiSO 4 aq║ CoSO 4 aq½Co.
Calculați emf-ul acestui element dacă a = 0,001 M, a \u003d 1 M. Potențialele standard ale electrozilor sunt, respectiv, egale: \u003d - 0,25 V; = - 0,28 V. Va funcționa spontan un astfel de element?
1. Deoarece potențialul standard al electrodului este mai pozitiv decât cel al electrodului, semnele electrozilor sunt:
(+) Ni½NiSO 4 aq║ CoSO 4 aq½Co (–).
Aceștia sunt electrozi de primul fel.
2. Pe un electrod care are un potențial mai pozitiv (), se eliberează electroni, adică procesul de oxidare. Acest electrod se numește anod.
Pe un electrod care are un potențial mai negativ (), electronii sunt acceptați, adică procesul de recuperare. Acest electrod se numește catod.
Procese care au loc pe electrozii dintr-o celulă galvanică:
_______________________________
Ecuația moleculară: .
3. FEM a elementului este:
E \u003d E + - E- \u003d -.
= + = - 0,28 + (0,059/2)lg1= - 0,28 V.
= + = - 0,25 + (0,059/2)lg0,001 = - 0,34 V.
E \u003d - 0,28 - (- 0,34) \u003d 0,06 V.
Întrucât EMF-ul elementului este o valoare pozitivă, elementul funcționează spontan, deoarece.
Exemplul 2. M Poate să apară o reacție spontan?
Desenați o diagramă a celulei galvanice în care are loc această reacție. Scrieți ecuațiile pentru procesele anodice și catodice, precum și ecuațiile ion-moleculare și moleculare totale. Determinați EMF-ul acestui element atunci când activitatea ionilor din soluție este egală cu 1.
1. Să facem o celulă galvanică din doi electrozi de primul fel și. Conform datelor din literatură = +0,22 V, a = -0,40 V, prin urmare, circuitul celulei galvanice arată astfel:
Cd½ CdCl2 (aq) || BiCI2 (aq) Bi.
2. În celula galvanică, pe electrodul negativ (), are loc reacția de oxidare a cadmiului, iar pe electrodul pozitiv (), procesul de reducere a ionului de bismut:
Ecuația ionico-moleculară: .
Ecuația moleculară: .
3. Deoarece activitățile ionilor sunt egale cu unu, potențialele electrodului vor fi egale cu potențialele electrodului standard. EMF-ul elementului este:
E \u003d - \u003d + 0,22 - (-0,40) \u003d + 0,62 V\u003e 0.
D r G = – zFE. Prin urmare, D r G> 0 și reacția considerată
poate apărea spontan.
Exemplul 3 Calculați la 298 K EMF al următorului element:
Zn ½ZnCl 2 aq ║ СdCl 2 aq ½Cd
C¢ \u003d 0,005 M² \u003d 2 M
Potențialele standard ale electrodului Cd 2+ ½Cd și Zn 2+ ½Zn sunt (-0,402) și respectiv (-0,763) V. Coeficienții medii de activitate ai CdCl 2 și ZnCl 2 în soluții cu concentrațiile indicate sunt 0,044 și 0,789. Este posibil să se schimbe direcția curentului în celulă prin modificarea concentrației ionilor de cadmiu și zinc din soluții?
Soluție.Există o celulă electrochimică compusă din doi electrozi diferiți de primul fel. Comparând valorile potențialelor electrodului standard ale acestor electrozi, vedem că electrodul de zinc din acest circuit este negativ (E 0 \u003d - 0,763 V), iar electrodul de cadmiu este pozitiv (E 0 \u003d - 0,402 V) .
Pe electrozi au loc următoarele reacții:
(–) Zn \u003d Zn 2+ +2,
(+) Cd2+ +2 =Cd.
Reacția totală care are loc în timpul funcționării unui element electrochimic:
Zn + Cd2+ = Zn2+ + Cd.
Valorile potențiale ale fiecărui electrod sunt egale cu:
![]() ;
;
![]() .
.
Valoarea EMF a elementului este:
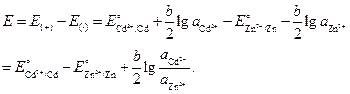
Să înlocuim valorile numerice, ținând cont de faptul că activitățile ionilor sunt egale cu activitatea medie e a electroliților corespunzători.
Unde .
Pentru a schimba direcția curentului în element, este necesar ca E (-) să devină mai mare decât E (+), adică astfel încât E devenit negativ. Să calculăm mai întâi la ce raport dintre activitățile ionilor de cadmiu și zinc în soluție vor deveni egale potențialele electrozilor. În acest caz, EMF va lua o valoare egală cu zero.
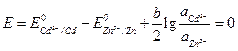 .
.
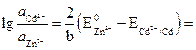
![]() .
.
Prin urmare:
 sau .
sau .
Rezultatul calculului arată că nici măcar egalitatea potențială nu poate fi atinsă prin modificarea concentrațiilor, deoarece activitatea ionilor de zinc trebuie să fie de peste 10 12 ori mai mare decât activitatea ionilor de cadmiu în soluție. Asemenea condiții sunt aproape imposibil de implementat.
Exemplul 4 O soluție diluată de FeCl 3 în HC1 0,5 M (f ± HCl = +0,757) este agitată cu mercur (la 298 K), iar reacția continuă
Fe 3+ + Hg + Cl - = Fe 2+ + 1/2 Hg 2 Cl 2
Determinați raportul activităților / după ce se stabilește echilibrul în această reacție, dacă potențialele standard ale electrodului Cl - / Hg 2 Cl 2, Hg și
Fe 3+ , Fe 2+ /Pt în raport cu electrodul standard de hidrogen sunt 0,268 și 0,771 V.
Decizie. Să compunem un element electrochimic în care ar avea loc reacția cerută de condiție. Să alegem electrozi de fier calomel și redox. Conform valorilor numerice ale potențialelor electrodului standard, concluzionăm că electrodul de calomel va fi negativ, iar electrodul de fier redox va fi pozitiv. Să scriem lanțul:
(–) Hg, Hg 2 CI 2 | Cl – || Fe 3+ , Fe 2+ | Pt(+)
Reacțiile electrodului care au loc în acest element electrochimic
(–) Hg + Cl - \u003d 1/2 Hg 2 Cl 2 + e -
(+) Fe 3+ + e - \u003d Fe 2+
și reacția totală care are loc în timpul funcționării elementului electrochimic compilat de noi,
Hg + Fe 3+ + Cl - \u003d Fe 2+ + ½ Hg 2 Cl 2.
Comparând această reacție cu reacția indicată de starea problemei și care are loc în balon atunci când FeCl3 este agitat în HC1 cu mercur, ajungem la concluzia că reacțiile sunt identice.
Să scriem expresiile pentru potențialele electrodului și EMF-ul elementului:
![]()
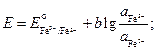
 .
.
În funcție de starea problemei, este necesar să se găsească raportul dintre activitățile ionilor de fier după stabilirea echilibrului. Luăm în considerare faptul că elementul electrochimic funcționează până la atingerea echilibrului, în timp ce EMF devine egal cu zero:

Să exprimăm rapoartele activităților ionilor de fier de aici:

Având în vedere că activitatea ionilor de clorură este egală cu activitatea medie a acidului clorhidric
unde pentru HCl. De aici

Întrebări pentru autocontrol
1. Definiți termenul potențial electrod standard și explicați motivul diferenței de potențial dintre un metal și o soluție a uneia dintre sărurile sale.
2. Într-o sursă de curent chimic
Pt½Fe +2, Fe +3 ║ Ag + ½ Ag
are loc reactia:
Fe +2 (sol.) + Ag + (sol.) = Fe +3 (sol.) + Ag (tv).
Ce efect (creștere, scădere sau fără efect) ar trebui să aibă următoarele modificări asupra tensiunii sursei de curent:
a) o creștere a concentrației de Fe +3 (sol);
b) creșterea simultană a concentrației de Fe +3 (soluție) și Fe +2 (soluție) în același număr de ori;
c) adăugarea de argint solid;
d) adăugarea unei anumite cantităţi de NaCl la o soluţie care conţine ioni de argint.
3. Cum se determină direcția transformării chimice spontane în cursul proceselor într-un element electrochimic? Dați un răspuns rezonabil în ce direcție va decurge spontan reacția:
4. Explicați semnificația semnelor de separare (½ și ║) în reprezentarea schematică a unei surse de curent chimic:
Zn ½ZnSO 4 aq ║ CuSO 4 aq ½Cu
Unde este anodul în acest circuit și unde este catodul? Explicați semnificația termenilor anod și catod și indicați pe diagramă direcția fluxului de electroni în circuitul extern.
5. Ce ar trebui să se întâmple când ionii (sub formă de săruri) sunt introduși într-o soluție care conține un exces de acid sulfuric diluat? Pentru o explicație, utilizați valorile potențialelor redox standard ale electrozilor: = 0,76 V; \u003d 1,52 V.
lanțuri de concentrare
Celulele galvanice de al doilea tip - circuitele de concentrare sunt elemente formate din electrozi pe care au loc aceleași reacții chimice, dar concentrațiile de reactanți pe electrozi sunt diferite. Energia electrică din celulele de concentrare este generată prin egalizarea concentrațiilor de substanțe.
Există lanțuri de concentrare fără transfer și cu transfer. Următoarele elemente se numesc lanțuri de concentrare fără transfer:
a) cu aceiași electrozi, dar cu concentrații diferite de electroliți în absența contactului direct între soluții;
b) cu electrozi din două aliaje (amalgame), identice ca natură, dar diferiți ca concentrație, scufundați într-o soluție de electrolit;
c) cu electrozi de gaz, de natură identică, dar cu presiune diferită a gazului (cu o soluție de electrolit).
Un exemplu de lanț de concentrare fără transfer este un lanț de concentrare de amalgam:
unde a1 și a2 sunt activitățile cadmiului din amalgam.
Pe electrozii acestui element de concentrare au loc următoarele reacții electrochimice:
Reacția totală în element - ![]() .
.
FEM a acestui element este generată prin egalizarea activității cadmiului din amalgame ():
Lanțurile de concentrare cu transfer sunt acele elemente de concentrare în care există o limită de contact direct între soluții. La limita dintre soluțiile a doi electroliți identici de concentrații diferite, ca urmare a mobilității diferite a cationilor și anionilor, apare așa-numitul potențial de difuzie.
De exemplu,
Cu | CuSO 4 ¦ CuSO 4 | Cu
unde și sunt diferitele activități ale ionilor de cupru pe electrozi, j D este potențialul de difuzie care are loc la limita soluțiilor.
Să scriem potențialele ambilor electrozi:
![]() . (3.38)
. (3.38)
Atunci emf-ul elementului va fi
De regulă, diferența dintre concentrațiile de substanțe pe diferiți electrozi ai elementelor de concentrație este mică, astfel încât potențialul de difuzie are o contribuție semnificativă la EMF total. Există mai multe relații pentru calcularea EMF a unei celule galvanice, ținând cont de potențialul de difuzie.
1. Dacă electrozii sunt reversibili în raport cu cationul, atunci forța electromotoare a celulei galvanice va fi egală cu:
![]() , (3.40)
, (3.40)
unde t este numărul transportului de anioni, n este totalul e numărul de particule de formulă care alcătuiesc un anumit electrolit (numărul total de ioni în care electrolitul se descompune), n + este numărul de particule de formulă de cationi (numărul de cationi în care electrolitul se disociază) care alcătuiesc acest electrolit .
Potenţialul de difuzie se calculează în acest caz prin relaţia: .

Unde de la 1 \u003d 0,68 M.
Întrebări pentru autocontrol
1. Câți electrozi pot fi incluși în elementul de concentrare?
2. Care este diferența dintre elementele de concentrare cu transport ionic și elementele de concentrare fără transport ionic?
3. Elementul de concentrare arată astfel:
K(Hg)|KCl(aq)|AgCl,Ag,AgCl|KCl(aq)|K(Hg)
Câte celule galvanice conține? Evaluați semnele elementelor care asigură funcționarea spontană a elementului. Cum se calculează emf-ul acestui element?
4. Elementul de concentrare arată astfel:
Hg, HgO|KOH(aq)|KOHaq)|HgO,Hg.
Ce tip este acest element de concentrare? Evaluați semnele electrozilor care asigură funcționarea spontană a elementului. Cum se calculează emf-ul acestui element?
5. Cum este relația EMF a unui element cu constantele de disociere ale electroliților CH 3 COOH și HCOOH?. Cărui tip de elemente galvanice aparține acest element și de ce?
H2,Pt |CH3COOH(aq)|HCOOH(aq)| Pt, H2,
LAB #9
Determinarea potențialelor de electrozi ale metalelor și EMFelemente galvanice.
eu.Secțiuni curs teoretic pentru repetari.
Apariția unui potențial salt la interfețele metal - apă, metal - soluție de sare metalică. Electrod standard de hidrogen. Conceptul de celule galvanice și procese care au loc pe electrozi. Potențialele electrozilor standard ale metalelor. Un număr de potențiale standard ale electrodului. Concluzii din poziția metalului într-un rând. Ecuația Nernst. Electrozi reversibili și ireversibili. Electrozi metalici Tip I și II, electrozi redox, electrozi de gaz. Electrozi de referință. Elemente chimice și galvanice de concentrație. Forta electromotoare(EMF) a celulelor galvanice. Procese care au loc pe electrozi în timpul funcționării unei celule galvanice.
3. Întrebări și exerciții.
1. Care este potențialul unui electrod de argint scufundat într-o soluție de sare de argint cu o concentrație
Cm = 10-2 mol/l?
2. Cum depinde valoarea potențialului electrodului de hidrogen de pH-ul mediului? Care este potențialul electrodului de hidrogen la pH = I; pH = 7, pH = 10?
3. Calculați potențialul unui electrod standard de argint în raport cu:
a) electrod de calomel saturat,
b) cupru saturat - electrod sulfat,
c) electrod de clorură de argint saturată?
4. Realizați diagrame ale celulelor galvanice în care au loc reacții:
a) 2Ag+ + Cu 0 → Ag 0 + Cu+2
b)CD 0 + CuSO4 → CdSO4 + Cu
5. Determinați valoarea EMF și indicați procesele care au loc pe electrozii din următoarele celule galvanice:
A)Zn / ZnSO4 //CDSO4/Cd
b)Rb/ Rb(NUh)2) //AgNO3/Ag
6. Calculați EMF al următoarei celule galvanice de concentrație:
A)Zn/ ZnCI2 // ZnCI2 / Zn
0,01 mol/l 1,0 mol/l
Care electrod este anodul și care este catodul?
3. partea experimentală
1. Determinarea valorii potenţialului electrod standard al zincului.
Asamblați electrodul de zinc (Zn/ ZnSO4 ) , prin scufundarea unei tije de zinc bine șlefuită într-o soluție de sare cu o concentrație de ioni de zinc de I mol/l.
Orez.eu. Schema de instalare pentru determinarea valorii potenţialului electrod al metalului.
1 - electrod investigat (zinc, cupru etc.)
2 - electrod de referință clorură de argint
3 - potențiometru.
4 - un pahar de soluție saturată de clorură de potasiu
În conformitate cu Fig.1, asamblați o celulă galvanică de la electrodul de zinc investigat (Zn/ ZnSO4 ) și electrod de referință cu clorură de argint saturată (KCl/ AgCl/ Ag) :
Notarea condiționată a acestei celule galvanice:
(-) Zn/ZnSO4//KCl/AgCl/Ag(+)
Pentru a face acest lucru, duzele electrozilor sunt scufundate într-un pahar cu o soluție de clorură de potasiu, iar electrozii înșiși sunt conectați la bornele corespunzătoare ale potențiometrului folosind fire de conectare.
Potențialul unui electrod de referință cu clorură de argint saturată în raport cu un electrod standard de hidrogen este de +0,201 V.
Exl. ser. ne.= +0,201V sau 201 mV.
În conformitate cu instrucțiunile privind procedura de măsurare, folosind un potențiometru adecvat, determinați EMF al celulei galvanice compuse și potențialul electrodului de zinc folosind un electrod saturat de clorură de argint.
Cunoscând valoarea potențialului electrodului de referință, calculați valoarea potențialului electrodului de zinc față de electrodul standard de hidrogen. Comparați valoarea rezultată cu valoarea tabelului:
E0 = - 0,76 B.
Notează valorile găsite:
Valoarea măsurată a E.D.S. celulă galvanică, compusă dintr-un electrod standard de zinc și un electrod de referință cu clorură de argint saturată:
E.D.S. (Zn/ ZnSO4 // KCl/ AgCl/ Ag) =
Valoarea experimentală a potențialului unui electrod standard de zinc în raport cu un electrod de referință cu clorură de argint saturată:
E ( ) prin saturaţie clor - argint .. =
Valoarea experimentală a potențialului unui electrod standard de zinc în raport cu un electrod standard de referință cu hidrogen:
E ( ) conform standardului hidrogen. =
Atenţie! Având în vedere toxicitatea ridicată a sărurilor metalelor grele, toate soluțiile uzate nu sunt scurse în chiuvetă, ci sunt predate asistentului de laborator pentru eliminarea ulterioară.
2. Determinarea valorii potenţialului electrod standard al cuprului.
Ca și în pasul I, asamblați electrodul de cupru prin scufundarea tijei de cupru decapate într-o soluție de sulfat de cupru IM.
Compuneți o celulă galvanică din electrodul de cupru investigat și un electrod de referință saturat de clorură de argint.
Determinați EMF al celulei galvanice. Dați o notație condiționată pentru această celulă galvanică.
Care este potențialul electrodului de cupru peste electrodul de clorură de argint saturată?
Calculați potențialul electrodului de cupru în raport cu electrodul standard de hidrogen și comparați-l cu valoarea din tabel a potențialului electrodului standard de cupru:
E0 = 0,34 B
Notează valorile găsite:
E.D.S. (CUu/ CuSO4 // KCl/ AgCl/ Ag) =
E() prin saturație clor - argint .. =
E() prin electrod standard de hidrogen =
3. Definiție chimic EMF element galvanic. (Element galvanic cupru-zinc).
Asamblați o celulă galvanică formată din zinc standard și electrozi standard de cupru (Fig. 2).
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Comparați valoarea obținută în experiment cu valoarea calculată (teoretică) Valoarea EMF pentru celulă galvanică cupru - zinc:
Teoria EMF. =E catod–E anod =
= E0(Cu+2/Cu0) - E0(Zn+2/Zn0) = 0,34 –(- 0,76) = 1,1B.
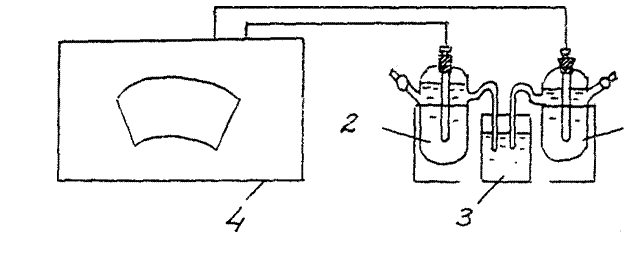 Fig. 2 Schema instalației pentru determinarea EMF a unei celule galvanice chimice:
Fig. 2 Schema instalației pentru determinarea EMF a unei celule galvanice chimice:
1 - electrod de cupru, 2 - electrod de zinc
3 - cheie electrolitică (un pahar cu o soluție de clorură de potasiu),
4 - potențiometru
Scrieți ecuațiile pentru procesele care au loc la catodul și anodul unei celule galvanice date în timpul funcționării acesteia.
4. Determinarea EMF a unei celule galvanice de concentrare.
Asamblați o celulă galvanică compusă dintr-un electrod de zinc standard (electrod de zinc scufundat într-o soluție de sare de zinc cu o concentrație de 1 mol/l) și un electrod de zinc scufundat într-o soluție de sare de zinc cu o concentrație de C = 10-2 mol/l (Fig. 3).
Zn/ ZnSO4 // Zn/ ZnSO4
Cm = 10-2 mol/l Cm = 10-2 mol/l
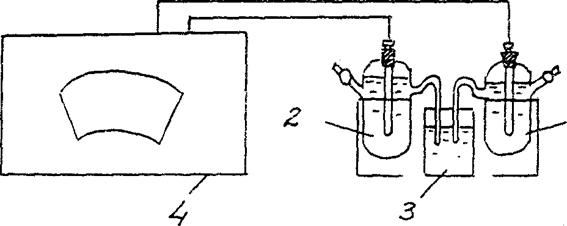
Fig.2 Schema de instalare pentru determinarea EMF a unei celule galvanice de concentrare:
1 - electrod de zinc în soluție de sare cu Cm = 10-2 mol/l ,
2 - electrod de zinc în soluție de sare cu Cm = 1 mol/l
3 - cheie electrolitică (soluție de clorură de potasiu),
4 - potențiometru
În conformitate cu instrucțiunile privind ordinea măsurătorilor folosind potențiometrul corespunzător, determinați EMF-ul acestei celule galvanice.
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Comparați valoarea obținută în experiment cu valoarea EMF calculată (teoretică) pentru o celulă galvanică de concentrație dată.