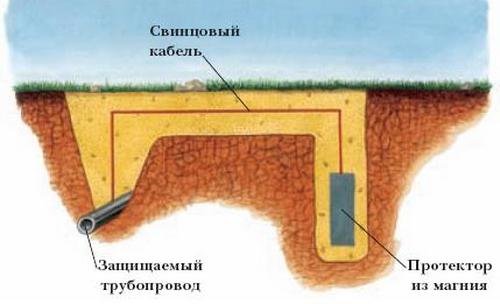
Schema de protectie impotriva coroziunii. Tranziție într-un număr de modele de la metal. Efectul negativ al coroziunii electrochimice
Protecție electrochimică – metoda eficienta protecția produselor finite împotriva coroziunii electrochimice. În unele cazuri, este imposibil să reînnoiți vopseaua sau materialul de ambalare de protecție, atunci este recomandabil să folosiți protecție electrochimică. Acoperirea unei conducte subterane sau a fundului unei nave maritime este foarte laborioasă și costisitoare de reînnoit, uneori este pur și simplu imposibil. Protecția electrochimică protejează în mod fiabil produsul împotriva coroziunii, prevenind distrugerea conductelor subterane, fundul navelor, diferite rezervoare etc.
Datorită importanței fundamentale a problemei în discuție, au început cercetările asupra unei noi generații de acoperiri ieftine rezistente la crom, care pot fi utilizate pe scară largă pentru protecția împotriva coroziunii la temperaturi înalte. Inovația soluției propuse se manifestă în acoperiri cu grosime redusă. Studiile de oxidare au fost efectuate la temperatură constantă, precum și în condiții de șoc termic.
Acoperirile cu crom au fost obținute prin pulverizare cu magnetron. S-a constatat că suprafețele supapelor modificatoare au devenit rezistente la oxidare. Conferința a avut loc pe Limba engleză cu traducerea simultană a întregului curs în poloneză.
Se aplică protectie electrochimicaîn cazurile în care potențialul de coroziune liberă este în regiunea dizolvării intense a metalului de bază sau suprapasivării. Acestea. când are loc o distrugere intensivă a structurii metalice.
Esența protecției electrochimice
a terminat produs metalic un curent continuu este conectat din exterior (sursa curent continuu sau protector). Curentul electric de pe suprafața produsului protejat creează polarizare catodică a electrozilor perechilor microgalvanice. Rezultatul este că zonele anodice de pe suprafața metalului devin catodice. Și ca urmare a expunerii la un mediu corosiv, nu metalul structurii este distrus, ci anodul.
La ea au participat peste 150 de pictori și oameni de știință din 19 țări și au participat peste 100 de instituții, dintre care peste 80% erau unități industriale. Pentru început, ne concentrăm în principal pe aspectele tehnice și financiare ale proiectului. La efectuarea protecției anticorozive probleme ecologice minimizarea contaminării în timpul sablarii și aplicării vopselei. În cazul lucrărilor anticorozive, acest lucru este foarte important datorită utilizării materialelor care sunt deosebit de periculoase pentru mediu.
În funcție de direcția (pozitivă sau negativă) potențialul metalului este deplasat, protecția electrochimică este împărțită în anod și catod.
Protecție catodică împotriva coroziunii
Protecția la coroziune electrochimică catodică este utilizată atunci când metalul protejat nu este predispus la pasivare. Acesta este unul dintre principalele tipuri de protecție a metalelor împotriva coroziunii. Esența protecției catodice este aplicarea unui curent extern de la polul negativ către produs, care polarizează secțiunile catodice ale elementelor de coroziune, apropiind valoarea potențialului de cele anodice. Polul pozitiv al sursei de curent este conectat la anod. În acest caz, coroziunea structurii protejate este aproape redusă la zero. Anodul este distrus treptat și trebuie înlocuit periodic.
Cu toate acestea, nu știm întotdeauna că realizarea de investiții poate fi o amenințare serioasă din cauza naturii înconjurătoare, în special din cauza păsărilor din jur. Structurile de inginerie sunt un loc atractiv pentru a crea noi habitate pentru păsări. Datorită faptului că cea mai bună perioadă pentru efectuarea lucrărilor anticorozive în domeniu „coincide” cu perioada pământului păsărilor, avem de-a face cu un „conflict de interese”. Foarte des, păsările care locuiesc în obiecte de inginerie aparțin unor specii protejate, ceea ce va duce la o problemă. Construcție de noi structuri de inginerie Construcția de noi structuri inginerești este o întreprindere care poate afecta semnificativ mediul înconjurător și, în conformitate cu Legea privind protecția mediului, într-un astfel de caz, este necesară obținerea așa-ziselor decizii privind condițiile de mediu.
Există mai multe opțiuni pentru protecția catodică: polarizare de la o sursă externă de curent electric; scăderea vitezei procesului catodic (de exemplu, dezaerarea electrolitului); contact cu un metal care are un potențial mai electronegativ pentru coroziune liberă într-un mediu dat (așa-numita protecție sacrificială).
Obligatia de a obtine aceasta decizie apartine investitorului si trebuie primita inainte de a lua alte decizii necesare investitiei. Păsările sunt un element important al mediului care ne înconjoară, ceea ce face necesară includerea acestuia într-o soluție ecologică. Articolul prezintă impactul apelor uzate menajere asupra inelelor de beton care au fost folosite la construirea stațiilor de pompare. Testele au fost efectuate pe mostre de beton și produse de coroziune din beton, care au fost colectate din puțuri de canalizare existente și funcționale.
Polarizarea de la o sursă externă de curent electric este folosită foarte des pentru a proteja structurile situate în sol, apă (fundurile navelor etc.). în afară de această specie protecția împotriva coroziunii este utilizată pentru zinc, staniu, aluminiu și aliajele acestuia, titan, cupru și aliajele acestuia, plumb, precum și oțeluri cu conținut ridicat de crom, carbon, aliaje (atât slab, cât și înalt aliate).
Problema degradării betonului a afectat mai multe puțuri ale întregului sistem de epurare a apelor uzate și în această ventilație defectuoasă. Autorii subliniază că lipsa unei ventilații adecvate ar putea fi un potențial motiv pentru care microclimatul este foarte agresiv față de beton. Studiul a folosit cercetări privind analiza chimică a betonului, precum și observații microscopice. În plus, au fost efectuate teste de rezistență a betonului pentru a determina efectele și amploarea modificărilor observate datorate coroziunii biologice în ceea ce privește modificările proprietăților mecanice.
O sursă de curent externă este stațiile de protecție catodică, care constau dintr-un redresor (convertor), o alimentare cu curent către structura protejată, electrozi de împământare anodici, un electrod de referință și un cablu anodic.
protectie catodica aplicat atât independent cât şi vedere suplimentară protectie anticoroziva.
Principalul criteriu după care se poate aprecia eficacitatea protecției catodice este potential protector. Potențialul de protecție este potențialul la care intră rata de coroziune a metalului anumite condiții mediu ia cea mai mică valoare (pe cât posibil).
Cuvinte cheie: bine, coroziune sulfat, bacterii sulfat. Acoperirile au fost caracterizate prin studiul morfologiei lor, compoziție chimică, grosimea și rugozitatea, precum și rezistența la coroziune a aliajului modificat la suprafață. A fost demonstrat efectul pozitiv al prezenței fluorului în stratul de oxid asupra rezistenței la coroziune a probelor de aliaj. Acoperirile au fost obținute prin depunere chimică de vapori cu un substrat de plasmă creat folosind unde electromagnetice de radiofrecvență.
Trebuie subliniat faptul că temperaturile mai ridicate ale motorului și utilizarea combustibililor alternativi accelerează semnificativ degradarea componentelor individuale ale motorului și în special supapele de evacuare a motorului. Este bine cunoscut faptul că poate fi susceptibil la pătrunderea clorurii. Procesul de clorinare face obiectul multor lucrări. Tema principală a acestor studii este: coroziunea armăturii din beton armat și efectul clorurilor, interacțiunea chimică dintre cloni și matricea de ciment. Modificare prin modificare prin modificare făcută de făcută de făcută de făcută de făcută de făcută de făcută de Cuvinte cheie: proprietăți fizice, beton, agregate de var, mediu clor, temperatura mediului ambiant.
Există dezavantaje în utilizarea protecției catodice. Una dintre ele este pericolul supraprotecție. Supraprotecția se observă cu o schimbare mare a potențialului obiectului protejat în direcția negativă. În același timp, iese în evidență. Ca urmare, distrugerea straturilor de protecție, fragilizarea metalului cu hidrogen, fisurarea coroziunii.
Se știe că betonul de ciment poate fi susceptibil la pătrunderea clorurilor. Descrierea acestui fenomen pentru betonul de ciment din minereu de pietriș nereactiv a făcut deja obiectul a numeroase lucrări. Lucrarea a ținut cont de avantajele metodei și de unele inconveniente care nu au fost încă eliminate. Efectele coroziunii de mai sus determină o scădere sistematică a capacității portante a elementelor din beton armat, astfel încât evaluarea coroziunii armăturii joacă un rol important. Odată ce pericolul de coroziune al barei de armare în proiectul testat a fost determinat, trebuie să luați o decizie imediată cu privire la remedierea specifică.
Protecția benzii de rulare (aplicarea benzii de rulare)
Un tip de protectie catodica este protectia catodica. Folosind protectia benzii de rulare la obiectul protejat este conectat un metal cu un potenţial mai electronegativ. În acest caz, nu structura este distrusă, ci banda de rulare. În timp, protectorul se corodează și trebuie înlocuit cu unul nou.
Pe lângă evaluarea vizuală, a fost cuantificat și progresul procesului de coroziune. Introducere Oțelul este un material structural important aplicabil în multe industrii. Cu toate acestea, în multe cazuri, este important să se protejeze în mod corespunzător suprafețele de oțel ale elementelor împotriva coroziunii. Una dintre modalitățile de a proteja oțelul împotriva coroziunii este utilizarea de acoperiri metalice cu natură anodă.
În cazul unei celule galvanice, această acoperire este un anod și suferă procese de oxidare distructivă; substratul din acest sistem este catodul și nu se corodează. Unele dintre cele mai bune acoperiri anodice includ acoperiri electrolitice de zinc cu metale din grupul fierului, adică nichel, cobalt și fier. Acoperirile de acest tip sunt produse electrolitic. În industrie, este adesea necesară mascarea unor părți ale produselor din oțel prin aplicarea unui strat de cupru pe suprafață. Acest strat este apoi îndepărtat cel mai adesea prin gravare în soluții de acid cromic, ceea ce creează un pericol imens pentru mediu.
Protecția benzii de rulare este eficientă în cazurile în care există o rezistență tranzitorie mică între protector și mediu.
Fiecare protector are propria sa rază de protecție, care este determinată de maxim distanta posibila, pe care protectorul poate fi îndepărtat fără a pierde efectul protector. Protecția de protecție este utilizată cel mai adesea atunci când este imposibil sau dificil și costisitor să aduceți curent în structură.
Lucrarea a analizat posibilitatea utilizării soluțiilor care conțin peroxid de hidrogen ca agent oxidant și compuși care conțin complecși de cupru. Pe baza analizei datelor fizico-chimice, acidul etilendiaminotetraacetic a fost ales ca complex potențial. Experimentele au arătat că soluțiile care conțin acest compus, precum și amoniac și peroxid de hidrogen, sunt ideale pentru gravarea cuprului de pe o suprafață de oțel. Rata de gravare a cuprului în cazul lor este de câteva ori mai mare decât în cazul soluțiilor de acid cromic, în timp ce acestea nu prezintă activitate corozivă față de oțel.
Protectoarele sunt folosite pentru a proteja structurile din medii neutre (apa de mare sau râu, aer, sol etc.).
Pentru fabricarea protectoarelor se folosesc urmatoarele metale: magneziu, zinc, fier, aluminiu. Metalele pure nu își îndeplinesc funcțiile de protecție în întregime, așa că sunt aliate suplimentar în timpul fabricării protectorilor.
Acest tratament este utilizat pentru a obține un strat de suprafață cu duritate ridicată, menținând în același timp un miez puternic. Cel mai adesea, aceste straturi sunt îndepărtate și apoi gravate în soluții de acid cromic, ceea ce provoacă probleme de mediu. Posibilitatea de a înlocui soluțiile de acid cromic cu probleme de oxigen. Rezultatele au fost completate cu studii ale microstructurii straturilor obținute și măsurători ale rugozității suprafeței. Rezultatele obținute au arătat că tipul procesului de nitrocarburare afectează microstructura și rezistența la coroziune a straturilor de suprafață rezultate.
Protecțiile de fier sunt fabricate din oteluri carbon sau fier pur.
Protectori de zinc
Protectorii de zinc contin aproximativ 0,001 - 0,005% plumb, cupru si fier, 0,1 - 0,5% aluminiu si 0,025 - 0,15% cadmiu. Proiectoarele din zinc sunt folosite pentru a proteja produsele împotriva coroziunii marine (în apă sărată). Dacă protectorul de zinc este folosit în apă ușor salină, proaspătă sau sol, acesta este rapid acoperit cu un strat gros de oxizi și hidroxizi.
Cuvinte cheie: straturi de nitrocen, aliaje de titan, rezistență la coroziune, soluție Ringer Introducere Bun proprietăți mecanice, rezistenta foarte buna la coroziune in multe medii agresive si biocompatibilitatea permit utilizarea titanului si aliajelor sale in numeroase aplicatii medicale.
Este fabricat în principal din instrumente medicale și implanturi osoase și cardiace, dar din cauza prezenței vanadiului în chimia sa, utilizarea sa continuă este pusă sub semnul întrebării. Vanadiul este recunoscut pe scară largă ca un element alergic și cancerigen care provoacă inflamație. S-a discutat metoda și tehnica protecției anticorozive a elementelor din oțel ale structurilor hidraulice operate în apă de mare, în special în zonele cu niveluri variabile de apă și stropire. Problema se bazează pe protecția unui morman de structuri hidraulice din oțel din portul de nord din Gdansk.
Protector de magneziu
Aliajele pentru fabricarea protectoarelor cu magneziu sunt aliate cu 2–5% zinc și 5–7% aluminiu. Cantitatea de cupru, plumb, fier, siliciu, nichel din aliaj nu trebuie să depășească zecimi și sutimi de procent.
Protectorul cu magneziu este utilizat în preparate ușor sărate, ape proaspete, soluri. Protectorul este utilizat în medii în care protectoarele din zinc și aluminiu sunt ineficiente. Un aspect important este ca protectoarele cu magneziu trebuie folosite intr-un mediu cu un pH de 9,5 - 10,5. Acest lucru se datorează vitezei mari de dizolvare a magneziului și formării de compuși puțin solubili pe suprafața sa.
Cuvinte cheie: structuri hidraulice marine, coroziune în zona diferitelor niveluri de apă și stropire, refacerea protecției anticorozive. Metodologie și specificații sunt descrise protecția anticorozivă a apei, în special în zonele cu apă mare și stropire. Portul este situat în Portul de Nord din Gdansk, Polonia. Cuvinte cheie: structuri offshore, coroziune de maree mare, reînnoire protecție împotriva coroziunii Introducere Piloții de oțel utilizați la construcția structurilor hidraulice în Portul de Nord din Gdansk sunt în funcțiune de o jumătate de secol.
Protectorul cu magneziu este periculos, deoarece. este cauza fragilizării prin hidrogen și a fisurării prin coroziune a structurilor.
Protectoare din aluminiu
Protectiile din aluminiu contin aditivi care previn formarea oxizilor de aluminiu. În astfel de protectori sunt introduse până la 8% zinc, până la 5% magneziu și zecimi până la sutimi de siliciu, cadmiu, indiu și taliu. Protecțiile din aluminiu sunt utilizate în raftul de coastă și în apa de mare curgătoare.
Trebuie subliniat faptul că protecția anticorozivă încă de la începutul acestui piloți a avut loc doar pe o parte a suprafeței sub forma unei acoperiri bituminoase din piloți de țevi de oțel. Se prezinta problema defectiunii protectiei anticorozive in domeniul vopsirii acoperirilor de protectie si decorative realizate pe elemente de otel ale barierelor protejate anterior prin zincare la cald. Folosind exemple din diferite locații, problema delaminării straturilor de vopsea se repetă, indiferent de tipul de vopsele folosite și de dezvoltarea semnificativă a coroziunii pe un substrat de zinc expus.
Protectie anodica anticoroziva
Protecția electrochimică a anodului este utilizată pentru structurile din titan, inox slab aliat, oțeluri carbon, aliaje feroase înalt aliate, metale pasivate diferite. Protecția anodului este utilizată în medii corozive foarte conductive.
S-au atras atenția și asupra cazurilor de încălcări referitoare la aceleași elemente, dar legate de lipsa unei supravegheri adecvate în realizarea lucrărilor anticoroziune. Cuvinte cheie: vopsea pulbere, vopsea pulbere poliester, obiect pod, bariera de protectie pod, vopsea vopsea pe otel zincat, protectie duplex, defecte de vopsea, erori de implementare elemente realizate pe baza zincarii la cald sunt prezentate in articol. Exemple luate din diferite acoperiri.
Recunoașterea problemelor de suprafață a vopselei. Atenție se aplică și altor cazuri de daune. Cuvinte cheie: vopsele pentru poduri, acoperiri din poliester, poduri, acoperiri, poduri, vopsele de acoperire pe otel galvanizat, acoperiri de protectie pe structuri de pod. Elementul principal al majorității structurilor de pod sunt diferite tipuri de bariere de protecție.
Cu protecția anodică, potențialul metalului protejat este mutat într-o latură mai pozitivă până când se atinge o stare pasivă stabilă a sistemului. Avantajele protecției electrochimice anodice nu sunt doar o încetinire foarte semnificativă a vitezei de coroziune, ci și faptul că produsele de coroziune nu intră în produs și în mediu.
Protecția anodului poate fi implementată în mai multe moduri: prin deplasarea potențialului către partea pozitivă folosind o sursă externă de curent electric sau prin introducerea de agenți oxidanți (sau elemente în aliaj) în mediul corosiv, care cresc eficiența procesului catodic asupra suprafata metalica.
Protecția anodului cu utilizarea oxidanților este similară prin mecanismul său de protecție cu polarizarea anodică.
Dacă se folosesc inhibitori de pasivizare cu proprietăți oxidante, atunci suprafața protejată trece într-o stare pasivă sub influența curentului care a apărut. Acestea includ dicromații, nitrații etc. Dar poluează destul de puternic mediul tehnologic din jur.
Odată cu introducerea de aditivi în aliaj (în principal dopaje cu un metal nobil), reacția de reducere a depolarizatorilor care are loc la catod are loc cu o supratensiune mai mică decât pe metalul protejat.
Dacă trecem prin structura protejată electricitate, potențialul se schimbă în direcția pozitivă.
O instalație de protecție electrochimică anodică împotriva coroziunii constă dintr-o sursă de curent externă, un electrod de referință, un catod și obiectul protejat în sine.
Pentru a afla dacă este posibilă aplicarea unei protecții electrochimice anodice pentru un anumit obiect, se iau curbe de polarizare anodică, cu ajutorul cărora se poate determina potențialul de coroziune al structurii studiate într-un anumit mediu coroziv, regiune de pasivitate stabilă și densitatea de curent în această regiune.
Pentru fabricarea catozilor se folosesc metale cu solubilitate scăzută, cum ar fi oțelurile inoxidabile cu aliaje ridicate, tantalul, nichelul, plumbul și platina.
Pentru ca protecția electrochimică anodică să fie eficientă într-un anumit mediu, este necesar să se utilizeze metale și aliaje ușor pasivate, electrodul de referință și catodul trebuie să fie întotdeauna în soluție, iar elementele de legătură trebuie să fie de înaltă calitate.
Pentru fiecare caz de protecție a anodului, aspectul catozilor este proiectat individual.
Pentru a protectie anodica a fost eficient pentru un anumit obiect, este necesar ca acesta să îndeplinească anumite cerințe:
Toate suduri trebuie să fie de înaltă calitate;
În mediul tehnologic, materialul din care este realizat obiectul protejat trebuie să treacă în stare pasivă;
Numărul de buzunare de aer și fante ar trebui să fie redus la minimum;
Nu trebuie să existe îmbinări nituite pe structură;
În dispozitivul de protejat, electrodul de referință și catodul trebuie să fie întotdeauna în soluție.
Pentru a implementa protecția anodului în industria chimică, se folosesc adesea schimbătoare de căldură și unități cilindrice.
Protecție electrochimică a anodului otel inoxidabil aplicabil pentru depozitele industriale de acid sulfuric, solutii pe baza de amoniac, ingrasaminte minerale, precum si tot felul de colectoare, rezervoare, rezervoare de masura.
Protecția anodului poate fi utilizată și pentru a preveni deteriorarea coroziunii în băile de nichelare chimică, schimbătoarele de căldură în producția de fibre artificiale și acid sulfuric.
Coroziunea este procesul de distrugere spontană a suprafeței materialelor datorită interacțiunii cu mediul. Cauza sa este instabilitatea termodinamică. elemente chimice la anumite substante. Formal, polimerii, lemnul, ceramica, cauciucul sunt supuși coroziunii, dar termenul „îmbătrânire” este folosit mai des pentru ele. Cele mai grave daune sunt cauzate de ruginirea metalelor, pentru protecția cărora se dezvoltă contramăsuri de înaltă tehnologie. Dar despre asta vom vorbi mai târziu. Oamenii de știință disting între coroziunea chimică și electrochimică a metalelor.
Coroziunea chimică
Apare de obicei atunci când o structură metalică este expusă la gaze uscate, lichide sau soluții care nu conduc curentul electric. Esența acestui tip de coroziune este interacțiunea directă a metalului cu un mediu agresiv. Elementele se corodează chimic în timpul tratamentului termic sau ca urmare a funcţionare pe termen lung la suficient temperaturi mari. Acest lucru se aplică palelor turbinelor cu gaz, fitingurilor pentru cuptoare de topire, părți ale motoarelor cu ardere internă și așa mai departe. Ca urmare, la suprafață se formează anumiți compuși: oxizi, nitruri, sulfuri.
Este o consecință a contactului unui metal cu un mediu lichid capabil să conducă un curent electric. Datorită oxidării, materialul suferă modificări structurale care duc la formarea ruginii (un produs insolubil), sau particulele de metal trec într-o soluție de ioni.
Coroziunea electrochimică: exemple
Se împarte în:
- Atmosferic, care apare atunci când pe suprafața metalului există o peliculă lichidă, în care gazele conținute în atmosferă (de exemplu, O 2, CO 2, SO 2) sunt capabile să se dizolve odată cu formarea de sisteme electrolitice.
- Lichid, care curge într-un mediu lichid conductor.
- Apele subterane, care curge sub influența apelor subterane.

Cauze
Deoarece de obicei orice metal care este utilizat pentru nevoi industriale nu este în mod ideal pur și conține incluziuni de altă natură, coroziunea electrochimică a metalelor are loc datorită formării unui număr mare de celule galvanice locale scurtcircuitate pe suprafața fierului.
Aspectul lor poate fi asociat nu numai cu prezența diferitelor impurități (în special metalice) (coroziunea de contact), ci și cu eterogenitatea suprafeței, defecte ale rețelei cristaline, deteriorări mecanice și altele asemenea.
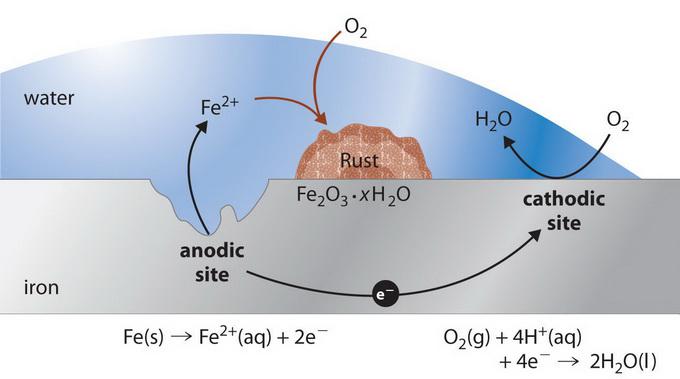
Mecanismul de interacțiune
Procesul de coroziune electrochimică depinde de compoziția chimică a materialelor și de caracteristicile mediului extern. Dacă așa-numitul metal tehnic este acoperit cu o peliculă umedă, atunci în fiecare dintre aceste microelemente galvanice, care se formează la suprafață, au loc două reacții independente. Componenta mai activă a perechii de coroziune donează electroni (de exemplu, zinc într-o pereche Zn-Fe) și trece în mediul lichid sub formă de ioni hidratați (adică corodează) conform următoarei reacții (proces anodic):
M + nH 2 O \u003d M z + * nH 2 O + ze.
Această parte a suprafeței este polul negativ al microelementului local, unde metalul se dizolvă electrochimic.
Pe partea mai puțin activă a suprafeței, care este polul pozitiv al microelementului (fier într-o pereche Zn-Fe), electronii sunt legați datorită reacției de reducere (proces catodic) conform schemei:
Astfel, prezența agenților oxidanți în pelicula de apă, care sunt capabili să lege electronii, face posibilă continuarea procesului anodic. În consecință, coroziunea electrochimică se poate dezvolta numai dacă procesele anodice și catodice au loc simultan. Datorită inhibării unuia dintre ele, rata de oxidare scade.

proces de polarizare
Ambele procese de mai sus provoacă polarizarea polilor respectivi (electrozi) microelementului. Care sunt caracteristicile aici? De obicei, coroziunea electrochimică a metalelor este încetinită mai semnificativ de polarizarea catodului. Prin urmare, va crește sub influența factorilor care împiedică această reacție și sunt însoțite de așa-numita depolarizare a electrodului pozitiv.
În multe procese de coroziune, depolarizarea catodică se realizează prin descărcarea ionilor de hidrogen sau prin reducerea moleculelor de apă și corespunde formulelor:
- Într-un mediu acid: 2H + + 2e \u003d H 2.
- În alcalin: 2H 2 O + 2e \u003d H 2 + 2OH -.
Interval de potențial
Potențialul care corespunde acestor procese, în funcție de natura mediului agresiv, poate varia de la -0,83 la 0 V. Pentru o soluție apoasă neutră la temperaturi apropiate de standard, este de aproximativ -0,41 V. Prin urmare, ionii de hidrogen, continut in apa si in sisteme apoase neutre, poate oxida doar metale cu potential mai mic de -0,41 V (situate in seria de tensiuni pana la cadmiu). Având în vedere că unele dintre elemente sunt protejate de o peliculă de oxid, numărul de metale supuse oxidării în medii neutre de către ionii de hidrogen este nesemnificativ.
Dacă pelicula umedă conține oxigen din aer dizolvat, atunci este capabilă, în funcție de natura mediului, de a lega electronii prin efectul depolarizării oxigenului. În acest caz, schema coroziunii electrochimice este următoarea:
- O 2 + 4e + 2H 2 O \u003d 4OH - sau
- O2 + 4e + 4H + = 2H2O.
Potențialele reacțiilor acestor electrozi la temperaturi apropiate de standard variază de la 0,4 V (alcalin) la 1,23 V (acid). În medii neutre, potențialul procesului de reducere a oxigenului în aceste condiții corespunde unei valori de 0,8 V. Aceasta înseamnă că oxigenul dizolvat este capabil să oxideze metale cu un potențial mai mic de 0,8 V (situat într-o serie de tensiuni până la argint). ).

Cei mai importanți oxidanți
Tipurile de coroziune electrochimică sunt caracterizate prin elemente oxidante, dintre care cei mai importanți sunt ionii de hidrogen și oxigenul. În același timp, o peliculă care conține oxigen dizolvat este mult mai corozivă decât umezeala, acolo unde nu există oxigen și care este capabilă să oxideze metalele exclusiv cu ioni de hidrogen, deoarece în acest din urmă caz numărul de tipuri de materiale capabile să se corodeze este mult mai putin.
De exemplu, impuritățile de carbon sunt prezente în oțel și fontă în principal sub formă de carbură de fier Fe 3 C. În acest caz, mecanismul de coroziune electrochimică cu depolarizarea hidrogenului pentru aceste metale este următorul:
- (-) Fe - 2e + nH20 = Fe2+ nH20 (se poate forma rugină);
- (+) 2H ++ 2e \u003d H 2 (în mediu acidificat);
- (+) 2H 2 O + 2e \u003d H 2 + 2OH - (în mediu neutru și alcalin).
Mecanismul de coroziune al fierului, care conține impurități de cupru, în cazul depolarizării oxigenului a catodului este descris de ecuațiile:
- (-) Fe-2e + nH20 = Fe2+ nH20;
- (+) 0,5O 2 + H 2 O + 2e \u003d 2OH - (în mediu acidificat);
- (+) 0,5O 2 + 2H + + 2e \u003d H 2 O (în mediu neutru și alcalin).
Coroziunea electrochimică are loc cu viteze diferite. Acest indicator depinde de:
- diferența de potențial dintre polii unui microelement galvanic;
- compoziția și proprietățile mediului electrolitic (pH, prezența inhibitorilor de coroziune și stimulanților);
- concentrația (viteza de alimentare) a agentului de oxidare;
- temperatura.
Metode de protecție
Protecția electrochimică a metalelor împotriva coroziunii se realizează în următoarele moduri:
- Crearea aliajelor anticorozive (aliare).
- Creșterea purității metalului individual.
- Aplicarea diferitelor straturi de protecție pe suprafață.
Aceste acoperiri, la rândul lor, sunt:
- Nemetalice (vopsele, lacuri, lubrifianți, emailuri).
- Metalice (acoperiri anodice și catodice).
- Format prin tratament special de suprafață (pasivarea fierului în acizi sulfuric sau azotic concentrat; fier, nichel, cobalt, magneziu în soluții alcaline; formarea unei pelicule de oxid, de exemplu, pe aluminiu).
Strat de protecție metalic
Cea mai interesantă și promițătoare este protecția electrochimică împotriva coroziunii de către un alt tip de metal. În funcție de natura efectului de protecție, acoperirile metalizate sunt împărțite în anodice și catodice. Să ne oprim asupra acestui punct mai detaliat.
Un înveliș anodic este un înveliș format dintr-un metal mai activ (mai puțin nobil) decât cel care este protejat. Adică, protecția este realizată de un element care se află într-o serie de tensiuni până la materialul de bază (de exemplu, acoperirea fierului cu zinc sau cadmiu). Odată cu distrugerea locală a stratului protector, stratul de metal mai puțin nobil se va coroda. În zona zgârieturilor și crăpăturilor, un localnic celulă galvanică, catodul în care se află metalul protejat, iar anodul este învelișul care este oxidat. Integritatea unui astfel de film de protecție nu contează. Cu toate acestea, cu cât este mai gros, cu atât se va dezvolta coroziunea electrochimică mai lentă, iar efectul benefic va dura mai mult.
Un strat catodic este o acoperire cu un metal cu un potențial ridicat, care, într-o serie de tensiuni, este după materialul protejat (de exemplu, pulverizare oțeluri slab aliate cupru, cositor, nichel, argint). Acoperirea trebuie să fie continuă, deoarece dacă este deteriorată, se formează celule galvanice locale, în care metalul de bază va fi anodul, iar stratul protector va fi catodul.

Cum să protejați metalul de oxidare
Protecția împotriva coroziunii electrochimice este împărțită în două tipuri: sacrificială și catodică. Învelișul de protecție este similar cu stratul anod. O placă mare dintr-un aliaj mai activ este atașată materialului de protejat. Se formează o celulă galvanică, în care metalul de bază servește ca catod, iar protectorul servește ca anod (se corodează). De obicei, pentru acest tip de protecție se folosesc aliaje pe bază de zinc, aluminiu sau magneziu. Protectorul se dizolvă treptat, așa că trebuie înlocuit periodic.
O mulțime de probleme în utilitățile publice și în industrie în ansamblu sunt cauzate de coroziunea electrochimică a conductelor. În lupta împotriva acesteia, metoda polarizării catodice este cea mai potrivită. Pentru a face acest lucru, o structură metalică, care este protejată de procesele de oxidare distructivă, este conectată la polul negativ al unei surse externe de curent continuu (aceasta devine apoi un catod, în timp ce rata de degajare a hidrogenului crește, iar viteza de coroziune scade) și un metal de valoare mică este atașat de polul pozitiv.
Metodele de protecție electrochimică sunt eficiente într-un mediu conductiv (apa de mare este un prim exemplu). Prin urmare, protectorii sunt adesea folosiți pentru a proteja părțile subacvatice ale navelor marine.
Prelucrarea mediului agresiv
Această metodă este eficientă atunci când coroziunea electrochimică a fierului are loc într-un volum mic de lichid conductor. În acest caz, există două moduri de a face față proceselor distructive:
- Eliminarea oxigenului din lichid (dezaerare) ca urmare a purjării cu un gaz inert.
- Introducerea de inhibitori în mediu - așa-numiții inhibitori de coroziune. De exemplu, dacă suprafața este distrusă ca urmare a oxidării cu oxigen, se adaugă substanțe organice ale căror molecule conțin anumiți aminoacizi (imino-, tio- și alte grupe). Ele sunt bine adsorbite pe suprafața metalului și reduc semnificativ rata reacțiilor electrochimice care conduc la distrugerea stratului de contact cu suprafața.
Concluzie
Desigur, coroziunea chimică și electrochimică aduce daune semnificative atât în industrie, cât și în viața de zi cu zi. Dacă metalul nu s-ar coroda, durata de viață a multor articole, piese, ansambluri, mecanisme ar crește semnificativ. Acum, oamenii de știință dezvoltă în mod activ materiale alternative care pot înlocui metalul, care nu sunt inferioare în ceea ce privește performanța, dar este probabil imposibil să se abandoneze complet utilizarea pe termen scurt. În acest caz, metodele avansate de protejare a suprafețelor metalice împotriva coroziunii vin în prim-plan.