Formula reacției chimice Eds. Celulele galvanice și fem
3.5.1 Potențiale electrice la limitele de fază
Când un conductor de primul fel (electrod) vine în contact cu un solvent polar (apă) sau cu o soluție de electrolit la interfața electrod-lichid, așa-numitul dublu strat electric (DES). Ca exemplu, luați în considerare un electrod de cupru scufundat în apă sau într-o soluție de sulfat de cupru.
Când un electrod de cupru este scufundat în apă, o parte din ionii de cupru situati la nodurile rețelei cristaline, ca urmare a interacțiunii cu dipolii de apă, vor intra în soluție. Sarcina negativă care apare în același timp pe electrod va menține ionii care au trecut în soluție în spațiul apropiat de electrod - se formează un strat electric dublu (Fig. 3.12a; pentru modele ale structurii DEL, vezi Secțiunea 4.2). .4). Sarcina negativă de pe electrod va împiedica tranziția ulterioară a ionilor de cupru în soluție, iar după un timp se va stabili un echilibru dinamic, care poate fi caracterizat fără ambiguitate prin potențialul câmpului electric DEL Φ, în funcție de sarcina de pe electrod. electrod, sau printr-o concentrație de echilibru a ionilor în stratul apropiat de electrod C o . Când un electrod de cupru este scufundat într-o soluție de CuSO4 care conține ioni de cupru la o concentrație de C, sunt posibile trei cazuri:
Orez. 3.12 Schema unui dublu strat electric la interfața electrod-soluție
1. C< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в Strat de suprafață o soluție de cationi va fi mai mult decât anioni (Fig. 3.9a).
2. C > C o . Deoarece concentrația ionilor de cupru în stratul de suprafață este mai mare decât cea de echilibru, va începe trecerea ionilor de la soluție la electrod; pe electrod ia naştere o sarcină pozitivă şi anionii SO 4 2- predomină în stratul de suprafaţă (Fig. 3.12b).
3. C \u003d C o. Deoarece concentrația ionilor de cupru din stratul de suprafață este egală cu cea de echilibru (astfel de soluții se numesc zero), nu apare nicio sarcină pe electrod și nu se formează un strat electric dublu.
3.5.2 Celulă galvanică. EMF a unei celule galvanice
Luați în considerare cea mai simplă celulă galvanică Daniel-Jacobi, constând din două semicelule - plăci de zinc și cupru, plasate în soluții de sulfați de zinc și, respectiv, de cupru, care sunt interconectate prin intermediul unei chei electrolitice - de exemplu, o bandă de hârtie umezită. cu o soluție de electrolit. Schematic, acest element este reprezentat după cum urmează:
Zn / Zn2+ // Cu2+ / Cu
Pe suprafața fiecăruia dintre electrozi există un echilibru dinamic al tranziției ionilor metalici de la electrod la soluție și invers, caracterizat prin potențialul EDL (sarcina electrodului q). Dacă conectați electrozi de cupru și zinc cu un conductor metalic, va avea loc imediat o redistribuire a sarcinilor - electronii vor începe să se miște de la un electrod cu o sarcină mai negativă (în cazul nostru, zinc) la un electrod cu o sarcină mai pozitivă (cuprul). ), adică în conductor va curge un curent electric. O modificare a valorii de încărcare a fiecărui electrozi deranjează echilibrul - pe electrodul de zinc va începe procesul de tranziție a ionilor de la electrod la soluție (oxidarea metalului), pe electrodul de cupru - de la soluție la electrod (reducere de metal); în acest caz, cursul procesului pe un electrod determină apariția simultană a procesului opus pe celălalt:
Zn o ––> Zn 2+ + 2е -
Cu 2+ + 2e - ––> Cu o
Se numește electrodul pe care are loc procesul de oxidare în timpul funcționării unei celule galvanice anod, electrodul pe care are loc procesul de recuperare - catod. Cu o reprezentare schematică celule galvanice anodul este scris în stânga, catodul este scris în dreapta (electrodul standard de hidrogen este întotdeauna scris în stânga). Procesul redox total care are loc într-o celulă galvanică este exprimat prin următoarea ecuație:
Cu 2+ + Zn o ––> Cu o + Zn 2+
Astfel, o celulă galvanică poate fi definită ca un dispozitiv pentru transformarea energiei chimice a unei reacții redox în energie electrică datorită separării spațiale a proceselor de oxidare și reducere. Munca pe care o poate face un curent electric generat de o celulă galvanică este determinată de diferența de potențiale electrice dintre electrozi (denumită de obicei pur și simplu diferența de potențial) ΔΦ și cantitatea de electricitate trecută prin circuitul q:
Lucrarea curentului unei celule galvanice (și, în consecință, diferența de potențial) va fi maximă în timpul funcționării sale reversibile, când procesele de pe electrozi decurg infinit lent și puterea curentului în circuit este infinit de mică. Diferența maximă de potențial care apare în timpul funcționării reversibile a unei celule galvanice este forta electromotoare(EMF) a unei celule galvanice .
3.5.3 Potențialul electrodului. Ecuația Nernst
EMF a unei celule galvanice E este convenabil reprezentată ca o diferență a unor cantități care caracterizează fiecare dintre electrozi - potențialele electrodului; cu toate acestea, pentru a determina cu precizie aceste valori, este necesar un punct de referință - un potențial de electrod cunoscut cu precizie al oricărui electrod. Potențialul electrodului ε e se numește element emf, compus din acest electrod și un electrod standard de hidrogen (vezi mai jos), al cărui potențial electrod se presupune a fi zero. În acest caz, semnul potențialului electrodului este considerat pozitiv dacă electrodul testat într-o astfel de celulă galvanică este catodul și negativ dacă electrodul testat este anodul. Trebuie remarcat că uneori potențialul electrodului este definit ca „diferența de potențial la interfața electrod-soluție”, adică. consideră-l identic cu potențialul DEL, care nu este în întregime corect (deși aceste cantități sunt interdependente).
Valoare potenţialul electrodului a electrodului metalic depinde de temperatura și activitatea (concentrația) ionului metalic din soluția în care este scufundat electrodul; matematic se exprimă această dependenţă Ecuația Nernst (aici F este constanta Faraday, z este sarcina ionică):
În ecuația Nernst ε ° – potenţial standard al electrodului , egal cu potenţialul electrodului la activitatea ionului metalic, egal cu 1 mol/l. Potențialele electrozilor standard ale electrozilor în soluții apoase sunt o serie de tensiuni. Valoarea lui ε ° este o măsură a capacității formei oxidate a unui element sau ion de a accepta electroni, i.e. restabili. Uneori, diferența dintre concentrația și activitatea unui ion într-o soluție este neglijată, iar concentrația ionilor în soluție apare sub semnul logaritmului în ecuația Nernst. Mărimea potențialului electrodului determină direcția procesului care are loc pe electrod în timpul funcționării celulei galvanice. Pe o jumătate de celulă, al cărei potențial electrod are o valoare mai mare (uneori se spune - mai pozitivă), procesul de recuperare va continua, adică. acest electrod va fi catodul.
Luați în considerare calculul EMF al elementului Daniel - Jacobi folosind ecuația Nernst. EMF este întotdeauna o valoare pozitivă și este egală cu diferența dintre potențialele electrodului catodului și anodului:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
După cum se poate observa din ecuația (III.45), EMF-ul elementului Daniel - Jacobi depinde de concentrația (mai precis, activitatea) ionilor de cupru și zinc; la concentrațiile lor egale, EMF-ul elementului va fi egal cu diferența de potențiale standard ale electrodului:
![]() (III.46)
(III.46)
Analizând ecuația (III.45), se poate determina limita de lucru ireversibilă a unei celule galvanice. Deoarece zincul este oxidat la anod, concentrația ionilor de zinc crește constant în timpul funcționării ireversibile a celulei galvanice; concentrația ionilor de cupru, dimpotrivă, scade. Raportul dintre concentrațiile ionilor de cupru și zinc este în scădere constantă, iar logaritmul acestui raport la [Сu 2+ ]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Ecuația (III.45) explică și performanța așa-numitului. lanțuri de concentrare – celule galvanice formate din doi electrozi metalici identici scufundati in solutii sarate ale acestui metal cu activitati diferite a 1 > a 2 . În acest caz, catodul va fi un electrod cu o concentrație mai mare, deoarece potențialele electrozilor standard ale ambilor electrozi sunt egale; pentru EMF al unei celule galvanice de concentrație, obținem:
![]() (III.47)
(III.47)
Singurul rezultat al muncii elementului de concentrare este transferul ionilor metalici dintr-o soluție mai concentrată într-una mai puțin concentrată. Astfel, lucrul curentului electric într-o celulă galvanică de concentrare este opera unui proces de difuzie, care se desfășoară reversibil ca urmare a separării sale spațiale în două procese reversibile de electrozi opuse în direcție.
Copyright © S. I. Levchenkov, 1996 - 2005.
TERMODINAMICĂ
CELULA GALVANICĂ
la lucrarea de laborator nr 18
Samara 2010
Alcătuit de: Yu.P. Kovriga, B.M. STIFATOV, V.V. SLEPUSHKIN
Termodinamica unei celule galvanice: Metodă. decret. la laborator. muncă. /Eu insumi. stat tehnologie. un-t; Comp.: Yu.P.Kovriga, B.M. Stifatov, V.V. Slepushkin.- Samara, 2010. 16 p.
Sunt luate în considerare bazele teoretice și determinarea experimentală a caracteristicilor termodinamice ale reacțiilor electrochimice care apar în timpul funcționării unei celule galvanice.
Instrucțiunile sunt destinate studenților la chimie și alte specialități care studiază electrochimia într-un curs de chimie fizică.
Tab. 1. Ill. 2. Bibliografie: 6 titluri.
Publicat prin hotărâre a consiliului editorial și editorial al SamSTU.
Obiectiv– studiul teoriei și practicii calculelor termodinamice pentru reacțiile electrochimice care apar în timpul funcționării celulelor galvanice reversibile pe baza rezultatelor măsurării forței electromotoare.
1. INTRODUCERE TEORETICĂ
Caracteristici termodinamice
Celulă galvanică
celulă galvanică numit sistem de doi electrozi, în care energia unei reacții chimice este transformată spontan în energie electrică. Este format din două electrozi (semi-celule), scufundat în soluții de electroliți. Între aceste soluții, contactul se stabilește folosind un despărțitor poros sau punte electrolitică, adică un tub sifon umplut cu o soluție saturată de KCl sau NH4NO3. O partiție poroasă sau o punte electrolitică asigură conductivitate electrică între soluțiile de electrozi, dar împiedică difuzia lor reciprocă. În unele cazuri, ambii electrozi sunt scufundați în aceeași soluție.
Dacă conectați electrozii cu un conductor metalic, pe unul dintre ei are loc o reacție oxidare,și este încărcat negativ și se numește anod, iar pe de altă parte - reacția recuperare, este încărcat pozitiv și se numește catod.
Teodinamica este o ramură a științei care studiază transformările reciproce ale căldurii în muncă și invers. Termodinamica chimica este o ramură a chimiei fizice care studiază procesele fizice și chimice însoțite de eliberarea sau absorbția de energie. O celulă galvanică aparține sistemelor fizico-chimice. Prin urmare, funcționarea unei celule galvanice, ca orice alt sistem termodinamic, este caracterizată de valorile termodinamice ale schimbării energiei Gibbs Δ g, entalpia Δ H, entropia Δ S si constanta de echilibru K a pentru reacţiile electrochimice care apar în timpul funcţionării celulelor galvanice reversibile.
Cu cât rezistența conductorului care leagă electrozii este mai mare, cu atât reacțiile la electrozi au loc mai încet. În principiu, este posibil să se închidă electrozii cu un conductor de rezistență infinită, iar reacția va decurge infinit lent, adică. reversibil.
Când o reacție chimică se desfășoară izotermic și reversibil, munca este cea mai mare: în acest caz, cea mai mare parte a căldurii de reacție este transformată în lucru electric. Diferența de potențial dintre electrozii măsurați în acest caz se numește forta electromotoare(pe scurt - EMF) a unei celule galvanice.
munca Electrica celula galvanica ( DAR) este egal cu EMF ( E) înmulțit cu taxa transferată ( q). Dacă în timpul reacţiei are loc reducerea sau oxidarea z echivalenții molar ai unei substanțe, atunci conform legii lui Faraday vor fi transferați q = zF coulombii (A . c) energie electrică, unde F- Numărul Faraday (96500 C/mol). Prin urmare, munca maximă ( A" max) prin transfer zF coulombii de electricitate prin diferența de potențial ( ∆φ = E) electrozii unei celule galvanice este egal cu
unde E este EMF al celulei galvanice, V; E 0 - emf standard o celulă galvanică cu activități individuale ale participanților la reacție; a(OX 1),a(Red 1),a(OX 2),a(Red 2) - concentrații active (activități) ale perechilor conjugate redox OX 1 / Red 1 și OX 2 /Red 2 formate ca urmare a reacție în soluție.
Măsurarea EMF a unei celule galvanice Eși modificările acesteia cu temperatura dE/dT vă permite să calculați cele mai importante mărimi termodinamice pentru reacția chimică redox care are loc în element.
Din ecuația Gibbs-Helmholtz
Ecuația (8) implică faptul că
Valoare d E/ d T este numit coeficientul de temperatură al forței electromotoare a unei celule galvanice.Coeficient de temperatură d E/ d T poate fi determinat din dependența forței electromotoare a unei celule galvanice de temperatură. Valoare d E/ d T poate fi pozitiv, negativ sau zero, în funcție de natura celulei.
La d E/ d T \u003d 0, adică atunci când EMF-ul elementului nu depinde de temperatură, E \u003d - ΔU/zF.În acest caz, lucrul elementului are loc în întregime datorită scăderii energiei interne a sistemului fără eliberarea sau absorbția de căldură.
La d E/ d T<0, т.е. когда ЭДС элемента уменьшается с повышением температуры, работа элемента совершается тоже за счет убыли внутренней энергии системы, но сопровождается выделением теплоты. В этом случае работа элемента и расход энергии на нагревание окружающей среды осуществляется за счет убыли внутренней энергии системы.
La d E/ d T >0, adică când EMF al unui element crește odată cu creșterea temperaturii, elementul funcționează prin absorbția căldurii. În acest caz, raportul dintre EȘi T . d E/ d T determină natura muncii și direcția schimbării energiei interne a sistemului:
1) când E = T d E/ d T, energia internă a unui element de lucru la o temperatură constantă nu se modifică: ΔU= 0. Lucrarea elementului se realizează în întregime datorită căldurii absorbite din mediul înconjurător;
2) când E > T . d E/ d T , energia internă a elementului scade în timpul lucrului său, ΔU <0, и работа совершается частично за счет убыли внутренней энергий и частично за счет поглощения теплоты извне;
3) când E< Т . d E/ d T energia internă a elementului în timpul funcționării sale crește, ΔU> 0, adică elementul absoarbe căldură într-o cantitate care depășește munca efectuată de acesta. Excesul de căldură absorbită este folosit pentru a crește energia internă a sistemului. Aici munca este făcută, iar procesul decurge spontan, în ciuda naturii endoterme a reacției chimice.
Valoare d E/ d T poate fi calculat aproximativ prin formula
| | (11) |
Unde E 1Și E 2 -– Valorile EMF ale unei celule galvanice la temperaturi T 1Și T 2. Calculul va fi mai precis, cu atât mai puțin diferă unul de celălalt. T 1Și T 2, deoarece dependenta E \u003d f (T) aproape de liniar numai pentru intervale mici de temperatură.
Constanta de echilibru a unei reacții chimice K a poate fi calculată din ecuațiile izotermei unei reacții chimice în condiții standard. De Ecuația izotermei van't Hoff valoarea muncii maxime utile pentru o reacție chimică se calculează ca
| , | (14) |
Unde E 0 \u003d E 0 2 - E 0 1- EMF standard, egal cu diferența de potențiale standard ale electrodului.
Calculul constantei de echilibru se efectuează folosind date de referință privind valorile potențialelor standard ale electrozilor electrozilor corespunzători, prezentate în cartea de referință a cantităților fizico-chimice.
Măsurarea EMF a celulelor galvanice
Modificarea valorilor termodinamice ale reacțiilor electrochimice poate fi determinată foarte precis prin măsurarea forțelor electromotoare ale celulelor galvanice în care au loc aceste reacții. Precizia acestei metode se explică prin precizia ridicată a măsurătorilor EMF-ului unei celule galvanice cu ajutorul unui potențiometru de tip R-307, care funcționează conform metoda Poggendorf compensatorie. Oferă măsurarea EMF a unei celule galvanice în condițiile în care un curent infinitezimal trece prin celulă, ceea ce corespunde unei celule galvanice reversibile. Când se măsoară EMF folosind un voltmetru obișnuit, curentul generat de element trece prin electrozi, ceea ce duce la o schimbare a potențialelor electrodului de la valorile de echilibru cărora le corespunde ecuația Nernst.
Măsurarea EMF a unui element în condiții de echilibru, reacția redox având loc pe electrozii săi, se realizează prin utilizarea metoda de compensare Poggendorf, implementat folosind circuitul electric prezentat în fig. 2.
normal) celula Weston
Θ Сd(Hg) | CdS048/3H2O(sat.), Hg2S04 (t) | hg,
având o valoare EMF constantă şi reproductibilă. Aici anodul este amalgam de cadmiu, iar catodul este mercur metalic. Când circuitul este închis, au loc semireacții:
La 25 0 C, EMF al elementului Weston este 1,0183 V.
Măsurarea începe cu gradarea scării reocordului, care este o riglă gradată în mm cu un fir de nicrom de secțiune transversală constantă întins peste ea.
O baterie este conectată la circuit, furnizând un curent electric constant în circuit. Comutatorul „P” introduce un element standard în circuit și deplasează contactul mobil „C” de-a lungul firului reocordului. Periodic, prin apăsarea scurtă a tastei „K”, aceștia închid circuitul, verificând prezența curentului în circuit folosind un galvanometru, adică. compensare. La momentul compensarii, segmentul AC firul reocord corespunde rezistenței, al cărei produs și curentul bateriei este egal cu tensiunea care compensează EMF-ul elementului Weston. Cunoscând lungimea segmentului AC(de exemplu, l N), pe care căderea de tensiune a bateriei compensează EMF (E N) al celulei Weston, puteți calcula căderea de tensiune pe 1 mm reocordă ca E N /l N, V/mm.
Apoi, celula galvanică investigată cu o valoare EMF necunoscută este inclusă în circuit E Xși repetați operațiile de măsurare de mai sus, măsurând în momentul compensării lungimea segmentului de sârmă al reocordului l X. Din relatie
găsi necunoscutul Valoarea EMF.
Pentru a măsura cu precizie EMF-ul unei celule galvanice, utilizați potențiometru de înaltă rezistență R-307, al cărui panou superior este prezentat în Fig. 2.
Funcționarea aparatului se bazează pe principiul compensării, când în momentul măsurării EMF, curentul din circuitul celulei galvanice investigate are o valoare infinitezimală (zero la instrumentul nul (galvanometru)). La asamblarea circuitului de măsurare se conectează o baterie sau un redresor de 2,5 - 3,5 V la bornele „B”, un element Weston normal la bornele „NE”, iar celula galvanică investigată la bornele X 1 sau X 2. În acest caz, în toate cazurile, țineți cont de semnele de polaritate „+” și „-” de pe tabloul de bord și sursa conectată curent continuu. Galvanometrul este conectat la bornele corespunzătoare „G”. După aceea, potențiometrul este conectat printr-un redresor la rețeaua electrică.
Lucrarea începe cu calibrarea dispozitivului conform elementului standard Weston.
Comutatorul pentru tipul de lucru (3) este setat în poziția „NE”. Butoanele de rezistență (2) produc compensare „aspră” și apoi „fină” pentru EMF-ul elementului Weston, închizând periodic circuitul de măsurare cu butonul de 430 kOhm, apoi cu butonul „0”. Setarea corectă corespunde absenței curentului în circuitul galvanometru în timpul unui scurtcircuit (1-2 s) cu butonul său „0”.
Ca urmare, se furnizează un curent de lucru la butoanele de măsurare (5) ale potențiometrului de la redresor, care furnizează o tensiune egală cu EMF-ul elementului Weston, adică. 1,0186 V.
|
||||
| Orez. Fig. 2. Vedere a panoului superior al potențiometrului R-308: 1 - mufe „X 1” și „X 2” pentru conectarea electrozilor celulei galvanice; 2 - butoane de rezistenta "grosiera" "fina" pentru calibrarea potentiometrului; 3 - comutator pentru funcționarea potențiometrului la normal (NE) sau a elementului studiat „NE” sau „X 2”; 4 - prize „G” pentru conectarea unui galvanometru; 5 - butoane de rezistență (decenii) cu ferestre pentru măsurarea valorilor numerice ale EMF; 6 - prize „X 1” pentru conectarea unui element Weston normal; 7 - prizele „B” și pentru conectarea bateriei; 8 - element normal al lui Weston; 9 - redresor curent alternativ; 10 - galvanometru; 11 - ferestre de valori digitale ale EMF; 12 - butoane pentru închiderea circuitului de măsurare „430” și „0” și oprirea vibrațiilor săgeții galvanometrului „Usp”. |
Se numesc pixuri de măsurare decenii, deoarece fiecare dintre ele are 10 poziții. Fiecare dintre pozițiile primului deceniu (I) oferă rezistență, care, înmulțită cu curentul de funcționare, dă o valoare de compensare EMF de 0,1 V. Prin urmare, butonul (I) permite compensarea de la 0,1 la 1 V. Decada (II) vă permite să compensați de la 0,01 la 0,1 V etc. Prin urmare, valoarea digitală măsurată a EMF indicată în casetă pentru prima decadă ar trebui înmulțită cu 0,1, pentru a doua - cu 0,01 etc.
După calibrarea dispozitivului, întrerupătorul pentru tipul de lucru (2) este pus în poziţia X 1 sau X 2 (în funcţie de borna la care este conectată celula galvanică investigată) iar mânerele deceniilor de întrerupătoare I - VI echilibrează măsurat EMF cu o creștere consistentă a sensibilității, realizând absența curentului în circuit cu un scurtcircuit cu butonul „0”.
Valoarea valorii măsurate este numărată de numerele din casetele cu multiplicatorii corespunzători.
2. EXPERIMENTAL
Plan de muncă
1. Familiarizați-vă cu fundamentele teoretice ale termodinamicii unei celule galvanice.
2. Colectați celula galvanică investigată și puneți-o în prizele din capacul termostatului.
3. Conectați celula galvanică investigată cu fire de conectare la potențiometrul R-308.
4. Calibrați potențiometrul P-308 folosind un element Weston standard.
5. Măsurați EMF-ul celulei galvanice studiate în intervalul de temperatură specificat în sarcină, modificând temperatura termostatului.
7. Întocmește un raport asupra muncii efectuate și trage o concluzie despre corespondența valorilor valorilor calculate cu procesele care au loc în celula galvanică.
8. Verificați rezultatele muncii profesorului și puneți în ordine locul de muncă.
Instrumente și reactivi
1. Electrozi de platină cu fire de legătură (2 buc.).
2. Eprubete din sticlă cu gură largă (2 buc.).
3. Termostat.
4. Potențiometru R-308.
5. Redresor de curent alternativ.
6. Element Weston standard.
7. Solutii pentru prepararea unei celule galvanice.
8. Punte de sare din tub de sticlă.
9. Soluție saturată de KCl.
10. Hârtie de filtru pentru realizarea dopurilor de punte de sare.
Progresul lucrărilor
1. Alcătuiți celula galvanică specificată în sarcina de lucru. Pentru a face acest lucru, turnați soluțiile adecvate de o anumită concentrație în două eprubete mari cu gura largă.
2. Scufundați electrozii de platină în electroliții corespunzători.
3. Așezați eprubetele cu soluții în fantele din capacul termostatului.
4. Faceți o punte de sare umplând un tub de sticlă în formă de U cu o soluție saturată de KCl și astupați găurile astfel încât să nu existe bule de aer în puntea de sare.
5. Conectați tuburile cu o punte de sare.
6. Calibrați potențiometrul P-308 folosind elementul Weston.
7. Măsurați EMF al celulei galvanice asamblate în domeniul de temperatură specificat în atribuirea lucrării prin creșterea temperaturii apei din termostat. Temperatura din termostat este măsurată cu precizie de un termometru separat. Înregistrați valoarea EMF măsurată și temperatura corespunzătoare.
9. Determinați potențialele standard ale electrozilor celulei galvanice investigate din cartea de referință și întocmiți circuitul acesteia. Scrieți o ecuație pentru semireacțiile care au loc pe electrozi și o ecuație generală pentru o reacție redox. Calculați valoarea standard a EMF a elementului și găsiți constanta de echilibru K a conform formulei (14).
10. Introduceți rezultatele experimentului și valorile calculate în tabel.
întrebări de testare
1. Relația dintre energia Gibbs a unei reacții electrochimice și EMF a unei celule galvanice.
2. Derivarea formulelor pentru calcularea ΔG, ΔH, ΔS reacție electrochimică.
3. Dependența EMF a celulelor galvanice de temperatură.
4. Conceptul de „coeficient de temperatură al EMF” și metode de determinare a acestuia.
5. Relația dintre semnul coeficientului de temperatură și natura reacției electrochimice.
6. Principiul de funcționare al potențiometrului R-307.
7. Metodologia de realizare a muncii.
REFERINȚE
1. Semchenko D.P., Stromberg A.G.. Chimie fizică.- M.: Vyssh. şcoală, 2000. - 512 p.
2. Atelier de chimie fizică / Ed. I.V. Kudriashov. - M.: Mai sus. şcoală., 1999.- 400 p.
3. Atelier de chimie fizică / Ed. V.V. Budanov,
N.K. Vorobyov. - M.: Chimie, 2000. - 387 p.
4. Lucrări practice de chimie fizică: Proc. indemnizatie pentru universități / Ed. K.P. Mișcenko, A.A. Ravdel, A.M. Ponomareva.- Sankt Petersburg, editura „Profesia”, 2002. - 384 p.
5. Scurtă carte de referință a mărimilor fizice și chimice / Ed. A.A. Ravdel, A. M. Ponomareva. - M.: Chimie, 2002. - 327 p.
6. Kiseleva E. V., Karetnikov G. S., Kudryashov I. V. Culegere de exemple și probleme de chimie fizică. - M.: Mai sus. şcoală, 2001. - 389 p.
Conversia energiei chimice în energie electrică are loc în sisteme electrochimice, care sunt numite celule galvanice.
O celulă galvanică este un sistem electrochimic închis format din doi electrozi.
Luați în considerare o celulă galvanică Jacobi-Daniel. Se compune dintr-o placă de cupru scufundată într-o soluție de CuSC4 și o placă de zinc scufundată într-o soluție de ZnSC4. Pentru a preveni interacțiunea directă între agentul de oxidare și agentul de reducere, electrozii sunt separați unul de celălalt printr-o partiție poroasă.
Diagrama unei celule galvanice:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
Pe suprafața plăcii de zinc apare un strat electric dublu și se stabilește echilibrul:
Ca rezultat al acestui proces, apare potențialul electrod al zincului.
Pe suprafața plăcii de cupru apare și un strat electric dublu și se stabilește echilibrul:
Сu2+ + 2е « Сu, prin urmare, apare un potențial electrod de cupru.
Potențialul electrodului de zinc are o valoare mai negativă decât potențialul electrodului de cupru, prin urmare, atunci când circuitul extern este închis, adică atunci când zincul este conectat la cupru cu un conductor metalic, electronii se vor transfera de la zinc la cupru.
Astfel, atunci când circuitul extern este închis, au loc procese spontane de dizolvare a zincului pe electrodul de zinc și precipitare a cuprului pe electrodul de cupru. Aceste procese vor continua până când potențialele electrozilor sunt egalizate sau tot zincul este dizolvat (sau tot cuprul este depus pe electrodul de cupru).
Deci, în timpul funcționării elementului Jacobi-Daniel, au loc următoarele procese:
1) reacție de oxidare a zincului: Zn - 2е ® Zn2+.
Procesele de oxidare din electrochimie se numesc procese anodice, iar electrozii pe care au loc procesele de oxidare se numesc anozi;
2) reacția de reducere a ionilor de cupru: Сu2+ + 2е « Сu.
Procesele de reducere din electrochimie se numesc procese catodice, iar electrozii pe care au loc procesele de reducere se numesc catozi;
mișcarea electronilor în circuitul extern;
mișcarea ionilor în soluție: anioni (SO4-2) către anod, cationi (Cu2+, Zn2+) către catod. Mișcarea ionilor în soluție închide circuitul electric al celulei galvanice. Însumând reacțiile electrodului, obținem:
Zn + Cu2+ = Zn2+ + Сu.
Ca rezultat al acestei reacții chimice într-o celulă galvanică, are loc mișcarea electronilor în circuitul extern și a ionilor în interiorul celulei, adică se formează un sistem electric închis și în acesta ia naștere un curent electric. Reacția chimică totală care are loc într-o celulă galvanică se numește generatoare de curent.
Curentul electric care apare într-un sistem electrochimic dat este caracterizat numeric de mărimea forței electromotoare (EMF) a elementului. Este egal cu diferența dintre potențialele electrodului catodului și anodului:
În condiții standard, o reacție chimică spontană este posibilă atunci când munca maximă utilă efectuată ca urmare a acestei reacții este egală cu valoarea negativă a modificării energiei libere:
Într-o celulă galvanică, lucrul electric maxim efectuat în condiții standard este egal cu EMF al celulei înmulțit cu cantitatea de energie electrică (nF), adică.
A = nFE0, (7,5)
unde n este numărul de electroni implicați în reacție;
F este constanta Faraday, egală cu 96500 C/mol;
E0 - forța electromotoare standard a unei celule galvanice (T= 298 K, concentrația molară a electroliților este de 1 mol/dm3). Astfel, lucrul maxim al unei celule galvanice este egal cu:
A \u003d -DG0 \u003d nFE0. (7,6)
EMF standard al unei celule galvanice este:
Celulele galvanice, în funcție de natura electrozilor și de concentrația electroliților, sunt împărțite în chimice și concentrație.
Celulele galvanice chimice sunt astfel de celule în care electrozii și electroliții sunt diferiți. Un exemplu de celulă galvanică chimică este celula Jacobi-Daniel.
Celulele galvanice de concentrație sunt astfel de celule care constau din aceiași electrozi, dar concentrațiile de electroliți sunt diferite, de exemplu, electrozii de argint scufundați în soluții de nitrat de argint de diferite concentrații:
Ag | AgNO3 (0,01 mol/dm3) | | AgNO3 (0,1 mol/dm3) | Ag.
Exemplul 1. O celulă galvanică este formată din zinc metalic scufundat într-o soluție de azotat de zinc cu o concentrație molară de 0,1 mol/dm3 și plumb metalic scufundat într-o soluție de azotat de plumb cu o concentrație molară de 0,02 mol/dm3 diagramă element.
Soluţie. Pentru a determina EMF al unui element, este necesar să se calculeze potențialele electrodului folosind ecuația Nernst (7.2):
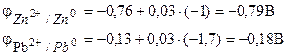
Găsim EMF al elementului conform formulei (7.3).
Celulă galvanică- un dispozitiv care convertește energie chimicaîn electric. Un astfel de element este elementul Daniel-Jacobi. Acest element este format din doi electrozi: zinc și cupru, cufundați în soluțiile de sulfat corespunzătoare, între care există o partiție poroasă:
Când circuitul extern este închis, electronii trec de la Zn la Cu, iar zincul difuzează în cupru:
Formăm un circuit electrochimic:
Anod - electrod negativ (stânga). Catodul este electrodul pozitiv.
Pentru a determina EMF-ul acestui element, trebuie să comparați potențialele electrozilor standard ale ambilor electrozi. Când se înregistrează reacțiile electrodului, se presupune că forma oxidată este pe partea stângă, iar forma redusă este pe partea dreaptă a ecuației.
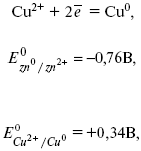
Unde E 0 - forța electromotoare (EMF) a unei celule galvanice, când toți reactivii sunt în stare standard.
Femeia electromagnetică a celulei este calculată prin scăderea potențialului anodic din potențialul catodului.
EMF-ul elementului este +0,34 - (-0,76) \u003d 1,1 V; cu cât potenţialele electrodului diferă între ele, cu atât EMF este mai mare. Dacă un metal este scufundat într-o soluție de sare cu o concentrație mai mare, atunci potențialul este nestandard. Aceasta înseamnă că concentrația și temperatura afectează mărimea potențialului electrodului. Această dependență este exprimată V. Ecuația Nernst.
Unde P - numărul de ioni;
R este constanta universală a gazului;
T - temperatura;
DE LA - concentrația ionilor activi în soluție;
F- Numărul Faraday = 96500 V.
HITURI dispozitive care sunt folosite pentru a transforma direct energia unei reacții chimice în energie electrică. Hiturile sunt folosite în diferite domenii ale tehnologiei. În mijloacele de comunicare: radio, telefon, telegraf; în echipamente electrice de măsură; servesc ca surse de energie pentru mașini, avioane, tractoare; folosit pentru a conduce demaroare etc.
Dezavantaje HIT:
1) costul substanțelor necesare muncii: Pb, Cd, este ridicat;
2) raportul dintre cantitatea de energie pe care o poate da un element și masa sa este mic.
Beneficii HIT:
1) Hiturile sunt împărțite în două grupuri principale: reversibil (baterii), ireversibil (celule galvanice). Bateriile pot fi folosite în mod repetat, deoarece performanța lor poate fi restabilită prin trecerea curentului în sens opus față de o sursă externă, iar în celulele galvanice pot fi utilizate o singură dată, deoarece unul dintre electrozi (Zn în celula Daniel-Jacobi) este consumat ireversibil;
2) se folosesc electroliti absorbiti de materiale poroase, au o rezistenta interna mai mare;
3) crearea pilelor de combustie, a căror funcționare ar consuma substanțe ieftine cu o densitate scăzută ( gaz natural, hidrogen);
4) funcționare convenabilă, fiabilitate, tensiune ridicată și stabilă.
Luați în considerare procesul de tehnologie bazat pe o baterie plumb-acid cu electrozi acoperiți.
Schemă generală: (–) substanță activă | electrolit | substanță activă (+).
Substanța activă a electrodului negativ este agent de reducere donând electroni. În timpul descărcării, electrodul negativ este un anod, adică un electrod pe care au loc procesele oxidative. Substanța activă a electrodului pozitiv este oxidant. Substanțele active - un agent oxidant și un agent reducător - participă la o reacție electrochimică.
Schema electrochimică a unei baterii plumb-acid
Substanțele active ale unei baterii cu plumb sunt plumbul spongios și PbO 2 . Crearea de mase active în electrozi este următoarea: pe cadrul conductiv electric al structurii se aplică o pastă sau un amestec de oxizi de Pb; în timpul formării ulterioare a plăcilor, oxizii de Pb sunt transformați în substanțe active. Formare– conversia masei neîncărcate în masă încărcată. Astfel de plăci sunt împărțite în funcție de tipul de cadru în împrăștiere și zăbrele. Majoritatea bateriilor sunt asamblate din plăci tencuite. La fabricarea lor, o pastă de oxizi de plumb este unsă în celulele grătarelor profilate de 1–7 mm grosime, turnate dintr-un aliaj Pb–Sb. După întărire, pasta este ținută pe rețea, garanția unei astfel de baterii este de 2-3 ani. La alegerea materialelor pentru colectoarele de curent ai electrozilor pozitivi ai bateriei, este important să se asigure pasivitatea lor practică (în același timp menținând conductivitatea electrică) în condiții de încărcare (până la potențiale foarte mari cu polarizare anodică). În acest scop, Pb sau aliajele sale sunt utilizate în soluții de H 2 SO 4. Carcasa și capacul HIT-ului pot fi din oțel sau dielectrici diverși, dar în cazul bateriilor plumb-acid, carcasa este din ebonită, polipropilenă și sticlă. Electrolitul dintr-o baterie plumb-acid poate participa la reacția generală de generare a curentului. Pentru prizele purtătoare de curent ale electrodului negativ, se folosesc Cu, Ti, Al.
3. Regenerarea și eliminarea HIT-urilor
Durata de viață a celulelor galvanice se termină (descărcare HIT) după utilizarea completă sau parțială a materialelor active, a căror performanță după descărcare poate fi restabilită prin încărcare, adică prin trecerea curentului în direcția opusă direcției curentului în timpul descărcare: astfel de celule galvanice se numesc acumulatoare. Electrodul negativ, care era anodul când bateria se descarca, devine catod când este încărcat. conditii cea mai bună utilizare materialele active au densități de curent scăzute, temperaturi mari pana la norma. De obicei, motivul pentru funcționarea defectuoasă a HIT-urilor este pasivarea electrozilor– o scădere bruscă a vitezei procesului electrochimic în timpul descărcării, cauzată de o modificare a stării suprafeței electrodului în timpul descărcării datorită formării de straturi de oxid sau pelicule de sare. Modul de combatere a pasivării este reducerea densităților reale de curent de descărcare prin utilizarea electrozilor cu suprafețe dezvoltate. Producția de HIT se remarcă prin utilizarea diferitelor substanțe toxice (agenți oxidanți puternici, compuși Pb, Hg, Zn, Cd, Ni utilizați în stare fin dispersată; acizi, alcaline, solvenți organici). Pentru a asigura condiții normale de lucru, se preconizează automatizarea proceselor de producție, a sistemelor de ventilație raționale, inclusiv utilizarea aspirației locale de la dispozitive cu emisii toxice, echipamente de etanșare, înlocuirea metodelor uscate de prelucrare a materialelor prăfuite cu cele umede, curățarea aerului și gazelor poluate din aerosoli și tratarea apelor uzate industriale. Utilizarea masivă a HIT economie nationala asociate cu problemele de mediu. În timp ce plumbul de la baterii poate fi returnat în mare parte la fabricile de reciclare de către consumatori, eliminarea CIT primară de mici dimensiuni nu este viabilă din punct de vedere economic.
Fiecare baterie Hg-Zn asigură 5-7 zile de funcționare a aparatului auditiv.
Vehiculele electrice sunt dezvoltate folosind HIT în loc de motoare cu ardere internă, care otrăvește atmosfera orașelor cu gaze de eșapament. În ceea ce privește gradul de impact negativ asupra mediului, producția galvanică se află pe primul loc. Motivul pentru impactul extrem de negativ al producției de galvanizare este că marea majoritate a întreprinderilor în procese tehnologice aplicarea acoperirii, doar 10 - 30% din sarurile metalelor grele sunt consumate util, in timp ce restul, cu munca nesatisfacatoare, intra in mediu. Calea de ieșire este de a minimiza pierderea de săruri de metale neferoase, adică de a reduce eliminarea electroliților de către piesele din băi galvanice. Acest lucru va duce la o scădere a concentrațiilor și volumelor de apă uzată și, prin urmare, va crea conditiile necesare pentru tehnologii de aplicare cu deșeuri reduse (LWT) și fără deșeuri (LWT). acoperiri galvanizate. Mai întâi trebuie să alegeți electrolitul potrivit. Un principiu fundamental al OIM și BOT este de a reduce substanțele chimice de intrare și de a furniza mai puține otrăvuri la ieșirea procesului.




