Care este forța electromotoare a unei celule galvanice. Marea enciclopedie a petrolului și gazelor. Determinarea valorii potenţialului electrod standard al cuprului
Dacă separăm spațial procesele de oxidare și de reducere, atunci reacția redox poate fi folosită pentru a genera energie electrică.
Un dispozitiv care transformă energia chimică în energie electrică se numește element galvanic. O celulă galvanică este formată din două metale scufundate într-o soluție de electrolit. Dacă conectați aceste metale cu un conductor de primul fel (un fir metalic), atunci se va forma un curent electric, care apare ca urmare a apariției unui proces redox. Într-o celulă galvanică, anodul este un electrod al cărui potențial electrod într-o soluție dată este mai electronegativ. Oxidarea are loc la anod. Catodul este un electrod realizat dintr-un metal mai puțin activ. Ionii metalici pozitivi, ionii de hidrogen sau moleculele neutre sunt reduse la catod. Într-o celulă galvanică, anodul este indicat cu un semn minus, iar catodul cu un semn plus. Celula galvanică este prezentată în figură.
Determinarea valorii potenţialului electrod standard al cuprului
O celulă galvanică este un dispozitiv simplu prin care energia chimică este convertită în energie electrică. Celulele galvanice constau din două compartimente separate, numite semicelule, care conțin soluții de electroliți și electrozi care pot fi conectați într-un circuit. Două metale diferite sunt scufundate într-un electrolit. Dacă metalele sunt conectate printr-o buclă exterioară, un metal este redus și celălalt metal este oxidat.
În exemplul de mai sus, cuprul este redus și zincul este oxidat. Diferența dintre potențialele de oxidare ale celor două metale asigură puterea electrică a celulei. Celula de volți poate fi construită folosind simboluri simple. În diagramă, electrozii sunt în exteriorul diagramei, iar linia verticală este folosită pentru a separa electrodul de soluția de electrolit din compartiment. De obicei, într-o diagramă, speciile oxidate sunt scrise în stânga barei oblice. Iată un exemplu de celula lui Daniel.
O placă de zinc este scufundată într-o soluție de sulfat de zinc, o placă de cupru este scufundată într-o soluție de sulfat de cupru. Plăcile sunt conectate printr-un fir, soluțiile sunt separate printr-un perete poros pentru a preveni amestecarea soluțiilor. Electronii merg de-a lungul circuitului extern de la anod la catod, iar de-a lungul circuitului intern SO 4 2- anionii se deplasează în soluție din cupru în zinc, închizând circuitul electric al celulei galvanice.
Întrebări și exerciții
Numele se referă la oamenii de știință italieni din secolul al XVIII-lea Alessandro Volte și Luigi Galvani. Celula Daniell a constat dintr-un borcan de sticlă care conținea electrozi de cupru și zinc, fiecare fiind scufundat în soluțiile lor de sulfat acid. Cele două soluții au fost separate printr-un separator cilindric de argilă poroasă. Era o celulă galvanică în care prospectarea electrică spontană a zincului și galvanizarea cuprului furnizau un curent electric.
O celulă electrochimică este un dispozitiv care transformă energie chimicaîn energie electrică, sau invers, atunci când are loc o reacție chimică în celulă. Este format din două faze conductoare electric conectate printr-o fază conductoare ionic. Pe măsură ce trece curentul electric, acesta trebuie să treacă de la curentul de electroni la curentul de ioni și înapoi la curentul de electroni.
O celulă galvanică este scrisă ca un circuit electrochimic:
A(-) Zn | ZnSO 4 || CuSO4 | Cu(+)K
Deoarece potențialul electrodului zincului este mai mic decât potențialul electrodului cuprului, zincul va fi anodul, iar cuprul va fi catodul. Placa de zinc este oxidată, iar cuprul este redus din soluția de pe suprafața plăcii de cupru.
Procesele care au loc în timpul funcționării unei celule galvanice trebuie înregistrate:
O caracteristică esențială a unei celule electrochimice este aceea că reacțiile redox care apar simultan sunt separate spațial. De exemplu, într-o reacție chimică spontană în timpul oxidării hidrogenului cu oxigenul în apă, electronii sunt trecuți direct de la hidrogen la oxigen.
În schimb, într-o reacție electrochimică spontană într-o celulă galvanică, hidrogenul este oxidat la anod, transferând electroni la anod, iar oxigenul este redus la catod, acceptând electroni din catod. Ionii produși în reacțiile electrodului, în acest caz ionii de hidrogen pozitivi și ionii de hidroxid negativi, se vor recombina în soluție pentru a forma produsul final de reacție: apa. În timpul acestui proces, electronii sunt conduși de la anod la catod printr-un circuit electric extern, unde curentul electric poate conduce un motor, poate aprinde un bec și așa mai departe. reacția poate fi, de asemenea, modificată: apa poate fi descompusă în hidrogen și oxigen prin aplicarea energiei electrice într-o celulă electrolitică.
A Zn - 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Diferența maximă de potențial a electrozilor care poate fi obținută în timpul funcționării unei celule galvanice se numește forța electromotoare (EMF) a celulei. Este egal cu diferența dintre potențialele de echilibru ale catodului și anodului:
EMF= e K - e A
Pentru o celulă electrochimică cupru-zinc în condiții standard:
O celulă de combustie este un dispozitiv care transformă energia chimică în energie electrică. Diferă de o baterie prin aceea că conversia energiei continuă atâta timp cât combustibil și oxidant sunt furnizate celulei de combustie; adică, în principiu, pe perioadă nedeterminată. Aceasta este o celulă galvanică, unde spontan reacții chimice. Combustibilul este oxidat la anod, iar oxidatorul este redus la catod. În prezent, cel mai des folosit combustibil este hidrogenul. Combustibilii mai convenționali trebuie convertiți în hidrogen înainte de a fi utilizați într-o celulă de combustie.
EMF \u003d 0,34-(-0,76) \u003d 1,1 V
Diferența de potențial se formează nu numai între diferite, ci și între metale cu același nume, încărcate în soluții ale sărurilor lor cu concentrații diferite. O astfel de celulă galvanică se numește concentraţie. De exemplu, o celulă galvanică cu concentrație de nichel.
(-) Ni | NiSO4 || NiSO4 | Ni(+)
0,01 mol 0,1 mol
Reacțiile, electronii sunt transferați de la o specie la alta. Dacă reacția este spontană, se eliberează energie, care poate fi apoi folosită pentru muncă utilă. Pentru a valorifica această energie, reacția trebuie împărțită în două jumătăți separate ale reacției: reacțiile de oxidare și de reducere. Reacțiile sunt plasate în două recipiente diferite și se folosește un fir pentru a conduce electronii dintr-o parte în alta.
Exemple de rezolvare a problemelor
Când are loc o reacție redox, electronii sunt transferați de la o specie la alta. Dacă reacția este spontană, se eliberează energie care poate fi folosită pentru lucru. În această reacție, un electrod de cupru este plasat într-o soluție care conține ioni de argint.
Să notăm munca unei astfel de celule galvanice de concentrare.
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -2) \u003d -0,25 + (0,058 / 2) (-2) \u003d -0,308 V
e Ni 2+ / Ni \u003d e 0 + (0,058 / n) lg (1 * 10 -1) \u003d -0,25 + (0,058 / 2) (-1) \u003d -0,28 V
EMF = -0,28 - (-0,308) = 0,028 V
Procese pe electrozi:
A: Ni 0 - 2e - \u003d Ni 2+
K: Ni 2+ + 2e - \u003d Ni 0
SARCINI DE CONTROL
48. Calculați EMF al unei celule galvanice cadmiu - argint, dacă concentrația ionilor de argint în soluție este de 0,1 mol / l, iar ionii de cadmiu 0,001 mol / l. Scrieți ecuațiile pentru reacțiile care au loc pe electrozi.
Această reacție eliberează energie. Cu toate acestea, atunci când un electrod de cupru solid este plasat direct în soluția de azotat de argint, energia se pierde sub formă de căldură și nu poate fi folosită pentru lucru. Pentru a folosi această energie și a folosi munca ei utilă, trebuie să împărțim reacția în două jumătăți separate de reacții; Reacții de oxidare și reducere. Firul conectează cele două reacții și permite electronilor să curgă dintr-o parte în alta.
Celula de volți este o celulă electrochimică care utilizează reacții redox spontane pentru a genera electricitate. Este format din două jumătăți de elemente separate. Cele două jumătăți de celule sunt conectate între ele printr-un fir care trece de la un electrod la altul. Puntea de sare se conectează și la semicelule.
49. Realizați o diagramă a două celule galvanice în una dintre care nichelul este catodul, iar în cealaltă anodul. Scrieți ecuațiile reacțiilor care au loc în timpul funcționării acestor elemente.
50. Calculați EMF galvanic un element compus din plăci de fier și plumb scufundate în soluții 0,1M de săruri ale acestora. Scrieți ecuațiile de reacție.
Funcțiile acestor părți sunt discutate mai jos. Electrodul este o bandă de metal pe care are loc reacția. Într-o celulă de tensiune, oxidarea și reducerea metalelor au loc la electrozi. Celula de volți are doi electrozi, câte unul în fiecare jumătate de celulă. Catodul este locul unde are loc reducerea și oxidarea are loc la anod.
Prin electrochimie, aceste reacții interacționează cu suprafețele metalice sau cu electrozii. Se stabilește echilibrul de oxidreducere între metal și substanțele în soluție. Când electrozii sunt scufundați într-o soluție care conține ioni din același metal, se numește semicelulă. Electroliții sunt ioni în soluție, de obicei un lichid, care conduc electricitatea prin conducție ionică. Pot avea loc două interacțiuni posibile între atomii de metal de pe electrod și soluțiile ionice.
51. Calculați EMF al unei celule galvanice cu concentrație de nichel. Concentrația ionilor metalici în soluții este de 1 mol/l și 0,0001 mol/l. Scrieți procesele care au loc la anod și catod.
52. Ce procese au loc la electrozii unei celule galvanice concentrate de cupru, dacă unul dintre electrozi are o concentrație de ioni metalici egală cu 1 mol/l, iar celălalt 0,001 mol/l. în ce direcție se mișcă electronii în circuitul extern. Ce este EMF?
Procese la anod
Aceasta înseamnă că ionii sunt în scădere. . Când electrodul este oxidat în soluție se numește anod și când electrodul este redus în soluție. se numeste catod.
- Anodul: Anodul este locul reacției de oxidare.
- Cu alte cuvinte, aici metalul pierde electroni.
- Aici electrodul metalic primește electronii.
Când vine vorba de reacții redox, este important să înțelegem ce înseamnă pentru un metal să „oxideze” sau să „reducă”. Puntea de sare este o componentă vitală a oricărei celule voltaice. Scopul punții de sare este de a menține soluțiile neutre din punct de vedere electric și de a permite fluxul liber al ionilor de la o celulă la alta. Fără o punte de sare, sarcinile pozitive și negative s-ar acumula în jurul electrozilor, determinând oprirea reacției.
53. Realizați schema unei celule galvanice formată din plăci de Zn și Fe scufundate în soluții ale sărurilor acestora. Scrieți ecuațiile pentru procesele care au loc pe ionii de fier, astfel încât EMF-ul elementului să devină zero la o concentrație de ioni de zinc de 0,0001 mol/l.
54. Plăcile de fier și argint sunt legate printr-un conductor extern și scufundate într-o soluție de acid sulfuric. Faceți o diagramă a acestei celule galvanice, scrieți ecuațiile reacțiilor care au loc pe plăci.
Electronii curg întotdeauna de la anod la catod, sau de la jumătatea celulei de oxidare la jumătatea de reducere. O diagramă de celule este o reprezentare a unei celule electrochimice. Figura de mai jos arată diagrama celulei pentru voltiză prezentată în figura 1 de mai sus.
Figura de mai jos arată diagrama celulei pentru voltayse prezentată în figura 1. Când construim o diagramă de celule, respectăm următoarele convenții. Anodul este întotdeauna în stânga și catodul în dreapta. Diferența de fază a unui element este reprezentată de o singură linie verticală, iar modificările stării de oxidare sunt reprezentate prin virgule.
55. Desenați diagrama unei celule galvanice formată dintr-un electrod de argint scufundat într-o soluție 1M de azotat de argint și un electrod standard de hidrogen. Scrieți ecuațiile proceselor cu electrozi. Care este EMF-ul elementului?
56. În ce direcție se vor mișca electronii în circuitul extern al următoarelor celule galvanice
Procese la catod
Când vi se cere să trasați o diagramă celulară, urmați aceste instrucțiuni simple. Luați în considerare următoarea reacție. Pasul 1: scrieți două jumătăți de reacții. Pasul 2: Identificați catodul și anodul. \\ câștigă electroni, deci scade; reducerea are loc la catod. Pasul 3: construiți o diagramă celulară.
Anodul merge întotdeauna pe stânga și catodul pe dreapta. Absența concentrațiilor indică faptul că soluțiile sunt în condiții standard. Citirile voltmetrului dau tensiunea de răspuns pe celulă sau diferența de potențial dintre două două semicelule. Tensiunea celulei este cunoscută și ca forță electromotoare și este afișată ca \\.
a) Mg | Mg2+ | | Pb 2+ | Pb
b) Pb | Pb 2+ | | Cu 2+ | Cu
c) Cu | Cu 2+ | | Ag 2+ | Ag
dacă toate soluțiile de electroliți sunt unimolare? Ce metal se va dizolva în fiecare dintre aceste cazuri.
57. Realizați o diagramă a unei celule galvanice pe baza reacției care se desfășoară conform ecuației:
Ni + Pb (NO 3) 2 \u003d Ni (NO 3) 2 + Pb.
Scrieți ecuațiile electronice ale proceselor anodului și catodic, calculați EMF-ul acestui element în condiții standard.
Aceste valori se numesc potențiale de reducere standard. Fiecare semireacție are un potențial de reducere diferit, diferența dintre cele două potențiale de reducere dă tensiunea celulei electrochimice. Luați în considerare următoarele două reacții. Împărțiți reacția în jumătate de reacție și determinați potențialele lor standard de reducere.
- Specificați care vor fi anodul și catodul.
- Trasează o diagramă celulară pentru următoarele reacții.
- Definiți \\ pentru celula voltaică formată de fiecare reacție.
- Henral Chemistry: Principles and Modernity Applications Ed. a 9-a.
58. EMF al unei celule galvanice formată dintr-o placă de cupru scufundată într-o soluție de sare a acesteia cu o concentrație de ioni de cupru egală cu 0,001 mol/l și cromul scufundat într-o soluție a sării sale este de 1,05 V. Determinați concentrația ionilor de crom într-o soluție de sare a acesteia. Realizați o diagramă a unei celule galvanice și scrieți ecuațiile electronice ale proceselor electrozilor.
Prin urmare, electronii curg spontan de la ionii de zinc la cupru, formând ioni de zinc și cupru metalic. Așa cum apa curge spontan în vale, ceea ce poate fi făcut să funcționeze prin forțarea unei roți de apă, fluxul de electroni de la o energie potențială mai mare la una mai mică poate fi, de asemenea, folosit pentru a lucra.
Deoarece energia potențială a electronilor de valență diferă foarte mult de la o substanță la alta, tensiunea unei celule galvanice depinde parțial de identitatea substanțelor care reacţionează. Potențialul celular măsurat depinde, de asemenea, puternic de concentrațiile reactanților și de temperatura sistemului. Pentru a dezvolta o scară de potențiale relative care ne va permite să prezicem direcția unei reacții electrochimice și mărimea forței motrice a reacției, potențialele de oxidare și reducere a diferitelor substanțe trebuie măsurate în condiții comparabile.
59. Realizați o diagramă, scrieți ecuațiile proceselor cu electrozi și calculați EMF-ul unei celule galvanice formată din plăci de cadmiu și magneziu scufundate în soluții ale sărurilor acestora cu o concentrație de ioni metalici egală cu 1 mol/l. se va modifica EMF-ul acestei celule galvanice dacă concentrația fiecărui ioni se reduce la 0,01 mol/l.
Măsurarea potențialelor electrodului standard
Potențialele redox măsurate depind de energia potențială a electronilor de valență, de concentrațiile speciilor din reacție și de temperatura sistemului. Este imposibil din punct de vedere fizic să măsurați potențialul unui electrod: poate fi măsurată doar diferența de potențial a doi electrozi. Acest lucru vă permite să măsurați diferența de potențial dintre doi electrozi diferiți. De fapt, acesta este exact potențialul măsurat în condiții standard dacă celula este construită cu următorul aspect al celulei. Prin urmare, potențialul celulei standard este diferența dintre potențialele de reducere tabelate ale celor două semireacții, și nu suma lor.
60. EMF al unei celule galvanice constând dintr-un electrod standard de hidrogen și un electrod cu plumb scufundat într-o soluție de sare de plumb 1M este de 126 mV. Când elementul este închis, electronii din circuitul extern se deplasează de la plumb la electrodul de hidrogen. Care este potențialul electrodului plumb. Desenați o diagramă a unei celule galvanice și scrieți procesele care au loc pe electrozi.
61. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii cu plumb.
62. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii cadmiu-nichel.
63. Ce procese au loc pe electrozi la încărcarea și descărcarea unei baterii fier-nichel.
64. Faceți o diagramă a două celule galvanice în una dintre care cromul ar fi anodul, iar în cealaltă - catodul. Scrieți pentru fiecare dintre aceste elemente ecuațiile electronice ale reacțiilor care au loc pe electrozi.
65. Desenați o diagramă a unei celule galvanice formată din electrod de aluminiu, scufundat într-o soluție 1M de azotat de aluminiu și un electrod standard de hidrogen. Scrieți ecuațiile proceselor electrodului și calculați EMF-ul celulei galvanice.
66. În ce direcție se vor mișca electronii în circuitul extern al unei celule galvanice din aluminiu-zinc. Concentrațiile ionilor în soluții sunt de 0,1 mol/l. Faceți o diagramă a unei celule galvanice, scrieți ecuațiile pentru procesele care au loc pe electrozi, calculați EMF.
67. Într-un element argint-zinc folosit pentru alimentarea diferitelor echipamente are loc o reacție
ELECTROLIZĂ
prin electroliză numit ansamblu de procese care au loc atunci când un curent electric continuu trece printr-un sistem format din doi electrozi și o soluție de topitură sau electrolit. În timpul electrolizei, ionii încărcați pozitiv se deplasează la catod, care este conectat la polul negativ al unei surse externe de CC, iar ionii încărcați negativ se deplasează la anod, care este conectat la polul pozitiv al sursei de curent continuu. Pe suprafața catodului are loc un proces de reducere, pe anod - oxidare.
Luați în considerare electroliza unei topituri de clorură de sodiu.
Când doi electrozi de grafit conectați la o sursă de curent sunt scufundați într-o topitură constând din ioni Na + și Cl -, o mișcare direcționată a ionilor va începe în electrolit, iar pe electrozi vor avea loc procese redox.
Schema electrolizei topiturii de sodiu:
NaCl \u003d Na + + Cl -
Catod (-) (+) anod
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
Ecuația generală a reacției:
2Na + + 2Cl - electroliza 2 Na + Cl 2
Electroliza 2NaCl 2Na + Cl 2
La electroliza soluțiilor apoase de electroliți moleculele de apă polară sunt atrase atât de catod, cât și de anod și pot participa, de asemenea, la procesele de la electrozi.
Procese la catod
Secvența de reducere a ionilor la catod în timpul electrolizei soluțiilor depinde de valorile potențialelor standard ale electrodului. Cu cât valoarea potențialului electrodului elementului este mai mare, cu atât recuperarea acestuia este mai ușoară.
Primii care se reduc la catod sunt ionii acelor metale al caror potential este cel mai pozitiv. De exemplu, o soluție cu ioni Ag + și H +. Ag este restaurat mai întâi:
Ag + + e - = Ag 0 e 0 = +0,8 B
Hidrogenul nu este recuperat, deoarece potențialul său este mai mic.
Potențialele metalelor și hidrogenului depind de concentrația lor în electrolit. Prin urmare, nu este întotdeauna posibil să se judece reducerea ionilor H+ din valorile potențialului standard. Într-o soluție neutră, concentrația ionilor de hidrogen este de 10 -7 mol/L. și după formula Nernst:
În consecință, hidrogenul poate fi eliberat din soluții neutre doar la un potențial mai mic de -0,41V, iar metalele de pe catod vor fi eliberate doar acelea al căror potențial este mai pozitiv decât potențialul -0,41V.
În practică, multe metale (Zn, Fe, Cr etc.) sunt eliberate din soluțiile de hidrogen, a căror valoare potențialelor electrodului este mai mică de –0,41V.
Acest lucru se datorează supratensiunii hidrogenului, adică. Pe suprafața majorității metalelor, hidrogenul este eliberat cu dificultate. Mărimea supratensiunii hidrogenului depinde de proprietățile metalului, de densitatea curentului și de temperatura electrolitului. supratensiune– aceasta este diferența de potențial dintre potențialul practic al degajării hidrogenului și cel teoretic.
Exemplu.
Potențial de eliberare a zincului în electrolit neutru –0,76V, hidrogen –0,41V. supratensiunea de hidrogen pe zinc este de aproximativ –0,72V. Astfel, hidrogenul va fi eliberat pe zinc doar la un potențial de –0,41+(-0,72)=-1,13V. Dacă comparăm potențialul de descărcare a zincului (-0,76 V) cu potențialul de descărcare a hidrogenului pe zinc (-1,13 V), este clar că zincul va fi eliberat. De fapt, este așa, în timpul electrolizei unei soluții neutre de sare de zinc, se eliberează zinc și o cantitate mică de hidrogen.
Cu un proces generalizat la catod, în funcție de locația metalului în seria potențialelor standard ale electrodului, se disting trei cazuri:
1) ioni metalici, al căror potențial electrod este mai mic de –1,18 V (de la Li la Mn). Ionii de hidrogen sunt restaurați:
2 H ++ 2e - \u003d H 2 PH< 7
2 H 2 O + 2e - \u003d H 2 + 2OH - PH>= 7
2) ioni metalici, al căror potențial de electrod este de la –1,18 V la 0,00 V (de la Mn la H). În acest caz, atât ionii metalici, cât și ionii de hidrogen sunt reduse simultan:
Me n+ + ne - = Me 0
2H + + 2e- = H2PH<7
2H2O + 2e - = H2 + 2OH - PH>=7
3) ioni metalici, al căror potențial electrod este mai mare de 0,0 V (de la H la Au). În acest caz, doar ionii metalici sunt redusi
Me n+ + ne - = Me 0
Procese la anod
Pentru electroliză se folosesc anozi solubili (activi) și insolubili (inerți). În timpul electrolizei, anozii solubili se dizolvă și ionii metalici - anodul trece în soluție. Anozii solubili sunt de obicei fabricați din metalul a cărui sare este supusă electrolizei.
Anozii insolubili nu participă la reacțiile redox. De obicei, aceștia sunt anozi din grafit, aur, platină. Anionii cu potențiale mai negative sunt oxidați la suprafața lor. Aceștia sunt ioni care nu conțin oxigen, cum ar fi J - , Br - , Cl - , S 2- și alții (cu excepția F -)
Dacă soluția conține ioni Cl - , Br -, atunci ionii Br - vor fi oxidați pe un anod inert.
2Br - - 2e - = Br 2
2H 2 0 - 4e - \u003d O 2 + 4H + (PH<=7)
4OH - 4e - \u003d 2H 2 O + O 2 (PH> 7)
Să luăm în considerare câteva cazuri de electroliză a soluțiilor apoase.
Exemplu.
Schema de electroliză a unei soluții apoase de clorură de cupru cu un anod inert CuCl 2 \u003d Cu 2+ + 2Cl -
H 2 O \u003d H + \u003d OH -
Catod (-) Cu 2+ H + (H 2 O) Cl -, OH - (H 2 O) (+) anod
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
Cuprul are un potențial mai mare de 0, astfel încât metalul este redus la catod, iar un reziduu de acid fără oxigen este oxidat la anod.
Exemplu.
Schema de electroliză a unei soluții de sulfat de potasiu cu un anod inert. K 2 SO 4 \u003d 2K + + SO 4 2
H 2 O \u003d H + + OH -
Catod (-) 2K +, H + (H 2 O) SO 4 2-, OH (H 2 O) (+) anod
2H 2 O + 2e - \u003d H 2 + 2OH - 2H 2 O - 4e - \u003d O 2 + 4H +
K + + OH - \u003d KOH 2H + + SO 4 2- \u003d H 2 SO 4
Deoarece potasiul din seria potențialelor standard ale electrodului este mult mai devreme decât hidrogenul, hidrogenul este redus la catod și se acumulează ionii OH -
La anod, moleculele de apă vor fi oxidate și se vor acumula ionii de H+. Astfel, în spațiul catodic, produsul secundar va fi alcalin, iar în spațiul anodic, acid.
Exemplu.
Electroliza unei soluții apoase de sulfat de nichel cu un anod activ. Ni SO 4 \u003d Ni 2+ \u003d SO 4 2-
H2O H + + OH -
Catod (-) Ni 2+, H + (H 2 O) SO 4 2-, OH - (H 2 O) (+) anod
Ni 2+ +2e - = Ni 0 Ni - 2e - = Ni 2+
e 0 Ni \u003d -0,25V este mai mare decât potențialul de reducere a ionilor de hidrogen din apă (-0,41V), prin urmare, metalul este redus, iar anodul-metal este oxidat la anod, deoarece potențialul de nichel este mult mai mic decât potențialul de oxidare al apei (+1,23V).
Legile electrolizei
Masa electrolitului supus transformării chimice, precum și masele de substanțe eliberate pe electrozi conform legilor lui Faraday, sunt direct proporționale cu cantitatea de electricitate trecută prin electrolit și cu masele molare ale echivalenților de substanțe:
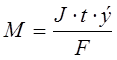 , Unde
, Unde
m este masa electrolitului supus electrolizei sau masa substanțelor eliberate pe electrozi, g;
J - puterea curentului, A;
e-masa molară a echivalenților de substanță, g/mol;
F-numărul lui Faraday - 96500 C;
t este timpul de electroliză, s;
SARCINI DE CONTROL
68. Faceți ecuații pentru procesele care au loc în timpul electrolizei topiturii de NaOH și NiCl 2 cu electrozi inerți.
69. Realizați o diagramă a electrolizei soluțiilor apoase de acid sulfuric, clorură de cupru, azotat de plumb cu electrozi de platină.
70. Scrieți ecuațiile proceselor electrozilor care au loc în timpul electrolizei soluțiilor apoase de clorură de bariu și clorură de fier (II) cu electrozi de carbon.
71. Realizați o diagramă a electrolizei unei soluții apoase de clorură de zinc, dacă a) anodul este zinc; b) anod de carbon.
72. Ce volum de hidrogen va fi eliberat când un curent de 3 A este trecut printr-o soluție apoasă de acid sulfuric timp de 1 oră.
73. În timpul electrolizei unei soluții apoase de SnCl 2 s-au eliberat la anod 4,48 litri. clor (condiții normale). Ce substanță și în ce cantitate a fost eliberată la catod.
74. În ce secvență vor fi eliberate metalele în timpul electrolizei unei soluții care conține sulfați de nichel, argint, cupru în aceeași concentrație. Scrieți ecuațiile proceselor pe electrozi.
75. Realizați o diagramă a proceselor care au loc pe electrozii de cupru în timpul electrolizei unei soluții apoase de azotat de potasiu.
76. Cuprul nerafinat conține impurități de argint și zinc. Ce se întâmplă cu aceste impurități în timpul rafinării electrolitice a cuprului. Scrieți ecuațiile proceselor pe electrozi.
77. Cât timp va dura descompunerea completă a 2 moli de apă cu un curent de 2A.
78. Trecut prin soluții de sare de masă și fosfat de sodiu pentru ceva timp DC.. Va schimba acest lucru cantitatea de sare în ambele cazuri. Motivați-vă răspunsul prin compilarea ecuațiilor electronice ale proceselor care au loc pe catod și anod.
79. În timpul electrolizei unei soluții de sulfat de cupru (II) s-au eliberat la anod 0,168 litri de gaz (condiții normale), se alcătuiesc ecuațiile electronice ale proceselor și se calculează cât de mult cupru va fi eliberat la catod.
80. Compuneți ecuațiile electronice ale proceselor care au loc în timpul electrolizei unei soluții și topituri de KOH.
81. Ce substanțe și în ce cantitate vor fi eliberate pe electrozii de carbon în timpul electrolizei unei soluții de NaI timp de 2,5 ore dacă puterea curentului este de 6 A.
82. Câte grame de acid sulfuric se formează lângă anod în timpul electrolizei unei soluții de sulfat de sodiu, dacă la anod se eliberează 1,12 litri de oxigen (n.o.), se calculează masa substanței eliberate la catod.
83. În timpul electrolizei unei soluții de azotat de argint la anod s-au eliberat 0,28 litri de oxigen. Câte grame de argint au ieșit în evidență la catod.
84. Sărurile de aluminiu, zinc și cupru se dizolvă în apă cu o concentrație de cationi de 1 mol/l. alcătuiți ecuațiile electronice ale proceselor de pe electrozi și indicați succesiunea reacțiilor pe catod.
85. Ce produse pot fi obținute prin electroliza soluției de NaNO 3, dacă spațiile anodului și catodic:
a) separate printr-un compartiment poros;
b) nu se separă și soluția se agită.
86. Ce produse vor fi eliberate pe catod și anod în primul rând în timpul electrolizei soluțiilor apoase cu electrozi de grafit, dacă electrolitul conține un amestec de sulfat de cupru (II) și clorură de potasiu.
87. Plăcile de cupru și argint sunt scufundate într-o soluție apoasă de azotat de argint. La ce pol al sursei de curent trebuie conectată o placă de cupru pentru a o acoperi cu argint. Scrieți o diagramă a procesului de electroliză.
COROZIUNEA METALELOR
Coroziune numită distrugere spontană a metalului sub influența mediului. Coroziunea este un proces eterogen redox care are loc la interfață. După mecanismul procesului de coroziune, se disting coroziunea chimică și electrochimică. Coroziunea chimică numită oxidarea metalului, neînsoțită de apariția unui curent electric în sistem. Un astfel de mecanism se observă în interacțiunea metalelor cu gazele agresive la temperatura ridicata(coroziune gazoasă) și cu lichide organice - non-electrolites (coroziune în non-electrolites).
coroziunea electrochimică numită distrugerea metalului din mediul electrolitic, însoțită de apariția unui curent electric în interiorul sistemului.
Metalele folosite în inginerie conțin impurități ale altor metale, prin urmare, atunci când sunt în contact cu o soluție de electrolit, pe suprafața lor se obține un număr mare de celule microvoltaice care funcționează continuu. Metalul mai activ, anodul, se oxidează pentru a forma cationi metalici sau produse insolubile precum rugina. Electronii eliberați se deplasează la catod, unde agentul de oxidare este redus. Oxigenul dizolvat și ionii de hidrogen, cei mai importanți agenți oxidanți care provoacă coroziune, sunt numiți depolarizatori catodici. Ce fel de proces de reducere va avea loc pe catod depinde de compoziția electrolitului.
Exemplu.
Când fierul și cuprul intră în contact într-o soluție de acid clorhidric, se formează o celulă microgalvanică:
AFe| HCI | Cu K
e 0 Fe/Fe2+ = -0,44B
e 0 Cu/Cu2+ = +0,34B
Fierul - un metal mai activ va fi anodul, iar cuprul - catodul. Reacțiile care apar la anod și catod pot fi exprimate astfel:
1 A: Fe -2e \u003d Fe 2+
1 K: 2H + + 2e = H2
Rezumând procesele anodice și catodice, obținem o reacție redox, a cărei apariție spontană provoacă coroziunea metalului:
Fe + 2H + = Fe 2+ + H2
Fe + 2HCl \u003d FeCl 2 + H 2
Exemplu.
Cu coroziune înăuntru mediu neutru,în absența oxigenului dizolvat în apă, depolarizarea cu hidrogen a catodului are loc în același mod ca în exemplul anterior.
Să notăm schema celulei galvanice și ecuațiile reacțiilor care au loc în această celulă galvanică:
A Fe|H2O| Cu K
1 A: Fe - 2e \u003d Fe 2+
1 K: 2H 2 O + 2e \u003d H 2 + 2OH -
Fe + 2H 2 0 \u003d Fe 2+ + H 2 + 2OH -
Sau sub formă moleculară: Fe + 2H 2 O = Fe (OH) 2 + H 2
Exemplu.
Când fierul intră în contact cu cuprul în aer umed, se formează o celulă galvanică.
AFe| H2O + O2 | Cu K
Și procesul de coroziune este exprimat prin următoarele ecuații:
A: Fe - 2e = Fe 2+
K: O 2 + 2H 2 O + 4e \u003d 4OH -
2Fe + O 2 + 2H 2 O \u003d 2Fe (OH) 2
Sub influența oxigenului atmosferic, hidroxidul de fier (2) este oxidat în continuare conform ecuației
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
După cum se poate observa din exemplu, în acest caz are loc depolarizarea oxigenului a catodului.
Posibilitatea unui proces redox spontan este calculată din EMF
EMF = e agent reducător - e agent de oxidare
Dacă EMF-ul procesului este mai mare decât zero, atunci procesul este posibil.
LAB #9
Determinarea potențialelor de electrozi ale metalelor și EMFelemente galvanice.
eu.Secțiuni curs teoretic pentru repetari.
Apariția unui potențial salt la interfețele metal - apă, metal - soluție de sare metalică. Electrod standard de hidrogen. Conceptul de celule galvanice și procese care au loc pe electrozi. Potențialele electrozilor standard ale metalelor. Un număr de potențiale standard ale electrodului. Concluzii din poziția metalului într-un rând. Ecuația Nernst. Electrozi reversibili și ireversibili. Electrozi metalici Tip I și II, electrozi redox, electrozi de gaz. Electrozi de referință. Elemente chimice și galvanice de concentrație. Forța electromotoare (EMF) a celulelor galvanice. Procese care au loc pe electrozi în timpul funcționării unei celule galvanice.
3. Întrebări și exerciții.
1. Care este potențialul unui electrod de argint scufundat într-o soluție de sare de argint cu o concentrație
Cm = 10-2 mol/l?
2. Cum depinde valoarea potențialului electrodului de hidrogen de pH-ul mediului? Care este potențialul electrodului de hidrogen la pH = I; pH = 7, pH = 10?
3. Calculați potențialul unui electrod standard de argint în raport cu:
a) electrod de calomel saturat,
b) cupru saturat - electrod sulfat,
c) electrod de clorură de argint saturată?
4. Realizați diagrame ale celulelor galvanice în care au loc reacții:
a) 2Ag+ + Cu 0 → Ag 0 + Cu+2
b)CD 0 + CuSO4 → CdSO4 + Cu
5. Determinați valoarea EMF și indicați procesele care au loc pe electrozii din următoarele celule galvanice:
dar)Zn / ZnSO4 //CDSO4/Cd
b)Rb/ Rb(NUh)2) //AgNO3/Ag
6. Calculați EMF al următoarei celule galvanice de concentrație:
dar)Zn/ ZnCI2 // ZnCI2 / Zn
0,01 mol/l 1,0 mol/l
Care electrod este anodul și care este catodul?
3. partea experimentală
1. Determinarea valorii potenţialului electrod standard al zincului.
Asamblați electrodul de zinc (Zn/ ZnSO4 ) , prin scufundarea unei tije de zinc bine șlefuită într-o soluție de sare cu o concentrație de ioni de zinc de I mol/l.
Orez.eu. Schema de instalare pentru determinarea valorii potenţialului electrod al metalului.
1 - electrod investigat (zinc, cupru etc.)
2 - electrod de referință clorură de argint
3 - potențiometru.
4 - un pahar de soluție saturată de clorură de potasiu
În conformitate cu Fig.1, asamblați o celulă galvanică de la electrodul de zinc investigat (Zn/ ZnSO4 ) și electrod de referință cu clorură de argint saturată (KCl/ AgCl/ Ag) :
Notarea condiționată a acestei celule galvanice:
(-) Zn/ZnSO4//KCl/AgCl/Ag(+)
Pentru a face acest lucru, duzele electrozilor sunt scufundate într-un pahar cu o soluție de clorură de potasiu, iar electrozii înșiși sunt conectați la bornele corespunzătoare ale potențiometrului folosind fire de conectare.
Potențialul unui electrod de referință cu clorură de argint saturată în raport cu un electrod standard de hidrogen este de +0,201 V.
Exl. ser. S.U.A.= +0,201V sau 201 mV.
În conformitate cu instrucțiunile privind procedura de măsurare, folosind un potențiometru adecvat, determinați EMF al celulei galvanice compuse și potențialul electrodului de zinc folosind un electrod saturat de clorură de argint.
Cunoscând valoarea potențialului electrodului de referință, calculați valoarea potențialului electrodului de zinc față de electrodul standard de hidrogen. Comparați valoarea rezultată cu valoarea tabelului:
E0 = - 0,76 B.
Notează valorile găsite:
Valoarea măsurată a E.D.S. celulă galvanică, compusă dintr-un electrod standard de zinc și un electrod de referință cu clorură de argint saturată:
E.D.S. (Zn/ ZnSO4 // KCl/ AgCl/ Ag) =
Valoarea experimentală a potențialului unui electrod standard de zinc în raport cu un electrod de referință cu clorură de argint saturată:
E ( ) prin saturaţie clor - argint .. =
Valoarea experimentală a potențialului unui electrod standard de zinc în raport cu un electrod standard de referință cu hidrogen:
E ( ) conform standardului hidrogen. =
Atenţie! Având în vedere toxicitatea ridicată a sărurilor metalelor grele, toate soluțiile uzate nu sunt scurse în chiuvetă, ci sunt predate asistentului de laborator pentru eliminarea ulterioară.
2. Determinarea valorii potenţialului electrod standard al cuprului.
Ca și în pasul I, asamblați electrodul de cupru prin scufundarea tijei de cupru decapate într-o soluție de sulfat de cupru IM.
Compuneți o celulă galvanică din electrodul de cupru investigat și un electrod de referință saturat de clorură de argint.
Determinați EMF al celulei galvanice. Dați o notație condiționată pentru această celulă galvanică.
Care este potențialul electrodului de cupru peste electrodul de clorură de argint saturată?
Calculați potențialul electrodului de cupru în raport cu electrodul standard de hidrogen și comparați-l cu valoarea din tabel a potențialului electrodului standard de cupru:
E0 = 0,34 B
Notează valorile găsite:
E.D.S. (DINu/ CuSO4 // KCl/ AgCl/ Ag) =
E() prin saturație clor - argint .. =
E() prin electrod standard de hidrogen =
3. Definiție substanță chimică EMF element galvanic. (Element galvanic cupru-zinc).
Asamblați o celulă galvanică formată din zinc standard și electrozi standard de cupru (Fig. 2).
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Comparați valoarea obținută în experiment cu valoarea calculată (teoretică) Valoarea EMF pentru celulă galvanică cupru - zinc:
Teoria EMF. =E catod–E anod =
= E0(Cu+2/Cu0) - E0(Zn+2/Zn0) = 0,34 –(- 0,76) = 1,1B.
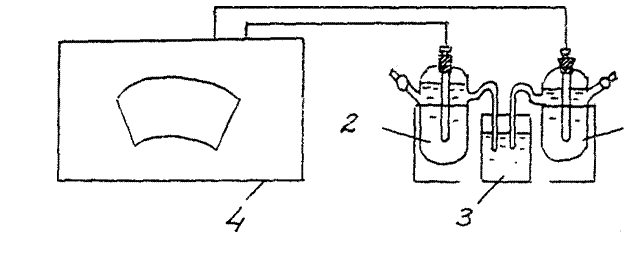 Fig. 2 Schema instalației pentru determinarea EMF a unei celule galvanice chimice:
Fig. 2 Schema instalației pentru determinarea EMF a unei celule galvanice chimice:
1 - electrod de cupru, 2 - electrod de zinc
3 - cheie electrolitică (un pahar cu o soluție de clorură de potasiu),
4 - potențiometru
Scrieți ecuațiile pentru procesele care au loc la catodul și anodul unei celule galvanice date în timpul funcționării acesteia.
4. Determinarea EMF a unei celule galvanice de concentrare.
Asamblați o celulă galvanică compusă dintr-un electrod de zinc standard (electrod de zinc scufundat într-o soluție de sare de zinc cu o concentrație de 1 mol/l) și un electrod de zinc scufundat într-o soluție de sare de zinc cu o concentrație de C = 10-2 mol/l (Fig. 3).
Zn/ ZnSO4 // Zn/ ZnSO4
Cm = 10-2 mol/l Cm = 10-2 mol/l
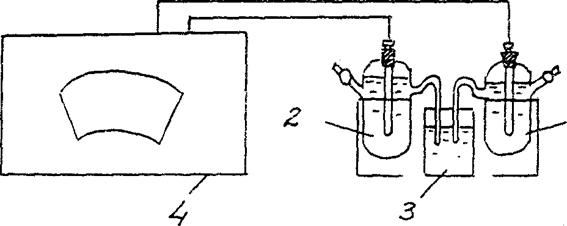
Fig.2 Schema de instalare pentru determinarea EMF a unei celule galvanice de concentrare:
1 - electrod de zinc în soluție de sare cu Cm = 10-2 mol/l ,
2 - electrod de zinc în soluție de sare cu Cm = 1 mol/l
3 - cheie electrolitică (soluție de clorură de potasiu),
4 - potențiometru
În conformitate cu instrucțiunile privind ordinea măsurătorilor folosind potențiometrul corespunzător, determinați EMF-ul acestei celule galvanice.
E.D.S.(Cu/ CuSO4 // Zn/ ZnSO4 )exp. =………..
Comparați valoarea obținută în experiment cu valoarea EMF calculată (teoretică) pentru o celulă galvanică de concentrație dată.




