Protectie de protectie. Cum să depășești rugina folosind remedii electrochimice
Coroziunea este o reacție chimică și electrochimică a unui metal cu mediul său, provocând deteriorarea acestuia. Curge cu viteze diferite, care pot fi reduse. Din punct de vedere practic, este de interes protecția catodică anticorozivă a structurilor metalice în contact cu solul, apa și mediile transportate. Suprafețele exterioare ale conductelor sunt afectate în special de influența solului și a curenților vagabonzi.
Coroziunea interioară depinde de proprietățile mediului. Dacă este un gaz, acesta trebuie curățat temeinic de umiditate și substanțe agresive: hidrogen sulfurat, oxigen etc.
Principiul de funcționare
Procesați obiectele coroziunea electrochimică sunt mediul, metalul și interfața dintre ele. Mediul, care este de obicei sol umed sau apă, are o conductivitate electrică bună. O reacție electrochimică are loc la interfața dintre aceasta și structura metalică. Dacă curentul este pozitiv (electrodul anod), ionii de fier trec în soluția din jur, rezultând o pierdere de masă a metalului. Reacția provoacă coroziune. Cu un curent negativ (electrod catod), aceste pierderi sunt absente, deoarece electronii trec în soluție. Metoda este utilizată în galvanizarea pentru acoperirea oțelului cu metale neferoase.
Protecția la coroziune catodică se realizează atunci când un potențial negativ este aplicat unui obiect de fier. 
Pentru a face acest lucru, un electrod anod este plasat în pământ și un potențial pozitiv este conectat la acesta de la o sursă de alimentare. Minusul se aplică obiectului protejat. Protecția catodic-anodică duce la distrugerea activă prin coroziune numai a electrodului anod. Prin urmare, ar trebui schimbat periodic.
Efectul negativ al coroziunii electrochimice
Coroziunea structurilor poate apărea din acțiunea curenților vagabonzi din alte sisteme. Sunt utile pentru obiectele țintă, dar provoacă daune semnificative structurilor din apropiere. Curenții vagabonzi se pot răspândi de pe șinele vehiculelor electrificate. Trec spre substație și intră în conducte. La părăsirea acestora, se formează secțiuni anodice, provocând coroziune intensă. Pentru protecție, se folosește drenajul electric - o îndepărtare specială a curenților de la conductă la sursa lor. Este posibil și aici.Pentru aceasta, este necesar să se cunoască magnitudinea curenților vagabonzi, care este măsurată prin dispozitive speciale. 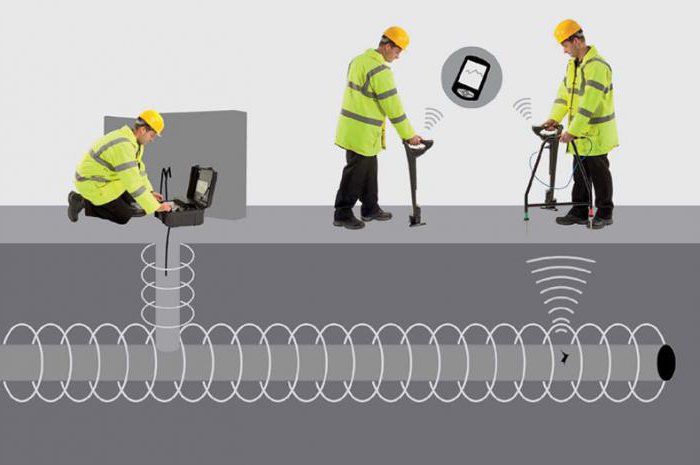
Pe baza rezultatelor măsurătorilor electrice, este selectată o metodă de protecție a conductei de gaz. Instrumentul universal este mod pasivîmpotriva contactului cu solul cu acoperiri izolatoare. Protecția catodă a conductei de gaz se referă la metoda activă. 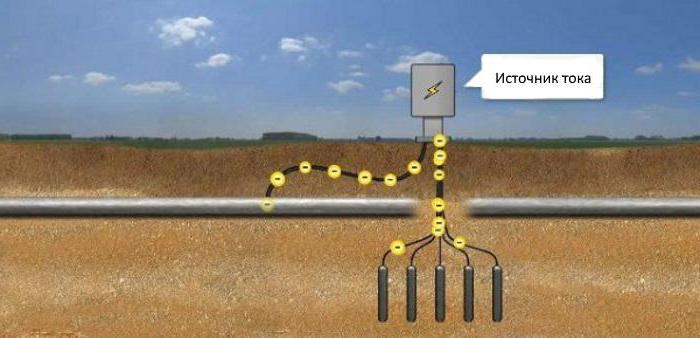
Protecția conductelor
Structurile din pământ sunt protejate împotriva coroziunii dacă sursa negativă este conectată la ele curent continuu, și plus - la electrozii anodici îngropați în apropiere în pământ. Curentul va ajunge la structură, protejând-o de coroziune. In acest fel se realizeaza protectia catodica a conductelor, rezervoarelor sau conductelor situate in pamant. 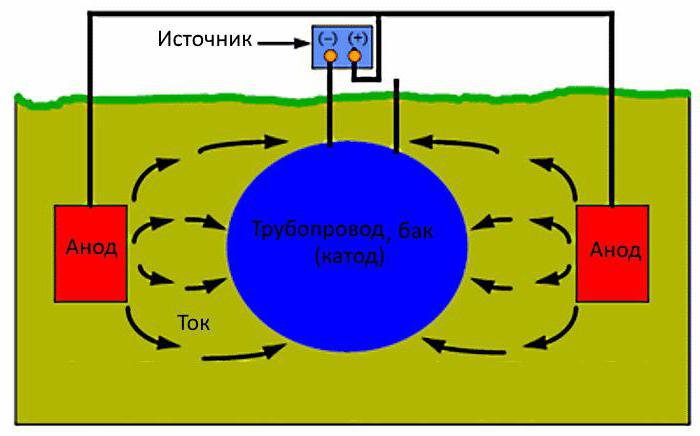
Electrodul anodului se va degrada și trebuie înlocuit periodic. Pentru un rezervor umplut cu apă, electrozii sunt plasați în interior. În acest caz, lichidul va fi electrolitul prin care curentul va curge de la anozi la suprafața recipientului. Electrozii sunt bine controlați și ușor de schimbat. Este mai dificil să faci asta în pământ.
Sursă de putere
În apropierea conductelor de petrol și gaze, în rețelele de încălzire și de alimentare cu apă care necesită protecție catodică, sunt instalate stații de la care se alimentează obiectele cu tensiune. Daca sunt amplasate in aer liber, gradul lor de protectie trebuie sa fie de cel putin IP34. Pentru camere uscate, oricare este potrivit.
Statii protectie catodica conductele de gaz și alte structuri mari au o capacitate de la 1 la 10 kW. 
Parametrii lor energetici depind în primul rând de următorii factori:
- rezistență între sol și anod;
- conductivitatea electrică a solului;
- lungimea zonei de protecție;
- efectul izolator al acoperirii.
În mod tradițional, un convertor de protecție catodică este o instalație de transformator. Acum este înlocuit cu unul cu invertor, care are dimensiuni mai mici, stabilitate de curent mai bună și eficiență mai mare. În zonele importante se instalează controlere care au funcții de reglare a curentului și tensiunii, egalizarea potențialelor de protecție etc.
Echipamentul este prezentat pe piață în diverse versiuni. Pentru nevoi specifice, o furnizare Condiții mai bune Operațiune.
Parametrii sursei curente
Pentru protecția împotriva coroziunii pentru fier, potențialul de protecție este de 0,44 V. În practică, ar trebui să fie mai mare din cauza influenței incluziunilor și a stării suprafeței metalice. Valoarea maximă este de 1 V. În prezența acoperirilor pe metal, curentul dintre electrozi este de 0,05 mA/m 2 . Dacă izolația este ruptă, aceasta crește la 10 mA/m 2 .
Protecția catodă este eficientă în combinație cu alte metode, deoarece se consumă mai puțină energie electrică. Dacă pe suprafața structurii există un strat de vopsea, numai locurile în care este spart sunt protejate prin metoda electrochimică.
Caracteristicile protecției catodice
- Stațiile sau generatoarele mobile servesc drept surse de energie.
- Locația electrozilor de împământare a anodului depinde de specificul conductelor. Metoda de plasare poate fi distribuită sau concentrată, precum și situată la diferite adâncimi.
- Materialul anodului este ales cu solubilitate scăzută pentru a rezista timp de 15 ani.
- Se calculează potențialul câmpului de protecție pentru fiecare conductă. Nu este reglementat dacă nu există acoperiri de protecție pe structuri.
Cerințe standard Gazprom pentru protecție catodică
- Acțiune pe toată perioada de funcționare a echipamentului de protecție.
- Protecție împotriva supratensiunilor atmosferice.
- Amplasarea stației în box-box sau separat în picioare în design anti-vandal.
- Împământarea anodului este selectată în zonele cu o rezistență electrică minimă a solului.
- Caracteristicile traductorului sunt selectate ținând cont de îmbătrânirea stratului de protecție al conductei.
Protectie de protectie
Metoda este un tip de protecție catodică cu conectarea electrozilor dintr-un metal mai electronegativ printr-un mediu conductiv electric. Diferența constă în absența unei surse de energie. Banda de rulare absoarbe coroziunea prin dizolvarea în mediul conductiv electric.
După câțiva ani, anodul trebuie înlocuit pe măsură ce se uzează.
Efectul anodului crește odată cu scăderea rezistenței sale de contact cu mediul. În timp, poate deveni acoperit cu un strat coroziv. Acest lucru duce la o defecțiune a contactului electric. Dacă anodul este plasat într-un amestec de săruri, care asigură dizolvarea produselor de coroziune, eficiența crește.
Influența protectorului este limitată. Raza de acțiune este determinată de rezistența electrică a mediului și diferența de potențial dintre
Protectie de protectie Se folosește în absența surselor de energie sau când utilizarea acestora nu este fezabilă din punct de vedere economic. De asemenea, este dezavantajos în aplicații acide datorită vitezei mari de dizolvare a anozilor. Protectoarele sunt instalate in apa, in sol sau intr-un mediu neutru. Anozii nu sunt de obicei fabricați din metale pure. Dizolvarea zincului are loc neuniform, magneziul se corodează prea repede și pe aluminiu se formează o peliculă puternică de oxizi.
Materiale de rulare
Pentru ca protectorii să aibă proprietățile de performanță necesare, acestea sunt realizate din aliaje cu următorii aditivi de aliere.
- Zn + 0,025-0,15% Cd + 0,1-0,5% Al - protectia echipamentelor situate in apa de mare.
- Al + 8% Zn +5% Mg + Cd, In, Gl, Hg, Tl, Mn, Si (fracții de procent) - funcționarea structurilor în apă de mare curgătoare.
- Mg + 5-7% Al + 2-5% Zn - protectia structurilor mici in sol sau in apa cu o concentratie mica de sare.
Utilizarea incorectă a unor tipuri de protector duce la consecințe negative. Anozii de magneziu pot provoca fisurarea echipamentelor din cauza dezvoltării fragilizării hidrogenului.
Protecția catodică sacrificială îmbinată cu acoperiri anticoroziune îi mărește eficacitatea. 
Distribuția curentului de protecție este îmbunătățită și sunt necesari mult mai puțini anozi. Un anod de magneziu protejează o conductă acoperită cu bitum pe o lungime de 8 km și fără acoperire - doar 30 m.
Protecția caroserii auto împotriva coroziunii
În cazul încălcării stratului de acoperire, grosimea caroseriei mașinii poate scădea în 5 ani la 1 mm, adică rugina. Restaurarea stratului de protecție este importantă, dar pe lângă aceasta, există o modalitate de a opri complet procesul de coroziune folosind protecție catodic-protectivă. Dacă transformați corpul într-un catod, coroziunea metalului se oprește. Anozii pot fi orice suprafețe conductoare situate în apropiere: plăci metalice, buclă de pământ, caroserie de garaj, suprafață de drum udă. În acest caz, eficiența protecției crește odată cu creșterea ariei anozilor. Dacă anodul este o suprafață de drum, se folosește o „coadă” de cauciuc metalizat pentru a-l contacta. Este plasat vizavi de roți pentru ca stropii să fie mai bine. „Coada” este izolată de corp.
Bateria plus este conectată la anod printr-un rezistor de 1 kΩ și un LED conectat în serie cu acesta. Când circuitul este închis prin anod, când minusul este conectat la corp, în modul normal LED-ul abia se aprinde vizibil. Dacă arde puternic, atunci a avut loc un scurtcircuit în circuit. Cauza trebuie găsită și eliminată.
Pentru protecție, o siguranță trebuie instalată în serie în circuit.
Când mașina se află în garaj, este conectată la un anod de împământare. În timpul mișcării, legătura are loc prin „coadă”.
Concluzie
Protecția catodică este o modalitate de a îmbunătăți fiabilitatea operațională a conductelor subterane și a altor structuri. În același timp, ar trebui să se țină seama de impactul său negativ asupra conductelor adiacente din cauza curenților vagabonzi.
Protecția de protecție a conductelor și a altor produse metalice împotriva coroziunii este una dintre opțiunile pentru protejarea diferitelor structuri de fenomenele negative de coroziune.
1 Esența protecției de protecție a metalelor împotriva coroziunii
Aceasta presupune atașarea unui protector special pe suprafața metalică protejată - un metal cu caracteristici mai electronegative. Când este dizolvat sub acțiunea aerului, un astfel de protector începe să-și îndeplinească funcția, care constă în protejarea produsului principal de distrugere.
De fapt, protecția sacrificială a conductelor și a altor conducte împotriva coroziunii este unul dintre tipurile de metode electrochimice catodice.
Metoda descrisă de tratare anticorozivă este optimă pentru situațiile în care întreprinderea nu are posibilitatea de a construi linii electrice speciale pentru organizarea unei protecții catodice eficiente împotriva sau construcția acestora este recunoscută ca fiind necorespunzătoare din punct de vedere economic. Protectorul își îndeplinește pe deplin sarcinile, cu condiția ca valoarea rezistenței tranzitorii dintre mediul care înconjoară obiectul prelucrat și același obiect să fie mică.
Protecția de protecție a produselor metalice împotriva coroziunii este eficientă numai la o anumită distanță. Pentru stabilirea acestei distanțe se introduce conceptul de rază de acțiune anticorozivă a protectorului utilizat. Indică cea mai mare îndepărtare a metalului de protecție din structura protejată.

Esența coroziunii metalelor este de așa natură încât cele mai puțin active dintre ele, atunci când interacționează, vor atașa ionilor săi electronii celor mai active, care vor fi produși de componenta activă a sistemului. Ca urmare, două procese simultane au loc simultan:
- reducerea unui metal mai puțin activ (este un catod);
- oxidarea unui metal anod mai puțin activ, datorită căreia are loc protecția anticoroziune a unei conducte de gaz, a altei rețele principale sau a oricărei structuri metalice.
După un anumit timp, acțiunea protectorului se termină (din cauza pierderii contactului cu metalul protejat sau când „protectorul” este complet dizolvat), după care va trebui înlocuit.
2 Protectie anticoroziva cu protectoare - caracteristici ale tehnicii
Utilizarea protecției de protecție împotriva coroziunii conductelor și structurilor metalice în medii acide nu are sens, din cauza ratei crescute de autodizolvare a protectorului. Este recomandat pentru utilizare în medii neutre, fie că este vorba de sol obișnuit, apă de râu sau de mare.
În raport cu fierul, următoarele metale sunt mai active - magneziu, crom, cadmiu, zinc și altele. Teoretic, acestea ar trebui folosite pentru a proteja o conductă de gaz sau o altă structură. Dar aici există o serie de nuanțe care fac inutilă din punct de vedere tehnologic utilizarea metalelor pure ca „apărători”.
Magneziul în formă pură, de exemplu, se caracterizează printr-o viteză crescută a propriei ruginări, pe aluminiu apare foarte repede o peliculă groasă de oxid, iar zincul, fără impurități, datorită structurii sale dendritice cu granulație grosieră, tinde să se dizolve extrem de inegal. Pentru a nivela toate aceste fenomene negative, metalelor pure se adaugă componente de aliere menite să protejeze conductele și structurile metalice de coroziune. Cu alte cuvinte, protecția anticorozivă, de exemplu, a unei conducte de gaz, a unui rezervor subteran, în cele mai multe cazuri, se realizează folosind diferite aliaje.
Sunt adesea folosite aliaje pe bază de magneziu. În ele sunt introduse aluminiu (de la 5 la 7 la sută) și zinc (de la 2 la 5 la sută), precum și cantități mici (literal sutimi sau zecimi) de nichel, plumb și cupru. Protecția împotriva coroziunii cu aliaje de magneziu este utilizată atunci când o structură metalică (elemente ale conductelor, conductelor de gaz și așa mai departe) funcționează în medii cu o valoare a pH-ului de cel mult 10,5 (sol obișnuit, rezervoare cu apă dulce sau ușor sărată).
Această limitare se datorează faptului că magneziul se dizolvă mai întâi foarte repede, iar apoi pe suprafața sa se formează compuși caracterizați prin dizolvare dificilă. Merită menționat separat pericolul utilizării compozițiilor de magneziu pentru protecția împotriva coroziunii - acestea pot provoca fisurarea produselor metalice, precum și fragilizarea acestora (hidrogen).
Pentru structurile metalice instalate în apă sărată, o conductă de gaz așezată pe fundul mării, se recomandă utilizarea de protecție pe bază de zinc, care conțin:
- cadmiu (de la 0,025 la 0,15%);
- aluminiu (nu mai mult de 0,5%);
- cupru, plumb, fier (de la 0,001 la 0,005% în total).

Protecția de protecție a conductelor din apa de mare cu compoziții de zinc va fi garantată a fi eficientă și de lungă durată. Dacă astfel de protectori sunt utilizați în sol sau în corpurile de apă dulce, aceștia sunt aproape instantaneu acoperiți cu hidroxizi și oxizi, ceea ce anulează toate măsurile anticorozive.
Dar în apa curgătoare sărată, pe raftul mării de coastă, se folosesc de obicei protectori de coroziune din aluminiu. Conțin taliu, cadmiu, siliciu, indiu (în total până la 0,02%), magneziu (nu mai mult de 5%) și zinc (nu mai mult de 8%). Această compoziție nu permite apariția oxizilor pe aluminiu. Protecția benzii de rulare din compușii de aluminiu este utilizată în aceleași condiții ca și din magneziu.
Protectoarele din zinc sunt utilizate de obicei pentru protecția anticoroziune a acelor structuri metalice pentru care trebuie asigurată siguranță maximă la incendiu și explozie (în special, diverse conducte pentru transportul materialelor potențial combustibile, de exemplu, o conductă de gaz). De asemenea, compozițiile de protecție cu zinc nu creează compuși poluanți în timpul dizolvării anodice. Din acest motiv, practic nu există nici un substitut pentru ele atunci când vine vorba de protecția împotriva coroziunii a conductelor care transportă petrol, precum și a petrolierelor și a navelor de marfă și a tancurilor.
3 Utilizarea combinată de vopsele și lacuri și protectori
Adesea, protecția unei conducte de petrol sau de gaz, o anumită structură metalică împotriva manifestărilor de coroziune este realizată printr-o combinație de protecție a benzii de rulare și a vopselei. Acesta din urmă este în mod inerent clasificat ca o metodă pasivă de protecție împotriva coroziunii. Nu oferă rezultate cu adevărat ridicate, dar permite în combinație cu un protector:

- pentru a nivela eventualele defecte ale acoperirii conductelor și structurilor metalice care apar din cauze naturale (decojirea metalului, umflarea acestuia, umflarea, crăparea și așa mai departe), precum și în timpul utilizării lor (nu există o astfel de conductă de gaz sau cisternă). , a cărui acoperire nu suferă anumite modificări);
- reduce (uneori destul de semnificativ) consumul de materiale destul de scumpe pentru benzi de rulare, crescând în același timp durata de viață a acestora;
- pentru a asigura distribuția curentului de protecție pe suprafața metalică a conductelor cât mai uniform (uniform) posibil.

Adăugăm că, în multe cazuri, este destul de dificil să aplicați straturi de vopsea pe unele secțiuni ale unui rezervor, conductă de gaz sau vas de apă care funcționează deja. Atunci este mai bine, bineînțeles, să nu compliceți procesul și să folosiți numai protectori.
Protecția electrochimică a structurilor metalice împotriva manifestărilor de coroziune se bazează pe impunerea unui potențial negativ asupra produsului protejat. Demonstrează un nivel ridicat de eficiență în cazurile în care structurile metalice sunt supuse distrugerii electrochimice active.
1 Esența protecției electrochimice anticorozive
Orice structură metalică începe să se descompună în timp, ca urmare a coroziunii. Din acest motiv, suprafețele metalice sunt în mod necesar acoperite cu compuși speciali constând din diverse elemente anorganice și organice înainte de utilizare. Astfel de materiale în timpul anumită perioadă protejați fiabil metalul de oxidare (rugina). Dar după un timp trebuie să fie actualizate (aplicați compuși noi).
Atunci când stratul de protecție nu poate fi reînnoit, protecția împotriva coroziunii a conductelor, caroseriei și altor structuri se realizează folosind o tehnică electrochimică. Este indispensabil pentru protecția împotriva ruginării rezervoarelor și containerelor care funcționează în subteran, a fundului navelor maritime, a diverselor utilitati subterane când potențialul de coroziune (se numește liber) se află în zona de repasivare a metalului de bază al produsului sau de dizolvare activă a acestuia.
esență protectie electrochimica constă în faptul că la structura metalică este conectat din exterior un curent electric constant, care formează pe suprafața structurii metalice polarizarea electrozilor de tip catodic ai cuplurilor microgalvanice. Ca urmare, pe suprafața metalului se observă transformarea regiunilor anodice în regiuni catodice. După o astfel de transformare, influența negativă a mediului este percepută de anod, și nu de materialul din care este realizat produsul protejat.

Protecția electrochimică poate fi fie catodică, fie anodică. La potențialul catodic al metalului este deplasat spre partea negativă, la anod - spre pozitiv.
2 Protecție electrică catodică - cum funcționează?
Mecanismul procesului, dacă îl înțelegeți, este destul de simplu. Un metal scufundat într-o soluție electrolitică este un sistem cu un număr mare de electroni, care include zone catodice și anodice separate în spațiu, închise electric între ele. Această stare de fapt se datorează structurii electrochimice eterogene a produselor metalice (de exemplu, conducte subterane). Pe zonele anodice ale metalului se formează manifestări de coroziune datorită ionizării acestuia.

Când un material cu un potențial ridicat (negativ) este atașat de metalul de bază în electrolit, se observă formarea unui catod comun datorită procesului de polarizare a zonelor catodice și anodice. În acest caz, un potențial mare este înțeles ca fiind o astfel de valoare care depășește potențialul reacției anodice. În cuplul galvanic format, materialul cu un potențial scăzut al electrodului se dizolvă, ceea ce duce la suspendarea coroziunii (deoarece ionii din produs metalic nu poate intra în soluție).
Necesar pentru a proteja caroseria mașinii, rezervoarele și conductele subterane, fundul navelor, curentul electric poate proveni dintr-o sursă externă, și nu doar din funcționarea unui cuplu microgalvanic. Într-o astfel de situație, structura protejată este conectată la „minusul” sursei de curent electric. Anodul, realizat din materiale cu un grad scăzut de solubilitate, este conectat la „plusul” sistemului.
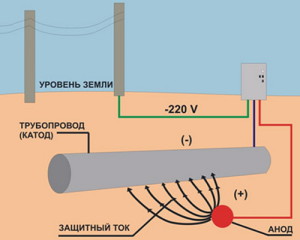
Daca curentul se obtine numai din cupluri galvanice, se vorbeste de un proces cu anozi de sacrificiu. Și atunci când se utilizează curent dintr-o sursă externă, vorbim despre protecția conductelor, a părților vehiculelor și a vehiculelor de apă folosind curent suprapus. Utilizarea oricăreia dintre aceste scheme asigură o protecție de înaltă calitate a obiectului împotriva degradarii generale a coroziunii și a unui număr de opțiuni speciale ale acestuia (selectiv, pitting, cracking, intergranular, contact).
3 Cum funcționează tehnica anodică?
Această tehnică electrochimică pentru protejarea metalelor împotriva coroziunii este utilizată pentru structurile realizate din:
- oțeluri carbon;
- materiale diferite pasivate;
- foarte aliat și;
- aliaje de titan.
Schema anodică presupune o schimbare a potențialului oțelului protejat într-o direcție pozitivă. Mai mult, acest proces continuă până când sistemul intră într-o stare pasivă stabilă. O astfel de protecție împotriva coroziunii este posibilă în medii care conduc bine curentul electric. Avantajul tehnicii anodice este că încetinește semnificativ rata de oxidare a suprafețelor protejate.

În plus, o astfel de protecție poate fi realizată prin saturarea mediului corosiv cu componente oxidante speciale (nitrați, bicromați și altele). În acest caz, mecanismul său este aproximativ identic cu metoda tradițională de polarizare anodică a metalelor. Agenții oxidanți măresc semnificativ efectul procesului catodic asupra suprafeței oțelului, dar de obicei afectează negativ mediul prin eliberarea de elemente agresive în acesta.
Protecția anodică este utilizată mai rar decât protecția catodică, deoarece sunt prezentate multe cerințe specifice pentru obiectul protejat (de exemplu, calitate impecabilă suduri conducte sau caroserie, prezența constantă a electrozilor în soluție etc.). Catozii în tehnologia anodică sunt aranjați conform unei scheme strict definite, care ia în considerare toate caracteristicile structurii metalice.

Pentru tehnica anodului, se folosesc elemente puțin solubile (catozii sunt alcătuiți din ei) - platină, nichel, aliaje inoxidabile de înalt aliaj, plumb, tantal. Instalația în sine pentru o astfel de protecție împotriva coroziunii constă din următoarele componente:
- structura protejata;
- sursa actuala;
- catod;
- electrod de referință special.
Este permis să se aplice protectie anodica pentru rezervoarele în care se depozitează îngrășăminte minerale, compuși de amoniac, acid sulfuric, pentru instalații cilindrice și schimbătoare de căldură operate la uzine chimice, pentru rezervoare în care se execută nichelarea chimică.
4 Caracteristici de protecție a benzii de rulare din oțel și metal
Destul de des folosită versiunea protecției catodice este tehnologia utilizării materialelor speciale de protecție. Cu o tehnică similară, un metal electronegativ este conectat la structură. Într-o anumită perioadă de timp, coroziunea afectează protectorul și nu obiectul protejat. După ce protectorul se defectează la un anumit nivel, în schimb au pus un nou „apărător”.
Protecția electrochimică de protecție este recomandată pentru prelucrarea obiectelor aflate în sol, aer, apă (adică în medii neutre din punct de vedere chimic). În același timp, va fi eficient numai atunci când există o oarecare rezistență de tranziție între mediu și materialul de protecție (valoarea acestuia variază, dar în orice caz este mică).

În practică, dispozitivele de protecție sunt utilizate atunci când este inutil din punct de vedere economic sau fizic imposibil să furnizeze sarcina necesară de curent electric unui obiect din oțel sau metal. Este demn de remarcat separat faptul că materialele de protecție sunt caracterizate de o anumită rază, la care se extinde efectul lor pozitiv. Din acest motiv, este necesar să se calculeze corect distanța pentru a le îndepărta din structura metalică.
Protectori populari:
- Magneziu. Sunt utilizate în medii cu un pH de 9,5–10,5 unități (pământ, apă dulce și cu conținut scăzut de sare). Fabricat din aliaje pe bază de magneziu cu aliaje suplimentare cu aluminiu (nu mai mult de 6–7%) și zinc (până la 5%). Pentru mediul înconjurător, astfel de protectori care protejează obiectele împotriva coroziunii sunt potențial nesiguri din cauza faptului că pot provoca fisurarea și fragilizarea prin hidrogen a produselor metalice.
- Zinc. Aceste „protectoare” sunt indispensabile structurilor care funcționează în apă cu un conținut ridicat de sare. Nu are sens să le folosiți în alte medii, deoarece hidroxizii și oxizii apar pe suprafața lor sub forma unei pelicule groase. Protectorii pe bază de zinc conțin adaosuri minore (până la 0,5%) de fier, plumb, cadmiu, aluminiu și alte elemente chimice.
- Aluminiu. Ele sunt utilizate în apele curgătoare ale mării și la instalațiile situate pe platforma de coastă. Protectorii din aluminiu conțin magneziu (aproximativ 5%) și zinc (aproximativ 8%), precum și cantități foarte mici de taliu, cadmiu, siliciu și indiu.

În plus, se folosesc uneori protectoare de fier, care sunt fabricate din fier fără aditivi sau din oțeluri carbon obișnuite.
5 Cum se realizează schema catodică?
Fluctuațiile de temperatură și razele ultraviolete provoacă daune grave tuturor componentelor și componentelor externe ale vehiculelor. Protecția caroseriei și a altor elemente ale acesteia împotriva coroziunii prin metode electrochimice este recunoscută ca fiind foarte bună mod eficient extinderea idealului aspect mașini.
Principiul de funcționare a unei astfel de protecție nu este diferit de schema descrisă mai sus. Atunci când protejați caroseria mașinii de rugină, funcția anodului poate fi îndeplinită de aproape orice suprafață care este capabilă să conducă curentul electric de înaltă calitate (suprafață udă a drumului, plăci metalice, structuri de oțel). Catodul este direct corpul vehiculului.

Metode elementare de protecție electrochimică a caroseriei mașinii:
- Conectăm prin firul de montare și un rezistor suplimentar la plusul bateriei caroseria garajului în care stă mașina. Această protecție împotriva coroziunii caroseriei mașinii este deosebit de productivă vara, când există un efect de seră în garajul auto. Acest efect protejează doar părțile exterioare ale mașinii de oxidare.
- Montam o "coada" metalizata de impamantare speciala din cauciuc in spatele vehiculului, astfel incat sa cad picaturi de umezeala pe acesta in timp ce conduceti pe vreme ploioasa. La umiditate ridicată, se formează o diferență de potențial între autostradă și caroseria mașinii, care protejează părțile exterioare ale vehiculului de oxidare.
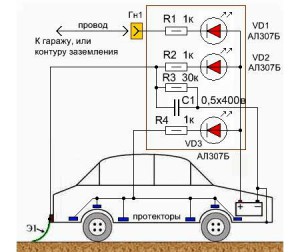
De asemenea, protectia caroseriei masinii se realizeaza cu ajutorul unor protectii. Sunt montate pe pragurile mașinii, pe fund, sub aripi. Protectorii in acest caz sunt placi mici din platina, magnetit, carboxil, grafit (anozi care nu se defecteaza in timp), precum si din aluminiu si otel inoxidabil (trebuie schimbate la cativa ani).
6 Nuanțe de protecție anticorozivă a conductelor
Sistemele de conducte sunt în prezent protejate prin drenare și tehnici electrochimice catodice. La protejarea conductelor de coroziune conform schemei catodice, se folosesc următoarele:
- Surse externe de curent. Plusul lor va fi conectat la împământarea anodului, iar minusul la conducta în sine.
- Anozi de protecție folosind curent de la perechi galvanice.

Tehnica catodica presupune polarizarea suprafetei de otel protejate. În același timp, conductele subterane sunt conectate la „minusul” complexului de protecție catodică (de fapt, este o sursă de curent). „Plus” este conectat la un electrod extern suplimentar folosind un cablu special, care este realizat din cauciuc conductor sau grafit. Această schemă vă permite să obțineți un circuit închis, care include următoarele componente:
- electrod (exterior);
- electrolit în solul unde sunt așezate conductele;
- conducte direct;
- cablu (catod);
- sursa actuala;
- cablu (anodic).
Pentru protecția benzii de rulare a conductelor se folosesc materiale pe bază de aluminiu, magneziu și zinc, a căror eficiență este de 90% atunci când se folosesc protectori pe bază de aluminiu și zinc și de 50% pentru protectori din aliaje de magneziu și magneziu pur.

Pentru protecția drenajului sistemelor de conducte, se folosește tehnologia de deviere a curenților vagabonzi în pământ. Există patru opțiuni pentru conductele de drenaj - polarizate, pământ, armate și drepte. Cu drenaj direct și polarizat, jumperii sunt plasați între „minusul” curenților vagabonzi și conductă. Pentru un circuit de protecție la pământ, este necesar să se facă împământare cu ajutorul electrozilor suplimentari. Și cu drenarea îmbunătățită a sistemelor de conducte, se adaugă un convertor la circuit, care este necesar pentru a crește magnitudinea curentului de drenaj.
Există două grupe principale de metode pentru prevenirea distrugerii (sau reducerea intensității) metalelor sub influența factorilor externi (în primul rând umiditatea) - active și pasive. Prima este protecția electrochimică. Cu una dintre aceste metode de combatere a coroziunii - banda de rulare (galvanică) - cititorul se va putea familiariza în acest articol.
Principiul de funcționare
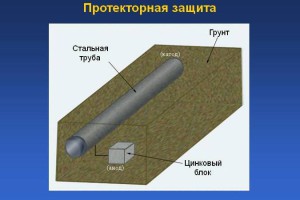
Scopul protecției benzii de rulare este reducerea maximă a potențialului materialului de bază, care asigură protecția acestuia împotriva distrugerii prin coroziune. Acest lucru se face prin atașarea unui electrod special, care este adesea denumit „anod de sacrificiu”. Este selectat dintr-un metal mai activ în raport cu baza. Astfel, protectorul este expus în primul rând la coroziune, prin urmare, durabilitatea unuia sau altuia element structural cu care este conectat () crește.
Eficiența protecției benzii de rulare
considerată foarte ridicată. În ciuda faptului că en / costurile pentru implementarea protecției sacrificiale împotriva coroziunii sunt relativ mici. Dacă utilizarea unui anod de magneziu cu parametrii corespunzători previne distrugerea metalului conductei, de exemplu, aproximativ 7,5 km, atunci fără el - doar 25 - 30 m.
Când să folosiți protecția benzii de rulare
Există suficiente moduri de a face față coroziunii și întotdeauna există o alegere. Utilizarea unui „anod de sacrificiu” este recomandabilă:
- dacă întreprinderea nu are capacitățile necesare pentru a implementa alte metode mai costisitoare;
- dacă este necesar, protejați structurile mici;
- pentru protecția anticorozivă a produselor metalice (obiectelor) cu un strat de suprafață (izolare). Aceleași conducte.
Eficacitatea maximă a protecției de protecție se atinge dacă este utilizată în medii numite electrolitice. De exemplu, apa de mare.
Ce metale sunt folosite ca protectoare
De regulă, protecția benzii de rulare a produselor din fier și aliajele acestuia (oțel) se referă în principal. În comparație cu acestea, metalele precum zincul, cromul, aluminiul, cadmiul și magneziul sunt mai active. Deși aceasta nu este singura opțiune posibilă.
O caracteristică a fabricării „anozilor de sacrificiu” este că aceste materiale nu sunt luate în forma lor pură pentru producerea lor. Ca materii prime se folosesc diferite aliaje pe baza acestora. Acest lucru ține cont de specificul utilizării protectorilor. În primul rând, în ce mediu este planificat să ofere protecție împotriva coroziunii.
De exemplu, dacă un electrod de zinc este plasat în sol uscat, atunci eficacitatea acestuia va fi practic zero. Prin urmare, alegerea unuia sau altuia protector este determinată de condițiile locale.
Există următoarele metode de protecție.
1) Tratarea mediului în care are loc coroziune. Esența metodei este fie de a îndepărta din mediu acele substanțe care acționează ca depolarizant, fie de a izola metalul de depolarizator. De exemplu, substanțe speciale sau fierbere sunt folosite pentru a elimina oxigenul din apă. Se numește îndepărtarea oxigenului dintr-un mediu coroziv dezaerare . Este posibil să încetiniți procesul de coroziune cât mai mult posibil prin introducerea de substanțe speciale în mediu - inhibitori . Sunt folosiți pe scară largă inhibitorii volatili și de fază de vapori, care protejează articolele din metale feroase și neferoase de coroziunea atmosferică în timpul depozitării, transportului etc. Mecanismul de acțiune al inhibitorilor este acela că moleculele lor sunt adsorbite pe suprafața metalului, împiedicând derularea proceselor cu electrozi.
DAR (-) Cr| H2O, O2 | Fe(+)K
la anod: Cr-2e→ Cr2+
pe catod: 2H 2 O+O 2 + 4e → 4OH -
Cr2+ + 2OH - → Cr(OH)2
Hidroxidcromul (II) este oxidat de oxigenul atmosferic la Cr (OH) 3:
4 Cr(OH)2 + 2H2O + O2→ 4Cr(OH)3
Astfel, ca urmare a coroziunii electrochimice, învelișul anodic este distrus.
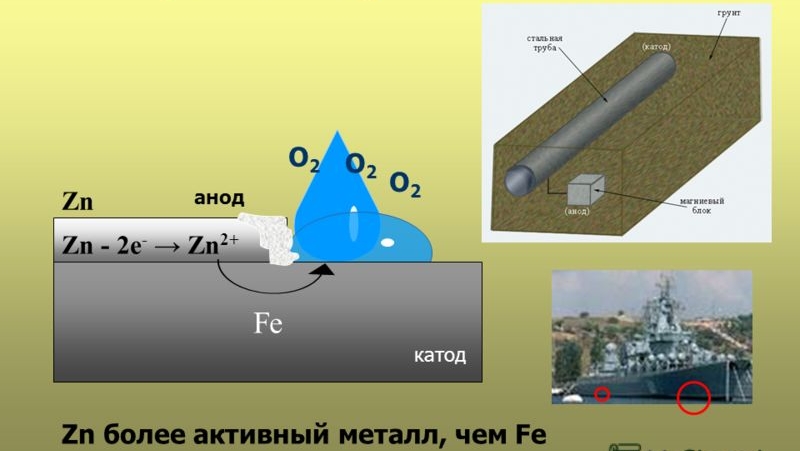
acoperiri catodice . Învelișul catodic are un potențial de electrod standard mai pozitiv decât metalul protejat. Atâta timp cât stratul de acoperire izolează metalul de mediu, coroziunea electrochimică nu are loc. Dacă continuitatea stratului catodic este întreruptă, acesta încetează să protejeze metalul de coroziune. Mai mult, chiar intensifică coroziunea metalului de bază, deoarece în cuplul galvanic rezultat, anodul este metalul de bază, care va fi distrus. Un exemplu este acoperirea cu tablă pe fier (fier cositor). Luați în considerare munca unei celule galvanice care are loc în acest caz.
DAR (-) Fe| H2O, O2 | Sn (+) K
la anod: Fe-2e→ Fe2+
pe catod: 2H 2 O+O 2 + 4e → 4OH -
Fe 2+ + 2 OH - → Fe(OH)2
Metalul protejat este distrus. Astfel, când se compară proprietățile acoperirilor anodice și catodice, se poate concluziona că acoperirile anodice sunt cele mai eficiente. Acestea protejează metalul de bază chiar dacă integritatea acoperirii este compromisă, în timp ce acoperirile catodice protejează metalul doar mecanic.
3) Protecție electrochimică. Există două tipuri de protecție electrochimică: catodică și de protecție. În ambele cazuri, sunt create condiții pentru apariția unui potențial electronegativ ridicat pe metalul protejat.
Protectie de protectie . Produsul protejat de coroziune este combinat cu un rest de metal dintr-un metal mai electronegativ (banda de rulare). Acest lucru este echivalent cu crearea unei celule galvanice, în care protectorul este anodul şi va fi distrus. De exemplu, pentru a proteja structurile subterane (conducte), fier vechi (protector) este îngropat la o oarecare distanță de acestea, atașându-l de structură (Figura 8.3).




