Fenolul se formează prin interacțiune. Obținerea de fenol
1. Fenoli- derivaţi ai hidrocarburilor aromatice, în moleculele cărora gruparea hidroxil (-OH) este legată direct de atomii de carbon din ciclul benzenic.
2. Clasificarea fenolilor
Există un, doi, trei fenoli atomici în funcție de numărul de grupări OH din moleculă:
În funcție de numărul de cicluri aromatice condensate din moleculă, se disting fenolii înșiși (un inel aromatic - derivați de benzen), naftoli (2 inele condensate - derivați de naftalenă), antranoli (3 inele condensate - derivați de antracen) și fenantoli:
3. Izomeria și nomenclatura fenolilor
Există 2 tipuri de izomerie:
- izomeria poziţiei substituenţilor în ciclul benzenic
- izomeria lanțului lateral (structurile radicalului alchil și numărul de radicali)
Pentru fenoli, denumirile banale care s-au dezvoltat istoric sunt utilizate pe scară largă. Prefixele sunt folosite și în denumirile fenolilor mononucleari substituiți orto-,meta-și pereche -, utilizate în nomenclatura compuşilor aromatici. Pentru compușii mai complecși, atomii care alcătuiesc inelele aromatice sunt numerotați și poziția substituenților este indicată cu ajutorul indicilor digitali.
4. Structura moleculei
Gruparea fenil C6H5- și hidroxil-OH se influențează reciproc
- perechea de electroni singuratică a atomului de oxigen este atrasă de norul de 6 electroni al inelului benzenic, datorită căruia legătura O–H este și mai polarizată. Fenolul este un acid mai puternic decât apa și alcoolii.
- În inelul benzenic, simetria norului de electroni este întreruptă, densitatea electronică crește în pozițiile 2, 4, 6. Acest lucru face ca legăturile C-H din pozițiile 2, 4, 6 să fie mai reactive și - legăturile inelului benzenic.
5. Proprietăți fizice
Majoritatea fenolilor monoatomici în condiții normale sunt substanțe cristaline incolore cu un punct de topire scăzut și un miros caracteristic. Fenolii sunt slab solubili în apă, ușor solubili în solvenți organici, toxici și se întunecă treptat atunci când sunt depozitați în aer ca urmare a oxidării.
Fenol C6H5OH (acidul carbolic ) - o substanță cristalină incoloră se oxidează în aer și devine roz, la temperaturi obișnuite este puțin solubilă în apă, peste 66 ° C este miscibilă cu apa în orice raport. Fenolul este o substanță toxică, provoacă arsuri ale pielii, este un antiseptic.
6. Proprietăți toxice
Fenolul este otrăvitor. Provoacă disfuncții ale sistemului nervos. Praful, vaporii și soluția de fenol irită membranele mucoase ale ochilor, căilor respiratorii și ale pielii. Odată ajuns în organism, Fenolul este absorbit foarte repede chiar și prin zonele intacte ale pielii și după câteva minute începe să acționeze asupra țesutului cerebral. În primul rând, există o excitație pe termen scurt și apoi paralizia centrului respirator. Chiar și atunci când este expus la doze minime de fenol, se observă strănut, tuse, dureri de cap, amețeli, paloare, greață și pierderea forței. Cazurile severe de otrăvire se caracterizează prin inconștiență, cianoză, dificultăți de respirație, insensibilitate a corneei, puls rapid, abia perceptibil, transpirație rece, adesea convulsii. Adesea, fenolul este cauza cancerului.
7. Aplicarea fenolilor
1. Productia de rasini sintetice, materiale plastice, poliamide
2. Medicamente
3. Coloranți
4. Surfactanți
5. Antioxidanți
6. Antiseptice
7. Explozivi
8. Obținerea fenolului în industrie
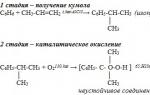
unu). Metoda cumenului pentru producerea fenolului (URSS, Sergeev P.G., Udris R.Yu., Kruzhalov B.D., 1949). Avantajele metodei: tehnologie fără deșeuri (randament produse utile > 99%) și economie. În prezent, metoda cumenului este utilizată ca principală în producția mondială de fenol.

2). Din gudron de cărbune (ca produs secundar - randament scăzut):
C 6 H 5 ONa + H 2 SO 4 (razb) → C 6 H 5 - OH + NaHSO 4
fenolat de sodiu
(imaginea produsuluicizme de rășinăsodă caustică)
3). Din halobenzeni :
De la 6 H5-CI + NaOH t , p→ C6H5-OH + NaCI
4). Fuziunea sărurilor acizilor sulfonici aromatici cu alcaline solide :
C6H5-S03Na + NaOH t → Na2S03 + C6H5-OH
sare de sodiu
acizi benzensulfonici
9. Proprietățile chimice ale fenolului (acidul carbolic)
eu . Proprietățile grupării hidroxil
Proprietăți acide- sunt mai pronunțate decât în alcoolii saturați (culoarea indicatorilor nu se schimbă):
- cu metale active-
2C 6 H 5 -OH + 2Na → 2C 6 H 5 -ONa + H 2
fenolat de sodiu
- Cu alcalii-
C6H5-OH + NaOH (soluție apoasă)↔ C6H5-ONa + H2O
! Fenolați - săruri ale unui acid carbolic slab, descompuse de acidul carbonic -
C6H5-ONa + H20+CuO2 → C6H5-OH + NaHC03
În ceea ce privește proprietățile acide, fenolul este de 10 ori superior etanolului. În același timp, este inferior acidului acetic cu aceeași cantitate. Spre deosebire de acizii carboxilici, fenolul nu poate înlocui acidul carbonic din sărurile sale.
C 6 H 5 - Oh + NaHCO 3 = reacția nu merge - fiind perfect solubilă în soluții apoase de alcaline, de fapt nu se dizolvă într-o soluție apoasă de bicarbonat de sodiu.
Proprietățile acide ale fenolului sunt îmbunătățite sub influența grupărilor de atragere de electroni asociate cu inelul benzenic ( NU 2 - , Br - )
2,4,6-trinitrofenolul sau acidul picric este mai puternic decât carbonicul
II . Proprietățile inelului benzenic
1). Influența reciprocă a atomilor din molecula de fenol se manifestă nu numai în comportamentul grupării hidroxi (vezi mai sus), ci și în reactivitatea mai mare a inelului benzenic. Gruparea hidroxil crește densitatea electronilor în inelul benzenic, în special în orto-și pereche- prevederi (+ M-efectul grupei OH):
Prin urmare, fenolul este mult mai activ decât benzenul în reacțiile de substituție electrofilă din ciclul aromatic.
- Nitrare. Sub acțiunea acidului azotic 20% HNO 3, fenolul este ușor transformat într-un amestec orto-și pereche- nitrofenoli:
Când se utilizează HNO3 concentrat, se formează 2,4,6-trinitrofenol ( acid picric):
- Halogenare. Fenolul interacționează ușor cu apa cu brom la temperatura camerei pentru a forma un precipitat alb de 2,4,6-tribromofenol (reacție calitativă pentru fenol):
- Condens cu aldehide. De exemplu:
2). Hidrogenarea fenolului
C6H5-OH + 3H2 Ni, 170ºC→ C6H11-OH alcool ciclohexil (ciclohexanol)
fenoli - substanţe organice ale căror molecule conţin un radical fenil asociat cu una sau mai multe grupări hidroxo. Exact ca alcoolurile fenolii se clasifică prin atomicitate, adică prin numărul de grupări hidroxil.
Fenoli monotomici conțin o grupare hidroxil în moleculă:

Fenoli polihidric conțin mai mult de o grupare hidroxil în molecule:

Există, de asemenea, fenoli polihidroxici care conțin trei sau mai multe grupări hidroxil în ciclul benzenic.
Să ne familiarizăm mai detaliat cu structura și proprietățile celui mai simplu reprezentant al acestei clase - fenolul C 6 H 5 OH. Numele acestei substanțe a stat la baza denumirii întregii case de marcat - fenoli.
Proprietățile fizice ale fenolului
Fenolul este o substanță cristalină solidă, incoloră, punct de topire=43°C, punctul de fierbere=181°C, cu miros caracteristic ascuțit.Otrăvitoare.Fenolul se dizolvă ușor în apă la temperatura camerei. O soluție apoasă de fenol se numește acid carbolic. La contactul cu pielea, provoacă arsuri, prin urmare, fenolul trebuie manevrat cu mare atenție!
Proprietățile chimice ale fenolului
 Fenolii sunt mai activi în majoritatea reacțiilor de legătură O–H, deoarece această legătură este mai polară datorită deplasării densității electronilor de la atomul de oxigen către inelul benzenic (participarea perechii de electroni singuri a atomului de oxigen la conjugarea p). sistem). Aciditatea fenolilor este mult mai mare decât cea a alcoolilor. Pentru fenoli, reacțiile de rupere a legăturii C-O nu sunt tipice, deoarece atomul de oxigen este ferm legat de atomul de carbon al inelului benzenic datorită participării perechii sale de electroni singuri în sistemul de conjugare. Influența reciprocă a atomilor din molecula de fenol se manifestă nu numai în comportamentul grupării hidroxi, ci și în reactivitatea mai mare a inelului benzenic. Gruparea hidroxil crește densitatea electronilor în inelul benzenic, în special în pozițiile orto și para (grupări OH)
Fenolii sunt mai activi în majoritatea reacțiilor de legătură O–H, deoarece această legătură este mai polară datorită deplasării densității electronilor de la atomul de oxigen către inelul benzenic (participarea perechii de electroni singuri a atomului de oxigen la conjugarea p). sistem). Aciditatea fenolilor este mult mai mare decât cea a alcoolilor. Pentru fenoli, reacțiile de rupere a legăturii C-O nu sunt tipice, deoarece atomul de oxigen este ferm legat de atomul de carbon al inelului benzenic datorită participării perechii sale de electroni singuri în sistemul de conjugare. Influența reciprocă a atomilor din molecula de fenol se manifestă nu numai în comportamentul grupării hidroxi, ci și în reactivitatea mai mare a inelului benzenic. Gruparea hidroxil crește densitatea electronilor în inelul benzenic, în special în pozițiile orto și para (grupări OH)
Proprietățile acide ale fenolului
Atomul de hidrogen al grupării hidroxil este acid. pentru că Deoarece proprietățile acide ale fenolului sunt mai pronunțate decât cele ale apei și alcoolilor, atunci fenolul reacționează nu numai cu metalele alcaline, ci și cu alcalii pentru a forma fenolați:

Aciditatea fenolilor depinde de natura substituenților (donator sau acceptor de densitate de electroni), poziția față de grupa OH și numărul de substituenți. Cea mai mare influență asupra acidității OH a fenolilor o exercită grupările situate în pozițiile orto și para. Donatorii măresc puterea legăturii O-H (reducând astfel mobilitatea hidrogenului și proprietățile acide), acceptorii reduc puterea legăturii O-H, în timp ce aciditatea crește:

Cu toate acestea, proprietățile acide ale fenolului sunt mai puțin pronunțate decât cele ale acizilor anorganici și carboxilici. Deci, de exemplu, proprietățile acide ale fenolului sunt de aproximativ 3000 de ori mai mici decât cele ale acidului carbonic. Prin urmare, prin trecerea dioxidului de carbon printr-o soluție apoasă de fenolat de sodiu, fenolul liber poate fi izolat.

Adăugarea de acid clorhidric sau sulfuric la o soluție apoasă de fenolat de sodiu duce, de asemenea, la formarea de fenol:

Reacție calitativă la fenol
Fenolul reacționează cu clorura de fier(3) pentru a forma un compus complex de culoare violet intens.Această reacție îi permite să fie detectat chiar și în cantități foarte limitate.Alți fenoli care conțin una sau mai multe grupări hidroxil în inelul benzenic dau, de asemenea, o culoare albastru-violet strălucitoare în reacție cu clorura de fier(3).
Reacții ale inelului benzenic al fenolului
Prezența unui substituent hidroxil facilitează foarte mult cursul reacțiilor de substituție electrofilă în ciclul benzenic.
- Bromurarea fenolului. Spre deosebire de benzen, bromurarea fenolului nu necesită adăugarea unui catalizator (bromură de fier(3)). În plus, interacțiunea cu fenolul are loc selectiv (selectiv): atomii de brom sunt trimiși către orto-și pereche- pozitii, inlocuind atomii de hidrogen situati acolo. Selectivitatea substituției este explicată prin caracteristicile structurii electronice a moleculei de fenol discutate mai sus.
Deci, atunci când fenolul interacționează cu apa cu brom, se formează un precipitat alb de 2,4,6-tribromofenol:

Această reacție, precum și reacția cu clorura de fier(3), servește la detectarea calitativă a fenolului.
2.Nitrarea fenolului de asemenea, apare mai ușor decât nitrarea benzenului. Reacția cu acid azotic diluat are loc la temperatura camerei. Rezultatul este un amestec orto-și paro izomerii nitrofenolului:

Când se utilizează acid azotic concentrat, 2,4,6, trinitrifenol-acid picric, se formează un exploziv:

3. Hidrogenarea inelului aromatic al fenoluluiîn prezența unui catalizator trece ușor:

4.Policondensarea fenolului cu aldehide,în special, cu formaldehida are loc cu formarea produselor de reacție - rășini fenol-formaldehidă și polimeri solizi.
Interacțiunea fenolului cu formaldehida poate fi descrisă prin schema:

Molecula dimer reține atomi de hidrogen „mobili”, ceea ce înseamnă că reacția poate fi continuată cu o cantitate suficientă de reactivi:

Reacţie policondensare, acestea. reacția de producere a polimerului, care procedează cu eliberarea unui produs secundar cu molecularitate scăzută (apa), poate continua mai departe (până când unul dintre reactivi este consumat complet) cu formarea de macromolecule uriașe. Procesul poate fi descris prin ecuația generală:

Formarea moleculelor liniare are loc la temperatura obișnuită. Efectuarea aceleiași reacții în timpul încălzirii duce la faptul că produsul rezultat are o structură ramificată, este solid și insolubil în apă.Ca urmare a încălzirii unei rășini liniare fenol-formaldehidă cu un exces de aldehidă, mase plastice solide cu unic se obțin proprietăți. Polimerii pe bază de rășini fenol-formaldehidice sunt utilizați pentru fabricarea lacurilor și vopselelor, produse din plastic rezistente la încălzire, răcire, apă, alcalii, acizi.Au proprietăți dielectrice ridicate. Polimerii pe bază de rășini fenol-formaldehidă sunt utilizați pentru a realiza cele mai critice și importante părți ale aparatelor electrice, carcaselor unităților de alimentare și pieselor de mașini, baza polimerică a plăcilor de circuite imprimate pentru dispozitive radio. Adezivii pe bază de rășini fenol-formaldehidă sunt capabili să conecteze în mod fiabil părți de diferite naturi, menținând cea mai mare rezistență de aderență într-un interval de temperatură foarte larg. Un astfel de adeziv este folosit pentru a atașa baza metalică a lămpilor de iluminat pe un bec de sticlă.Astfel, fenolul și produsele pe bază de acesta sunt utilizate pe scară largă.
Utilizarea fenolilor
Fenolul este o substanță solidă cu un miros caracteristic care provoacă arsuri atunci când intră în contact cu pielea. Otrăvitoare. Se dizolvă în apă, soluția sa se numește acid carbolic (antiseptic). Ea a fost primul antiseptic introdus în operație. Este utilizat pe scară largă pentru producerea de materiale plastice, medicamente (acid salicilic și derivații săi), coloranți, explozivi.
Fenol, o substanță chimică de origine organică, aparține grupului de hidrocarburi aromatice.
În 1842, organicul francez Auguste Laurent a reușit să obțină formula fenolului (C6H5OH), constând dintr-un inel benzenic și o grupare hidroxi OH. Fenolul are mai multe denumiri care sunt folosite atât în literatura științifică, cât și în vorbirea colocvială și a apărut din compoziția acestei substanțe. Astfel, fenolul este adesea numit oxibenzen sau acidul carbolic.
Fenolul este otrăvitor. Praful și soluția de fenol irită membranele mucoase ale ochilor, căilor respiratorii și ale pielii. Posedă proprietăți ușor acide, sub acțiunea alcalinelor formează săruri - fenolați. Sub acțiunea bromului se formează tribromofenol, care este folosit pentru a obține un antiseptic - xeroform. Nucleul benzenului și grupa OH combinate în molecula de fenol se afectează reciproc, crescând semnificativ reactivitatea reciprocă. De o importanță deosebită sunt reacțiile de condensare ale fenolilor cu aldehide și cetone, în urma cărora se obțin produse polimerice.
Proprietățile fizice ale fenolului
Proprietățile chimice ale fenolului
Fenolul este o substanță cristalină albă, cu un miros ascuțit de dulce-zahăr caracteristic, care se oxidează ușor atunci când este expus la aer, devenind mai întâi roz, iar după un timp o culoare maro bogată. O caracteristică a fenolului este solubilitatea sa excelentă nu numai în apă, ci și în alcool, mediu alcalin, benzen și acetonă. În plus, fenolul are un punct de topire foarte scăzut și se lichefiază ușor la +42°C și are, de asemenea, proprietăți acide slabe. Prin urmare, atunci când interacționează cu alcalii, fenolul formează săruri numite fenolați.
În funcție de tehnologia de producție și de scop, fenolul este produs în trei grade: A, B și C conform GOST 23519-93. Mai jos sunt specificațiile sale tehnice.
Caracteristicile tehnice ale fenolului conform GOST 23519-93
|
Numele indicatorului |
Sens | ||
| Nota A | Mark B | Clasa B | |
| Aspect | alb cristalin substanţă |
cristal alb- chesky in-in. Permis roz sau nuanță gălbuie |
|
| Temperatura de cristalizare, °С, nu mai scăzută | 40,7 | 40,6 | 40,4 |
| Fracția de masă a reziduului nevolatil, %, max | 0,001 | 0,008 | 0,01 |
| Densitatea optică a unei soluții apoase de fenol (8,3 g marca A, 8,0 g marca B, 5,0 g marca C în 100 cm3 de apă) la 20 °C, nu mai mult |
0,03 | 0,03 | 0,03 |
| Densitatea optică a fenolului sulfonat, nu mai mult de | 0,05 | Nu raționați | |
| Culoarea topiturii fenolului în funcție de platină-cobalt scară, unități Hazen: |
|||
| de la producător, nu mai mult | 5 | Nu raționați | |
| la consumator: | |||
| în timpul transportului prin conducte și rezervoare din oțel inoxidabil, nu mai mult |
10 | La fel | |
| atunci când sunt transportate în rezervoare din carbon otel si zincat, nu mai mult |
20 | >> | |
| Fracție de masă de apă, %, nu mai mult | 0,03 | Nu raționați | |
| Fracția de masă a impurităților organice totale, %, max | 0,01 | Nu raționați | |
| inclusiv oxid de mesitil, %, nu mai mult | 0,0015 | 0,004 | Nu raționați |
| sume de -metilstiren și izopropilbenzen (cumen), %, max | Nu raționați | 0,01 | La fel |
Metode de obținere a fenolului
În forma sa pură, fenolul nu se găsește în natură; este un produs artificial al chimiei organice. În prezent, există trei modalități principale de obținere a fenolului la scară industrială. Cota principală a producției sale revine așa-numitei metode cumpole, care implică oxidarea compusului organic aromatic izopropilbenzen cu aer. Ca urmare a unei reacții chimice, se obține hidroperoxid de cumpol, care, la interacțiunea cu acidul sulfuric, se descompune în acetonă, urmată de precipitarea fenolului sub formă de precipitat cristalin. Pentru producție se folosește și metilbenzen (toluen), ca urmare a oxidării căreia se formează această substanță chimică și acidul benzoic. În plus, în unele industrii, cum ar fi producția de cocs metalurgic, fenolul este eliberat din gudronul de cărbune. Cu toate acestea, această metodă de producție este neprofitabilă din cauza consumului crescut de energie. Printre cele mai recente realizări ale industriei chimice se numără producția de fenol prin interacțiunea benzenului cu acidul acetic, precum și clorurarea oxidativă a benzenului.
Pentru prima dată în volume industriale, fenolul a fost obținut de compania germană BASF în 1899, prin sulfonarea benzenului cu acid sulfuric. Tehnologia producerii sale a constat în faptul că, ulterior, acidul sulfonic a fost supus la topire alcalină, în urma căreia s-a format fenol. Această metodă a fost folosită de mai bine de 100 de ani, dar în a doua jumătate a secolului XX, industria chimică a fost nevoită să o abandoneze din cauza cantității uriașe de deșeuri de sulfit de sodiu, care era un produs secundar al sintezei organice a fenol.
În prima jumătate a secolului XX, compania americană Dow Chemical a introdus o altă metodă de producere a fenolului, prin clorurarea benzenului, care a fost numit procesul Raschig. Metoda sa dovedit a fi destul de eficientă, deoarece greutatea specifică a substanței rezultate a atins 85%. Ulterior, aceeași companie a introdus metoda de oxidare a metilbenzolului cu descompunerea ulterioară a acidului benzoic, însă, din cauza dezactivării problematice a catalizatorului, astăzi este folosit de aproximativ 3-4% din industria chimică.
Cea mai eficientă este metoda cumpole pentru producerea de fenol, care a fost dezvoltată de chimistul sovietic Pyotr Sergeev și introdusă în producție în 1942. Prima fabrică de cumpole, construită în 1949 în orașul Dzerjinsk, regiunea Gorki, a fost capabilă să asigure o treime din cererea de fenol a URSS.
Domeniul de aplicare al fenolului
Inițial, fenolul a fost folosit pentru a produce diferite tipuri de coloranți, datorită capacității sale de a-și schimba culoarea în timpul oxidării de la o nuanță roz pal la o nuanță maro. Această substanță chimică se găsește în multe tipuri de vopsele sintetice. În plus, proprietatea fenolului de a distruge bacteriile și microorganismele a fost adoptată în industria pielii la tăbăcirea pieilor de animale. Mai târziu, fenolul a fost folosit cu succes în medicină ca unul dintre mijloacele de dezinfecție și dezinfecție a instrumentelor și spațiilor chirurgicale și ca soluție apoasă de 1,4% - ca analgezic și antiseptic pentru uz intern și extern. În plus, fenolul acidului salicilic este baza aspirinei, iar derivatul său, acidul para-aminosalicilic, este utilizat pentru tratarea bolnavilor de tuberculoză. Fenolul face, de asemenea, parte dintr-un puternic medicament laxativ - purgen.
În prezent, scopul principal al fenolului este industria chimică, unde această substanță este utilizată pentru fabricarea materialelor plastice, a rășinilor fenol-formaldehidice, a fibrelor artificiale precum nailon și nailon, precum și a diverși antioxidanți. În plus, fenolul este folosit pentru producerea de plastifianți, aditivi pentru uleiuri și este unul dintre componentele care compun produsele de protecție a plantelor. Fenolul este, de asemenea, utilizat activ în inginerie genetică și biologie moleculară, ca mijloc de purificare și izolare a moleculelor de ADN.
Proprietățile nocive ale fenolului
Aproape imediat după obținerea fenolului, oamenii de știință au descoperit că această substanță chimică nu numai că are proprietăți utile, ceea ce îi permite să fie utilizat în diferite domenii ale științei și producției, dar este și o otravă puternică. Deci, inhalarea vaporilor de fenol pentru o perioadă scurtă de timp poate duce la iritarea nazofaringelui, arsuri ale tractului respirator și edem pulmonar ulterior cu un rezultat fatal. Când o soluție de fenol intră în contact cu pielea, se formează arsuri chimice, care ulterior se transformă în ulcere. Dacă mai mult de 25 la sută din piele este tratată cu o soluție, atunci aceasta poate provoca moartea unei persoane. Ingestia de fenol în organism cu apă potabilă duce la dezvoltarea ulcerului peptic, atrofie musculară, coordonare afectată a mișcărilor și sângerare. În plus, oamenii de știință au descoperit că fenolul este cauza cancerului, contribuie la dezvoltarea insuficienței cardiace și a infertilității.
Datorită proprietății de oxidare, vaporii acestei substanțe chimice se dizolvă complet în aer după aproximativ 20-25 de ore. Când este eliberat în sol, fenolul își păstrează proprietățile toxice pe tot parcursul zilei. Cu toate acestea, în apă, viabilitatea sa poate ajunge la 7-12 zile. Prin urmare, calea cea mai probabilă pentru ca această substanță toxică să pătrundă în corpul uman și pe piele este apa contaminată.
În compoziția materialelor plastice, fenolul nu își pierde proprietățile volatile, prin urmare utilizarea materialelor plastice fenolice în industria alimentară, producția de articole de uz casnic și jucării pentru copii este strict interzisă astăzi. De asemenea, utilizarea lor nu este recomandată pentru finisarea spațiilor rezidențiale și de birouri, unde o persoană petrece cel puțin câteva ore pe zi. De regulă, fenolul este excretat din organism cu transpirație și urină în 24 de ore, dar în acest timp reușește să provoace daune ireparabile sănătății umane. Datorită proprietăților dăunătoare din multe țări ale lumii, există o restricție privind utilizarea acestei substanțe în scopuri medicale.
Conditii de transport si depozitare
Există standarde internaționale pentru transportul fenolului, concepute pentru a evita eliberarea substanței în mediu.
Fenolul este transportat pe calea ferată în conformitate cu regulile de transport de mărfuri în rezervoare echipate cu dispozitiv de încălzire. Rezervoarele vor fi realizate din oțel inoxidabil crom-nichel, oțel carbon placat cu zinc sau oțel carbon. Fenolul, destinat producției de produse medicale, este transportat în cisterne feroviare din oțel inoxidabil crom-nichel și oțel carbon zincat. Fenolul este de asemenea transportat printr-o conductă încălzită din oțel inoxidabil crom-nichel.
Fenolul în stare topită și solidă este depozitat în rezervoare etanșate din oțel inoxidabil crom-nichel, oțel carbon zincat sau oțel carbon, precum și în rezervoare din aluminiu solid. Se permite depozitarea fenolului în stare topită sub azot (fracția de volum a oxigenului din azot nu trebuie să depășească 2%) la o temperatură de (60 ± 10) °C timp de 2-3 zile. atunci când este depozitat în recipiente de aluminiu, temperatura trebuie controlată strict pentru a evita dizolvarea aluminiului în produs.
Compuși cu una sau mai multe grupări hidroxil atașate la inelul benzenic; se numesc fenoli. Cel mai important dintre acestea este fenolul însuși:
Fenolul a fost descoperit în 1834 când a fost izolat din gudronul de cărbune. La început a fost numit acid carbolic, iar acest nume este folosit și astăzi pentru fenolul lichid care conține 5% apă. Fenolul și-a primit numele actual în 1841.
Toți cei mai simpli fenoli în condiții normale sunt solide cu un punct de topire scăzut. Fenolul este o substanță cristalină incoloră cu un punct de topire de 43°C. Are un miros caracteristic. La fel ca alcoolii, fenolii au puncte de fierbere mai mari decât ar fi de așteptat din greutatea lor moleculară relativă. Acest lucru se datorează formării legăturilor de hidrogen intermoleculare în fenoli. S-a remarcat deja mai sus că 2-nitrofenolul are un punct de fierbere mai mic decât 4-nitrofenolul. Acest lucru se explică prin existența unei legături de hidrogen intramoleculare în primul dintre acești compuși, în timp ce al doilea compus are legături de hidrogen intermoleculare, care îl fac mai puțin volatil (vezi Secțiunea 2.2).
Fenolii sunt slab solubili în apă, dar foarte solubili în solvenți organici, în special alcooli și eteri. Fenolul este miscibil limitat cu apa numai la temperaturi sub 66°C. Peste 66°C, fenolul este miscibil cu apa în orice proporție (vezi Figura 6.22 și Secțiunea 6.2).
Metode de laborator de obţinere
Pentru a obține fenol în condiții de laborator, o sare de sodiu anhidră a acidului benzensulfonic este topită la 300-350 ° C cu hidroxid de sodiu solid, apoi se adaugă acid clorhidric diluat la amestec:

Acidul benzensulfonic este preparat prin sulfonarea benzenului (vezi pct. 18.2). Neutralizarea acestui acid cu hidroxid de sodiu duce la formarea sării sale de sodiu.
Fenolul se obține și prin încălzirea peste 10 ° C a unei soluții apoase de clorură de fenildiazoniu:

Clorura de fenildiazoniu se obţine prin diazotizarea fenilaminei (vezi pct. 19.4).
Proprietățile chimice ale fenolilor
Reacții ale grupării hidroxil. Aciditate. Fenolul are o constantă de aciditate de 9,95. Astfel, are proprietățile unui acid slab, deși mai puternic decât metanolul, etanolul și apa (vezi tabelul. 19.4). Fenolația formată ca urmare a clivajului ionic este stabilizată datorită delocalizării
sarcina negativa:

Poate fi considerat ca un hibrid al formelor de rezonanță indicate (vezi secțiunile 2.1 și 18.2).
La fel ca alcoolii, fenolul reacționează cu metale foarte electropozitive, cum ar fi sodiul, pentru a elibera hidrogen:

Cu toate acestea, spre deosebire de alcooli, fenolii reacţionează cu hidroxidul de sodiu:

Fenolul nu este la fel de acid ca acizii carboxilici. Acizii carboxilici, cum ar fi acetic sau benzoic, sunt capabili să înlocuiască dioxidul de carbon din bicarbonatul de sodiu sau carbonatul de sodiu, dar fenolul nu este. Această reacție este utilizată în scopuri analitice pentru a distinge acizii carboxilici de fenoli.
Formarea esterilor. Deși fenolul nu reacționează cu acizii carboxilici pentru a forma esteri, reacționează cu clorurile de acid carboxilic în soluții alcaline:

Acest tip de reacție se numește acilare.
Formarea eterilor. Fenolul reacţionează cu haloalcanii într-un mediu alcalin, formând eteri:

Această reacție este un exemplu de sinteză Williamson (vezi secțiunea anterioară).
Reacția cu pentaclorură de fosfor. Spre deosebire de alcooli, fenolul nu reacționează cu halogenurile de hidrogen și trihalogenurile de fosfor. Cu toate acestea, reacționează lent cu pentaclorură de fosfor pentru a forma clorobenzen cu randament scăzut:

Reacția cu clorura de fier (III). Când se adaugă fenol o soluție neutră de clorură de fier (III), se formează un complex care are o culoare violet. Această reacție este utilizată ca test analitic pentru fenol. Această reacție este caracteristică compușilor care conțin o grupare enol.

Reacția în inelul benzenic. Inelul benzenic din molecula de fenol suferă o substituție electrofilă mai ușor decât benzenul însuși. Acest lucru se datorează faptului că electronii care nu se leagă de pe atomul de oxigen sunt atrași în inelul benzenic și, prin urmare, îl activează. Gruparea hidroxil a fenolului are un efect de direcție 2,4 asupra substituenților electrofili (vezi secțiunea 18.2).
Halogenare. Halogenarea fenolilor se realizează în condiții mult mai blânde decât halogenarea benzenului. De exemplu, când se adaugă apă cu brom la o soluție apoasă de fenol, se formează un precipitat alb de 2,4,6-tribromofenol:

În sec. 18.2 s-a afirmat că bromurarea benzenului necesită prezența unui catalizator.
Nitrare. Fenolul poate fi nitrat cu acid azotic diluat. În acest caz, se formează un amestec de 2-nitrofenol și 4-nitrofenol:

Să comparăm din nou aceste condiții blânde cu condițiile pentru reacția corespunzătoare a benzenului. Nitrarea benzenului trebuie efectuată într-un amestec de acid azotic concentrat și acid sulfuric (a se vedea secțiunea 18.2).
2-nitrofenolul și 4-nitrofenolul sunt acizi mai puternici decât fenolul. Ambele sunt caracterizate de valori aproximativ egale cu 7,2. Aciditatea crescută a nitrofenolilor se explică prin faptul că grupul nitro atrage electroni spre sine. Ca rezultat, inelul benzenic trage electronii mai puternic din atomul de oxigen al grupării hidroxil.
Sulfonare. Reacția fenolului cu acidul sulfuric concentrat duce la formarea unui amestec de acizi hidroxibenzensulfonici:

Acid hidroxibenzensulfonic (randament 85%)
Ambele produse ale acestei reacții reacționează cu acidul azotic concentrat, formând 2,4,6-trinitrofenol - o substanță cristalină galbenă, cunoscută sub numele banal de "acid picric":

Datorită acțiunii comune de atragere de electroni a celor trei grupări nitro, acidul picric este un acid relativ puternic. Se caracterizează printr-o constantă de aciditate apropiată de 1, iar atunci când interacționează cu o soluție de carbonat de sodiu, înlocuiește dioxidul de carbon din aceasta.
Reacții combinate. O soluție alcalină de fenol reacționează cu o soluție de clorură de fenildiazoniu, rezultând formarea unui precipitat portocaliu de 4-hidroxifenilazo-benzen:

Acest produs este un colorant azoic. O reacție de acest tip se numește reacție de cuplare (în acest caz, cuplare azoică).
DEFINIȚIE
Fenolii- derivaţi ai hidrocarburilor aromatice, în moleculele cărora grupările hidroxil sunt legate direct de atomii de carbon din ciclul benzenic. Grupa funcțională, ca și alcoolii, este OH.
Fenolul este o substanță cristalină solidă, incoloră, cu punct de topire scăzut, foarte higroscopică, cu miros caracteristic. În aer, fenolul se oxidează, astfel încât cristalele sale capătă inițial o nuanță roz (Fig. 1) și se întunecă și devin mai roșii în timpul depozitării pe termen lung. Este ușor solubil în apă la temperatura camerei, dar se dizolvă rapid și bine la 60 - 70 o C. Fenolul este fuzibil, punctul său de topire este de 43 o C. Otrăvitor.
Orez. 1. Fenol. Aspect.
Obținerea de fenol
La scară industrială, fenolul este obținut din gudron de cărbune. Printre metodele de laborator cele mai des utilizate se numără următoarele:
– hidroliza clorobenzenului
C6H5CI + NaOH→C6H5OH + NaCI (kat = Cu, t0).
— topirea alcalină a sărurilor acizilor arenesulfonici
C6H5SO3Na + 2NaOH → C6H5OH + Na2S03 + H2O (t0).
– metoda cumenului (oxidarea izopropilbenzenului)
C6H5-C (CH3) H-CH3 + O2 → C6H5OH + CH3-C(O)-CH3 (H+, t0).
Proprietățile chimice ale fenolului
Transformările chimice ale fenolului au loc în principal prin scindare:
1) Conexiuni O-N
- interacțiunea cu metalele
2C6H5OH + 2Na→ 2C6H5ONa + H2.
- interacțiunea cu alcalii
C6H5OH + NaOH → C6H5ONa + H2O.
— interacțiunea cu anhidridele acizilor carboxilici
C6H5-OH + CI-C(O)-O-C(O)-CH3 → C6H5-O-C (O)-CH3 + CH3COOH (t0).
- interacţiunea cu halogenuri de acid carboxilic
C6H5-OH + CI-C(O)-CH3 → C6H5-O-C(O)-CH3 + HCI (t0).
- interacțiune cu FeCl 3 (reacție calitativă la fenol - aspectul unei culori violet care dispare la adăugarea acidului)
6C 6 H 5 OH + FeCl 3 → (C 6 H 5 OH) 3 + 3CI -.
2) conexiuni C sp 2 -H predominant în despre- și n-dispoziții
- bromurare
C6H5-OH + 3Br2(aq) →Br3-C6H2-OH↓ + 3HBr.
- nitrarea (formarea acidului picric)
C6H5-OH + 3HONO2 (conc) → (NO2)3-C6H2-OH + 3H2O (H+).
3) un singur nor de electroni de 6π al inelului benzenic
– hidrogenare
C 6 H 5 OH + 3H 2 → C 6 H 11 -OH (kat \u003d Ni, t 0 \u003d 130 - 150, p \u003d 5 - 20 atm).
Aplicarea fenolului
Fenolul este utilizat în cantități mari pentru producerea de coloranți, materiale plastice fenol-formaldehide și substanțe medicinale.
Dintre fenolii diatomici, resorcinolul este folosit în medicină ca antiseptic și ca substanță pentru unele teste clinice, iar hidrochinona și alți fenoli diatomici sunt utilizați ca dezvoltatori în prelucrarea materialelor fotografice.
În medicină, lizolul, care include diverși fenoli, este folosit pentru a dezinfecta încăperile și mobilierul.
Unii fenoli sunt folosiți ca antioxidanți - substanțe care previn alterarea alimentelor în timpul depozitării pe termen lung (grăsimi, uleiuri, concentrate alimentare).
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | O soluţie apoasă conţinând 32,9 g de fenol a fost tratată cu un exces de brom. Calculați masa derivatului brom rezultat. |
| Decizie | Să scriem ecuația reacției pentru interacțiunea fenolului cu bromul: C6H5OH + 3Br2 → C6H2Br3OH + 3HBr. Ca rezultat al acestei interacțiuni, se formează 2,4,6-tribromofenol. Calculați cantitatea de substanță fenolică (masa molară este de 94 g/mol): n (C6H5OH) \u003d m (C6H5OH) / M (C6H5OH); n (C 6 H 5 OH) \u003d 32,9 / 94 \u003d 0,35 mol. Conform ecuației reacției n(C6H5OH) :n(C6H2Br3OH) = 1:1, adică. n (C 6 H 2 Br 3 OH) \u003d n (C 6 H 5 OH) \u003d 0,35 mol. Apoi masa de 2,4,6-tribromofenol va fi egală cu (masa molară -331 g / mol): m (C 6 H 2 Br 3 OH) \u003d 0,35 × 331 \u003d 115,81 g. |
| Răspuns | Masa derivatului brom rezultat este de 115,81 g. |
EXEMPLUL 2
| Exercițiu | Cum să obțineți fenol din iodobenzen? Calculați masa de fenol care poate fi obținută din 45,9 g de iodobenzen. |
| Decizie | Scriem ecuația de reacție pentru producerea de fenol din iodobenzen: C6H5I + NaOH → C6H5OH + Nal (kat = Cu, t0). |