صيغة التفاعل الكيميائي. الخلايا الجلفانية و emf
3.5.1 الجهد الكهربائي عند حدود الطور
عندما يتلامس موصل من النوع الأول (قطب كهربائي) مع مذيب قطبي (ماء) أو محلول إلكتروليت في واجهة القطب السائلة ، فإن ما يسمى طبقة كهربائية مزدوجة (DES). على سبيل المثال ، فكر في قطب كهربائي نحاسي مغمور في الماء أو في محلول من كبريتات النحاس.
عند غمر قطب كهربائي نحاسي في الماء ، يدخل جزء من أيونات النحاس الموجودة في عقد الشبكة البلورية ، نتيجة للتفاعل مع ثنائيات أقطاب الماء ، في المحلول. ستحافظ الشحنة السالبة التي تنشأ في نفس الوقت على القطب الكهربي على الأيونات التي مرت إلى المحلول في الفضاء القريب من القطب الكهربي - تتشكل طبقة كهربائية مزدوجة (الشكل 3.12 أ ؛ بالنسبة لنماذج بنية DEL ، انظر القسم 4.2 .4). ستمنع الشحنة السالبة على القطب الكهربائي مزيدًا من انتقال أيونات النحاس إلى المحلول ، وبعد مرور بعض الوقت سيتم إنشاء توازن ديناميكي ، والذي يمكن تمييزه بشكل لا لبس فيه من خلال إمكانات المجال الكهربائي ، اعتمادًا على الشحنة الموجودة في قطب كهربائي ، أو عن طريق بعض تركيز الاتزان للأيونات في الطبقة القريبة من القطب C o. عندما يتم غمر قطب كهربائي نحاسي في محلول CuSO 4 يحتوي على أيونات النحاس بتركيز C ، فمن الممكن حدوث ثلاث حالات:
أرز. 3.12مخطط طبقة كهربائية مزدوجة في واجهة محلول القطب
1. ج< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в طبقة سطحيةسيكون محلول الكاتيونات أكثر من الأنيونات (الشكل 3.9 أ).
2. C> C o. نظرًا لأن تركيز أيونات النحاس في الطبقة السطحية أكبر من تركيز أيونات التوازن ، سيبدأ انتقال الأيونات من المحلول إلى القطب ؛ تنشأ شحنة موجبة على القطب الكهربي ويسود SO4 2- الأنيونات في الطبقة السطحية (الشكل 3.12 ب).
3. C \ u003d C o. نظرًا لأن تركيز أيونات النحاس في الطبقة السطحية يساوي توازن واحد (تسمى هذه الحلول صفر) ، فلا توجد شحنة على القطب ، ولا تتشكل طبقة كهربائية مزدوجة.
3.5.2 خلية كلفانية. EMF لخلية كلفانية
ضع في اعتبارك أبسط خلية جلفانية Daniel-Jacobi ، تتكون من خليتين نصفيتين - صفائح الزنك والنحاس ، موضوعة في محاليل من الزنك وكبريتات النحاس ، على التوالي ، والتي يتم ربطها ببعضها البعض عن طريق مفتاح كهربائي - على سبيل المثال ، شريط من الورق مبلل بمحلول بعض المنحل بالكهرباء. من الناحية التخطيطية ، يصور هذا العنصر على النحو التالي:
Zn / Zn2 + // Cu2 + / Cu
على سطح كل من الأقطاب الكهربائية ، يوجد توازن ديناميكي لانتقال أيونات المعادن من القطب إلى المحلول والعكس بالعكس ، يتميز بإمكانية EDL (شحنة القطب الكهربائي q). إذا قمت بتوصيل أقطاب النحاس والزنك بموصل معدني ، فستحدث على الفور إعادة توزيع الشحنات - ستبدأ الإلكترونات في الانتقال من قطب ذي شحنة سالبة أكثر (في حالتنا ، الزنك) إلى قطب كهربائي بشحنة موجبة أكثر (النحاس )، بمعنى آخر. تيار كهربائي سوف يتدفق في الموصل. يؤدي التغيير في قيمة الشحن لكل من الأقطاب الكهربائية إلى اضطراب التوازن - على قطب الزنك ، ستبدأ عملية انتقال الأيونات من القطب إلى المحلول (أكسدة المعدن) ، على القطب النحاسي - من المحلول إلى القطب (تخفيض المعادن) ؛ في هذه الحالة ، يتسبب مسار العملية على أحد القطبين في حدوث العملية المعاكسة في وقت واحد على الآخر:
Zn o ––> Zn 2+ + 2е -
النحاس 2+ + 2e - ––> النحاس o
يسمى القطب الذي تحدث عليه عملية الأكسدة أثناء تشغيل خلية كلفانية الأنود، القطب الذي تجري عليه عملية الاسترداد - الكاثود. مع تمثيل تخطيطي الخلايا الجلفانيةالأنود مكتوب على اليسار ، والكاثود مكتوب على اليمين (قطب الهيدروجين القياسي مكتوب دائمًا على اليسار). يتم التعبير عن إجمالي عملية الأكسدة والاختزال التي تحدث في خلية جلفانية بالمعادلة التالية:
Cu 2+ + Zn o ––> Cu o + Zn 2+
وبالتالي ، يمكن تعريف الخلية الجلفانية على أنها جهاز لتحويل الطاقة الكيميائية لتفاعل الأكسدة والاختزال إلى طاقة كهربائية بسبب الفصل المكاني لعمليات الأكسدة والاختزال. يتم تحديد العمل الذي يمكن للتيار الكهربائي المتولد من خلية جلفانية القيام به من خلال الاختلاف في الجهد الكهربائي بين الأقطاب الكهربائية (يُسمى عادةً ببساطة فرق الجهد) ΔΦ وكمية الكهرباء التي تمر عبر الدائرة q:
سيكون عمل التيار للخلية الجلفانية (وبالتالي فرق الجهد) إلى أقصى حد أثناء تشغيلها القابل للانعكاس ، عندما تستمر العمليات على الأقطاب الكهربائية ببطء غير محدود وتكون قوة التيار في الدائرة صغيرة بشكل لا نهائي. الحد الأقصى لفرق الجهد الذي يحدث أثناء العملية العكسية لخلية كلفانية هو القوة الدافعة الكهربائية(EMF) لخلية كلفانية .
3.5.3 جهد القطب. معادلة نرنست
يتم تمثيل EMF للخلية الجلفانية E بشكل ملائم كفرق في بعض الكميات التي تميز كل من الأقطاب الكهربائية - جهود القطب ؛ ومع ذلك ، لتحديد هذه القيم بدقة ، هناك حاجة إلى نقطة مرجعية - جهد قطب كهربائي معروف بدقة لأي قطب كهربائي. إمكانات الكهربائية ε البريد يسمى عنصر emf، يتكون من هذا القطب وإلكترود هيدروجين قياسي (انظر أدناه) ، الذي يُفترض أن يكون قطبها الكهربائي صفرًا. في هذه الحالة ، تعتبر علامة جهد القطب موجبة إذا كان القطب المختبر في مثل هذه الخلية الجلفانية هو الكاثود ، وسالب إذا كان القطب المختبَر هو الأنود. وتجدر الإشارة إلى أنه في بعض الأحيان يتم تعريف جهد القطب بأنه "فرق الجهد في واجهة محلول القطب الكهربائي" ، أي اعتبرها متطابقة مع احتمالية DEL ، وهي ليست صحيحة تمامًا (على الرغم من أن هذه الكميات مترابطة).
قيمة إمكانات الكهربائيةمن القطب المعدني يعتمد على درجة حرارة ونشاط (تركيز) أيون الفلز في المحلول الذي يغمر فيه القطب ؛ رياضيا يتم التعبير عن هذا الاعتماد معادلة نرنست (هنا F هو ثابت فاراداي ، z هو الشحنة الأيونية):
في معادلة نرنست ε ° - جهد القطب القياسي ، تساوي جهد القطب عند نشاط أيون الفلز ، يساوي 1 مول / لتر. جهود القطب القياسية للأقطاب الكهربائية في المحاليل المائية هي سلسلة من الفولتية. قيمة ε ° هي مقياس لقدرة الشكل المؤكسد لعنصر أو أيون على قبول الإلكترونات ، أي يعيد. في بعض الأحيان يتم إهمال الفرق بين تركيز ونشاط أيون في محلول ، ويظهر تركيز الأيونات في المحلول تحت علامة اللوغاريتم في معادلة نرنست. يحدد حجم جهد القطب اتجاه العملية التي تحدث على القطب أثناء تشغيل الخلية الجلفانية. في نصف خلية ، يكون لإمكانات القطب الكهربائي قيمة أكبر (يقولون أحيانًا - أكثر إيجابية) ، ستستمر عملية الاسترداد ، أي سيكون هذا القطب هو الكاثود.
ضع في اعتبارك حساب EMF لعنصر Daniel-Jacobi باستخدام معادلة Nernst. دائمًا ما تكون EMF قيمة موجبة وتساوي الفرق بين إمكانات القطب الكهربائي للكاثود والأنود:
![]() (ثالثا - 42)
(ثالثا - 42)
![]() (ثالثا 43)
(ثالثا 43)
![]() (ثالثا - 45)
(ثالثا - 45)
كما يتضح من المعادلة (III.45) ، فإن المجال الكهرومغناطيسي لعنصر دانيال جاكوبي يعتمد على تركيز أيونات النحاس والزنك (بتعبير أدق ، النشاط) ؛ بتركيزاتها المتساوية ، فإن المجالات الكهرومغناطيسية للعنصر ستكون مساوية للاختلاف في جهود القطب القياسية:
![]() (ثالثا 46)
(ثالثا 46)
تحليل المعادلة (III.45) ، من الممكن تحديد حد العمل الذي لا رجعة فيه للخلية الجلفانية. نظرًا لأن الزنك يتأكسد عند الأنود ، فإن تركيز أيونات الزنك يزداد باستمرار أثناء التشغيل غير القابل للانعكاس للخلية الجلفانية ؛ على العكس من ذلك ، ينخفض تركيز أيونات النحاس. تتناقص نسبة تركيزات أيونات النحاس والزنك باستمرار ولوغاريتم هذه النسبة عند [Сu 2+]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
تشرح المعادلة (III.45) أيضًا أداء ما يسمى ب. سلاسل التركيز - خلايا جلفانية تتكون من قطبين متطابقين من المعدن مغمور في محاليل ملحية من هذا المعدن وأنشطة مختلفة أ 1> أ 2. في هذه الحالة ، سيكون الكاثود قطبًا كهربائيًا بتركيز أعلى ، لأن إمكانات القطب القياسي لكلا القطبين متساوية ؛ بالنسبة للمجالات الكهرومغناطيسية لخلية كلفانية تركيز ، نحصل على:
![]() (ثالثا - 47)
(ثالثا - 47)
النتيجة الوحيدة لعمل عنصر التركيز هي نقل أيونات المعادن من محلول أكثر تركيزًا إلى محلول أقل تركيزًا. وبالتالي ، فإن عمل التيار الكهربائي في خلية جلفانية بتركيز هو عمل عملية انتشار ، والتي تتم بشكل عكسي نتيجة الفصل المكاني إلى عمليتي قطب كهربائي عكسيتين في الاتجاه المعاكس.
حقوق النشر © S. I. Levchenkov ، 1996 - 2005.
الديناميكا الحرارية
خلية جلفانية
للعمل المخبري رقم 18
سمارة 2010
بقلم: يو.ب. Kovriga ، BM STIFATOV ، V.V. SLEPUSHKIN
الديناميكا الحرارية للخلية الجلفانية:طريقة. مرسوم. الى المختبر. الشغل. /نفسي. دولة تقنية. الامم المتحدة. شركات: يو بي كوفريجا ، بي إم. ستيفاتوف ، في. سلبوشكين. - سمارة ، 2010. 16 ص.
يتم النظر في الأسس النظرية والتحديد التجريبي للخصائص الديناميكية الحرارية للتفاعلات الكهروكيميائية التي تحدث أثناء تشغيل الخلية الجلفانية.
التعليمات مخصصة لطلاب الكيمياء والتخصصات الأخرى التي تدرس الكيمياء الكهربائية في مقرر الكيمياء الفيزيائية.
فاتورة غير مدفوعة. 1. سوء. 2. ببليوغرافيا: 6 عناوين.
تم النشر بقرار من مجلس التحرير والنشر في SamSTU.
هدف- دراسة نظرية وممارسة الحسابات الديناميكية الحرارية للتفاعلات الكهروكيميائية التي تحدث أثناء تشغيل الخلايا الجلفانية العكسية بناءً على نتائج قياس القوة الدافعة الكهربائية.
1. مقدمة نظرية
الخصائص الديناميكية الحرارية
خلية جلفانية
خلية جلفانيةيسمى نظامًا من قطبين ، حيث يتم تحويل طاقة التفاعل الكيميائي تلقائيًا إلى طاقة كهربائية. يتكون من اثنين أقطاب كهربائية (نصف خلايا) ،مغمورة في المحاليل المنحل بالكهرباء. بين هذه الحلول ، يتم إنشاء الاتصال باستخدام قسم مسامي أو جسر كهربائياأي أنبوب سيفون مملوء بمحلول مشبع من KCl أو NH 4 NO 3. يوفر القسم المسامي أو الجسر الكهربائي الموصلية الكهربائية بين محاليل القطب ، ولكنه يمنع انتشارها المتبادل. في بعض الحالات ، يتم غمر كلا القطبين في نفس المحلول.
إذا قمت بتوصيل الأقطاب الكهربائية بموصل معدني ، يحدث تفاعل على أحدها أكسدة،وهو سالب الشحنة ويسمى الأنود، ومن ناحية أخرى - رد الفعل التعافي،مشحون إيجابيا ويسمى الكاثود.
الديناميكاهو فرع من فروع العلم يدرس التحولات المتبادلة للحرارة إلى عمل والعكس صحيح. الديناميكا الحرارية الكيميائيةهو فرع من فروع الكيمياء الفيزيائية يدرس العمليات الفيزيائية والكيميائية المصحوبة بإطلاق أو امتصاص الطاقة. تنتمي الخلية الجلفانية إلى الأنظمة الفيزيائية والكيميائية. لذلك ، فإن تشغيل الخلية الجلفانية ، مثل أي نظام ديناميكي حراري آخر ، يتميز بالقيم الديناميكية الحرارية لتغير طاقة جيبس Δ زالمحتوى الحراري Δ حإنتروبيا Δ سوثابت التوازن ك أللتفاعلات الكهروكيميائية التي تحدث أثناء تشغيل الخلايا الجلفانية العكسية.
كلما زادت مقاومة الموصل الذي يربط الأقطاب الكهربائية ، كلما كانت التفاعلات على الأقطاب الكهربائية أبطأ. من حيث المبدأ ، من الممكن إغلاق الأقطاب الكهربائية بموصل ذي مقاومة لانهائية ، وسيستمر التفاعل ببطء شديد ، أي تفريغ.
عندما يتم إجراء تفاعل كيميائي متساوي الحرارة وعكسًا ، يكون العمل أكبر: في هذه الحالة ، يتم تحويل الجزء الأكبر من حرارة التفاعل إلى عمل كهربائي. يسمى فرق الجهد بين الأقطاب الكهربائية المقاسة في هذه الحالة القوة الدافعة الكهربائية(قريبًا - EMF) لخلية كلفانية.
عمل كهربائيخلية جلفانية ( لكن) يساوي EMF ( ه) مضروبة في الشحنة المحولة ( ف). إذا حدث الاختزال أو الأكسدة أثناء التفاعل ضسيتم نقل معادلات الخلد من مادة ، ثم وفقًا لقانون فاراداي ف = ضكولوم (أ . ج) الكهرباء أين F- رقم فاراداي (96500 س / مول). لذلك ، فإن أقصى عمل ( أ "ماكس) عن طريق التحويل ضكولوم للكهرباء من خلال فرق الجهد ( ∆φ = ه)أقطاب خلية جلفانية يساوي
أين E هو EMF للخلية الجلفانية ، V ؛ ه 0 - معيار emfخلية كلفانية مع أنشطة فردية للمشاركين في التفاعل ؛ أ (OX 1) ، أ (أحمر 1) ، أ (OX 2) ، أ (أحمر 2) - تركيزات نشطة (أنشطة) لأزواج الأكسدة والاختزال المترافقة OX 1 / Red 1 و OX 2 / Red 2 التي تشكلت نتيجة رد فعل في المحلول.
قياس EMF لخلية كلفانية هوتغيراته مع درجة الحرارة دي إي / دي تييسمح لك بحساب أهم الكميات الديناميكية الحرارية لتفاعل الأكسدة والاختزال الكيميائي الذي يحدث في العنصر.
من معادلة جيبس هيلمهولتز
المعادلة (8) تدل على ذلك
قيمة ده / دتي يسمى معامل درجة الحرارة للقوة الدافعة الكهربائية لخلية جلفانية.معامل درجة الحرارة ده / ديمكن تحديد T من اعتماد القوة الدافعة الكهربائية للخلية الجلفانية على درجة الحرارة. قيمة ده / ديمكن أن يكون T موجبًا أو سالبًا أو صفرًا حسب طبيعة الخلية.
في ده / د T \ u003d 0 ، أي عندما لا تعتمد EMF للعنصر على درجة الحرارة ، E \ u003d - ΔU/ض.في هذه الحالة ، يحدث عمل العنصر بالكامل بسبب انخفاض الطاقة الداخلية للنظام دون إطلاق الحرارة أو امتصاصها.
في ده / دتي<0, т.е. когда ЭДС элемента уменьшается с повышением температуры, работа элемента совершается тоже за счет убыли внутренней энергии системы, но сопровождается выделением теплоты. В этом случае работа элемента и расход энергии на нагревание окружающей среды осуществляется за счет убыли внутренней энергии системы.
في ده / د T> 0 ، أي عندما تزداد EMF لعنصر ما مع زيادة درجة الحرارة ، يعمل العنصر عن طريق امتصاص الحرارة. في هذه الحالة ، النسبة بين هو تي . ده / ديحدد T طبيعة العمل واتجاه التغيير في الطاقة الداخلية للنظام:
1) متى E = T ده / د T ، الطاقة الداخلية لعنصر عامل عند درجة حرارة ثابتة لا تتغير: ΔU= 0. يتم تنفيذ عمل العنصر بالكامل بسبب الحرارة الممتصة من البيئة ؛
2) متى ه> ت . ده / دتي , تقل الطاقة الداخلية للعنصر أثناء عمله ، ΔU <0, и работа совершается частично за счет убыли внутренней энергий и частично за счет поглощения теплоты извне;
3) متى ه< Т . ده / د T تزداد الطاقة الداخلية للعنصر أثناء تشغيله ، ΔU> 0 ، أي يمتص العنصر الحرارة بكمية تتجاوز الشغل الذي يقوم به. يتم استخدام فائض الحرارة الممتصة لزيادة الطاقة الداخلية للنظام. هنا يتم العمل ، وتستمر العملية تلقائيًا ، على الرغم من الطبيعة الماصة للحرارة للتفاعل الكيميائي.
قيمة ده / ديمكن حساب T تقريبًا بواسطة الصيغة
| | (11) |
أين ه 1و ه 2 -- قيم EMF لخلية جلفانية عند درجات الحرارة تي 1و تي 2. سيكون الحساب أكثر دقة ، كلما قل اختلافهم عن بعضهم البعض. تي 1و تي 2، لأن مدمن E \ u003d و (T)قريبة من الخطي فقط لفترات صغيرة من درجات الحرارة.
ثابت التوازن لتفاعل كيميائي ك أيمكن حسابها من معادلات متساوي الحرارة لتفاعل كيميائي في ظل الظروف القياسية. بواسطة معادلة فانت هوف متساوية الحرارةيتم حساب قيمة أقصى عمل مفيد لتفاعل كيميائي على النحو التالي
| , | (14) |
أين E 0 \ u003d E 0 2 - E 0 1- معيار EMF ، يساوي فرق إمكانات القطب القياسية.
يتم حساب ثابت التوازن باستخدام البيانات المرجعية حول قيم إمكانات القطب القياسية للأقطاب الكهربائية المقابلة الواردة في الكتاب المرجعي للكميات الفيزيائية والكيميائية.
قياس EMF للخلايا الجلفانية
يمكن تحديد التغيير في القيم الديناميكية الحرارية للتفاعلات الكهروكيميائية بدقة شديدة عن طريق قياس القوى الدافعة الكهربائية للخلايا الجلفانية التي تحدث فيها هذه التفاعلات. تفسر دقة هذه الطريقة بالدقة العالية لقياسات المجال الكهرومغناطيسي لخلية كلفانية بواسطة مقياس جهد من النوع R-307 ، يعمل وفقًا لـ طريقة بوجندورف التعويضية. يوفر قياس EMF لخلية كلفانية في ظل الظروف التي يتدفق فيها تيار متناهي الصغر عبر الخلية ، وهو ما يتوافق مع خلية جلفانية قابلة للانعكاس. عند قياس EMF باستخدام مقياس الفولتميتر العادي ، يتدفق التيار الناتج عن العنصر عبر الأقطاب الكهربائية ، مما يؤدي إلى حدوث تحول في إمكانات القطب من قيم التوازن التي تتوافق معها معادلة Nernst.
يتم قياس EMF لعنصر في ظروف التوازن ، تفاعل الأكسدة والاختزال الذي يحدث على أقطابها ، باستخدام طريقة التعويض Poggendorf ،نفذت باستخدام الدائرة الكهربائية الموضحة في الشكل. 2.
عادي) خلية ويستون
Θ Сd (زئبق) | CdSO 4 8 / 3H 2 O (جلس) ، Hg 2 SO 4 (t) | زئبق
لها قيمة EMF ثابتة وقابلة للتكرار. هنا الأنود هو ملغم الكادميوم والكاثود هو الزئبق المعدني. عندما تكون الدائرة مغلقة ، تستمر ردود الفعل النصفية:
عند 25 0 درجة مئوية ، يكون EMF لعنصر Weston هو 1.0183 V.
يبدأ القياس بتدرج مقياس ريوشورد ، وهو عبارة عن مسطرة مدرجة بالملليمتر مع سلك نيتشروم ذي مقطع عرضي ثابت ممتد فوقه.
يتم توصيل البطارية بالدائرة ، مما يوفر تيارًا كهربائيًا ثابتًا في الدائرة. يُدخل المفتاح "P" عنصرًا قياسيًا في الدائرة وينقل جهة الاتصال المحمولة "C" على طول سلك إعادة تشكيل. بشكل دوري ، عن طريق الضغط لفترة وجيزة على المفتاح "K" ، يتم إغلاق الدائرة ، والتحقق من وجود التيار في الدائرة باستخدام مقياس الجلفانومتر ، أي تعويضات. في وقت التعويض ، الجزء تيار متردديتوافق سلك rheochord مع المقاومة ، حيث يكون ناتجها وتيار البطارية مساوياً للجهد الذي يعوض EMF لعنصر Weston. معرفة طول المقطع تيار متردد(علي سبيل المثال، ل ن) ، حيث يعوض انخفاض جهد البطارية عن EMF (E N) لخلية Weston ، يمكنك حساب انخفاض الجهد لكل 1 مم reochord E N / l N، V / مم.
بعد ذلك ، يتم تضمين الخلية الجلفانية التي تم فحصها بقيمة EMF غير معروفة في الدائرة السابقوكرر عمليات القياس المذكورة أعلاه ، مع القياس في لحظة التعويض على طول مقطع السلك في reochord ل X. من العلاقة
تجد المجهول قيمة EMF.
لقياس EMF للخلية الجلفانية بدقة ، استخدم مقياس جهد عالي المقاومة R-307، تظهر اللوحة العلوية في الشكل. 2.
يعتمد تشغيل الجهاز على مبدأ التعويض ، عندما يكون للتيار في دائرة الخلية الجلفانية التي تم فحصها ، في لحظة قياس EMF ، قيمة متناهية الصغر (صفر على الجهاز الفارغ (الجلفانومتر)). عند تجميع دائرة القياس ، يتم توصيل بطارية أو مقوم 2.5 - 3.5 فولت بأطراف "B" ، وعنصر Weston العادي بأطراف "NE" ، والخلية الجلفانية التي تم فحصها إلى طرفي X 1 أو X 2. في هذه الحالة ، في جميع الحالات ، ضع في الاعتبار علامتي القطبية "+" و "-" على لوحة العدادات والمصدر المتصل التيار المباشر. يتم توصيل الجلفانومتر بالمطاريف المقابلة "G". بعد ذلك ، يتم توصيل مقياس الجهد من خلال مقوم بالشبكة الكهربائية.
يبدأ العمل بمعايرة الجهاز وفقًا لعنصر Weston القياسي.
تم ضبط مفتاح نوع العمل (3) على الوضع "NE". تنتج مقابض المقاومة (2) تعويضًا "تقريبيًا" ثم "دقيقًا" لـ EMF لعنصر Weston ، حيث يتم إغلاق دائرة القياس بشكل دوري باستخدام الزر 430 كيلو أوم ، ثم الزر "0". يتوافق الإعداد الصحيح مع عدم وجود تيار في دائرة الجلفانومتر أثناء دائرة قصيرة (1-2 ثانية) مع الزر "0".
نتيجة لذلك ، يتم توفير تيار عمل لمقابض القياس (5) لمقياس الجهد من المعدل ، والذي يوفر جهدًا يساوي EMF لعنصر Weston ، أي 1.0186 خامسا
|
||||
| أرز. الشكل 2. منظر للوحة العلوية لمقياس الجهد R-308: 1 - مقابس "X 1" و "X 2" لتوصيل أقطاب الخلية الجلفانية ؛ 2 - مقابض المقاومة "الخشنة" "الدقيقة" لمعايرة مقياس الجهد ؛ 3 - التبديل لتشغيل مقياس الجهد إلى الوضع الطبيعي (NE) أو العنصر قيد الدراسة "NE" أو "X 2" ؛ 4 - مقابس "G" لتوصيل الجلفانومتر ؛ 5 - مقابض المقاومة (عقود) مع نوافذ لقياس القيم العددية للمجالات الكهرومغناطيسية ؛ 6 - مقابس "X 1" لتوصيل عنصر Weston عادي ؛ 7 - مآخذ "ب" و لتوصيل البطارية ؛ 8 - عنصر عادي من Weston ؛ 9 - المعدل التيار المتناوب؛ 10 - الجلفانومتر 11 - نوافذ القيم الرقمية لـ EMF ؛ 12- أزرار إغلاق دائرة القياس "430" و "0" وإراحة اهتزازات سهم الجلفانومتر "Usp". |
تسمى أقلام القياس عقود، لأن لكل منهم 10 وظائف. يوفر كل موقع من مواضع العقد الأول (I) مقاومة ، والتي ، مضروبة في تيار التشغيل ، تعطي قيمة تعويض EMF تبلغ 0.1 فولت ، لذلك ، يسمح المقبض (I) بالتعويض من 0.1 إلى 1 V. العقد (II) يسمح لك بالتعويض من 0.01 إلى 0.1 فولت ، إلخ. لذلك ، يجب ضرب القيمة الرقمية المقاسة لـ EMF المشار إليها في المربع للعقد الأول بـ 0.1 ، للعقد الثاني - 0.01 ، إلخ.
بعد معايرة الجهاز ، يتم ضبط المفتاح الخاص بنوع العمل (2) على الموضع X 1 أو X 2 (اعتمادًا على الطرف الذي تتصل به الخلية الجلفانية التي تم فحصها) ومقابض عقود المفاتيح I - VI توازن بين تم قياس EMF مع زيادة ثابتة في الحساسية ، مما يحقق غياب التيار في الدائرة بدائرة كهربائية قصيرة باستخدام الزر "0".
يتم حساب قيمة القيمة المقاسة بالأرقام الموجودة في المربعات ذات المضاعفات المقابلة.
2. التجريبية
خطة عمل
1. تعرف على الأسس النظرية للديناميكا الحرارية للخلية الجلفانية.
2. اجمع الخلية الجلفانية التي تم فحصها وضعها في الفتحات الموجودة في غطاء الترموستات.
3. قم بتوصيل الخلية الجلفانية التي تم فحصها بأسلاك توصيل بمقياس الجهد R-308.
4. قم بمعايرة مقياس الجهد P-308 باستخدام عنصر Weston القياسي.
5. قم بقياس EMF للخلية الجلفانية المدروسة في نطاق درجة الحرارة المحدد في المهمة ، مع تغيير درجة حرارة منظم الحرارة.
7. إعداد تقرير عن العمل المنجز واستخلاص استنتاج حول تطابق قيم القيم المحسوبة مع العمليات التي تحدث في الخلية الجلفانية.
8. التحقق من نتائج عمل المعلم وترتيب مكان العمل.
الأدوات والكواشف
1. أقطاب كهربائية بلاتينية مع أسلاك توصيل (2 قطعة).
2. أنابيب اختبار زجاجية واسعة الفم (عدد 2 قطعة).
3. ترموستات.
4. مقياس الجهد R-308.
5. مقوم التيار المتردد.
6. عنصر ويستون القياسي.
7. حلول لتحضير الخلية الجلفانية.
8. جسر ملح أنبوب زجاجي.
9. محلول بوكل مشبع.
10. ورق ترشيح لصنع سدادات جسر الملح.
سير العمل
1. تشكل الخلية الجلفانية المحددة في مهمة العمل. للقيام بذلك ، قم بصب المحاليل المناسبة لتركيز معين في أنبوبين كبيرين واسع الفم للاختبار.
2. اغمر أقطاب البلاتين في الإلكتروليتات المناسبة.
3. ضع أنابيب الاختبار مع المحاليل في الفتحات الموجودة في غطاء منظم الحرارة.
4. قم بعمل جسر ملح عن طريق ملء أنبوب زجاجي على شكل حرف U بمحلول KCl مشبع وقم بسد الفتحات بحيث لا توجد فقاعات هواء في جسر الملح.
5. قم بتوصيل الأنابيب بجسر ملح.
6. قم بمعايرة مقياس الجهد P-308 باستخدام عنصر Weston.
7. قم بقياس EMF للخلية الجلفانية المجمعة في نطاق درجة الحرارة المحدد في مهمة المهمة عن طريق زيادة درجة حرارة الماء في منظم الحرارة. يتم قياس درجة الحرارة في منظم الحرارة بدقة بواسطة مقياس حرارة منفصل. سجل قيمة EMF المقاسة ودرجة الحرارة المقابلة.
9. تحديد الجهد القياسي لأقطاب الخلية الجلفانية المدروسة من الكتاب المرجعي ورسم دائرتها. اكتب معادلة لأنصاف التفاعلات التي تحدث على الأقطاب الكهربائية ومعادلة عامة لتفاعل الأكسدة والاختزال. احسب القيمة القياسية لـ EMF للعنصر وأوجد ثابت التوازن ك أحسب الصيغة (14).
10. أدخل نتائج التجربة والقيم المحسوبة في الجدول.
أسئلة الاختبار
1. العلاقة بين طاقة جيبس للتفاعل الكهروكيميائي والمجال الكهرومغناطيسي للخلية الجلفانية.
2. اشتقاق الصيغ لحساب ΔG ، ΔH، ΔSتفاعل كهروكيميائي.
3. اعتماد المجالات الكهرومغناطيسية للخلايا الجلفانية على درجة الحرارة.
4. مفهوم "معامل درجة حرارة المجالات الكهرومغناطيسية" وطرق تحديدها.
5. العلاقة بين علامة معامل درجة الحرارة وطبيعة التفاعل الكهروكيميائي.
6. مبدأ تشغيل مقياس الجهد R-307.
7. منهجية أداء العمل.
المراجع
1. سيمشينكو دي بي ، سترومبيرج إيه.. الكيمياء الفيزيائية. - م: Vyssh. المدرسة ، 2000. - 512 ص.
2. ورشة عمل في الكيمياء الفيزيائية / إد. إ. كودرياشوف. - م: العالي. المدرسة ، 1999. - 400 ص.
3. ورشة عمل في الكيمياء الفيزيائية / إد. في. بودانوف ،
ن. فوروبيوف. - م: الكيمياء 2000. - 387 ص.
4. العمل العملي في الكيمياء الفيزيائية: بروك. مخصص للجامعات / إد. ك. ميششينكو ، أ. رافديل ، أ. بونوماريفا. - سانت بطرسبرغ ، دار النشر "المهنة" ، 2002. - 384 ص.
5. كتاب مرجعي موجز للكميات الفيزيائية والكيميائية / إد. أ. رافديل ، إيه إم بونوماريفا. - م: الكيمياء ، 2002. - 327 ص.
6. Kiseleva E. V. ، Karetnikov G. S. ، Kudryashov I. V.مجموعة من الأمثلة والمشكلات في الكيمياء الفيزيائية. - م: العالي. المدرسة ، 2001. - 389 ص.
يحدث تحويل الطاقة الكيميائية إلى طاقة كهربائية في الأنظمة الكهروكيميائية ، والتي تسمى الخلايا الجلفانية.
الخلية الجلفانية هي نظام كهروكيميائي مغلق يتكون من قطبين.
فكر في خلية جلفانية جاكوبي دانيال. يتكون من صفيحة نحاسية مغمورة في محلول CuSC4 ولوحة زنك مغمورة في محلول ZnSC4. لمنع التفاعل المباشر بين العامل المؤكسد وعامل الاختزال ، يتم فصل الأقطاب الكهربائية عن بعضها بواسطة قسم مسامي.
رسم تخطيطي لخلية كلفانية:
زن | ZnSO4 | | CuSO4 | النحاس ،
زن | Zn2 + | | النحاس 2 + | النحاس.
تظهر طبقة كهربائية مزدوجة على سطح صفيحة الزنك ويتم تحقيق التوازن:
نتيجة لهذه العملية ، ينشأ جهد القطب الكهربائي للزنك.
تظهر أيضًا طبقة كهربائية مزدوجة على سطح الصفيحة النحاسية ويتم إنشاء التوازن:
وبالتالي ، ينشأ جهد قطب كهربائي للنحاس.
تتمتع إمكانات القطب الكهربائي بالزنك بقيمة سالبة أكثر من إمكانات القطب النحاسي ، لذلك ، عندما تكون الدائرة الخارجية مغلقة ، أي عندما يتم توصيل الزنك بالنحاس بموصل معدني ، تنتقل الإلكترونات من الزنك إلى النحاس.
وهكذا ، عندما تكون الدائرة الخارجية مغلقة ، تحدث عمليات عفوية لانحلال الزنك على قطب الزنك وترسيب النحاس على القطب النحاسي. ستستمر هذه العمليات حتى تتساوى إمكانات الأقطاب الكهربائية أو يتم إذابة كل الزنك (أو يتم ترسيب كل النحاس على القطب النحاسي).
لذلك ، أثناء تشغيل عنصر Jacobi-Daniel ، تحدث العمليات التالية:
1) تفاعل أكسدة الزنك: Zn - 2E ® Zn2 +.
تسمى عمليات الأكسدة في الكيمياء الكهربائية عمليات الأنود ، وتسمى الأقطاب الكهربائية التي تتم عليها عمليات الأكسدة الأنودات ؛
2) رد فعل اختزال أيونات النحاس: Сu2 + + 2е «Сu.
تسمى عمليات الاختزال في الكيمياء الكهربائية بالعمليات الكاثودية ، وتسمى الأقطاب التي تتم عليها عمليات الاختزال الكاثودات ؛
حركة الإلكترونات في الدائرة الخارجية ؛
حركة الأيونات في المحلول: الأنيونات (SO4-2) إلى القطب الموجب ، الكاتيونات (Cu2 + ، Zn2 +) إلى الكاثود. حركة الأيونات في المحلول تغلق الدائرة الكهربائية للخلية الجلفانية. تلخيصًا لتفاعلات القطب الكهربائي ، نحصل على:
Zn + Cu2 + = Zn2 + + Сu.
نتيجة لهذا التفاعل الكيميائي في الخلية الجلفانية ، تحدث حركة الإلكترونات في الدائرة الخارجية والأيونات داخل الخلية ، أي يتكون نظام كهربائي مغلق وينشأ فيه تيار كهربائي. يسمى التفاعل الكيميائي الكلي الذي يحدث في خلية جلفانية توليد التيار.
يتميز التيار الكهربائي الذي يحدث في نظام كهروكيميائي معين عدديًا بحجم القوة الدافعة الكهربائية (EMF) للعنصر. إنه يساوي الفرق بين إمكانات القطب للكاثود والأنود:
في ظل الظروف القياسية ، يكون التفاعل الكيميائي التلقائي ممكنًا عندما يكون الحد الأقصى للعمل المفيد المنجز نتيجة لهذا التفاعل مساويًا للقيمة السالبة للتغير في الطاقة الحرة:
في الخلية الجلفانية ، يكون الحد الأقصى للعمل الكهربائي المنجز في ظل الظروف القياسية مساويًا لـ EMF للخلية مضروبًا في كمية الكهرباء (nF) ، أي
أ = nFE0 ، (7.5)
حيث n هو عدد الإلكترونات المشاركة في التفاعل ؛
F هو ثابت فاراداي ، يساوي 96500 درجة مئوية / مول ؛
E0 - القوة الدافعة الكهربائية القياسية للخلية الجلفانية (T = 298 K ، التركيز المولي للإلكتروليتات هو 1 مول / dm3). وبالتالي ، فإن أقصى عمل للخلية الجلفانية يساوي:
أ \ u003d -DG0 \ u003d nFE0. (7.6)
معيار EMF للخلية الجلفانية هو:
تنقسم الخلايا الجلفانية ، اعتمادًا على طبيعة الأقطاب الكهربائية وتركيز الإلكتروليت ، إلى مادة كيميائية وتركيز.
الخلايا الكيميائية الجلفانية هي مثل هذه الخلايا التي تختلف فيها الأقطاب الكهربائية والإلكتروليتات. مثال على خلية كيميائية كلفانية هي خلية جاكوبي دانيال.
الخلايا الجلفانية للتركيز هي تلك الخلايا التي تتكون من نفس الأقطاب الكهربائية ، لكن تركيزات الإلكتروليت مختلفة ، على سبيل المثال ، أقطاب الفضة المغمورة في محاليل نترات الفضة بتركيزات مختلفة:
حج | AgNO3 (0.01 مول / دسم 3) | | AgNO3 (0.1 مول / دسم 3) | اي جي.
مثال 1. تتكون الخلية الجلفانية من زنك معدني مغمور في محلول من نترات الزنك بتركيز مولاري قدره 0.1 مول / دسم 3 ، ورصاص معدني مغمور في محلول من نترات الرصاص بتركيز مولاري يبلغ 0.02 مول / دسم 3 مخطط عنصر.
قرار. لتحديد EMF لعنصر ما ، من الضروري حساب جهود القطب باستخدام معادلة Nernst (7.2):
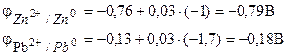
نوجد EMF للعنصر وفقًا للصيغة (7.3).
خلية جلفانية- جهاز يتحول الطاقة الكيميائيةفي الكهرباء. أحد هذه العناصر هو عنصر دانيال جاكوبي. يتكون هذا العنصر من قطبين كهربائيين: الزنك والنحاس ، مغموران في محاليل الكبريتات المقابلة ، يوجد بينهما قسم مسامي:
عند إغلاق الدائرة الخارجية ، تمر الإلكترونات من الزنك إلى النحاس ، وينتشر الزنك في النحاس:
نشكل دائرة كهروكيميائية:
الأنود - القطب السالب (يسار). الكاثود هو القطب الموجب.
لتحديد EMF لهذا العنصر ، تحتاج إلى مقارنة إمكانات القطب القياسية لكلا القطبين. عند تسجيل تفاعلات الإلكترود ، يُفترض أن الشكل المؤكسد موجود على الجانب الأيسر ، والشكل المختزل على الجانب الأيمن من المعادلة.
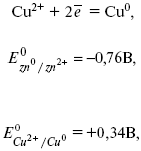
أين ه 0 - القوة الدافعة الكهربائية (EMF) للخلية الجلفانية ، عندما تكون جميع الكواشف في الحالة القياسية.
يتم حساب emf للخلية عن طريق طرح إمكانات الأنود من إمكانات الكاثود.
EMF للعنصر هو +0.34 - (-0.76) \ u003d 1.1 فولت ؛ كلما اختلفت جهود القطب عن بعضها البعض ، زادت قوة الكهرومغناطيسية. إذا تم غمر معدن في محلول ملحي بتركيز أعلى ، فإن الإمكانات غير قياسية. هذا يعني أن التركيز ودرجة الحرارة يؤثران على حجم جهد القطب. يتم التعبير عن هذا الاعتماد خامسا معادلة نرنست.
أين ف -عدد الأيونات
R هو ثابت الغاز العالمي؛
تي -درجة الحرارة؛
مع -تركيز الأيونات النشطة في المحلول ؛
F-عدد فاراداي = 96500 ف.
ضربالأجهزة التي تُستخدم لتحويل طاقة تفاعل كيميائي مباشرة إلى طاقة كهربائية. تستخدم الفعالية في مجالات التكنولوجيا المختلفة. في وسائل الاتصال: الراديو ، الهاتف ، التلغراف ؛ في معدات القياس الكهربائية. أنها بمثابة مصادر الطاقة للسيارات والطائرات والجرارات ؛ تستخدم لتشغيل المبتدئين ، إلخ.
مساوئ الضرب:
1) تكلفة المواد اللازمة للعمل: الرصاص ، الكادميوم ، مرتفعة ؛
2) نسبة كمية الطاقة التي يمكن أن يعطيها عنصر لكتلته صغيرة.
فوائد HIT:
1) تنقسم الفعالية إلى مجموعتين رئيسيتين: قابل للعكس (بطاريات) ، لا رجوع فيه (خلايا جلفانية). يمكن استخدام البطاريات بشكل متكرر ، حيث يمكن استعادة أدائها عن طريق تمرير التيار في الاتجاه المعاكس من مصدر خارجي ، وفي الخلايا الجلفانية يمكن استخدامها مرة واحدة فقط ، لأن أحد الأقطاب الكهربائية (Zn في خلية دانيال جاكوبي) هو تستهلك بشكل لا رجعة فيه
2) يتم استخدام الإلكتروليتات التي تمتصها المواد المسامية ، ولديها مقاومة داخلية أكبر ؛
3) تكوين خلايا الوقود التي يستهلك تشغيلها مواد رخيصة ذات كثافة منخفضة ( غاز طبيعيوالهيدروجين) ؛
4) التشغيل المريح والموثوقية والجهد العالي والمستقر.
ضع في اعتبارك عملية التكنولوجيا القائمة على بطارية الرصاص الحمضية ذات الأقطاب الكهربائية المطلية.
المخطط العام: (-) المادة الفعالة | المنحل بالكهرباء | مادة فعالة (+).
المادة الفعالة للقطب السالب هي الحد من وكيلالتبرع بالإلكترونات. أثناء التفريغ ، يكون القطب السالب عبارة عن أنود ، أي قطب كهربائي تحدث عليه عمليات الأكسدة. المادة الفعالة للقطب الموجب هي عامل مؤكسد. المواد الفعالة - عامل مؤكسد وعامل مختزل - تشارك في تفاعل كهروكيميائي.
رسم تخطيطي كهروكيميائي لبطارية الرصاص الحمضية
المواد الفعالة لبطارية الرصاص هي الرصاص الإسفنجي و PbO 2. يتم تكوين الكتل النشطة في الأقطاب الكهربائية على النحو التالي: يتم تطبيق عجينة أو خليط من أكاسيد الرصاص على الإطار الموصّل كهربيًا للهيكل ؛ أثناء التكوين اللاحق للصفائح ، يتم تحويل أكاسيد الرصاص إلى مواد فعالة. تشكيل - تكوين- تحويل الكتلة غير المشحونة إلى كتلة مشحونة. تنقسم هذه الألواح اعتمادًا على نوع الإطار إلى انتشار وشبكة. يتم تجميع معظم البطاريات من ألواح مغطاة بالبلاط. في تصنيعها ، يتم تلطيخ عجينة من أكاسيد الرصاص في خلايا حواجز شبكية ذات سماكة 1-7 مم ، مصبوبة من سبيكة Pb-Sb. بعد التصلب ، يتم وضع العجينة على الشبكة ، وضمان هذه البطارية هو 2-3 سنوات. عند اختيار المواد للمجمعات الحالية لأقطاب البطارية الموجبة ، من المهم ضمان سلبيتها العملية (مع الحفاظ على الموصلية الكهربائية) في ظل ظروف الشحن (حتى الإمكانات العالية جدًا مع الاستقطاب الأنودي). لهذا الغرض ، يتم استخدام الرصاص أو سبائكه في محاليل H 2 SO 4. يمكن أن يكون غلاف وغطاء HIT مصنوعًا من الفولاذ أو عوازل كهربائية مختلفة ، ولكن في بطاريات حمض الرصاص ، يتكون الغلاف من الإيبونيت والبولي بروبيلين والزجاج. يمكن أن يشارك المنحل بالكهرباء في بطارية الرصاص الحمضية في التفاعل العام لتوليد التيار. بالنسبة للصنابير الحاملة للتيار الكهربائي السالب ، يتم استخدام Cu ، Ti ، Al.
3. تجديد والتخلص من الضربات الضاربة
تنتهي مدة خدمة الخلايا الجلفانية (HIT التفريغ) بعد الاستخدام الكامل أو الجزئي للمواد الفعالة ، والتي يمكن استعادة أدائها بعد التفريغ عن طريق الشحن ، أي بتمرير التيار في الاتجاه المعاكس لاتجاه التيار أثناء التفريغ: تسمى هذه الخلايا الجلفانية المراكم. يصبح القطب السالب ، وهو الأنود عندما كانت البطارية فارغة ، هو الكاثود عند الشحن. الظروف أفضل استخدامالمواد الفعالة هي كثافة تيار منخفضة ، درجات حرارة عاليةيصل إلى القاعدة. عادة ما يكون سبب خلل في HITs التخميل الكهربائي- انخفاض حاد في معدل العملية الكهروكيميائية أثناء التفريغ ، بسبب تغير في حالة سطح القطب أثناء التفريغ نتيجة تكوين طبقات الأكسيد أو الأغشية الملحية. تتمثل طريقة مكافحة التخميل في تقليل كثافات تيار التفريغ الحقيقية باستخدام أقطاب كهربائية ذات أسطح مطورة. يتميز إنتاج HIT باستخدام مواد سامة مختلفة (عوامل مؤكسدة قوية ، Pb ، Hg ، Zn ، Cd ، Ni مركبات تستخدم في حالة مشتتة بدقة ؛ الأحماض ، القلويات ، المذيبات العضوية). لضمان ظروف العمل العادية ، من المخطط أتمتة عمليات الإنتاج وأنظمة التهوية العقلانية ، بما في ذلك استخدام الشفط المحلي من الأجهزة ذات الانبعاثات السامة ، ومعدات الختم ، واستبدال الطرق الجافة لمعالجة المواد المتربة بأخرى رطبة ، وتنظيف الهواء الملوث والغازات من الهباء الجوي ومعالجة مياه الصرف الصناعي. استخدام HIT على نطاق واسع اقتصاد وطنيالمرتبطة بالقضايا البيئية. بينما يمكن في الغالب إعادة الرصاص من البطاريات إلى مصانع إعادة التدوير من قبل المستهلكين ، فإن التخلص من تكنولوجيا المعلومات والاتصالات المنزلية الصغيرة الأولية ليس مجديًا اقتصاديًا.
توفر كل بطارية Hg-Zn 5-7 أيام من عملية السمع.
يتم تطوير السيارات الكهربائية باستخدام HIT بدلاً من محركات الاحتراق الداخلي ، التي تسمم أجواء المدن بغازات العادم. يحتل الإنتاج الجلفاني المرتبة الأولى من حيث درجة التأثير السلبي على البيئة. سبب التأثير السلبي للغاية لإنتاج الطلاء الكهربائي هو أن الغالبية العظمى من الشركات في العمليات التكنولوجيةعند استخدام الطلاء ، يتم استهلاك ما بين 10 إلى 30٪ فقط من أملاح المعادن الثقيلة بشكل مفيد ، بينما يدخل الباقي إلى البيئة مع عمل غير مُرضٍ. المخرج هو تقليل فقد الأملاح المعدنية غير الحديدية ، أي تقليل إزالة الإلكتروليت بأجزاء من حمامات كلفانية. سيؤدي هذا إلى انخفاض في تركيزات وأحجام المياه العادمة وبالتالي خلق الشروط اللازمةلتقنيات تطبيق منخفضة النفايات (LWT) وخالية من النفايات (LWT) الطلاءات المطلية بالكهرباء. يجب عليك أولا اختيار المنحل بالكهرباء الصحيح. يتمثل أحد المبادئ الأساسية لمنظمة العمل الدولية و BOT في تقليل المواد الكيميائية المدخلة وإخراج سموم أقل في ناتج العملية.




