خلية جلفانية. مفهوم المجالات الكهرومغناطيسية. عنصر دانيال جاكوبي
خلية جلفانية - هذا هو مصدر تيار كيميائي يتم فيه تحويل الطاقة المنبعثة أثناء تفاعل الأكسدة والاختزال على الأقطاب الكهربائية مباشرةً إلى طاقة كهربائية .
يمكن اعتبار مبدأ تشغيل الخلية الجلفانية باستخدام عنصر دانيال جاكوبي كمثال (الشكل 9.2).
أرز. 9.2. رسم تخطيطي لخلية دانيال جاكوبي الجلفانية
أنا هنا زجاج يحتوي على محلول ZnSO 4 في الماء مع صفيحة زنك مغمورة فيه ؛ II - زجاج يحتوي على محلول CuSO 4 في الماء مع صفيحة نحاسية مغمورة فيه ؛ III - جسر الملح (مفتاح التحليل الكهربائي) ، والذي يضمن حركة الكاتيونات والأنيونات بين المحاليل ؛ رابعا - الفولتميتر (مطلوب ل قياس EMF، ولكن لم يتم تضمينها في تكوين الخلية الجلفانية).
جهد القطب القياسي لقطب الزنك ![]() . جهد القطب القياسي للإلكترود النحاسي
. جهد القطب القياسي للإلكترود النحاسي ![]() . لأن
. لأن ![]() ، ثم تتأكسد ذرات الزنك:
، ثم تتأكسد ذرات الزنك:
يسمى القطب الذي يحدث فيه تفاعل الاختزال أو الذي يقبل الكاتيونات من الإلكتروليت الكاثود.
من خلال مفتاح التحليل الكهربائي ، تحدث حركة الأيونات في المحلول: SO 4 2– الأنيونات إلى الأنود ، Zn 2+ كاتيونات إلى الكاثود. حركة الأيونات في المحلول تغلق الدائرة الكهربائية للخلية الجلفانية.
التفاعلات (أ) و (ب) تسمى تفاعلات القطب.
بإضافة معادلات العمليات التي تحدث على الأقطاب الكهربائية ، نحصل على المعادلة الكلية لتفاعل الأكسدة والاختزال الذي يحدث في الخلية الجلفانية:
في الحالة العامة ، يمكن تمثيل المعادلة الكلية لتفاعل الأكسدة والاختزال التي تحدث في خلية جلفانية عشوائية على النحو التالي:
دائرة الخلية الجلفانية دانيال جاكوبي لها الشكل:
زن | ZnSO 4 || CuSO4 | النحاس
يسمى أقصى فرق جهد الأقطاب الكهربائية التي يمكن الحصول عليها أثناء تشغيل الخلية الجلفانية القوة الدافعة الكهربائية(emf) عنصر ه. يتم حسابه وفقًا للصيغة ؛
أين نهو عدد الإلكترونات في فعل الأكسدة والاختزال الأولي ، Fهو رقم فاراداي.
حجم التغيير في الجهد متساوي الضغط المتساوي الحرارة لتفاعل توليد التيار في ظل الظروف القياسية ∆ جي 0 يرتبط بثابت التوازن لهذا التفاعل ليساوي النسبة
| (9.6) |
الخلايا الجلفانية هي مصادر التيار الكيميائي الأولية (أحادية الاستخدام) (CSS). الضرب الثانوي (القابل لإعادة الاستخدام) عبارة عن بطاريات. العمليات التي تحدث أثناء تفريغ وشحن البطاريات معكوسة بشكل متبادل.
تسمى الخلايا الجلفانية التي تصنع فيها الأقطاب الكهربائية من نفس المعدن وتغمر في محاليل أملاحها بتركيزات مختلفة تركيز. يتم تنفيذ وظيفة الأنود في هذه العناصر بواسطة معدن مغمور في محلول ملحي بتركيز أقل ، على سبيل المثال:
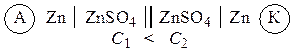
مثال 1قم بعمل رسم تخطيطي لخلية كلفانية بناءً على التفاعل: Mg + ZnSO 4 = MgSO 4 + Zn. ما هو القطب السالب والأنود في هذا العنصر؟ اكتب معادلات العمليات التي تحدث على هذه الأقطاب الكهربائية. احسب EMF للعنصر في ظل الظروف القياسية. احسب ثابت التوازن لتفاعل تكوين التيار.
المحلول
في الجدول نجد قيم المعيار جهود القطبأنظمة Zn / Zn 2+ و Mg / Mg 2+:
![]()
![]()
بقدر ما ![]() ، ثم يعمل قطب المغنيسيوم كقطب موجب ، ويعمل قطب الزنك كقطب كاثود. دائرة الخلية الجلفانية لها الشكل:
، ثم يعمل قطب المغنيسيوم كقطب موجب ، ويعمل قطب الزنك كقطب كاثود. دائرة الخلية الجلفانية لها الشكل:
تحدث الأكسدة عند الأنود
![]()
عند الكاثود - اختزال الكاتيونات للوسط:
![]()
معيار EMF كلفانيجزء
ه\ u003d φ 0 ك - φ 0 أ \ u003d -0.763 - (-2.37) \ u003d 1.607 فولت.
باستخدام المعادلتين (9.5) و (9.6) ، نحسب ثابت التوازن لتفاعل توليد التيار:
عن طريق التعزيز نجد ليساوي = 3.5 ∙ 10 54.
بقدر ما ل>> 1 ، فإن تفاعل تشكيل التيار عمليًا لا رجوع فيه.
مثال 2ارسم مخططًا لخلية كلفانية تتكون من أقطاب من الزنك والفضة مغمورة في محاليل أملاحها. تركيزات الأيونات في المحاليل: ج Zn 2+ \ u003d 0.1 مول / لتر ، ج Ag + = 0.01 مول / لتر. حدد القطب الذي يمثل القطب السالب وأي القطب الموجب هو القطب الموجب. اكتب معادلات التفاعلات التي تحدث على الأقطاب الكهربائية ، وكذلك المعادلة الكلية لتفاعل توليد التيار في خلية جلفانية. احسب emf لهذا العنصر.
المحلول
نظرًا لأن تركيزات الأيونات لا تساوي الوحدة ، فإننا نحسب أولاً إمكانات الأقطاب الكهربائية باستخدام صيغة Nernst. إذا لم تكن هناك قيمة لدرجة الحرارة في حالة المشكلة ، فسيتم أخذها مساوية لدرجة الحرارة القياسية تي= 298 ك.لذلك سوف نستخدم المعادلة (9.2):
![]()
نستبدل القيمة العددية للتركيز في صيغة Nernst باستخدام البيانات الواردة في الجدول 9.1:
يتضح من الحساب أن ![]() . لذلك ، يعمل قطب الزنك كقطب موجب ، ويعمل القطب الفضي كقطب كاثود.
. لذلك ، يعمل قطب الزنك كقطب موجب ، ويعمل القطب الفضي كقطب كاثود.
رسم تخطيطي لخلية كلفانية:
دعنا نحسب EMF للعنصر باستخدام الصيغة (9.4):
ه= φ ك - φ أ = 0.741 - (-0.789) = 1.530 فولت.
لنكتب الآن تفاعلات القطب الكهربائي. تتم عملية الأكسدة عند الأنود:
![]()
وفي الكاثود - عملية الاسترداد:
![]()
بإضافة معادلات عمليات الإلكترود (مع مراعاة المساواة في عدد الإلكترونات المتلقاة والمُعطاة) ، نحصل على المعادلة الإجمالية لتفاعل تشكيل التيار: Zn + 2Ag + = Zn 2+ + 2Ag.
مهام
221–226 اكتب معادلات العمليات الكاثودية والأنود وارسم مخططًا لخلية كلفانية ، يحدث خلالها التفاعل التالي (انظر الجدول). بناءً على قيم إمكانات القطب القياسي ، احسب ثابت التوازن لهذا التفاعل والمجال الكهرومغناطيسي للعنصر.
| رقم المهمة | رد فعل | إجابه |
| Sn + PbCl 2 = SnCl 2 + Pb | لص = 2.0 ؛ ه= 9 ∙ 10-3 ب | |
| Zn + Pb (NO 3) 2 = Zn (NO 3) 2 + Pb | لع \ u003d 3.5 10 21 ؛ ه= 0.633 فولت | |
| Zn + 2AgNO 3 \ u003d Zn (NO 3) 2 + 2Ag | لع \ u003d 8.7 10 52 ؛ ه= 1.56 فولت | |
| Ni + 2AgNO 3 \ u003d Ni (NO 3) 2 + 2Ag | لع \ u003d 3.8 10 35 ؛ ه= 1.05 فولت | |
| Zn + CdSO 4 = ZnSO 4 + Cd | لع \ u003d 1.56 10 12 ؛ ه= 0.36 فولت | |
| Mg + Ni (NO 3) 2 = Mg (NO 3) 2 + Ni | لع \ u003d 1.7 10 8 ؛ ه= 8.23 فولت |
227–233 احسب قيم جهد القطب للمعدن ، وهو الأنود ، بتركيزات مختلفة من المحلول: 10 ؛ 0.1 ؛ 0.01 ؛ 0.001 مول / لتر. تركيز المحلول الذي يغمر فيه الكاثود ثابت ويساوي 1 مول / لتر. حدد قيمة emf.
ارسم اعتماد القوة الدافعة الكهربائية لخلية كلفانية على لوغاريتم تركيز المحلول الذي يغمر فيه القطب الموجب. اكتب معادلة لتفاعل تكوين تيار يحدث في خلية جلفانية.
234–236 أحد أقطاب الخلية الجلفانية عبارة عن معدن (انظر الجدول) مغمور في محلول ملح بتركيز أيون قدره 0.01 مول / لتر ، والآخر هو قطب هيدروجين. emf لهذا العنصر هو ه، V. اكتب معادلات التفاعلات الكاثودية والأنودية ، أعط رسمًا تخطيطيًا لخلية كلفانية. احسب جهد قطب الهيدروجين وتركيز أيونات الهيدروجين في المحلول. تي= 298 ك.
237–240 اكتب معادلات تفاعلات القطب الكهربائي وارسم مخططًا لخلية كلفانية ، يتم التعبير عن تشغيلها بالمعادلة الواردة في الجدول. حدد أي قطب هو الكاثود والأنود. احسب قيم جهود القطب عند تركيزات محاليل الأنود من 1 والكاثود من 2 (انظر الجدول). حدد emf لهذا العنصر.
241–244 ارسم مخططًا لخلية كلفانية تتكون من معدنين Me 1 و Me 2 ، مغمورة في محلول من أملاحها مع تركيز أيوني من 1 و من 2 (انظر الجدول). حدد أي قطب هو الكاثود والأنود. اكتب معادلات التفاعلات التي تحدث على هذه الأقطاب ، وكذلك المعادلة الكلية لتفاعل توليد التيار في الخلية الجلفانية. احسب emf لهذا العنصر.
245 –247 احسب قيم جهود القطب الكهربائي للمعادن المعطاة في حالة المشكلة ، بتركيزات المحاليل من 1 (للمعدن الأول) و من 2 (للمعدن الثاني). التعرف على الأنود والكاثود. احسب EMF للعنصر.
قم بإجراء حسابات مماثلة لتركيزات المحاليل التي تم تقليلها بمقدار 10 مرات. سوف يتغير emf؟
أعط معادلات تفاعلات القطب.
248 ما العنصر الجلفاني يسمى التركيز؟ ارسمها. اكتب معادلات عمليات الأنود والكاثود ، واحسب emf. تتكون الخلية الجلفانية من أقطاب فضية مغمورة: الأولى في 0.01 م ، والثانية في 0.1 مولار من محلول AgNO 3.
الجواب: 0.059 فولت.
249 ارسم مخططًا لخليتين جلفانيتين ، يكون النيكل في إحداهما الأنود ، والآخر - الكاثود. اكتب لكل منها معادلات التفاعلات التي تحدث عند الأنود والكاثود ، واحسب EMF للخلايا الجلفانية في ظل الظروف القياسية. هل سيتغير المجال الكهرومغناطيسي لهذا العنصر إذا تم تقليل تركيز كل من الأيونات بمقدار 10 مرات؟
250 يتم توصيل ألواح الحديد والفضة بواسطة موصل خارجي ومغمورة في محلول حمض الكبريتيك. قم بعمل رسم تخطيطي لهذه الخلية الجلفانية واكتب المعادلات الإلكترونية للعمليات التي تجري على القطب السالب والأنود.
تآكل المعادن
تآكل- التدمير التلقائي للمعادن نتيجة التفاعل مع العوامل المؤكسدة البيئية.
هذه عملية الأكسدة والاختزال حيث يعمل المعدن كعامل اختزال. السبب الجذري للتآكل هو عدم الاستقرار الديناميكي الحراري للمعدن في البيئة وإمكانية انتقاله إلى حالة أكثر استقرارًا (مؤكسد).
في بعض الأحيان يسمى التآكل الصدأ. الصدأ - تآكل الحديد وسبائكه مع تكوين منتجات التآكل ، والتي تتكون أساسًا من هيدروكسيدات الحديد درجات متفاوتهترطيب ، أصفر-بني. تتآكل المعادن غير الحديدية ولكنها لا تصدأ. وفقًا لطبيعة التدمير ، ينقسم التآكل إلى انتخابي, مستمر(متساوي ومتفاوت) محلي(مبقعة أو متقرحة أو متقرحة) ، تكسير التآكل الإجهاديو التآكل بين البلورات.وفقًا لنوع البيئة التي تتم فيها العملية ، يمكن أن يكون التآكل عبارة عن تربة ، وغلاف جوي ، وكهرباء ، وغاز ، تحت تأثير التيارات الشاردة. اعتمادًا على آلية التدفق والظروف الخارجية ، ينقسم التآكل إلى مادة كيميائية وكهروكيميائية.
التآكل الكيميائييتدفق في البيئة الغازيةفي درجات حرارة مرتفعة (في حالة عدم وجود رطوبة) أو في سائل غير إلكتروليت. يتم تقليل جوهر عمليات التآكل من هذا النوع إلى تفاعل الأكسدة والاختزال ، والذي يتم إجراؤه عن طريق النقل المباشر للإلكترونات المعدنية إلى العامل المؤكسد. يمكن أن تعمل الغازات مثل O ، SO ، Cl ، HCl ، وما إلى ذلك كعامل مؤكسد ، كما يساهم H 2 S ، CO في التآكل. نتيجة للتفاعل ، يتم تشكيل أغشية من الأكاسيد والكبريتيدات والكلوريدات وما إلى ذلك على سطح المعدن.
يحدث التآكل بسبب انتقال الكاتيونات المعدنية أو الجزيئات المؤكسدة أو الإلكترونات من خلال الفيلم المتشكل. إذا كان الفيلم كثيفًا ومستمرًا وملتصقًا جيدًا بالمعدن ، فإن المزيد من أكسدة المعدن تتم ببطء شديد. يمكن استخدام هذه الأفلام لحماية المعادن من التآكل. على العكس من ذلك ، فإن الفيلم السائب غير قادر على حماية المعدن من تفاعل الأكسدة والاختزال اللاحق مع البيئة. يتم تحديد الخصائص الوقائية لمنتجات التآكل المتكونة بناءً على حساب عامل الرخاوة F:
| | (10.1) |
أين الخامسهو الحجم المولي (المولي) لمنتجات التآكل (أكسيد ، كلوريد ، كبريتيد ، إلخ) ؛
الخامسهو الحجم المولي (الضرس) للمعدن المستخدم في تكوين الأكسيد ؛
مهي الكتلة المولية لمنتجات التآكل ؛
ص هي كثافة المعدن ؛
نهو عدد ذرات المعدن في منتج التآكل ؛
لكنهي الكتلة الذرية للمعدن ؛
ص هي كثافة منتج التآكل.
إذا كان f< 1, то образуется пленка, частично покрывающая поверхность металла (рыхлая пленка). Сплошная пленка, обладающая защитным действием, получается лишь при условии 1< Ф < 2,5. Если фактор рыхлости Ф >2.5 ، ثم تنشأ ضغوط في الفيلم تدمره وتنتهك الاستمرارية (الفيلم ينتفخ ويتشقق).
مثال 1أثناء التآكل الكيميائي للحديد في جو من الهواء الجاف المحتوي على غاز H 2 S و O 2 ، تتشكل أفلام FeS و FeO. اكتب معادلات تكوين هذه المركبات. احسب عامل الرخاوة واستنتج الخواص الوقائية للأغشية. الكثافة ص = 7.87 ؛ ص = 4.7 ؛ ص = 5.7 جم / سم.
المحلول
تتكون الأغشية عندما يتفاعل المعدن مع بيئة عدوانية نتيجة للتفاعلات التالية:
2Fe + 2H 2 S + O = 2FeS + 2H 2 O ؛
2Fe + O 2 \ u003d 2FeO.
باستبدال القيم العددية في (10.1) نجد عامل الرخاوة:
![]() ,
,
![]() .
.
نظرًا لأن f> 2.5 بالنسبة لفيلم الكبريتيد ، فإن تكسيره وانقطاعه ممكنان.
يكمن المعيار Ф لفيلم الأكسيد في الفترة 1< Ф < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами.
التآكل الكهروكيميائي- التدمير التلقائي للمعادن في وجود إلكتروليت نتيجة تكوين أزواج جلفانية عند ملامسة معادن غير متشابهة ، مثل الصمامات وخطوط الأنابيب ، أو العديد من الخلايا الجلفانية الدقيقة على سطح سبيكة معدنية. ومن أهم الأنواع التآكل الكهروكيميائييشمل الغلاف الجوي وتحت الأرض والبحرية و مياه عذبة، كبريتيد الهيدروجين ، الحمضي ، القلوي ، في الأملاح المنصهرة ، في الوسط المائي العضوي والعضووي. يكمن الاختلاف الرئيسي بين التآكل الكهروكيميائي والتآكل الكيميائي في الفصل المكاني لتفاعلات أكسدة المعادن واختزال المؤكسد الذي يحدث في مقاطع الكاثود والأنود. أثناء التآكل الكهروكيميائي ، تحدث عمليات الأكسدة والاختزال في مناطق مختلفة التركيب الكيميائيأو الحالة الفيزيائية للسطح ، أي عدم التجانس الكيميائي والطاقة. يمكن أن ينشأ عدم التجانس هذا عندما تكون المرحلة و التركيب الكيميائيالمعدن والسبائك ، في وجود شوائب في المعدن ، مع معالجة كيميائية غير متكافئة ، مع تركيزات غير متكافئة من الإلكتروليت المحيط ، مع عدم تجانس وسماكات مختلفة لأغشية منتجات التآكل ، إلخ.
يمكن وصف النشاط المختلف كميًا لمساحات السطح بحجم جهد القطب φ ، والذي يحدث عند حدود "المحلول المعدني" (الجدول 9.1). المناطق الأكثر نشاطًا على السطح لها قيمة أقل لإمكانات القطب (أكثر سلبية) وتسمى مناطق الأنود.يتم استدعاء المناطق ذات النشاط الأقل كاثودية.
في مواقع الأنود ، يتأكسد المعدن ، أي تدميره:
أنا - لا → أنا ،
حيث أنا عبارة عن كاتيونات معدنية تمر إلى محلول ؛
أنا 0 - معدن.
تبقى الإلكترونات داخل المعدن وتنتقل من القطب الموجب إلى مناطق الكاثود ، حيث تكون على اتصال مباشر وحيث يحدث الاختزال. أيونات وجزيئات عامل مؤكسد في بيئة أكالة. اعتمادًا على تكوين الوسيط ، تتم العمليات التالية:
- في بيئة حمضية:
2H + 2ē \ u003d H ؛
- في بيئة محايدة أو قلوية قليلاً:
2Н 2 O + 2ē \ u003d H + 2OH.
العملية الكاثودية الأكثر احتمالا في وسط محايد في وجود الهواء المذاب في الماء (الغلاف الجوي ، تآكل التربة ، الهواء الرطب) هي كما يلي:
O 2 + 2H 2 O + 4ē = 4OH.
مثال 2قم بتكوين المعادلات الإلكترونية لعمليات التآكل الكاثودي والأنوديك لسبائك الحديد مع النيكل في حمض الهيدروكلوريك وفي الهواء الرطب. ما هي تركيبة منتج التآكل؟
المحلول
دعنا نكتب من الجدول 9.1 قيم جهد القطب القياسي للمعادن: φ 0 = -0.44 V، φ 0 = -0.25 V. منذ φ 0< φ 0 , то железо будет выполнять функцию анода, а никель – катода.
في بيئة حمضيةالمعادلات الإلكترونية للعمليات لها الشكل:
- تفاعل انوديك: Fe 0 - 2ē \ u003d Fe 2+ ؛
- التفاعل الكاثودي: 2H + + 2ē \ u003d H 0 2.
منتجات التآكل هي كلوريد الحديد FeCl والهيدروجين.
في الهواء الرطبتحدث التفاعلات التالية في مقاطع الكاثود والأنود:
- تفاعل انوديك: Fe - 2ē = Fe ؛
- تفاعل كاثودي: 2Н O + O + 4ē = 4OH.
نواتج التآكل Fe + 2OH = Fe (OH).
في وجود الرطوبة والأكسجين ، يتأكسد الحديد إلى الحالة الثلاثية التكافؤ:
4Fe (OH) + 2H O + O = 4Fe (OH).
لتحديد مقاومة تآكل المعادن ، الكتلة ( ي) ومؤشرات عميقة (P).
سرعة تفاعل كيميائييتحدد من النسبة:
أين ∆ مهو التغير في كتلة العينة ، g ؛
- وقت التآكل أو الساعة أو السنة ؛
سهي مساحة سطح التآكل ، م 2.
مؤشر التآكل العميق P يساوي:
| P = ، مم / سنة ، | (10.3) |
أين ∆ حهو سمك المعدن المدمر خلال الوقت t.
P و يمرتبطة بالنسب:
إذا يتقاس بالجرام / م 2. السنة ،
إذا يتقاس بالجرام / م 2. ساعة ،
حيث ص هي كثافة المعدن ، جم / سم 3.
وفقًا للمؤشرات المذكورة أعلاه ، كقاعدة عامة ، يتم تقدير التآكل الكلي للنظام.
الحماية من التآكل
نظرًا لأن عملية التآكل الكهروكيميائي ، كما هو مذكور أعلاه ، تتكون من حدوث تفاعلات كاثودية وأنودية مترابطة ، فإن تباطؤ أحدها يؤدي إلى انخفاض معدل عملية التآكل ككل.
يمكن تقسيم طرق الحماية من التآكل إلى ثلاث مجموعات:
- التأثير على المعدن ؛
- التأثير على البيئة العدوانية ؛
- طرق الحماية المركبة.
ل المجموعة الأولىترتبط:
أ) تنشيط المعادن - إنشاء طبقة سطحية واقية أو إدخال عناصر تقلل النشاط الكاثودي أو الأنود للسبائك ؛
ب) معالجة سطح المعدن - المعالجة الحرارية ، الرش ، التشغيل الآلي (التصلب ، إلخ) ، تعديل الصدأ على السطح ؛
ج) تطبيق الطلاءات الواقية ؛
د) اختيار المواد المقاومة للتآكل ؛
ه) التصميم العقلاني - سحب المكونات الفردية للهيكل من البيئات العدوانية.
المجموعة الثانيةتشمل طرق الحماية ما يلي:
أ) استخدام مثبطات التآكل ؛
ب) نزع الهواء عن البيئة ؛
ج) إنشاء بيئات اصطناعية (معالجة البيئات المائية ، استخدام بيئات محايدة ، إزالة رطوبة الهواء).
المجموعة الثالثةتستخدم طرق الحماية مجموعة من الأساليب المذكورة أعلاه.
الطلاءات الواقيةيمكن تقسيمها إلى عضوي(القار والدهانات والمينا والورنيش) ، غير عضوي(أكسيد ، فوسفات ، نيتريد وأغشية أخرى) و كلف(معدن يتم الحصول عليه عن طريق التحليل الكهربائي).
غير عضوييتم الحصول على الطلاءات (الكيميائية) عن طريق معالجة المعدن بمواد كيميائية معينة. عندما تتفاعل هذه المادة مع سطح المعدن ، يتشكل فيلم من مركب غير عضوي قوي يحمي المعدن من التلف.
كلفتنقسم الطلاءات إلى كاثودية وأنوديك (الشكل 10.1) اعتمادًا على نسبة جهود القطب القياسية للمادة المحمية j 0 والطلاء j 0. إذا كانت j 0> j 0 ، ففي حالة انتهاك سلامة الطلاء الواقي ، سيكون الأنود هو المعدن المطلي ( طلاء انوديك) ، الكاثود هو المعدن المحمي.
يعتبر الطلاء الأنوديك فعالاً للغاية ، لأنه عندما يتم إتلافه ، فإنه يحمي المعدن المحمي من التلف. مثال على الطلاء الأنوديك فيما يتعلق بالحديد هو طلاء الزنك والمغنيسيوم للفولاذ. إذا كانت j 0< j 0 , то при нарушении целостности покрытия защищаемый металл будет анодом, а металл покрытия – катодом (طلاء كاثودي). تحمي الطلاءات الكاثودية المعدن طالما استمرت هذه الطلاءات.
الأربعاء الأربعاء
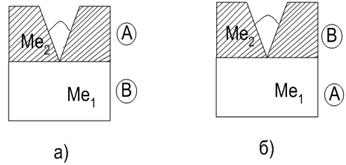
أرز. 10.1. الكهربائي: أ) طلاء الأنود j 0 1> j 0 2 ؛ ب) طلاء الكاثود j 0 1< j 0 2 . Ме 1 – защищаемый металл, Ме 2 – металл покрытия (А – анод, В – катод)
الحماية الكهروكيميائيةتنقسم إلى الكاثودية والذبيحة والأنود. أول نوعين الحماية الكهروكيميائيةتتم عن طريق إنشاء خلية كلفانية يلعب فيها المعدن المحمي دور الكاثود. يتم تحقيق ذلك عن طريق ملامسته بمعدن أكثر نشاطًا - واقي (له قيمة أقل لإمكانات القطب القياسي) أو عن طريق توصيل المنتج بالقطب السالب لمصدر تيار خارجي (الحماية الكاثودية).
حماية الأنوديحدث عندما يتم توصيل معدن بالقطب الموجب لمصدر تيار وتتشكل طبقة أكسيد قوية على سطحه بسبب الأكسدة الأنودية تحت تأثير التحليل الكهربائي (ويتم تحويل جهد القطب إلى منطقة الحالة السلبية).
مثبطاتهي مواد تضاف بكميات صغيرة إلى بيئة عدوانية تتراكم في واجهة المعدن بالكهرباء وتقلل من معدل التآكل. يتم تقدير فعالية عمل المثبطات من خلال قيم معامل التثبيط لودرجة الحماية ض:
![]()
أين ј هو معدل التآكل في المحلول بدون مثبط ؛
ј هو معدل التآكل في محلول مع مثبط.
قيمة ليوضح عدد المرات التي ينخفض فيها معدل تآكل المعدن مع إدخال مثبط. قيمة ضيميز الانخفاض النسبي في معدل التآكل. يتأثر التأثير الوقائي للمثبطات بشكل كبير بعدد من عوامل التآكل الخارجية والداخلية: حموضة الوسط ، ودرجة الحرارة ، وطبيعة الحمض والمواد المحمية ، وطبيعة المذيب والمثبط نفسه ، وتركيز المثبط ، والخلط ، إلخ.
مثال 3هل يمكن استخدام طلاء الزنك لحماية منتج الصلب من التآكل في الهواء الرطب؟ اكتب المعادلات الإلكترونية لعمليات التآكل الكاثودي والأنوديك التي لوحظت عند تلف هذا الطلاء. ما هو تكوين منتجات التآكل؟ ما هو سمك الطلاء بحيث يدوم 5 سنوات إذا كانت قيمة معامل العمق P تساوي 0.16 مم / سنة؟ يعتبر الطلاء غير صالح إذا كان سمكه المتبقي 18٪ من القيمة الأصلية.
المحلول
بمقارنة جهود القطب j 0 Zn / Zn 2+ = -0.76 V و j 0 Fe / Fe 2+ = -0.44 V ، نرى أن j 0 Zn< j 0 Fe .Следовательно, цинк по отношению к железу является анодом. Цинковое покрытие – анодное покрытие. На аноде идет процесс окисления:
Zn - 2ē \ u003d Zn 2+.
عند الكاثود (Fe) - عملية تقليل جزيئات البيئة (في الهواء الرطب ، يوجد الأكسجين والماء):
2Н O + O + 4ē = 4OH.
منتجات التآكل: Zn 2+ + 2OH - = Zn (OH) 2.
إذا تم كسر الطلاء ، فإن الفولاذ لا يذوب ، لذلك يمكن استخدام طلاء الزنك.
سمك الطلاء ∆ حيمكن العثور عليها من المعادلة:
من أين ∆ ح\ u003d P × t \ u003d 0.16. 5 = 0.8 ملم.
لكن 82٪ من السماكة الأصلية عرضة للتآكل. ثم يجب أن تكون سماكة الطلاء بالكامل مساوية لـ 100٪:
![]()
مهام
251 –255 قم بتكوين المعادلات الإلكترونية لعمليات التآكل الأنودي والكاثودي لخط أنابيب فولاذي (المكون الرئيسي للصلب هو الحديد) الذي يحتوي على شوائب معدنية A في التربة الرطبة (الماء والأكسجين موجودان). ما هو تكوين منتجات التآكل؟ احسب سمك جدار خط الأنابيب (مم) ليكون τ سنوات إذا كان معدل التآكل ي. يجب ألا يقل سمك الجدار المتبقي لخط الأنابيب عن 25٪ من القيمة الأصلية. كثافة الحديد ص \ u003d 7.87 جم / سم 3.
256–259 هل يمكن استخدام المادة المقترحة كحامية لحماية منتج الصلب من التآكل في المياه الطبيعية المشبعة بالأكسجين (المكون الرئيسي للفولاذ هو الحديد)؟ اكتب المعادلات الإلكترونية لعمليات التآكل الأنودي والكاثودي. ما هو تكوين منتجات التآكل؟ تحديد عمر الخدمة المحتمل لقسم المداس " أ × ب "إذا كان معدل التآكل ي، جم / م 2 × سنة ، والكتلة م، ج.
260–262 هل يمكن استخدام الطلاء المقصود لحماية منتج الصلب بشكل فعال من التآكل في الهواء الرطب؟ (المكون الرئيسي للصلب هو الحديد.)
قم بتكوين المعادلات الإلكترونية لعمليات التآكل الأنودي والكاثودي التي تحدث عند انتهاك سلامة الطلاء. ما هو تكوين منتجات التآكل؟ ماذا يجب أن يكون سمك الطلاء بحيث يدوم سنوات إذا كانت قيمة مؤشر العمق P، mm / year؟ يعتبر الطلاء ساري المفعول حتى يصبح سمكه المتبقي 15٪ من القيمة الأصلية.
263–266 أثناء التآكل الكيميائي للمعادن ، في جو من الهواء الجاف يحتوي على غاز O 2 ؛ حمض الهيدروكلوريك. H 2 S تحت التأثير درجات حرارة عاليةيتم تشكيل أفلام منتجات التآكل. اكتب معادلات تكوين المركبات. معرفة كثافة المعادن وأكاسيدها وكلوريداتها وكبريتيداتها ، وتحديد أي من الأغشية سيكون له تأثير وقائي.
| رقم المهمة | ميتال ، أنا | ص ، جم / سم 3 | منتجات التآكل وكثافتها جم / سم 3 |
| الحديد | 7,87 | الحديد O -5.7 ؛ Fe 2 O 3 -5.25 ؛ FeCl 2 - 2.9 ؛ FeS 2 - 5.03 ؛ Fe 3 O 4 - 5.18 | |
| النحاس | 8,94 | CuO - 6.46 ؛ نحاس 2 يا - 3.7 ؛ CuCl 2 - 3.05 ؛ نحاس 2 جنوب - 5.4 ؛ نحاس - 4.68 | |
| مينيسوتا | 7,74 | MnO -5.18 ؛ Mn 2 O 3 - 4.3 ؛ Mn 3 O 4 - 7.42 ؛ MnCl 2 - 2.98 ؛ MnO 2 - 5.03 | |
| ني | 8,91 | NiO - 7.45 ؛ Ni 2 S 3 - 5.82 ؛ NiCl 2 - 3.51 ؛ NiS - 4.12 |
267–270 منتج معدني، التي تحتوي على شوائب A (انظر الجدول) ، تتآكل بشدة في محلول HCl. تستخدم الموانع لإبطاء العملية في المحاليل الحمضية. تحديد معامل منع التآكل لودرجة الحماية ض، الذي يوفره المانع ، إذا كان من أجل رساعات من فقدان وزن المنتج ستشكل م 0 جرام في حالة عدم وجود مثبط و مجرام ، إن وجد. اصنع المعادلات الإلكترونية لعمليات التآكل الأنودي والكاثودي للمنتج في الحمض. ما هو تكوين منتجات التآكل؟
الجواب: 267) 3.5 ؛ 71.2٪ ؛ 268) 8.0 ؛ 87.6٪ ؛ 269) 8.0 ؛ 87.6٪ ؛ 270) 2.6 ؛ 61.6٪.
التحليل الكهربائي
التحليل الكهربائي -مجموعة من عمليات الأكسدة والاختزال التي تحدث على الأقطاب الكهربائية عندما يمر تيار كهربائي مباشر عبر محلول إلكتروليت أو يذوب.
القطب الموجب (أ) هو القطب الذي تحدث فيه عملية الأكسدة. الكاثود (K) - القطب الذي تتم عليه عملية الاختزال. أثناء التحليل الكهربائي ، يتم توصيل الكاثود بالقطب السالب للمصدر الحالي ، والقطب الموجب بالقطب الموجب.
ضع في اعتبارك جوهر العملية في مثال التحليل الكهربائي إنصهارهيدروكسيد الصوديوم مع أقطاب الكربون. في الذوبان ، كما هو الحال في المحاليل ، تتفكك جزيئات الإلكتروليت إلى أيونات:
هيدروكسيد الصوديوم Á Na + + OH -.
يؤدي مرور تيار كهربائي إلى حركة موجهة للأيونات. تتحرك كاتيونات الصوديوم Na + نحو الكاثود وتقبل الإلكترونات منه:
أنيون OH - اقترب من القطب الموجب وتبرع بالإلكترونات:
يتم تمثيل التفاعل الكلي للتحليل الكهربائي لمادة هيدروكسيد الصوديوم من خلال مجموع عمليتي قطب كهربائي ويتم التعبير عنه بالمعادلة:
يستخدم التحليل الكهربائي للأملاح أو الأكاسيد المنصهرة في التكنولوجيا للحصول على المعادن النشطة (Li ، Na ، K ، Ca ، Al).
في محاليل مائية، بالإضافة إلى أيونات المنحل بالكهرباء نفسه ، هناك جزيئات الماء ، والتي يمكن أن تشارك أيضًا في عمليات الأكسدة والاختزال على الأقطاب الكهربائية.
لتحديد نتائج التحليل الكهربائي حلوليمكنك استخدام القواعد التالية.
العمليات الكاثودية
في الكاثود ، يتم تقليل الكاتيونات ذات الجهد الكهربائي القياسي العالي φ 0 بسهولة أكبر.
لذلك ، إذا كان جهد القطب القياسي للمعدن أكبر من -0.41 فولت ، فعادة ما يتم تقليل أيونات هذا المعدن عند الكاثود. إذا كانت إمكانات المعدن في الفاصل الزمني ، فسيتم تقليل كل من أيونات المعدن والماء في وقت واحد عند الكاثود. إذا كانت إمكانات المعدن أقل من -1.4 فولت ، فسيتم تقليل الماء فقط عند الكاثود. يمكن تمثيل ما ورد أعلاه على أنه الرسم البياني التالي:
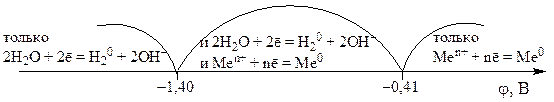
عمليات الأنود
يتم تقسيم الأنودات المستخدمة في التحليل الكهربائي إلى خامل(الجرافيت والفحم والبلاتين والذهب والإيريديوم) و نشيط(معادن أخرى).
في القطب الموجب ، يتأكسد النظام ذو إمكانات الأكسدة المنخفضة أولاً. ولكن في بعض الحالات ، نظرًا لتعقيد تصريف الأيونات المحتوية على الأكسجين (NO - 3 ، SO2-4 ، PO 3 - 4 ، CO 2 - 3 ، إلخ) ، لم يتم استيفاء هذه القاعدة. يتم تحديد نوع التفاعل الأنودي بشكل عام حسب طبيعة جسيم التفريغ.
في حالة الاستخدام نشيط (قابل للذوبان) الأنود ، يتأكسد فلز الأنود:
أنا 0 - nē \ u003d أنا n +.
عندما يتحلل كهربائيا مع خامليتأكسد الأنود بسهولة الأنيونات البسيطة من أحماض الأكسدة الموجودة في المحلول (I - ، Br - ، Cl -).
لا تتأكسد الأيونات المعقدة للأحماض المحتوية على الأكسجين (SO ، CO ، PO ، إلخ) في المحاليل المائية ، كقاعدة عامة - يتأكسد الماء بدلاً من ذلك:
2H 2 O - 4ē \ u003d O 2 + 4H +.
يمكن تمثيل تسلسل عمليات الأكسدة عند الأنود بالمخطط التالي:
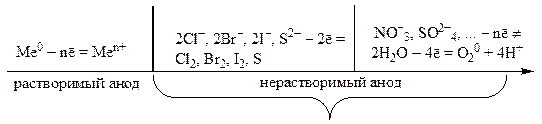
مثال 1يؤلف معادلات للعمليات الكاثودية والأنود التي تحدث أثناء التحليل الكهربائي لمحلول مائي من K 2 SO 4 على أقطاب الكربون.
المحلول
في محلول مائي ، يتفكك الملح K 2 SO 4: K 2 SO 4 2K + + SO 2-4.
تقترب جزيئات K + كاتيونات و H 2 O من الكاثود ، وتقترب جزيئات SO 2-4 أيونات وجزيئات H 2 O من الأنود. ![]() (انظر الجدول 9.1) أقل من -1.4 فولت ، سيتم تقليل جزيئات الماء عند الكاثود (انظر الرسم البياني أعلاه).
(انظر الجدول 9.1) أقل من -1.4 فولت ، سيتم تقليل جزيئات الماء عند الكاثود (انظر الرسم البياني أعلاه).
SO 2-4 الأنيونات عبارة عن أيونات معقدة لا تتأكسد في المحاليل المائية. لذلك ، تتأكسد جزيئات الماء عند الأنود.
يصبح المحلول عند الكاثود قلويًا (تظهر أيونات OH) ، وعند الأنود يصبح أكثر حمضية (تظهر أيونات H +). المعادلة الجزيئية الكلية لتفاعل التحليل الكهربائي هي:
يتكون KOH و H 2 SO 4 من K + و OH - و H + و SO 2 - 4 في المحلول.
مثال 2قم بتكوين معادلات للعمليات الكاثودية والأنود التي تحدث أثناء التحليل الكهربائي لمحلول CuCl 2 باستخدام أنود نحاسي.
المحلول
في محلول مائي ، يتفكك ملح CuCl 2: CuCl 2 Сu 2+ + 2Cl -.
الكاتيونات Cu 2+ و H 2 O مناسبة للكاثود ؛ إلى الأنود - أيونات Cl - و H 2 O. الأنود النحاسي قابل للذوبان ، ويشارك في تفاعل القطب. ستتم استعادة الإمكانات φ 0 С u / Cu2 + = 0.34 V ، و Cu 2+ على الكاثود ، وفقًا للمخطط أعلاه. يشارك معدن الأنود في عملية الأنود (الأنود القابل للذوبان في النحاس):
نتيجة للتحليل الكهربائي ، يتم نقل النحاس من القطب الموجب إلى القطب السالب ، ولا يتأثر الملح بهذه العملية ويوفر التوصيل الكهربائي فقط.
يتم إعطاء الخاصية الكمية لعمليات التحليل الكهربائي قوانين فاراداي. يمكن إعطاؤهم الصيغة العامة التالية:
كتلة المنحل بالكهرباء الذي خضع للتحول أثناء التحليل الكهربائي ، وكذلك كتل المواد المتكونة على الأقطاب الكهربائية ، تتناسب طرديًا مع كمية الكهرباء التي مرت عبر محلول الإلكتروليت أو الذوبان ، والكتل المكافئة للمواد المقابلة. .
يتم التعبير عن قانون فاراداي المشترك بالمعادلة التالية:
أين لكنهي الكتلة الذرية لمادة بسيطة تنطلق عند القطب ؛
نهي شحنة الأيون أو عدد الإلكترونات المشاركة في عملية التحليل الكهربائي ؛
أنا- القوة الحالية بالأمبير ، A ؛
ر- وقت المرور الحالي بالثواني ، ثانية ؛
F- رقم فاراداي (F = 96500 C / mol).
الكتلة المكافئة للمادة.
نظرًا لوجود عمليات متنافسة عادة ، يجب تعديل قوانين فاراداي.
نسبة كتلة المادة التي تم إطلاقها فعليًا على القطب مإلى كتلة المادة ، والتي كان يجب إطلاقها وفقًا لقانون فاراداي ، تسمى الإخراج الحالي h:
![]() .
.
مثال 3. مع مرور تيار كهربائي قدره 1 أ خلال محلول FeCl 2 (الأقطاب الكهربائية خاملة) لمدة ساعة واحدة ، تم إطلاق 0.90 جم من الحديد. تحديد الناتج الحالي. ما هي العمليات التي تستهلك بقية التيار؟
المحلول
بما أن الكتلة الذرية للحديد هي 56 جم / مول ، إذن ، وفقًا لقانون فاراداي ، فإن القيمة النظرية لكتلة الحديد المنبعثة عند الكاثود هي:
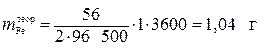 .
.
الإخراج الحالي:
دعونا ننتقل إلى مخطط العمليات في الكاثود. منذ القيمة ![]() تقع في منطقة -1.4 فولت< φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
تقع في منطقة -1.4 فولت< φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
Fe 2+ + 2ē \ u003d Fe
وجزءًا من جزيئات الماء:
2H 2 O + 2ē \ u003d H 2 + 2OH – .
وبالتالي ، فإن جزءًا من التيار المتدفق عبر الإلكتروليت يتم إنفاقه على تقليل الماء.
مثال 4يمر تيار كهربائي قدره 1 أ لمدة ساعة واحدة عبر محلول ZnCl 2 (الأقطاب الكهربائية خاملة). حدد كمية الزنك التي يتم إطلاقها على الكاثود خلال الوقت المحدد ، إذا كانت الكفاءة الحالية h هي 64٪. اشرح ما هي العمليات التي تستهلك بقية التيار.
المحلول
القدره ![]() B (انظر الجدول 9.1) وتقع في المنطقة
B (انظر الجدول 9.1) وتقع في المنطقة
-1.4 فولت< j < -0,41 В. Следовательно, на катоде будет идти совместное восстановление катионов Zn 2+ и, частично, молекул воды:
Zn 2+ + 2ē = Zn
2H 2 O + 2ē \ u003d 2OH - + H 2 (جزئيًا ، عملية جانبية)
لتحديد المقدار النظري للزنك المنطلق على الكاثود ، نستخدم معادلة قانون فاراداي:
الناتج الحالي يحسب بواسطة الصيغة
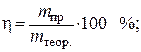
بالتالي
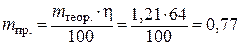 ج.
ج.
للحصول على الزنك عند الكاثود ، يتم إنفاق 64 ٪ من إجمالي التيار الذي يمر عبر الإلكتروليت ، ويتم إنفاق باقي التيار على تقليل الماء.
مهام
271–277
كتلة مادة صلبة تنطلق على القطب السالب أثناء التحليل الكهربائي لمحلول من مادة ب أثناء مرور تيار أنا(أ) خلال الوقت τ (ح) ، هو م(ز). احسب الناتج الحالي. اشرح لماذا ، في بعض الحالات ، لا يتم إنفاق كل التيار على ترسيب المعادن.
| رقم المهمة | روابط | أنود قابل للذوبان | أنا، لكن | τ ، ساعة | م، جي | ||
| لكن | ب | في | |||||
| بوكل | SnCl 2 | ZnSO4 | Zn | 8,5 | 36,6 | ||
| FeCl2 | ZnSO4 | MgCl 2 | ملغ | 1,5 | 11,3 | ||
| هيدروكسيد الصوديوم | FeCl2 | MnSO 4 | مينيسوتا | 0,5 | 4,2 | ||
| PbCl2 | النحاس (NO 3) 2 | FeCl2 | الحديد | 7,1 | |||
| كاليفورنيا (أوه) 2 | NiCl2 | AlCl 3 | ال | 9,3 | 18,8 | ||
| ليبر | MnSO 4 | CoCl2 | شارك | 10,5 | 0,5 | 3,0 | |
| SnCl 2 | FeSO4 | الرصاص (NO 3) 2 | الرصاص | 8,8 | 14,2 |
إجابه :
271) 97 %; 272) 62 %; 273) 67 %; 274) 99 %; 275) 91,9 %;
276) 55,8 %; 277) 77,3 %.
278–284. اصنع المعادلات الإلكترونية للعمليات التي تحدث على الكاثود والأنود أثناء التحليل الكهربائي:
1) ذوبان المادة أ مع أقطاب الجرافيت ؛
2) محلول من المادة B مع أقطاب الجرافيت ؛
3) محلول من المادة B مع أنود قابل للذوبان (نشط).
احسب الوقت اللازم للتحضير العملي لـ 100 غرام من المعدن من محلول المادة B بالقوة الحالية أنا، إذا كان الناتج الحالي h.
| رقم المهمة | مواد | أنود قابل للذوبان | أنا، أ | ح ،٪ | ||
| لكن | ب | في | ||||
| SnCl 2 | Fe (NO 3) 2 | NiSO4 | ني | 66,7 | ||
| ني (أوه) 2 | CoCl2 | الرصاص (NO 3) 2 | الرصاص | 9,5 | ||
| MgCl 2 | ZnSO4 | NiSO4 | Zn | 6,4 | ||
| ZnCl 2 | AgNO3 | CuCl 2 | النحاس | 14,8 | ||
| CuBr 2 | قرص مضغوط (رقم 3) 2 | AgNO3 | اي جي | 8,7 | ||
| هيدروكسيد الصوديوم | الرصاص (NO 3) 2 | NiCl2 | ني | 5,9 | ||
| PbCl2 | CoSO 4 | ملغ (NO 3) 2 | ملغ |
الجواب: 278) 12 ساعة ؛ 279) 10 ساعات ؛ 280) 17.3 ساعة ؛ 281) 1.7 ساعة ؛ 282) 6.4 ساعات ؛ 283) 4.7 ساعة ؛ 284) 12.3 ساعة
285–291 اصنع المعادلات الإلكترونية للعمليات التي تحدث على الكاثود والأنود أثناء التحليل الكهربائي:
1) ذوبان المادة أ مع أقطاب الجرافيت ؛
2) محلول من المادة B مع أقطاب الجرافيت ؛
3) محلول من المادة B مع أنود قابل للذوبان (نشط).
كيف ستتغير كتلة الأنود بعد تمرير تيار القوة I (A) لفترة زمنية τ (h) عبر المحلول B؟
| رقم المهمة | مواد | أنود قابل للذوبان | أنا، أ | τ ، ساعة | ||
| لكن | ب | في | ||||
| ناي | MgSO4 | ZnCl 2 | Zn | 8,5 | ||
| CaCl2 | النحاس (NO 3) 2 | FeCl2 | الحديد | |||
| RbCl | AgNO3 | CuSO4 | النحاس | 7,5 | 2,5 | |
| KOH | ZnCl 2 | CoCl2 | شارك | 3,7 | ||
| CuCl 2 | نانو 3 | الرصاص (NO 3) 2 | الرصاص | 2,5 | ||
| هيدروكسيد الصوديوم | ثنائية (رقم 3) 3 | NiCl2 | ني | 2,0 | 2,5 | |
| CaI 2 | H2SO4 | قرص مضغوط (رقم 3) 2 | قرص مضغوط | 6,8 | 0,8 |
إجابه :
285) 20.6 جم ؛ 286) 31.3 جم ؛ 287) 22.4 جم ؛ 288) 4.1 جم ؛ 289) 38.6 جم ؛
290) 5.5 جم ؛ 291) 7.1 جرام
292–300 اصنع المعادلات الإلكترونية للعمليات التي تحدث على الكاثود والأنود أثناء التحليل الكهربائي:
1) ذوبان المادة أ مع أقطاب الجرافيت ؛
2) محلول من المادة B مع أقطاب الجرافيت ؛
3) محلول من المادة B مع أنود قابل للذوبان (نشط).
ارسم التغير في كتلة الأنود القابل للذوبان ممن القوة الحالية أنافي زمن التحليل الكهربائي 0.5 ساعة. القوة الحالية أنايساوي 0.5 ؛ واحد؛ 2 ؛ 3 و 5 أ.
| رقم المهمة | روابط | أنود قابل للذوبان | ||
| لكن | ب | في | ||
| KOH | Na2SO4 | NiCl2 | ني | |
| RbCl | Li2SO4 | الرصاص (NO 3) 2 | الرصاص | |
| كلوريد الصوديوم | ني (رقم 3) 2 | AgNO3 | اي جي | |
| AlCl 3 | Fe 2 (SO 4) 3 | CuSO4 | النحاس | |
| ناي | النحاس (NO 3) 2 | ZnCl 2 | Zn | |
| SnCl 2 | CoSO4 | CuSO4 | النحاس | |
| CoCl2 | BiCl 3 | AgNO3 | اي جي | |
| رقم المهمة | روابط | أنود قابل للذوبان | ||
| لكن | ب | في | ||
| بوكل | SnCl 2 | ZnSO4 | Zn | |
| ناي | النحاس (NO 3) 2 | PbCl2 |
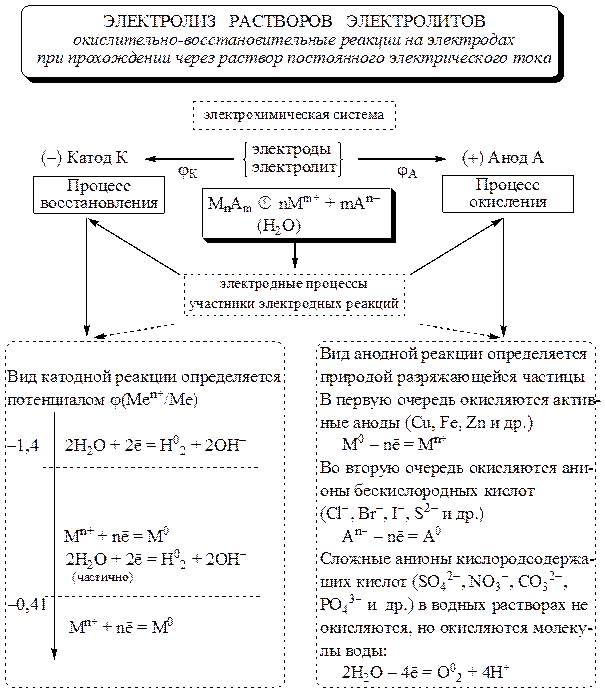
أرز. 11.1. مخطط هيكلي منطقي لعلاقة عمليات القطب الكهربي أثناء التحليل الكهربائي
تتكون الخلية الجلفانية من قطبين — الأنود والكاثود. سننظر في الجهاز ومبدأ التشغيل باستخدام مثال عنصر Daniel-Jacobi. يستخدم هذا العنصر أقطاب النحاس والزنك. يتم وضع كل قطب كهربي في وعاء به محلول إلكتروليت ، تكون كاتيوناته "تحمل نفس الاسم" مثل مادة القطب. الحاويات مفصولة بقسم. يتم إنزال قطب الزنك في محلول ZnSO 4. عندما يتم إغلاق دائرة الخلية الجلفانية بين القطب الكهربائي ومحلول الإلكتروليت ، يحدث تفاعل أكسدة:
![]()
تذهب أيونات الزنك من القطب إلى المحلول ، وتبقى الإلكترونات على القطب ؛ وهكذا تصبح صفيحة الزنك مشحونة سالبة وتصبح الأنود. هناك جهد قطب سالب.
يحدث تفاعل اختزال بين القطب النحاسي ومحلول CuSO 4 المحيط به:
![]()
تترسب أيونات النحاس من المحلول على قطب نحاسي يكتسب شحنة موجبة ويصبح القطب السالب. سيكون جهده الكهربائي مساويًا لـ.
أؤكد مرة أخرى أنه في الخلية الجلفانية ، الأكسدة — التبرع بالإلكترونات — يحدث في القطب الموجب (قطب الزنك) ، والاختزال — اكتساب الإلكترونات - في القطب السالب (القطب النحاسي).
يوصى بتذكر القاعدة: تحدث الأكسدة عند الأنود المشحون سالبًا ، — تبدأ الكلمات بحرف العلة "o" و "a" ، ويلاحظ الاختزال في القطب الموجب الشحنة — تبدأ الكلمات بالحروف الساكنة "v" و "to".
العملية على الأقطاب الكهربائية:
تفاعل الأكسدة والاختزال الكلي للخلية الجلفانية.
بين حلين — كبريتات الزنك وكبريتات النحاس — تقع جسر الملح (سم). عادة ما يتم عمل جسر الملح على شكل أنبوب مملوء بمحلول كلوريد البوتاسيوم (KCl) أو نترات الأمونيوم (NH 4 NO 3). عند الحد الفاصل بين المحلول المشبع لجسر الملح ومحاليل قطبي ZnSO 4 و CuSO 4 ، تنشأ محتملتان للانتشار ، وهما قريبان من القيمة المطلقة ، ولكنهما معاكسان في الإشارة. يساهم جسر الملح في انخفاض كبير في إمكانات الانتشار بين محاليل الإلكتروليت.
السمة المميزةأي خلية كلفانية هي تشكيل دائرة كهروكيميائية — مجموعة متسلسلة من جميع القفزات المحتملة على واجهات مختلفة تتوافق مع خلية كلفانية معينة.
يمكن كتابة الدائرة الكهروكيميائية لخلية جلفانية من النحاس والزنك ، مع مراعاة القفزات المحتملة التي نشأت ، على النحو التالي:
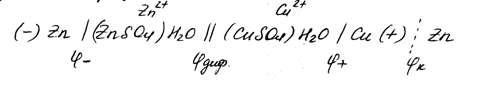 (1)
(1)
يشير أحد الخطوط الرأسية إلى الحد الفاصل بين المعدن ومحلول الإلكتروليت ، حيث تحدث جهود القطب الكهربائي وتحدث.
يشير خطان إلى الحد الفاصل بين الإلكتروليتين ، ويمران عبر جسر الملح (. — إمكانية الانتشار عند هذه الحدود). يُظهر الخط المنقط العمودي الحدود بين المعدنين ؛ تنشأ إمكانية الاتصال عند هذه الحدود. يسمح لك جسر الملح بالتخلص من إمكانية الانتشار التي ستزداد مع زيادة تشغيل الخلية الجلفانية.
يكون معنى سجل الدائرة الكهربائية ، إذا تمت قراءته من اليسار إلى اليمين ، كما يلي: القطب الموجب ، أي قطب الزنك ، مغمور في محلول ZnSO 4 يحتوي على أيونات Zn 2+ ؛ سيربط الجسر الملح محلول إلكتروليت بآخر يحتوي على أيونات النحاس ثنائية التكافؤ ؛ كاثود مغمور في محلول CuSO4 ، أثناء تفكك أيونات النحاس Cu 2+. في الدائرة الخارجية ، تنتقل الإلكترونات من القطب الموجب إلى القطب السالب (تظهر هذه الحركة في الشكل بواسطة سهم).
يحدد الشرط (1) عمل الخلية الجلفانية عندما تكون دائرتها مغلقة. يتم استيفاء هذا الشرط نتيجة التوصيل بأطراف الأجهزة المستهلكة للخلية الجلفانية أو أجهزة القياس.
EMF — هذه هي القيمة المحددة للاختلاف المحتمل للخلية الجلفانية ، والتي يتم ملاحظتها في ظل ظروف التيار الصفري في الدائرة الخارجية وعندما يتم إنشاء جميع التوازنات الكيميائية والمحلية في المراحل وعند حدود الطور ، باستثناء القطب حدود القطب.
تُطبق على خلية دانيال الجلفانية — يتم تمثيل دائرة Jacobi المفتوحة للخلية الجلفانية بالشرط (1) بدون واجهة Cu (+) / Zn ، والتي يشار إليها بخط منقط عمودي.
وفقًا للشرط (1) ، فإن المجال الكهرومغناطيسي للخلية الجلفانية المفتوحة يساوي المجموع الجبري للقفزات المحتملة عند حدود المرحلة:
إذا أهملنا إمكانية الانتشار (في حالة وجود جسر ملح ، فإنه لا يكاد يذكر) ، وكانت إمكانات الاتصال غير مهمة (أو تساوي الصفر بعد توصيل المستهلك) ، فإن EMF لخلية النحاس والزنك الجلفانية ستكون يساوي:
![]() أو
أو ![]()
EMF هي خاصية كمية لتشغيل الخلية الجلفانية — يوضح مدى اكتمال تنفيذ عملية الانتقال الطاقة الكيميائيةفي الكهرباء. من المقبول عمومًا أن قيمة EMF موجبة دائمًا.
نظرًا لأنه لا يمكن قياس القيمة المطلقة للإمكانات ، يتم استخدام قيمة الإمكانات الشرطية. الجهد المشروط لهذا القطب — هذا هو EMF لخلية كلفانية ، تتكون من قطب هيدروجين قياسي (= 0) وهذا القطب ، على القطب السالب للخلية الجلفانية ، هناك دائمًا عملية أكسدة ، على التخفيض الإيجابي. يتم تحديد قطب الخلية الجلفانية فقط فيما يتعلق بالإلكترود الثاني. على القطب السالب للخلية الجلفانية ، هناك دائمًا عملية أكسدة،على الإيجابي - التعافي.يتم تحديد قطب الخلية الجلفانية فقط فيما يتعلق بالإلكترود الثاني.
خذ بعين الاعتبار خلية جاكوبي دانيال الجلفانية. يتكون من صفيحة نحاسية مغمورة في محلول CuSC4 ولوحة زنك مغمورة في محلول ZnSC4. لمنع التفاعل المباشر بين العامل المؤكسد وعامل الاختزال ، يتم فصل الأقطاب الكهربائية عن بعضها بواسطة قسم مسامي.
رسم تخطيطي لخلية كلفانية:
زن | ZnSO4 | | CuSO4 | النحاس ،
زن | Zn2 + | | النحاس 2 + | النحاس.
تظهر طبقة كهربائية مزدوجة على سطح صفيحة الزنك ويتم تحقيق التوازن:
نتيجة لهذه العملية ، ينشأ جهد القطب الكهربائي للزنك.
تظهر أيضًا طبقة كهربائية مزدوجة على سطح الصفيحة النحاسية ويتم إنشاء التوازن:
وبالتالي ، ينشأ جهد قطب كهربائي للنحاس.
تتمتع إمكانات القطب الكهربائي بالزنك بقيمة سالبة أكثر من إمكانات القطب النحاسي ، لذلك ، عندما تكون الدائرة الخارجية مغلقة ، أي عندما يتم توصيل الزنك بالنحاس بموصل معدني ، تنتقل الإلكترونات من الزنك إلى النحاس.
وهكذا ، عندما تكون الدائرة الخارجية مغلقة ، تحدث عمليات عفوية لانحلال الزنك على القطب الكهربائي للزنك وترسيب النحاس على القطب النحاسي. ستستمر هذه العمليات حتى تتساوى إمكانات الأقطاب الكهربائية أو يتم إذابة كل الزنك (أو يتم ترسيب كل النحاس على القطب النحاسي).
لذلك ، أثناء تشغيل عنصر Jacobi-Daniel ، تحدث العمليات التالية:
1) تفاعل أكسدة الزنك: Zn - 2E ® Zn2 +.
تسمى عمليات الأكسدة في الكيمياء الكهربائية عمليات الأنود ، وتسمى الأقطاب الكهربائية التي تتم عليها عمليات الأكسدة الأنودات ؛
2) رد فعل اختزال أيونات النحاس: Сu2 + + 2е «Сu.
تسمى عمليات الاختزال في الكيمياء الكهربائية بالعمليات الكاثودية ، وتسمى الأقطاب التي تتم عليها عمليات الاختزال الكاثودات ؛
حركة الإلكترونات في دائرة خارجية ؛
حركة الأيونات في المحلول: الأنيونات (SO4-2) إلى القطب الموجب ، الكاتيونات (Cu2 + ، Zn2 +) إلى الكاثود. حركة الأيونات في المحلول تغلق الدائرة الكهربائية للخلية الجلفانية.
تلخيصًا لتفاعلات القطب الكهربائي ، نحصل على:
Zn + Cu2 + = Zn2 + + Сu.
نتيجة لهذا التفاعل الكيميائي ، تحدث حركة الإلكترونات في الدائرة الخارجية والأيونات داخل العنصر في الخلية الجلفانية ، أي يتم تشكيل نظام كهربائي مغلق و كهرباء. يسمى التفاعل الكيميائي الكلي الذي يحدث في خلية جلفانية توليد التيار.
يتميز التيار الكهربائي الذي يحدث في نظام كهروكيميائي معين عدديًا بحجم القوة الدافعة الكهربائية (EMF) للعنصر.
إنه يساوي الفرق بين إمكانات القطب للكاثود والأنود:
في ظل الظروف القياسية ، يكون التفاعل الكيميائي التلقائي ممكنًا عندما يكون الحد الأقصى للعمل المفيد المنجز نتيجة لهذا التفاعل مساويًا للقيمة السالبة للتغير في الطاقة الحرة:
في الخلية الجلفانية ، يكون الحد الأقصى للعمل الكهربائي المنجز في ظل الظروف القياسية مساويًا لـ EMF للخلية مضروبًا في كمية الكهرباء (nF) ، أي
أ = nFE0 ، (7.5)
حيث n هو عدد الإلكترونات المشاركة في التفاعل ؛
F - ثابت فاراداي ، يساوي 96500 درجة مئوية / مول ؛
E0- معيار emfخلية كلفانية (T = 298 كلفن ، والتركيز المولي للكهارل هو 1 مول / دسم 3). وبالتالي ، فإن أقصى عمل للخلية الجلفانية يساوي:
أ \ u003d -DG0 \ u003d nFE0. (7.6)
معيار EMF للخلية الجلفانية هو:
الخلايا الجلفانية ، اعتمادًا على طبيعة الأقطاب الكهربائية وتركيز الإلكتروليت ، تنقسم إلى مادة كيميائية وتركيز.
الخلايا الكيميائية الجلفانية هي مثل هذه الخلايا التي تختلف فيها الأقطاب الكهربائية والإلكتروليتات. مثال على خلية كيميائية كلفانية هي خلية جاكوبي دانيال.
المهمة 251.
تحت أي ظرف ستعمل الخلية الجلفانية التي تصنع أقطابها من نفس المعدن؟ قم بعمل رسم تخطيطي ، واكتب المعادلات الإلكترونية لعمليات القطب وحساب EMF لخلية كلفانية يكون فيها أحد قطب النيكل في محلول 0.001 M ، والآخر هو نفس القطب في محلول كبريتات النيكل 0.01 M. الجواب: 0.0295 ف.
المحلول:
خلية جلفانية، ستعمل الأقطاب الكهربائية المصنوعة من نفس المعدن بشرط أن تكون الأقطاب الكهربائية مغمورة في محاليل ملحية بتركيزات مختلفة. مخطط الخلية الجلفانية حيث يوجد أحد قطب النيكل في محلول 0.001 M ، والآخر في محلول كبريتات النيكل 0.01 M له الشكل:
الجهد الكهربائي للمعادن(هـ) يعتمد على تركيز أيوناته في المحلول. يتم التعبير عن هذا الاعتماد بواسطة معادلة Nernst:
![]()
ه 0 - ؛ ن هو عدد الإلكترونات المشاركة في العملية ؛ ج هو تركيز أيونات المعادن في محلول ملحها (بحسابات دقيقة ، نشاط). دعونا نحدد جهود القطب الكهربائي للأقطاب الفضية بتركيزات مختلفة من أيونات الفضة Ag + ، نحصل على:
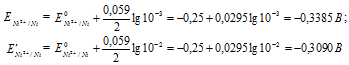
لتحديد EMF لخلية كلفانية ، يجب طرح جهد الأنود من جهد الكاثود ، نحصل على:
إجابه: 0.0295 فولت.
المهمة 252.
قم بعمل رسم تخطيطي ، واكتب المعادلات الإلكترونية لعمليات القطب وحساب EMF لخلية كلفانية تتكون من ألواح الرصاص والمغنيسيوم مغمورة في محاليل أملاحها بتركيز [Рb 2+] = [Mg 2+] = 0.01 مول / ل. هل سيتغير المجال الكهرومغناطيسي لهذا العنصر إذا زاد تركيز كل من الأيونات بنفس عدد المرات؟ الجواب: 2.244 V.
المحلول:
رسم تخطيطي لهذه الخلية الجلفانية
ملغ 0-2 = ملغ 2+ (1)
الرصاص ، وإمكانياته هو -0.127 فولت هو الكاثود ، أي القطب الكهربائي الذي تتم عليه عملية الاختزال:
الرصاص 2+ + 2 = الرصاص 0 (2)
ملغ 0 + الرصاص 2+ = ملغ 2+ + الرصاص 0
تعتمد جهد القطب الكهربائي للمعدن (E) على تركيز أيوناته في المحلول. يتم التعبير عن هذا الاعتماد بواسطة معادلة Nernst:
![]()
ه 0 - جهد القطب القياسي للمعدن; نهو عدد الإلكترونات المشاركة في العملية ؛ منهو تركيز أيونات المعادن في محلول ملحها (بحسابات دقيقة ، نشاط). دعونا نحدد جهود القطب للكادميوم والنحاس بتركيزات معينة:
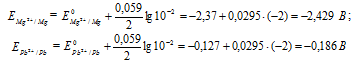
لتحديد EMF يجب أن تطرح الخلية الجلفانية من إمكانات القطب السالب إمكانات الأنود ، نحصل على:
إذا زاد تركيز كل من أيونات Mg 2+ و Pb 2+ بنفس العدد من المرات ، فلن يتغير EMF للخلية الجلفانية ، لأنه في هذه الحالة ستنخفض القيم العددية لإمكانات المعدن تبعا لذلك ، والفرق بين قيمهم لن يتغير. على سبيل المثال ، مع زيادة تركيز الأيونات بمعامل 100 ، سيأخذ تركيزها قيم 1 مول / لتر ، وستصبح إمكانات الأقطاب الكهربائية مساوية للإمكانات القياسية للمعادن ، EMF = -0.127 - (-2.37) = 2.243 فولت.
إجابه: 2.243 الخامس.
المهمّة 253.
ارسم مخططًا لخليتين جلفانيتين ، أحدهما النيكل هو الكاثود ، والآخر - الأنود. اكتب لكل عنصر من هذه العناصر المعادلات الإلكترونية للتفاعلات التي تحدث عند الكاثود وعند الأنود.
المحلول:
أ) مخطط خلية جلفانية يكون فيها النيكل هو الكاثود:
![]()
تشير المسطرة الرأسية إلى الواجهة بين المعدن والمحلول ، وتشير المسطرتان إلى الواجهة بين مرحلتين سائلتين - قسم مسامي (أو أنبوب متصل مملوء بمحلول إلكتروليت). يحتوي المغنيسيوم على جهد أقل (-2.37 فولت) وهو الأنود الذي تحدث عليه عملية الأكسدة:
ملغ 0-2 = ملغ 2+ (1)
النيكل الذي تبلغ طاقته -0.25 فولت هو الكاثود ، أي القطب الكهربائي الذي تتم عليه عملية الاختزال:
ني 2 + + 2 = ني 0 (2)
يمكن الحصول على معادلة تفاعل الأكسدة والاختزال التي تميز تشغيل خلية جلفانية معينة عن طريق إضافة المعادلات الإلكترونية لعمليات الأنود (1) والكاثود (2):
ملغ 0 + ني 2 + = مغ 2 + + ني 0
ب) مخطط خلية جلفانية يكون فيها النيكل هو الأنود:
![]()
يحتوي النيكل على جهد أقل (-0.25 فولت) وهو الأنود الذي تتم عليه عملية الأكسدة:
ني 0-2 = ني 2+ (1)
النحاس ، وإمكاناته (+0.34 فولت) هي الكاثود ، أي القطب الكهربائي الذي تتم عليه عملية الاختزال:
Сu 2+ + 2 = Сu 0 (2)
يمكن الحصول على معادلة تفاعل الأكسدة والاختزال التي تميز تشغيل خلية جلفانية معينة عن طريق إضافة المعادلات الإلكترونية لعمليات الأنود (1) والكاثود (2):
ني 0 + نحاس 2 + = ني 2 + + نحاس 0
المهمّة 254.
يتم توصيل ألواح الحديد والفضة بواسطة موصل خارجي ومغمورة في محلول حمض الكبريتيك. ارسم مخططًا لهذه الخلية الجلفانية واكتب المعادلات الإلكترونية للعمليات التي تحدث عند القطب الموجب والكاثود.
المحلول:
تبلغ إمكانات القطب القياسي للحديد والفضة على التوالي -0.44 فولت و +0.80 فولت.بناءً على حقيقة أن الحديد لديه جهد كهرسلبي أكبر من الهيدروجين بمقدار 0.00 فولت ، يحدث تفاعل بين الحديد ومحلول حمض الكبريتيك (يزيح الحديد الهيدروجين من الحمض) ، وستنخفض كتلة الصفيحة الحديدية:
Fe + H 2 SO 4 \ u003d FeSO 4 + H 2
استنادًا إلى حقيقة أن الفضة لها إمكانات أكثر حساسية من الهيدروجين ، لا يوجد تفاعل بين الفضة ومحلول حامض الكبريتيك. ولكن نظرًا لأن صفائح الحديد والفضة متصلة بواسطة موصل خارجي ومغمورة في محلول حمض الكبريتيك ، فستحدث عملية الأكسدة والاختزال بينهما ، حيث تكون الصفيحة الحديدية هي القطب الموجب ، وستكون الفضة هي الكاثود.
العملية عند الأنود هي:
Fe 0 → Fe 2+ + 2
سيتم تفريغ أيونات الهيدروجين عند كاثود الصفيحة الفضية:
2Н + 2 → Н 2 0
دائرة الخلية الجلفانية لها الشكل:
(-) الحديد | Fe 2+ || 2H + | H 2، حج (+)
المهمة 255.
قم بعمل رسم تخطيطي ، واكتب المعادلات الإلكترونية لعمليات الإلكترود وحساب EMF لخلية كلفانية تتكون من ألواح الكادميوم والمغنيسيوم المغمورة في محاليل أملاحها بتركيز [Mg 2+] = = 1 مول / لتر. هل ستتغير قيمة EMFإذا انخفض تركيز كل من الأيونات إلى 0.01 مول / لتر؟ الجواب: 1.967 V.
المحلول:
يحتوي المغنيسيوم على جهد أقل (-2.37 فولت) وهو الأنود الذي تحدث عليه عملية الأكسدة.
القوة الدافعة الكهربائية للخلية الجلفانية (EMF).
سيكون العمل الكهربائي الذي تنتجه الخلية الجلفانية بحد أقصى عندما يتم تشغيل الخلية في ظل ظروف قريبة قدر الإمكان من إمكانية عكسها. يُطلق على أقصى فرق الجهد بين الأقطاب الكهربائية لخلية كلفانية معينة ، والذي يتم تحديده في ظل ظروف التوازن ، القوة الدافعة الكهربائية (EMF). إنه يساوي الفرق بين إمكانات التوازن للكاثود والأنود للعنصر. في ظل الظروف القياسية:
EMF 0 = د j0 = j0 الكاثود - j0 الأنود . (7.3)
المثال 10. احسب المجال الكهرومغناطيسي لخلية كلفانية مكونة من قطبين من المغنيسيوم والرصاص ، حيث = 0.1 م ؛ = 0.001 م.
المحلول. ي 0 ملغ 2+ / مغ \ u003d -2.37 فولت ؛ ي 0 Pb 2+ / Pb = -0.13 B (الجدول 7.1) ؛ j 0 من قطب المغنيسيوم أصغر ، أي Mg هو معدن أكثر نشاطًا ، لذلك في الخلية الجلفانية ، سيكون المغنيسيوم هو الأنود ويقود الكاثود.
ستتم العمليات التالية على الأقطاب الكهربائية:
ج: Mg - 2e \ u003d Mg 2+ ،
K: Pb 2+ + 2e = Pb 0.
تتم كتابة دائرة الخلية الجلفانية على النحو التالي: Mg½Mg 2+ ║Pb 2+ Pb.
لحساب EMF ، من الضروري إيجاد إمكانات القطب. حسب المعادلة (7.2):
J0 + ![]() -2.37 + 0.0295. سجل 0.1 = -2.4 فولت ؛
-2.37 + 0.0295. سجل 0.1 = -2.4 فولت ؛
0.13 + 0.0295. lg 0.001 = -0.13 + 0.0295 (-3) \ u003d -0.22 فولت.
EMF \ u003d j cat - j an \ u003d -0.25 - (-2.4) \ u003d 2.15 فولت.
المثال 11. تحديد المجالات الكهرومغناطيسية لخلية كلفانية مكونة من أقطاب فضية مغمورة في محاليل 0.0001 M و 0.1 M AgNO 3.
المحلول. يمكن أن تتكون الخلية الجلفانية ليس فقط من أقطاب مختلفة ، ولكن أيضًا من نفس الأقطاب الكهربائية المغمورة في محاليل من نفس الإلكتروليت بتركيزات مختلفة ( عناصر التركيز). لنجد جهود القطب باستخدام صيغة Nernst (7.2):
j 1 Ag + / Ag = j 0 + × lg = 0.8 + 0.059 × lg0.001 = 0.8 + 0.059 × (-3) = 0.62 فولت ،
ي 2 Ag + / Ag \ u003d 0.8 + 0.059 × lg0.1 \ u003d 0.8 - 0.059 \ u003d 0.74 فولت.
منذ ي 1< j 2 , электрод, опущенный в 0,001 М раствор, будет являться анодом:
EMF \ u003d j cat - j an \ u003d 0.74 - 0.62 \ u003d 0.12 فولت.
تتم كتابة مخطط هذه الخلية الجلفانية على النحو التالي:
(-) Ag½ AgNO 3 (0.001M) ║ AgNO 3 (0.1M) ½ Ag (+).
كما تم توضيحه بالفعل في مثال قطب الهيدروجين ، يمكن إنشاء الأقطاب الكهربائية ، وبالتالي الخلايا الجلفانية ، ليس فقط لتفاعل الأكسدة والاختزال للمعادن ، ولكن أيضًا لأي مواد وتفاعلات الأكسدة والاختزال التي تحدث في المحاليل أو الذوبان. على سبيل المثال ، للتفاعل في المحلول
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
يمكن تقسيم عمليات الأكسدة والاختزال إلى نصف تفاعلات:
عند الأنود: 5 ½ SO 3 2 - + H 2 0 \ u003d SO 4 2 - + 2H + + 2ē ؛ (0.17 فولت) ،
عند الكاثود: 2 ½ MnO 4 - + 8H + + 5e = Mn 2+ + 4H 2 O(1.51 فولت).
نلخص:
2MnO 4 - + 5SO 3 2 - + 6H + + 10 '= 2Mn 2+ + 5SO 4 2 - + 3H 2 O + 10'.
تفاعل توليد التيار:
2MnO 4 - + 5SO 3 2 - + 6H + = 2Mn 2+ + 5SO 4 2 - + 3H 2 O.
لإجراء مثل هذه التفاعلات ، عادة ما يتم استخدام محفز ، وهو أيضًا موصل إلكتروني ، مثل البلاتين (الشكل 7.3).
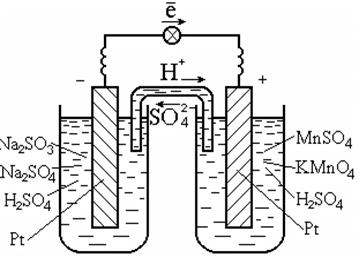
أرز. 7.3. خلية كلفانية على الأكسدة والاختزال
ردود الفعل في الحل
رسم تخطيطي لخلية كلفانية:
نقطة | SO 3 2 -، SO 4 2 -، H + || MnO 4 - ، Mn 2+ ، H + | نقطة.
يتم إعطاء قيم إمكانات القطب القياسي للتفاعلات النصفية في الكتب المرجعية.
يمكن تعريف emf لهذا العنصر في ظل الظروف القياسية على أنه فرق الجهد لنصف تفاعلات الاختزال (المؤكسد) والأكسدة (الاختزال).
EMF \ u003d Dj 0 \ u003d j 0 (MnO 4 - / Mn 2+) - j 0 (SO 4 2 - / SO 3 2 -) \ u003d
1.51 - 0.17 = 1.34 فولت.
إذا كان EMF موجبًا في نفس الوقت ، يكون التفاعل ممكنًا في ظل الظروف القياسية ، نظرًا لأن DG للتفاعل والعمل الكهربائي (EMF) مرتبطان بالعلاقة:
حيث F هو ثابت فاراداي (الشحنة التي يحملها مول واحد من الشحنات الأولية (F = 96485 ، أو "96500 Cul / mol equiv) ؛
n هي الشحنة التي يحملها جسيم واحد (لـ Zn 2+ و Cu 2+ n = 2) ؛
Dj \ u003d j cathode - j الأنود \ u003d j ok-la - j استعادة.
وبالتالي ، لا يمكن قياس فرق الجهد عبر الأقطاب بشكل مباشر فحسب ، بل يمكن أيضًا حسابه من البيانات التجريبية الكيميائية البحتة. في حالة الظروف غير القياسية ، يتم حساب جهد القطب ومجال الكهرومغناطيسي للعنصر باستخدام صيغة نرنست (7.1). على سبيل المثال ، للتفاعل المدروس:
(ن = 10). نظرًا لأن تركيزات الكواشف تحت علامة اللوغاريتم ، فإن اعتماد Dj عليها ضعيف.




