ما هي القوة الدافعة الكهربائية للخلية الجلفانية. موسوعة كبيرة عن النفط والغاز. تحديد قيمة جهد القطب القياسي للنحاس
إذا قمنا بفصل عمليات الأكسدة والاختزال مكانيًا ، فيمكن استخدام تفاعل الأكسدة والاختزال لتوليد الطاقة الكهربائية.
يسمى الجهاز الذي يحول الطاقة الكيميائية إلى طاقة كهربائية عنصر كلفاني. تتكون الخلية الجلفانية من معدنين مغموسين في محلول إلكتروليت. إذا قمت بتوصيل هذه المعادن بموصل من النوع الأول (سلك معدني) ، فسيتم تكوين تيار كهربائي يظهر نتيجة حدوث عملية الأكسدة والاختزال. الأنود في الخلية الجلفانية هو قطب كهربائي يكون جهده الكهربائي في محلول معين أكثر كهرسلبية. تحدث الأكسدة عند الأنود. الكاثود هو قطب كهربائي مصنوع من معدن أقل نشاطًا. يتم تقليل أيونات المعادن الموجبة أو أيونات الهيدروجين أو الجزيئات المحايدة عند الكاثود. في الخلية الجلفانية ، يُشار إلى القطب الموجب بعلامة ناقص ، والكاثود بعلامة زائد. تظهر الخلية الجلفانية في الشكل.
تحديد قيمة جهد القطب القياسي للنحاس
الخلية الجلفانية هي جهاز بسيط يتم من خلاله تحويل الطاقة الكيميائية إلى طاقة كهربائية. تتكون الخلايا الجلفانية من جزأين منفصلين ، تسمى الخلايا النصفية ، تحتوي على محاليل إلكتروليتية وأقطاب كهربائية يمكن توصيلها في دائرة. يتم غمر معدنين متباينين في إلكتروليت. إذا تم توصيل المعادن بواسطة حلقة خارجية ، يتم تقليل أحد المعادن ويتأكسد المعدن الآخر.
في المثال أعلاه ، يتم تقليل النحاس ويتأكسد الزنك. يوفر الاختلاف في إمكانات الأكسدة للمعدنين الطاقة الكهربائية للخلية. يمكن بناء خلية فولت باستخدام رموز بسيطة. في الرسم التخطيطي ، توجد الأقطاب الكهربائية على السطح الخارجي للمخطط ، ويتم استخدام الخط العمودي لفصل القطب عن محلول الإلكتروليت في الحجرة. عادةً ، في الرسم التخطيطي ، تتم كتابة الأنواع المؤكسدة على يسار الشرطة المائلة المزدوجة. هنا مثال على خلية دانيال.
تُغمر صفيحة الزنك في محلول من كبريتات الزنك ، وتُغمر صفيحة نحاسية في محلول من كبريتات النحاس. تتصل الصفائح بسلك ، ويتم فصل المحاليل بواسطة قسم مسامي لمنع اختلاط المحاليل. تنتقل الإلكترونات على طول الدائرة الخارجية من القطب الموجب إلى الكاثود ، وعلى طول الدائرة الداخلية SO 4 2- تتحرك الأنيونات في المحلول من النحاس إلى الزنك ، مما يؤدي إلى إغلاق الدائرة الكهربائية للخلية الجلفانية.
أسئلة وتمارين
تشير الأسماء إلى العلماء الإيطاليين في القرن الثامن عشر أليساندرو فولتي ولويجي جالفاني. تتكون خلية دانييل من وعاء زجاجي يحتوي على قطبين من النحاس والزنك ، كل منهما كان مغمورًا في محاليل كبريتات الحمض الخاصة بهما. تم فصل الحلين بواسطة فاصل أسطواني مسامي. كانت عبارة عن خلية كلفانية يوفر فيها التنقيب الكهربائي التلقائي للزنك والطلاء الكهربائي للنحاس تيارًا كهربائيًا.
الخلية الكهروكيميائية هي جهاز يتحول الطاقة الكيميائيةإلى طاقة كهربائية ، أو العكس ، عندما يحدث تفاعل كيميائي في الخلية. وهو يتألف من مرحلتين موصلين كهربائياً متصلين بمرحلة أيونية موصلة. مع مرور التيار الكهربائي ، يجب أن ينتقل من تيار الإلكترون إلى تيار الأيونات والعودة إلى تيار الإلكترون.
تتم كتابة الخلية الجلفانية كدائرة كهروكيميائية:
أ (-) زنك | ZnSO 4 || CuSO4 | النحاس (+) ك
نظرًا لأن جهد القطب الكهربائي للزنك أقل من جهد القطب الكهربائي للنحاس ، سيكون الزنك هو القطب الموجب ، وسيكون النحاس هو القطب السالب. تتأكسد صفيحة الزنك ، ويتم تقليل النحاس من المحلول الموجود على سطح الصفيحة النحاسية.
يجب تسجيل العمليات التي تحدث أثناء تشغيل الخلية الجلفانية:
الميزة الأساسية للخلية الكهروكيميائية هي أن تفاعلات الأكسدة والاختزال التي تحدث في وقت واحد يتم فصلها مكانيًا. على سبيل المثال ، في تفاعل كيميائي تلقائي أثناء أكسدة الهيدروجين مع الأكسجين في الماء ، يتم تمرير الإلكترونات مباشرة من الهيدروجين إلى الأكسجين.
في المقابل ، في تفاعل كهروكيميائي تلقائي في خلية كلفانية ، يتأكسد الهيدروجين عند الأنود ، وينقل الإلكترونات إلى القطب الموجب ، وينخفض الأكسجين عند الكاثود ، ويقبل الإلكترونات من الكاثود. الأيونات المنتجة في تفاعلات القطب ، في هذه الحالة أيونات الهيدروجين الموجبة وأيونات الهيدروكسيد السالبة ، سوف تتحد في محلول لتشكيل ناتج التفاعل النهائي: الماء. خلال هذه العملية ، يتم توصيل الإلكترونات من القطب الموجب إلى القطب السالب عبر دائرة كهربائية خارجية ، حيث يمكن للتيار الكهربائي أن يقود المحرك ، ويضيء المصباح الكهربائي ، وما إلى ذلك. يمكن أيضًا تغيير التفاعل: يمكن أن يتحلل الماء إلى هيدروجين وأكسجين عن طريق تطبيق الطاقة الكهربائية على خلية التحليل الكهربائي.
أ Zn - 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
يُطلق على أقصى فرق الجهد بين الأقطاب الكهربائية التي يمكن الحصول عليها أثناء تشغيل الخلية الجلفانية القوة الدافعة الكهربائية (EMF) للخلية. إنه يساوي الفرق بين إمكانات التوازن للكاثود والأنود:
EMF = e K - e A
بالنسبة لخلية كهروكيميائية من النحاس والزنك في ظل الظروف القياسية:
خلية الوقود هي جهاز يحول الطاقة الكيميائية إلى طاقة كهربائية. وهي تختلف عن البطارية في استمرار تحويل الطاقة هذا طالما يتم توفير الوقود والمؤكسد لخلية الوقود ؛ هذا هو ، من حيث المبدأ ، إلى أجل غير مسمى. هذه خلية كلفانية حيث تكون عفوية تفاعلات كيميائية. يتأكسد الوقود عند القطب الموجب ويتم تقليل المؤكسد عند القطب السالب. حاليًا ، الوقود الأكثر استخدامًا هو الهيدروجين. يجب تحويل الوقود التقليدي إلى هيدروجين قبل استخدامه في خلية وقود.
EMF = 0.34 - (- 0.76) = 1.1 فولت
لا يتشكل فرق الجهد بين المعادن المختلفة فحسب ، بل أيضًا بين المعادن التي تحمل الاسم نفسه ، حيث يتم تحميلها في محاليل أملاحها بتركيزات مختلفة. تسمى هذه الخلية الجلفانية تركيز. على سبيل المثال ، خلية جلفانية بتركيز النيكل.
(-) ني | NiSO4 || NiSO4 | ني (+)
0.01 مول 0.1 مول
ردود الفعل ، تنتقل الإلكترونات من نوع إلى آخر. إذا كان التفاعل تلقائيًا ، يتم إطلاق الطاقة ، والتي يمكن استخدامها بعد ذلك في عمل مفيد. لتسخير هذه الطاقة ، يجب تقسيم التفاعل إلى نصفين منفصلين من التفاعل: تفاعلات الأكسدة والاختزال. توضع التفاعلات في حاويتين مختلفتين ويستخدم سلك لدفع الإلكترونات من جانب إلى آخر.
أمثلة على حل المشكلات
عندما يحدث تفاعل الأكسدة والاختزال ، تنتقل الإلكترونات من نوع إلى آخر. إذا كان التفاعل تلقائيًا ، يتم إطلاق الطاقة التي يمكن استخدامها في العمل. في هذا التفاعل ، يتم وضع قطب كهربائي نحاسي في محلول يحتوي على أيونات الفضة.
دعونا نكتب عمل مثل هذه الخلية الجلفانية التركيز.
e Ni 2+ / Ni \ u003d e 0 + (0.058 / n) lg (1 * 10-2) \ u003d -0.25 + (0.058 / 2) (-2) \ u003d -0.308 V
e Ni 2+ / Ni \ u003d e 0 + (0.058 / n) lg (1 * 10-1) \ u003d -0.25 + (0.058 / 2) (-1) \ u003d -0.28 V
EMF = -0.28 - (-0.308) = 0.028 فولت
العمليات على الأقطاب الكهربائية:
ج: Ni 0 - 2e - \ u003d Ni 2+
K: Ni 2+ + 2e - \ u003d Ni 0
مهام التحكم
48. احسب EMF لخلية جلفانية من الفضة والكادميوم ، إذا كان تركيز أيونات الفضة في المحلول 0.1 مول / لتر ، وأيونات الكادميوم 0.001 مول / لتر. اكتب معادلات التفاعلات التي تحدث على الأقطاب الكهربائية.
هذا التفاعل يطلق طاقة. ومع ذلك ، عند وضع قطب كهربي صلب من النحاس مباشرة في محلول نترات الفضة ، تُفقد الطاقة كحرارة ولا يمكن استخدامها في العمل. من أجل استخدام هذه الطاقة واستخدام عملها المفيد ، يجب أن نقسم التفاعل إلى نصفين منفصلين من التفاعلات ؛ تفاعلات الأكسدة والاختزال. يربط السلك التفاعلين ويسمح للإلكترونات بالتدفق من جانب إلى آخر.
خلية الفولت هي خلية كهروكيميائية تستخدم تفاعلات الأكسدة والاختزال العفوية لتوليد الكهرباء. يتكون من عنصرين نصفين منفصلين. تتصل الخليتان النصفيتان ببعضهما البعض بواسطة سلك يمتد من قطب كهربائي إلى الآخر. يتصل جسر الملح أيضًا بنصف الخلايا.
49. قم بعمل رسم بياني لخليتين جلفانيتين ، في إحداهما النيكل هو القطب السالب ، وفي الأخرى الأنود. اكتب معادلات التفاعلات التي تحدث أثناء تشغيل هذه العناصر.
50. احسب EMF كلفانيعنصر مكون من صفائح حديد ورصاص مغموسة في محلول 0.1 م من أملاحها. اكتب معادلات التفاعل.
تتم مناقشة وظائف هذه الأجزاء أدناه. القطب الكهربائي عبارة عن شريط من المعدن يحدث عليه التفاعل. في خلية الجهد ، تحدث أكسدة المعادن واختزالها عند الأقطاب الكهربائية. تحتوي الخلية الفولتية على قطبين ، أحدهما في كل نصف خلية. الكاثود هو المكان الذي يحدث فيه الاختزال وتحدث الأكسدة عند الأنود.
من خلال الكيمياء الكهربائية ، تتفاعل هذه التفاعلات مع الأسطح المعدنية أو الأقطاب الكهربائية. يتم إنشاء توازن تقليل الأكسيد بين المعدن والمواد في المحلول. عندما تغمر الأقطاب الكهربائية في محلول يحتوي على أيونات من نفس المعدن ، فإنها تسمى نصف خلية. الإلكتروليتات هي أيونات في محلول ، عادة ما تكون سائلة ، توصل الكهرباء من خلال التوصيل الأيوني. يمكن أن يحدث تفاعلان محتملان بين ذرات المعادن على القطب والمحاليل الأيونية.
51. احسب EMF لخلية تركيز نيكل جلفانية. تركيز أيونات المعادن في المحاليل هو 1 مول / لتر و 0.0001 مول / لتر. اكتب العمليات التي تحدث عند الأنود والكاثود.
52. ما هي العمليات التي تحدث عند الأقطاب الكهربائية لخلية جلفانية مركزة بالنحاس ، إذا كان أحد الأقطاب الكهربائية يحتوي على تركيز أيونات معدنية يساوي 1 مول / لتر ، والآخر 0.001 مول / لتر. في أي اتجاه تتحرك الإلكترونات في الدائرة الخارجية. ما هو المجال الكهرومغناطيسي؟
العمليات في الأنود
هذا يعني أن الأيونات تتناقص. . عندما يتأكسد القطب في محلول يطلق عليه أنود وعندما يتم تقليل القطب في المحلول. يطلق عليه الكاثود.
- الأنود: الأنود هو موقع تفاعل الأكسدة.
- بمعنى آخر ، يفقد المعدن الإلكترونات هنا.
- هذا هو المكان الذي يستقبل فيه القطب المعدني الإلكترونات.
عندما يتعلق الأمر بتفاعلات الأكسدة والاختزال ، من المهم أن نفهم ما يعنيه أن "يتأكسد" المعدن أو "يقلل". يعتبر جسر الملح مكونًا حيويًا لأي خلية فولتية. الغرض من جسر الملح هو الحفاظ على المحاليل محايدة كهربائيًا والسماح بالتدفق الحر للأيونات من خلية إلى أخرى. بدون جسر الملح ، تتراكم الشحنات الموجبة والسالبة حول الأقطاب الكهربائية ، مما يؤدي إلى توقف التفاعل.
53. قم بعمل رسم تخطيطي لخلية كلفانية تتكون من صفائح الزنك والحديد المغمورة في محاليل أملاحها. اكتب معادلات العمليات التي تحدث على أيونات الحديد بحيث يصبح المجال الكهرومغناطيسي للعنصر صفراً عند تركيز أيونات الزنك بمقدار 0.0001 مول / لتر.
54. صفائح الحديد والفضة متصلة بواسطة موصل خارجي ومغمورة في محلول حامض الكبريتيك. قم بعمل رسم تخطيطي لهذه الخلية الجلفانية ، واكتب معادلات التفاعلات التي تحدث على الألواح.
تتدفق الإلكترونات دائمًا من القطب الموجب إلى القطب السالب ، أو من نصف خلية الأكسدة إلى نصف الاختزال. مخطط الخلية هو تمثيل لخلية كهروكيميائية. يوضح الشكل أدناه مخطط الخلية للجهد الموضح في الشكل 1 أعلاه.
يوضح الشكل أدناه مخطط خلية Voltise الموضح في الشكل 1. عند إنشاء مخطط خلية ، نتبع الاصطلاحات التالية. يوجد القطب الموجب دائمًا على اليسار والكاثود على اليمين. يتم تمثيل فرق طور العنصر بخط رأسي واحد ، ويتم تمثيل تغيرات حالة الأكسدة بفاصلات.
55. ارسم مخططًا لخلية جلفانية تتكون من قطب فضي مغمور في محلول 1M من نترات الفضة وقطب هيدروجين قياسي. اكتب معادلات عمليات القطب. ما هي المجالات الكهرومغناطيسية للعنصر؟
56. في أي اتجاه سوف تتحرك الإلكترونات في الدائرة الخارجية للخلايا الجلفانية التالية
العمليات في الكاثود
عندما يُطلب منك رسم مخطط خلية ، اتبع هذه التعليمات البسيطة. ضع في اعتبارك رد الفعل التالي. الخطوة 1: اكتب نصفي ردود أفعال. الخطوة 2: تحديد الكاثود والأنود. \\ يكتسب الإلكترونات ، وبالتالي يتناقص ؛ يحدث الاختزال عند الكاثود. الخطوة 3: بناء مخطط خلية.
يذهب الأنود دائمًا إلى اليسار والكاثود على اليمين. يشير غياب التركيزات إلى أن الحلول تخضع لشروط قياسية. تعطي قراءات الفولتميتر جهد الاستجابة لكل خلية ، أو فرق الجهد بين خليتين نصفيتين. يُعرف جهد الخلية أيضًا باسم أو القوة الدافعة الكهربائية ويتم عرضه كـ \\.
أ) ملغ | مغ 2 + | | Pb 2+ | الرصاص
ب) الرصاص | Pb 2+ | | النحاس 2+ | النحاس
ج) النحاس | النحاس 2+ | | حج 2+ | اي جي
إذا كانت جميع محاليل الإلكتروليت أحادية المولي؟ أي معدن سوف يذوب في كل من هذه الحالات.
57. قم بعمل رسم تخطيطي لخلية كلفانية على أساس التفاعل الجاري وفقًا للمعادلة:
Ni + Pb (NO 3) 2 \ u003d Ni (NO 3) 2 + Pb.
اكتب المعادلات الإلكترونية لعمليات الأنود والكاثود ، واحسب EMF لهذا العنصر في ظل الظروف القياسية.
تسمى هذه القيم إمكانات الخفض القياسية. كل رد فعل نصفي له إمكانية اختزال مختلفة ، والفرق بين إمكانات الاختزال يعطي جهد الخلية الكهروكيميائية. ضع في اعتبارك رد الفعل التاليين. قسّم التفاعل إلى نصف تفاعلات وحدد إمكانات الاختزال القياسية.
- حدد ما سيكون الأنود والكاثود.
- ارسم مخطط خلية للتفاعلات التالية.
- حدد \\ للخلية الفولتية المتكونة من كل تفاعل.
- كيمياء هنرال: المبادئ وتطبيقات الحداثة الطبعة التاسعة.
58. EMF لخلية جلفانية تكونت من صفيحة نحاسية مغمورة في محلول ملح مع تركيز أيونات النحاس يساوي 0.001 مول / لتر والكروم المغمور في محلول ملحها هو 1.05 فولت. تحديد تركيز أيونات الكروم في محلول ملحها. قم بعمل رسم تخطيطي لخلية كلفانية واكتب المعادلات الإلكترونية لعمليات القطب.
لذلك ، تتدفق الإلكترونات تلقائيًا من أيونات الزنك إلى النحاس ، وتشكل أيونات الزنك و النحاس المعدني. مثلما يتدفق الماء تلقائيًا إلى أسفل المنحدر ، والذي يمكن تشغيله عن طريق إجبار عجلة مائية ، يمكن أيضًا استخدام تدفق الإلكترونات من طاقة كامنة أعلى إلى طاقة أقل للقيام بعمل.
نظرًا لأن الطاقة الكامنة لإلكترونات التكافؤ تختلف اختلافًا كبيرًا من مادة إلى أخرى ، فإن جهد الخلية الجلفانية يعتمد جزئيًا على هوية المواد المتفاعلة. تعتمد إمكانات الخلية المقاسة بشدة أيضًا على تركيزات المواد المتفاعلة ودرجة حرارة النظام. من أجل تطوير مقياس للإمكانات النسبية التي تسمح لنا بالتنبؤ باتجاه التفاعل الكهروكيميائي وحجم القوة الدافعة للتفاعل ، يجب قياس إمكانات الأكسدة والاختزال للمواد المختلفة في ظل ظروف مماثلة.
59. قم بعمل رسم تخطيطي ، واكتب معادلات عمليات القطب وحساب EMF لخلية كلفانية تتكون من ألواح الكادميوم والمغنيسيوم مغمورة في محاليل أملاحها مع تركيز أيونات معدنية يساوي 1 مول / لتر. هل يتغير EMF لهذه الخلية الجلفانية إذا تم تقليل تركيز كل من الأيونات إلى 0.01 مول / لتر.
قياس جهد القطب القياسي
تعتمد إمكانات الأكسدة والاختزال المقاسة على الطاقة الكامنة لإلكترونات التكافؤ ، وتركيزات الأنواع في التفاعل ، ودرجة حرارة النظام. من المستحيل ماديًا قياس جهد قطب كهربائي واحد: يمكن قياس فرق الجهد فقط بين قطبين. يتيح لك ذلك قياس فرق الجهد بين قطبين غير متماثلين. في الواقع ، هذا هو بالضبط الاحتمال الذي تم قياسه في ظل الظروف القياسية إذا تم إنشاء الخلية باستخدام تخطيط الخلية التالي. لذلك ، فإن جهد الخلية القياسي هو الفرق بين إمكانات الاختزال المجدولة لنصف تفاعلات ، وليس مجموعها.
60. الكهرومغناطيسي للخلية الجلفانية المكونة من قطب هيدروجين قياسي وقطب كهربائي مغمور في محلول ملح رصاص 1M هو 126mV. عندما يتم إغلاق العنصر ، تتحرك الإلكترونات في الدائرة الخارجية من الرصاص إلى قطب الهيدروجين. ما هي إمكانات قطب الرصاص. ارسم مخططًا لخلية جلفانية واكتب العمليات التي تحدث على الأقطاب الكهربائية.
61. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية الرصاص.
62. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية من النيكل والكادميوم.
63. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية من الحديد والنيكل.
64. قم بعمل رسم تخطيطي لخليتين جلفانيتين في إحداهما يكون الكروم هو الأنود ، وفي الأخرى - الكاثود. اكتب لكل عنصر من هذه العناصر المعادلات الإلكترونية للتفاعلات التي تحدث على الأقطاب الكهربائية.
65. ارسم رسم تخطيطي لخلية كلفانية تتكون من قطب ألومنيوم، مغمورة في محلول 1M من نترات الألومنيوم وقطب هيدروجين قياسي. اكتب معادلات عمليات القطب وحساب القوة الدافعة الكهربائية لخلية كلفانية.
66. في أي اتجاه ستتحرك الإلكترونات في الدائرة الخارجية لخلية جلفانية من الألومنيوم والزنك. تركيزات الأيونات في المحاليل 0.1 مول / لتر. قم بعمل رسم تخطيطي لخلية كلفانية ، واكتب المعادلات للعمليات التي تحدث على الأقطاب الكهربائية ، وحساب EMF.
67- في عنصر الفضة والزنك المستخدم لتشغيل معدات مختلفة ، يحدث تفاعل
التحليل الكهربائي
عن طريق التحليل الكهربائيتسمى مجموعة من العمليات التي تحدث عندما يمر تيار كهربائي مباشر عبر نظام يتكون من قطبين ومحلول مصهور أو إلكتروليت. أثناء التحليل الكهربائي ، تتحرك الأيونات الموجبة الشحنة إلى القطب السالب المتصل بالقطب السالب لمصدر تيار مستمر خارجي ، وتتحرك الأيونات سالبة الشحنة إلى القطب الموجب المتصل بالقطب الموجب لمصدر التيار المستمر. على سطح الكاثود هناك عملية اختزال ، على الأنود - الأكسدة.
ضع في اعتبارك التحليل الكهربائي لمصهور كلوريد الصوديوم.
عندما يتم غمر قطبين من الجرافيت المتصلين بمصدر تيار في ذوبان يتكون من أيونات الصوديوم والكلوريد ، ستبدأ حركة موجهة للأيونات في الإلكتروليت ، وستحدث عمليات الأكسدة والاختزال على الأقطاب الكهربائية.
مخطط التحليل الكهربائي لذوبان الصوديوم:
كلوريد الصوديوم \ u003d Na + + Cl -
كاثود (-) (+) أنود
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
معادلة التفاعل العام:
2Na + 2Cl - التحليل الكهربائي 2 Na + Cl 2
التحليل الكهربائي 2NaCl 2Na + Cl 2
في التحليل الكهربائي للمحاليل المائية للشواردتنجذب جزيئات الماء القطبية إلى كل من الكاثود والأنود ، ويمكنها أيضًا المشاركة في العمليات على الأقطاب الكهربائية.
العمليات في الكاثود
يعتمد تسلسل اختزال الأيونات عند الكاثود أثناء التحليل الكهربائي للحلول على قيم جهود القطب القياسية. كلما زادت قيمة جهد القطب الكهربائي للعنصر ، كان استعادته أسهل.
أول ما يتم اختزاله عند الكاثود هو أيونات تلك المعادن التي تكون إمكاناتها هي الأكثر إيجابية. على سبيل المثال ، حل مع أيونات Ag + و H +. يتم استعادة Ag أولاً:
Ag + + e - = Ag 0 e 0 = +0.8 B
لا يتم استرداد الهيدروجين ، لأن إمكاناته أقل.
تعتمد إمكانات المعادن والهيدروجين على تركيزها في المنحل بالكهرباء. لذلك ، ليس من الممكن دائمًا الحكم على تقليل أيونات H + من قيم الإمكانات القياسية. في محلول متعادل ، يكون تركيز أيونات الهيدروجين 10-7 مول / لتر. ووفقًا لصيغة Nernst:
وبالتالي ، يمكن إطلاق الهيدروجين من المحاليل المحايدة فقط عند جهد أقل من -0.41 فولت ، وسيتم إطلاق المعادن الموجودة على الكاثود فقط تلك التي تكون إمكاناتها أكثر إيجابية من الجهد المحتمل -0.41 فولت.
من الناحية العملية ، يتم إطلاق العديد من المعادن (Zn ، Fe ، Cr ، إلخ) من محاليل الهيدروجين ، وتكون قيمة جهود القطب أقل من -0.41V.
هذا بسبب الجهد الزائد للهيدروجين ، أي على سطح معظم المعادن ، يتم إطلاق الهيدروجين بصعوبة. يعتمد حجم الجهد الزائد للهيدروجين على خصائص المعدن وكثافة التيار ودرجة حرارة المنحل بالكهرباء. الجهد الزائد- هذا هو فرق الجهد بين الإمكانات العملية لتطور الهيدروجين والإمكانات النظرية.
مثال.
احتمال إطلاق الزنك في المنحل بالكهرباء متعادل –0.76V ، الهيدروجين –0.41V. يبلغ الجهد الزائد للهيدروجين على الزنك حوالي -0.72 فولت. وبالتالي ، سيتم إطلاق الهيدروجين على الزنك فقط بإمكانية –0.41 + (- 0.72) = - 1.13 فولت. إذا قارنا إمكانات تفريغ الزنك (-0.76 فولت) بإمكانية تفريغ الهيدروجين على الزنك (-1.13 فولت) ، فمن الواضح أنه سيتم إطلاق الزنك. في الواقع ، هذا صحيح ، أثناء التحليل الكهربائي لمحلول محايد من ملح الزنك ، يتم إطلاق الزنك وكمية صغيرة من الهيدروجين.
مع عملية معممة على الكاثود ، اعتمادًا على موقع المعدن في سلسلة جهود القطب القياسية ، يتم تمييز ثلاث حالات:
1) أيونات معدنية ، يكون جهد القطب فيها أقل من -1.18 فولت (من Li إلى Mn). يتم استعادة أيونات الهيدروجين:
2 H + 2e - \ u003d H 2 PH< 7
2 H 2 O + 2e - \ u003d H 2 + 2OH - PH> = 7
2) أيونات المعادن التي يتراوح جهد القطب الكهربائي فيها من -1.18 فولت إلى 0.00 فولت (من Mn إلى H) وفي هذه الحالة يتم تقليل أيونات المعادن وأيونات الهيدروجين في وقت واحد:
أنا n + + ne - = أنا 0
2H + 2e - = H 2 PH<7
2H 2 O + 2e - = H 2 + 2OH - PH> = 7
3) أيونات معدنية ، يكون جهد القطب فيها أكبر من 0.0 فولت (من H إلى Au). في هذه الحالة ، يتم تقليل أيونات المعادن فقط
أنا n + + ne - = أنا 0
العمليات في الأنود
للتحليل الكهربائي ، يتم استخدام الأنودات القابلة للذوبان (النشطة) وغير القابلة للذوبان (الخاملة). أثناء التحليل الكهربائي ، تذوب الأنودات القابلة للذوبان والأيونات المعدنية - يمر الأنود إلى المحلول. تصنع الأنودات القابلة للذوبان عادة من المعدن الذي يتعرض ملحه للتحليل الكهربائي.
الأنودات غير القابلة للذوبان لا تشارك في تفاعلات الأكسدة والاختزال. عادة ما تكون هذه الأنودات مصنوعة من الجرافيت والذهب والبلاتين. تتأكسد الأنيونات ذات الإمكانات السلبية على سطحها. هذه هي الأيونات التي لا تحتوي على الأكسجين ، مثل J - و Br - و Cl - و S 2- وغيرها (باستثناء F -)
إذا كان المحلول يحتوي على Cl - ، Br - أيونات ، فإن Br - أيونات سوف تتأكسد على أنود خامل.
2Br - - 2e - = Br 2
2H 2 0-4e - \ u003d O 2 + 4H + (PH<=7)
4OH - 4e - \ u003d 2H 2 O + O 2 (PH> 7)
دعونا ننظر في العديد من حالات التحليل الكهربائي للمحاليل المائية.
مثال.
مخطط التحليل الكهربائي لمحلول مائي من كلوريد النحاس مع الأنود الخامل CuCl 2 \ u003d Cu 2+ + 2Cl -
H 2 O \ u003d H + \ u003d OH -
كاثود (-) Cu 2+ H + (H 2 O) Cl - ، OH - (H 2 O) (+) أنود
نحاس 2 + + 2 هـ - = نحاس 0 2 كلوريد - -2 هـ - = كلوريد 2
النحاس لديه إمكانات أكبر من 0 ، لذلك يتم تقليل المعدن عند الكاثود ، وتتأكسد بقايا الحمض الخالية من الأكسجين عند الأنود.
مثال.
مخطط التحليل الكهربائي لمحلول كبريتات البوتاسيوم مع الأنود الخامل. K 2 SO 4 \ u003d 2K + + SO 4 2
H 2 O \ u003d H + + OH -
كاثود (-) 2K + ، H + (H 2 O) SO 4 2- ، OH (H 2 O) (+) الأنود
2H 2 O + 2e - \ u003d H 2 + 2OH - 2H 2 O - 4e - \ u003d O 2 + 4H +
K + + OH - \ u003d KOH 2H + + SO 4 2- \ u003d H 2 SO 4
نظرًا لأن البوتاسيوم في سلسلة جهود القطب القياسية أقدم بكثير من الهيدروجين ، يتم تقليل الهيدروجين عند الكاثود وتتراكم أيونات OH -
عند الأنود ، ستتأكسد جزيئات الماء وتتراكم أيونات H +. وهكذا ، في الفضاء الكاثودي ، سيكون المنتج الثانوي قلويًا ، وفي الفضاء الأنوديك ، سيكون حمضًا.
مثال.
التحليل الكهربائي لمحلول مائي من كبريتات النيكل مع أنود نشط. Ni SO 4 \ u003d Ni 2+ \ u003d SO 4 2-
H 2 O H + OH -
كاثود (-) Ni 2+ ، H + (H 2 O) SO 4 2- ، OH - (H 2 O) (+) الأنود
Ni 2 + + 2e - = Ni 0 Ni - 2e - = Ni 2+
e 0 Ni \ u003d -0.25V أكبر من احتمال اختزال أيونات الهيدروجين من الماء (-0.41V) ، وبالتالي ، يتم تقليل المعدن ، ويتأكسد معدن الأنود عند الأنود ، نظرًا لأن جهد النيكل يكون أقل بكثير من جهد أكسدة الماء (+ 1.23 فولت).
قوانين التحليل الكهربائي
كتلة المنحل بالكهرباء المعرض للتحول الكيميائي ، وكذلك كتل المواد المنبعثة على الأقطاب الكهربائية وفقًا لقوانين فاراداي ، تتناسب طرديًا مع كمية الكهرباء التي تمر عبر الإلكتروليت والكتلة المولية لمكافئات المواد:
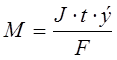 ، أين
، أين
م هي كتلة المنحل بالكهرباء المعرض للتحليل الكهربائي أو كتلة المواد المنبعثة على الأقطاب الكهربائية ، ز ؛
J - القوة الحالية ، أ ؛
الكتلة المولية الإلكترونية لمكافئات المادة ، جم / مول ؛
رقم F من فاراداي - 96500 درجة مئوية ؛
ر هو وقت التحليل الكهربائي ، ث ؛
مهام التحكم
68. عمل معادلات للعمليات التي تحدث أثناء التحليل الكهربائي من NaOH و NiCl 2 يذوب بأقطاب كهربائية خاملة.
69. عمل رسم تخطيطي للتحليل الكهربائي للمحاليل المائية لحمض الكبريتيك ، كلوريد النحاس ، نترات الرصاص مع أقطاب البلاتين.
70. اكتب معادلات عمليات القطب التي تحدث أثناء التحليل الكهربائي للمحاليل المائية لكلوريد الباريوم وكلوريد الحديد (II) بأقطاب الكربون.
71. قم بعمل رسم تخطيطي للتحليل الكهربائي لمحلول مائي من كلوريد الزنك ، إذا: أ) الأنود هو الزنك ؛ ب) أنود الكربون.
72. ما هو حجم الهيدروجين الذي سينطلق عندما يمر تيار 3 أ خلال محلول مائي من حمض الكبريتيك لمدة ساعة واحدة.
73. أثناء التحليل الكهربائي لمحلول مائي من SnCl 2 ، تم إطلاق 4.48 لتر في الأنود. الكلور (ظروف طبيعية). ما هي المادة وبأي كمية تم إطلاقها عند الكاثود.
74. في أي تسلسل سيتم إطلاق المعادن أثناء التحليل الكهربائي لمحلول يحتوي على كبريتات من النيكل والفضة والنحاس في نفس التركيز. اكتب معادلات العمليات على الأقطاب الكهربائية.
75. قم بعمل رسم تخطيطي للعمليات التي تحدث على أقطاب النحاس أثناء التحليل الكهربائي لمحلول مائي من نترات البوتاسيوم.
76. النحاس غير المكرر يحتوي على شوائب من الفضة والزنك. ماذا يحدث لهذه الشوائب أثناء التنقية الإلكتروليتية للنحاس. اكتب معادلات العمليات على الأقطاب الكهربائية.
77. كم من الوقت سيستغرق تحلل 2 مول من الماء بتيار 2A.
78. مرت محاليل ملح الطعام وفوسفات الصوديوم لبعض الوقت العاصمة. هل سيغير هذا كمية الملح في كلتا الحالتين. حفز إجابتك عن طريق تجميع المعادلات الإلكترونية للعمليات التي تجري على القطب السالب والأنود.
79. أثناء التحليل الكهربائي لمحلول من كبريتات النحاس (II) ، تم إطلاق 0.168 لترًا من الغاز عند القطب الموجب (الظروف العادية) ، وقم بتكوين المعادلات الإلكترونية للعمليات وحساب كمية النحاس التي سيتم إطلاقها عند الكاثود.
80. يؤلف المعادلات الإلكترونية للعمليات التي تحدث أثناء التحليل الكهربائي لمحلول وذوبان KOH.
81. ما هي المواد وبأي كمية سيتم إطلاقها على أقطاب الكربون أثناء التحليل الكهربائي لمحلول NaI لمدة 2.5 ساعة إذا كانت القوة الحالية 6 أ.
82. كم جرام من حامض الكبريتيك يتكون بالقرب من القطب الموجب أثناء التحليل الكهربائي لمحلول كبريتات الصوديوم ، إذا تم إطلاق 1.12 لتر من الأكسجين (عدد غير معروف) عند الأنود ، احسب كتلة المادة المنبعثة عند الكاثود.
83. أثناء التحليل الكهربائي لمحلول نترات الفضة عند الأنود ، تم إطلاق 0.28 لتر من الأكسجين. كم غراما من الفضة برزت عند الكاثود.
84- تذوب أملاح الألومنيوم والزنك والنحاس في الماء بتركيز كاتيونات 1 مول / لتر. يؤلف المعادلات الإلكترونية للعمليات على الأقطاب الكهربائية ويشير إلى تسلسل التفاعلات على القطب السالب.
85- ما هي المنتجات التي يمكن الحصول عليها عن طريق التحليل الكهربائي لمحلول NaNO 3 ، إذا كانت مسافات الأنود والكاثود:
أ) مفصولة بقسم مسامي ؛
ب) لا يتم فصلها ويتم تقليب المحلول.
86. ما هي المنتجات التي سيتم إطلاقها على الكاثود والأنود في المقام الأول أثناء التحليل الكهربائي للمحاليل المائية باستخدام أقطاب الجرافيت ، إذا كان الإلكتروليت يحتوي على خليط من كبريتات النحاس (II) وكلوريد البوتاسيوم.
87- تُغمس صفائح النحاس والفضة في محلول مائي من نترات الفضة. إلى أي قطب من المصدر الحالي يجب توصيل صفيحة نحاسية لتغطيتها بالفضة. اكتب مخططًا لعملية التحليل الكهربائي.
تآكل المعادن
تآكليسمى التدمير التلقائي للمعدن تحت تأثير البيئة. التآكل هو عملية غير متجانسة الأكسدة والاختزال تحدث في الواجهة. وفقًا لآلية عملية التآكل ، يتم تمييز التآكل الكيميائي والكهروكيميائي. التآكل الكيميائيتسمى أكسدة المعدن ولا يصاحبها ظهور تيار كهربائي في النظام. يتم ملاحظة هذه الآلية في تفاعل المعادن مع الغازات العدوانية في درجة حرارة عالية(تآكل الغاز) والسوائل العضوية - غير المنحل بالكهرباء (التآكل في غير المنحل بالكهرباء).
التآكل الكهروكيميائي يسمى تدمير المعدن في بيئة المنحل بالكهرباء ، مصحوبًا بظهور تيار كهربائي داخل النظام.
تحتوي المعادن المستخدمة في الهندسة على شوائب من معادن أخرى ، لذلك ، عند ملامستها لمحلول إلكتروليت ، يتم الحصول على عدد كبير من الخلايا الدقيقة التي تعمل باستمرار على سطحها. يتأكسد المعدن الأكثر نشاطًا ، الأنود ، لتكوين كاتيونات معدنية أو منتجات غير قابلة للذوبان مثل الصدأ. تنتقل الإلكترونات المحررة إلى القطب السالب ، حيث يتم تقليل العامل المؤكسد. الأكسجين المذاب وأيونات الهيدروجين ، أهم العوامل المؤكسدة المسببة للتآكل ، تسمى مزيلات الاستقطاب الكاثودية. يعتمد نوع عملية الاختزال التي ستحدث على الكاثود على تكوين الإلكتروليت.
مثال.
عندما يتلامس الحديد والنحاس في محلول حمض الهيدروكلوريك ، تتشكل خلية جلفانية دقيقة:
AFe | حمض الهيدروكلوريك | النحاس ك
ه 0 Fe / Fe2 + = -0.44B
ه 0 نحاس / نحاس 2 + = + 0.34 ب
الحديد - المعدن الأكثر نشاطًا سيكون الأنود ، والنحاس - الكاثود. يمكن التعبير عن التفاعلات التي تحدث عند الأنود والكاثود على النحو التالي:
1 أ: Fe -2e \ u003d Fe 2+
1 K: 2H + 2e = H 2
تلخيصًا لعمليات الأنوديك والكاثودية ، نحصل على تفاعل الأكسدة والاختزال ، والذي يتسبب حدوثه التلقائي في تآكل المعدن:
Fe + 2H + = Fe 2+ + H 2
Fe + 2HCl \ u003d FeCl 2 + H 2
مثال.
مع تآكل في بيئة محايدةفي حالة عدم وجود الأكسجين المذاب في الماء ، يحدث استقطاب الهيدروجين للكاثود بنفس الطريقة كما في المثال السابق.
دعنا نكتب مخطط الخلية الجلفانية ومعادلات التفاعلات التي تحدث في هذه الخلية الجلفانية:
أ Fe | H 2 O | النحاس ك
1 أ: Fe - 2e \ u003d Fe 2+
1 K: 2H 2 O + 2e \ u003d H 2 + 2OH -
Fe + 2H 2 0 \ u003d Fe 2+ + H 2 + 2OH -
أو في شكل جزيئي: Fe + 2H 2 O = Fe (OH) 2 + H 2
مثال.
عندما يتلامس الحديد مع النحاس في الهواء الرطب ، تتشكل خلية كلفانية.
AFe | H 2 O + O 2 | النحاس ك
ويتم التعبير عن عملية التآكل بالمعادلات التالية:
أ: Fe - 2e = Fe 2+
K: O 2 + 2H 2 O + 4e \ u003d 4OH -
2Fe + O 2 + 2H 2 O \ u003d 2Fe (OH) 2
تحت تأثير الأكسجين الجوي ، يتأكسد الحديد (2) هيدروكسيد وفقًا للمعادلة
4Fe (OH) 2 + O 2 + 2H 2 O = 4Fe (OH) 3
كما يتضح من المثال ، في هذه الحالة يحدث استقطاب الأكسجين للكاثود.
يتم حساب إمكانية إجراء عملية الأكسدة والاختزال العفوية من المجالات الكهرومغناطيسية
EMF = عامل الاختزال - عامل مؤكسد
إذا كان EMF للعملية أكبر من الصفر ، فإن العملية ممكنة.
مختبر # 9
تحديد جهود القطب الكهربائي للمعادن والمجالات الكهرومغناطيسيةالعناصر الجلفانية.
أنا.الأقسام بالطبع النظريبالنسبة التكرار.
ظهور قفزة محتملة عند الواجهات المعدنية - الماء ، المعدن - محلول الملح المعدني. قطب هيدروجين قياسي. مفهوم الخلايا الجلفانية والعمليات التي تحدث على الأقطاب الكهربائية. إمكانات القطب القياسية للمعادن. عدد من جهود القطب القياسية. استنتاجات من موقف المعدن على التوالي. معادلة نرنست. أقطاب كهربائية قابلة للعكس ولا رجوع فيها. أقطاب معدنيةالنوع الأول والثاني ، أقطاب الأكسدة والاختزال ، أقطاب الغاز. أقطاب مرجعية. العناصر الجلفانية الكيميائية والتركيزية. القوة الدافعة الكهربائية (EMF) للخلايا الجلفانية. العمليات التي تحدث على الأقطاب الكهربائية أثناء تشغيل الخلية الجلفانية.
3. أسئلة وتمارين.
1. ما هي احتمالية قطب كهربائي فضي مغمور في محلول ملح فضي مع تركيز
سم = 10-2 مول / لتر؟
2. كيف تعتمد قيمة جهد الهيدروجين على الرقم الهيدروجيني للوسط؟ ما هي إمكانات قطب الهيدروجين عند الرقم الهيدروجيني = I ؛ الرقم الهيدروجيني = 7 ، الرقم الهيدروجيني = 10؟
3. احسب جهد القطب الفضي القياسي فيما يتعلق بما يلي:
أ) قطب كالوميل مشبع ،
ب) النحاس المشبع - قطب الكبريتات ،
ج) قطب كلوريد الفضة المشبع؟
4. قم بعمل مخططات للخلايا الجلفانية التي تحدث فيها التفاعلات:
أ) 2اي جي+ + النحاس 0 → اي جي 0 + النحاس+2
ب)قرص مضغوط 0 + CuSO4 → CdSO4 + النحاس
5. تحديد قيمة المجالات الكهرومغناطيسية وبيان العمليات التي تحدث على الأقطاب الكهربائية في الخلايا الجلفانية التالية:
لكن)Zn / ZnSO4 //CDSO4 / C.د
ب)صب/ صب(رقمح) 2) //AgNO3 /اي جي
6. احسب EMF للخلية الجلفانية ذات التركيز التالي:
لكن)Zn/ ZnCI2 // ZnCI2 / Zn
0.01 مول / لتر 1.0 مول / لتر
أي قطب هو الأنود وما هو الكاثود؟
3. جزء تجريبي
1. تحديد قيمة جهد القطب القياسي للزنك.
قم بتجميع قطب الزنك (Zn/ ZnSO4 ) ، عن طريق غمر قضيب زنك جيد الصنفرة في محلول ملحي بتركيز أيون الزنك I mol / l.
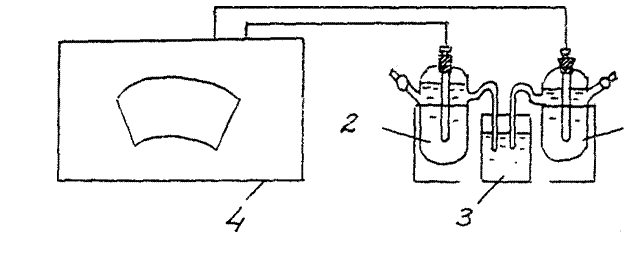
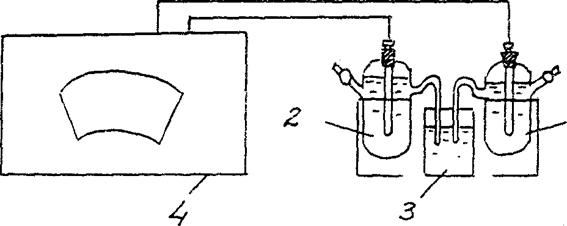
أرز.أنا. مخطط التثبيت لتحديد قيمة الجهد الكهربائي للمعدن.
1 - فحص قطب كهربائي (زنك ، نحاس ، إلخ)
2 - مرجع كلوريد الفضة القطب
3 - مقياس الجهد.
4 - كأس من محلول كلوريد البوتاسيوم المشبع
وفقًا للشكل 1 ، قم بتجميع خلية كلفانية من قطب الزنك الذي تم فحصه (Zn/ ZnSO4 ) والقطب المرجعي المشبع من كلوريد الفضة (بوكل/ AgCl/ اي جي) :
التدوين الشرطي لهذه الخلية الجلفانية:
(-) Zn / ZnSO4 // KCl / AgCl / Ag(+)
للقيام بذلك ، يتم غمر أنابيب الإلكترود في زجاج بمحلول من كلوريد البوتاسيوم ، ويتم توصيل الأقطاب الكهربائية نفسها بالمطاريف المقابلة لمقياس الجهد باستخدام أسلاك توصيل.
تبلغ احتمالية القطب المرجعي لكلوريد الفضة المشبع فيما يتعلق بإلكترود الهيدروجين القياسي + 0.201V.
اكسل. سر. نحن.= + 0.201V أو 201mV.
وفقًا للتعليمات الخاصة بإجراء القياس ، باستخدام مقياس جهد مناسب ، حدد EMF للخلية الجلفانية المكونة وإمكانات قطب الزنك باستخدام قطب كلوريد الفضة المشبع.
معرفة قيمة جهد القطب المرجعي ، وحساب قيمة الجهد الكهربائي للزنك بالنسبة لقطب الهيدروجين القياسي. قارن القيمة الناتجة بقيمة الجدول:
ه0 = - 0,76 ب.
اكتب القيم التي تم العثور عليها:
القيمة المقاسة لـ E.D.S. خلية جلفانية ، تتكون من قطب كهربائي قياسي من الزنك وقطب مرجعي مشبع من كلوريد الفضة:
د. (Zn/ ZnSO4 // بوكل/ AgCl/ اي جي) =
القيمة التجريبية لإمكانات قطب زنك قياسي فيما يتعلق بقطب مرجعي مشبع بكلوريد الفضة:
ه ( ) بالكلور - تشبع الفضة .. =
القيمة التجريبية لإمكانات قطب الزنك القياسي فيما يتعلق بإلكترود مرجعي للهيدروجين القياسي:
ه ( ) وفقًا لمعيار الهيدروجين. =
انتباه! نظرًا للسمية العالية لأملاح المعادن الثقيلة ، لا يتم تصريف جميع المحاليل المستهلكة في الحوض ، ولكن يتم تسليمها إلى مساعد المختبر للتخلص منها لاحقًا.
2. تحديد قيمة جهد القطب القياسي للنحاس.
كما في الخطوة الأولى ، قم بتجميع القطب النحاسي عن طريق غمر قضيب النحاس المجرد في محلول كبريتات النحاس IM.
يؤلف خلية كلفانية من القطب النحاسي الذي تم فحصه وقطب مرجعي مشبع من كلوريد الفضة.
حدد المجالات الكهرومغناطيسية للخلية الجلفانية. أعط تدوينًا شرطيًا لهذه الخلية الجلفانية.
ما هو جهد القطب النحاسي عبر القطب المشبع بكلوريد الفضة؟
احسب إمكانات القطب النحاسي فيما يتعلق بقطب الهيدروجين القياسي وقارنه بقيمة الجدول لإمكانات القطب النحاسي القياسي:
ه0 = 0,34 ب
اكتب القيم التي تم العثور عليها:
د. (منش/ CuSO4 // بوكل/ AgCl/ اي جي) =
ه() بالكلور - تشبع الفضة .. =
ه() بواسطة قطب الهيدروجين القياسي =
3. التعريف مادة كيميائية EMFعنصر كلفاني. (عنصر جلفاني من النحاس والزنك).
قم بتجميع خلية كلفانية مكونة من أقطاب كهربائية قياسية من الزنك والنحاس (الشكل 2).
(جش/ CuSO4 // Zn/ ZnSO4 ) إكسب. = ……… ..
قارن القيمة التي تم الحصول عليها في التجربة مع القيمة المحسوبة (النظرية) قيمة EMFلخلية النحاس والزنك الجلفانية:
نظرية EMF. =ه الكاثود- الأنود الكهربائي =
= E0 (Cu + 2 / Cu0) - E0 (Zn + 2 / Zn0) = 0.34 - (- 0.76) = 1.1B.
 الشكل 2 مخطط التركيب لتحديد المجالات الكهرومغناطيسية لخلية كيميائية كلفانية:
الشكل 2 مخطط التركيب لتحديد المجالات الكهرومغناطيسية لخلية كيميائية كلفانية:
1- قطب نحاسي 2- قطب من الزنك
3 - مفتاح كهربائيا (زجاج به محلول كلوريد البوتاسيوم) ،
4 - مقياس الجهد
اكتب معادلات العمليات التي تحدث عند الكاثود والأنود لخلية جلفانية معينة أثناء تشغيلها.
4. تحديد المجالات الكهرومغناطيسية لخلية كلفانية تركيز.
قم بتجميع خلية كلفانية مكونة من قطب كهربي قياسي من الزنك (قطب كهربائي مغمور في محلول ملح الزنك بتركيز 1 مول / لتر) وقطب كهربي من الزنك مغمور في محلول ملح الزنك بتركيز C = 10-2 مول / لتر (تين. 3).
Zn/ ZnSO4 // Zn/ ZnSO4
سم = 10-2 مول / لتر سم = 10-2 مول / لتر
الشكل 2 مخطط التثبيت لتحديد EMF لخلية تركيز كلفانية:
1 - قطب الزنك في محلول ملحي مع سم = 10-2 مول / لتر ,
2 - قطب الزنك في محلول ملحي مع سم = 1 مول / لتر
3 - مفتاح التحليل الكهربائي (محلول كلوريد البوتاسيوم) ،
4 - مقياس الجهد
وفقًا للتعليمات الخاصة بترتيب القياسات باستخدام مقياس الجهد المناسب ، حدد EMF لهذه الخلية الجلفانية.
(جش/ CuSO4 // Zn/ ZnSO4 ) إكسب. = ……… ..
قارن القيمة التي تم الحصول عليها في التجربة مع قيمة EMF المحسوبة (النظرية) لخلية جلفانية بتركيز معين.




