مفهوم emf القياسي للخلية الجلفانية. أساسيات الكيمياء الكهربائية
عندما يمر تيار كهربائي عبر الإلكتروليت ، يتدفق التيار الكهربائي على سطح الأقطاب الكهربائية. تفاعلات كيميائية. يمكن إنشاء تدفق التفاعلات الكهروكيميائية بواسطة مصدر تيار خارجي. الظاهرة العكسية ممكنة أيضًا: التفاعلات الكهروكيميائية التي تحدث على قطبين منغمسين في إلكتروليت تولد تيارًا كهربائيًا ، وتحدث التفاعلات فقط عندما تكون الدائرة مغلقة (مع مرور التيار).
خلية كهروكيميائية (أو جلفانية)يسمى جهاز لتوليد التيار الكهربائي بسبب التفاعلات الكهروكيميائية. تتكون أبسط خلية كهروكيميائية من قطبين معدنيين (موصلات من النوع الأول) مغمورة في إلكتروليت (موصل من النوع الثاني) ومتصلان ببعضهما البعض عن طريق ملامسة معدنية. عدة خلايا كهروكيميائية متصلة في شكل تسلسلي الدائرة الكهروكيميائية .
تعتبر القوة الدافعة الكهربية من أهم الخصائص الكمية للعنصر الكهروكيميائي(EMF ، E) ، والتي تساوي فرق الجهد فتح العنصر بشكل صحيح (واحد يتم فيه توصيل موصلات من النوع الأول من نفس المادة بأقطاب نهاية العنصر).
إذا حدث ، عندما يمر تيار كهربائي في اتجاهات مختلفة ، أن نفس التفاعل يحدث على سطح القطب ، ولكن في اتجاهين متعاكسين ، فإن هذه الأقطاب الكهربائية ، وكذلك العنصر أو الدائرة المكونة منها ، تسمى تفريغ . إن المجالات الكهرومغناطيسية للعناصر القابلة للعكس هي خصائصها الديناميكية الحرارية ، أي يعتمد فقط على T و P وطبيعة المواد التي تتكون منها الأقطاب الكهربائية والمحاليل وتركيز هذه المحاليل. مثال على عنصر قابل للعكس - عنصر دانيال جاكوبي :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
حيث يكون كل قطب كهربي قابل للانعكاس. أثناء تشغيل العنصر ، تحدث التفاعلات التالية: Zn ® Zn 2+ + 2 ه، نحاس 2+ + 2 ه® نحاس. عندما يتم تمرير تيار صغير للغاية من مصدر خارجي ، تحدث تفاعلات عكسية على الأقطاب الكهربائية.
مثال على عنصر لا رجوع فيه - عنصر فولتا :
(-) Zn ç H 2 SO 4 çCu (+)
أثناء تشغيل العنصر ، تحدث تفاعلات: Zn ® Zn 2+ + 2 ه، 2 س + 2 ه® H 2. عندما يمر التيار من مصدر خارجي ، ستكون تفاعلات القطب: 2H + 2 ه®H 2 ، Cu ® Cu 2+ + 2 ه .
تعتبر EMF لعنصر كهروكيميائي قيمة موجبة لأن إنه يتوافق مع عملية تلقائية معينة تنتج عملاً إيجابيًا. سيتم الرد على العملية العكسية ، التي لا يمكن أن تستمر بشكل مستقل ، بواسطة emf سالب. عند تجميع سلسلة من العناصر الكهروكيميائية ، يمكن توجيه العملية في أحد العناصر بحيث تكون مصحوبة بإنفاق العمل من الخارج (عملية غير تلقائية) ، وذلك باستخدام عمل عنصر آخر من الدائرة في التي تحدث عملية عفوية. إجمالي EMF لأي دائرة يساوي المجموع الجبري للقيم الموجبة والسالبة. لذلك ، من المهم جدًا عند كتابة مخطط دائرة أن تأخذ في الاعتبار علامات EMF ، باستخدام القواعد المقبولة.
تعتبر المجالات الكهرومغناطيسية للدائرة الكهروكيميائية موجبةإذا ، عند كتابة الدائرة ، يكون القطب الأيمن مشحونًا بشكل إيجابي بالنسبة للإلكترود الأيسر (أثناء تشغيل الدائرة ، تمر الكاتيونات في محلول من القطب الكهربائي المكتوب على اليسار باتجاه القطب الكهربائي المكتوب على اليمين ، وتتحرك الإلكترونات في نفس الشيء الاتجاه في الدائرة الخارجية). مثال.
الديناميات الحرارية لخلية جلفانية.
دع التفاعل التالي يستمر بشكل عكسي ومتساوي الحرارة في نظام كهروكيميائي:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
الطاقة الكهربائية التي يولدها العنصر تساوي العمل المفيد A ¢ للعملية الإجمالية. العمل المفيد A ¢ للعملية القابلة للعكس هو الحد الأقصى وعند P ، T = const يساوي الانخفاض في إمكانات متساوية الضغط للنظام:
DG P، T = nFE P، T
E P ، T - EMF عكسي للنظام.
E P، T = -DG P، T / nF، E V، T = -DF V، T / nF
وهكذا ، بعد أن قياس عنصر emfومعامل درجة الحرارة الخاصة به ، يمكن للمرء أن يجد قيم DG و DS للعملية الكلية التي تحدث في الخلية الجلفانية. هذه العملية عفوية ، ومن ثم DG< 0.
باستخدام معادلة Gibbs-Helmholtz ، يمكنك حساب التغيير في المحتوى الحراري للعملية:
DH = DG-T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
ويترتب على المعادلات أن النسبة بين الطاقة الكهربائية المولدة أو الممتصة بشكل عكسي في نظام كهروكيميائي والتأثير الحراري للتفاعل الذي يحدث فيه يعتمد على علامة وحجم معامل درجة حرارة EMF دي إي / دي تي :
1. إذادي إي / دي تي > 0 ، ثم nFE> (DG> DH) وسيحول النظام إلى طاقة كهربائية ليس فقط كمية الحرارة التي تتوافق مع التأثير الحراري للتفاعل ، ولكن أيضًا الحرارة الإضافية - دفء بيليتير Q P \ u003d nFT دي إي / دي تياقترضت من البيئة. في ظل ظروف ثابتة الحرارة (في ظل ظروف العزل الحراري ، عندما يكون التبادل مع البيئة مستحيلًا) ، يتناقص T للنظام. يكون تبريد النظام ملحوظًا بشكل خاص إذا ، في دي إي / دي تي > 0 < 0 (реакция эндотермична).
2. إذادي إي / دي تي < 0 ، ثم nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. إذادي إي / دي تي = 0 ، ثم DG = DH و nFE = - الطاقة الكهربائية التي ينتجها النظام بشكل عكسي تعادل التأثير الحراري لتفاعل كيميائي. تُعرف هذه النسبة باسم مبدأ (حكم) طومسون .
للحساب معادلات EMFيمكن إعادة كتابتها على النحو التالي:
عند استخدام المعادلات ، تذكر أنها صالحة فقط للأنظمة الكهروكيميائية العكسية، لذلك ، عند دراسة اعتماد EMF على T ، من الضروري تجنب استخدام الأنظمة الكهروكيميائية ذات الحدود السائلة ، لأن إمكانات الانتشار الناشئة عنها ليست توازنًا.
دعنا نربط EMF للعنصر بثابت التوازن للتفاعل الذي يحدث في العنصر. معادلة درجة حرارة التفاعل الكيميائي:
DG = RT lnك أ-RT
E = - = lnك أ-
المصطلح الأول على الجانب الأيمن من المعادلة ل P ، T قيمة ثابتة ، يمكن الإشارة إليها بواسطة E o. ه س - معيار emf لعنصر (نظام كهروكيميائي) ، بمعنى آخر. EMF على الإطلاق أنا= 0.
E \ u003d E o + ln= إيو + 2.303 إل جي
وبالتالي ، فإن المجالات الكهرومغناطيسية للنظام الكهروكيميائي هي دالة لأنشطة المشاركين في التفاعل الكهروكيميائي. تتيح المعادلات أعلاه حساب الكميات DG و K لكنعلى القيم التجريبية E ، وعلى العكس من ذلك ، احسب E ، مع معرفة الخصائص الديناميكية الحرارية للتفاعل الكيميائي.
قياس EMF.
لقياس قيمة التوازن (القابلة للانعكاس) لـ EMF لعنصر كهروكيميائي ، من الضروري أن تستمر العملية ببطء شديد ، أي بحيث يعمل العنصر بقوة تيار صغيرة بشكل لا نهائي. يتم استيفاء هذا الشرط في طريقة التعويض ، والتي تستند إلى حقيقة أن العنصر متصل في سلسلة مقابل فرق الجهد الخارجي ، ويتم اختيار الأخير بحيث لا يوجد تيار في الدائرة. ثم فرق الجهد الخارجي يساوي EMF للدائرة.
باستخدام طريقة التعويض ، يمكنك قياس قيمة EMF مباشرةً ، ولكن هذه عملية معقدة نوعًا ما ، لذلك ، في الممارسة المختبرية ، يفضلون مقارنة EMF للعنصر قيد الدراسة مع EMF لما يسمى المعيار ( العادي) ، والتي يتم قياسها بعناية عند مختلف T. هذه الطريقة المقارنة هي أيضًا تعويضية.
العنصر الطبيعي الأساسي هو عنصر ويستون المشبع .
(مخطط قياس EMF - بشكل مستقل).
هيكل حدود محلول الإلكترودات. طبقة كهربائية مزدوجة.
عندما يتلامس موصل من النوع الأول مع إلكتروليت ، أ طبقة كهربائية مزدوجة . كمثال ، ضع في اعتبارك قطبًا نحاسيًا مغمورًا في محلول CuSO 4. يمكن اعتبار الإمكانات الكيميائية لأيونات النحاس في المعدن عند درجة حرارة معينة ثابتة ، بينما تعتمد الإمكانات الكيميائية لأيونات النحاس في المحلول على تركيز الملح ؛ بشكل عام ، هذه الإمكانات الكيميائية ليست هي نفسها.
دع تركيز CuSO 4 يكون هكذا>. بعد ذلك ، عند غمر المعدن في المحلول ، فإن بعض أيونات النحاس 2+ من المحلول تجف وتنقل إلى المعدن ، مما يؤدي إلى شحنة موجبة عليه. ستمنع هذه الشحنة الانتقال الإضافي لأيونات النحاس 2+ من المحلول إلى المعدن وستؤدي إلى تكوين طبقة من الأنيونات المنجذبة إليها بالقرب من القطب الكهربي. ما يسمى ب التوازن الكهروكيميائي ، حيث ستختلف الإمكانات الكيميائية للأيونات في المعدن وفي المحلول حسب قيمة فرق الجهد للطبقة الكهربائية المزدوجة الناتجة (DEL):
يتم تعويض الفرق في الجهود الكهربائية والفرق في الجهود الكيميائية بالتوازن الكهروكيميائي.
دع تركيز CuSO 4 يكون منخفضًا جدًا< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
يمكنك اختيار مثل هذا التركيز بالكهرباء حيث تكون الإمكانات الكيميائية للأيونات في المعدن والمحلول متماثلًا. تسمى حلول هذا التركيز صفر الحلول . عند غمر معدن في محلوله الصفري ، لا يظهر DES على سطح القطب ، ومع ذلك ، في هذه الحالة ، لا يساوي فرق الجهد بين المعدن والمحلول صفرًا.
وفقًا لنيرنست ، فإن المصدر الوحيد للمجالات الكهرومغناطيسية في الخلية الكهروكيميائية هو DES الموجود على سطح الأقطاب الكهربائية. تم تعريف إمكانات المعادن في محلول صفري بواسطة Nernst على أنها الصفر المطلق للجهود. في أعمال A.N. Frumkin ، تبين أن أفكار Nernst غير صحيحة. لقد تم إثبات أن المجال الكهرومغناطيسي لعنصر مكون من قطبين مختلفين مغمور في محاليلهم الصفرية يختلف اختلافًا كبيرًا عن الصفر (ربما أكثر من 1 فولت). إمكانات المعدن في المحلول الصفري تسمى احتمال عدم الشحن ، لا يمكن اعتباره احتمال الصفر المطلق.
نظرية هيلمهولتز ثنائية الطبقة المكثفة. تم إنشاء أول نظرية كمية لهيكل DEL في واجهة المحلول المعدني بواسطة Helmholtz (1853). وفقًا لهيلمهولتز ، يمكن تشبيه DES بمكثف مسطح ، تتزامن إحدى لوحاته مع المستوى الذي يمر عبر الشحنات السطحية في المعدن ، والآخر مع المستوى الذي يربط مراكز شحن الأيونات في محلول ينجذب إلى السطح المعدني بواسطة القوى الكهروستاتيكية. سمك طبقة مزدوجة ليساوي نصف قطر الأيونات ص. وفقًا لشرط الحياد الكهربائي ، يجب أن يكون عدد الأيونات المنجذبة إلى سطح المعدن بحيث تعوض شحناتها عن الشحنات السطحية للمعدن ، أي
تتيح نظرية الطبقة المزدوجة المكثفة الحصول على قيم السعة DEL المتوافقة مع التجربة وسمك DEL المعقول ماديًا. ومع ذلك ، لا يمكنها تفسير العديد من الأنماط التجريبية: القيم التي تم العثور عليها تجريبياً للجهد الكهربائي (جهد x) واعتمادها على تركيز الإلكتروليت ، والتغير في علامة شحنة سطح المعدن في وجود المواد الخافضة للتوتر السطحي.
نظرية الطبقة المزدوجة من GOOEY-CHAPMAN. لا تأخذ نظرية هيلمهولتز في الاعتبار أن خصائص DEL تتغير بتركيز الإلكتروليت ، وحاول T. Gouy (1910) و Chapman (1913) ربط كثافة الشحنة في DEL بتركيبة المحلول. لقد أخذوا في الاعتبار أنه بالإضافة إلى القوى الكهروستاتيكية التي تنشأ بين المعدن والأيونات ، تتأثر الأيونات أيضًا بقوى الحركة الجزيئية الحرارية. عند تطبيق هاتين القوتين ، يجب توزيع الأيونات الموجودة في المحلول بشكل منتشر بالنسبة لسطح المعدن - مع انخفاض كثافة شحنة الحجم مع المسافة منه.
يعتقد Gouy و Chapman أنه يمكن اعتبار الأيونات كنقاط مادية ليس لها حجمها الخاص ، ولكن لها شحنة ، وأن توزيعها في مجال شحن القطب يخضع لتوزيع Boltzmann.
تعتبر نظرية Gouy-Chapman أفضل من نظرية Helmholtz في اتفاقها مع قوانين الظواهر الكهربية. فلو افترضنا أن الانطلاق من مسافة معينة لفي الشكل 1 ، لم تعد الأيونات مرتبطة بقوة بسطح القطب أثناء الحركة النسبية للمرحلتين الصلبة والسائلة ، ثم يمكن اعتبار الإمكانات المقابلة لهذه المسافة الجهد السيني (x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
وبالتالي ، فإن أفضل ما يبرر نظرية Gouy-Chapman عندما تكون نظرية هيلمهولتز غير قابلة للتطبيق ، وعلى العكس من ذلك ، فإن النظرية الأخيرة تعطي أفضل تقارب مع الخبرة في الحالات التي تعطي فيها الأولى نتائج غير صحيحة. وبالتالي ، يجب أن يتوافق هيكل DES مع مجموعة من النماذج التي اقترحها Helmholtz و Gouy-Chapman. مثل هذا الافتراض قدمه ستيرن (1924) في نظريته للامتصاص DEL.
نظرية الاستقطاب. يعتقد ستيرن أن جزءًا معينًا من الأيونات يتم الاحتفاظ به بالقرب من واجهة المعدن بالكهرباء ، مكونًا هيلمهولتز أو صفيحة مكثفة من طبقة مزدوجة بسماكة تقابل متوسط نصف قطر أيونات الإلكتروليت. يتم توزيع الأيونات المتبقية الموجودة في DEL بشكل منتشر بكثافة شحنة متناقصة تدريجيًا. بالنسبة للجزء المنتشر من DEL ، أهمل ستيرن ، مثل Gouy ، الأبعاد الجوهرية للأيونات. بالإضافة إلى ذلك ، اقترح ستيرن أن الأيونات يتم الاحتفاظ بها في الجزء الكثيف من DEL ليس فقط بسبب القوى الكهروستاتيكية ، ولكن أيضًا بسبب قوى الامتزاز المحددة ، أي قوات من أصل غير كولوم. لذلك ، في المحاليل التي تحتوي على أيونات نشطة السطح ، يمكن أن يتجاوز عددها في الجزء الكثيف من EDL شحنة سطح المعدن ببعض القيمة ، اعتمادًا على خصائص الأيونات وشحنة المعدن. وبالتالي ، وفقًا لشتيرن ، يجب التمييز بين نموذجين من نماذج DES ، يشير أحدهما إلى محاليل الإلكتروليتات السطحية غير النشطة ، والآخر إلى المحاليل التي تحتوي على أيونات ممتصة على وجه التحديد.
تحافظ نظرية الامتزاز أيضًا على المساواة:
س م = ف ل = س 1 + س 2
تتكون كثافة الشحنة على جانب المحلول q L من جزأين: كثافة الشحنة في طبقة Helmholtz q 1 وكثافة الشحنة في الطبقة المنتشرة q 2.
تجعل نظرية ستيرن من الممكن تعريف إمكانات x على أنها الانخفاض المحتمل في الجزء المنتشر من DEL ، حيث فقد الرابطة القوية بين المعدن والأيونات بالفعل. مع هذا التعريف ، لا ينبغي أن تتطابق إمكانات x مع إمكانات نيرست ، كما هو ملاحظ تجريبياً. كانت نظرية ستيرن أيضًا قادرة على تفسير إعادة شحن سطح الجسم الصلب.
عند التركيز المتناهي الصغر ، يتم توزيع جميع الشحنات في المحلول بشكل منتشر ، ويتم وصف بنية DEL بواسطة نظرية Gouy-Chapman. على العكس من ذلك ، في الحلول المركزة ، تقترب بنية DEL من النموذج الذي اقترحه Helmholtz. في نطاق التركيزات المتوسطة ، حيث يمكن مقارنة x في القيمة بـ RT / F ، يمكن التعبير عن اعتمادها على التركيز بواسطة معادلات تقريبية:
للقيم الموجبة س: س = ب - lnمن
لقيم س سالبة: س = ب ¢ + lnمن
تعطي نظرية ستيرن صورة صحيحة نوعياً لـ DES. يتوافق تحديد السعة باستخدام نموذج ستيرن مع الخبرة من حيث قيم السعة وطبيعة اعتمادها على جهد القطب وتركيز المحلول. لكن نظرية ستيرن لا تخلو من أوجه القصور. من بينها استحالة الوصف الكمي لمنحنيات السعة ، خاصة عند الابتعاد عن إمكانات الشحنة الصفرية.
مزيد من التطور لنظرية محطة DES. تم إجراء العديد من المحاولات لتطوير نظرية DEL التي تتوافق كميًا مع البيانات التجريبية (رايس ، وفرومكين وآخرون ، وبوكريس ، وديفاناثان ، وإيسين ، ومولر ، وبارسونز ، وإيرشلر ، وغيرهم). حصل نموذج جراهام (1947) على أكبر تقدير. وفقًا لغراهام ، فإن بطانة DEL ، التي هي قيد الحل ، لا تتكون من جزأين ، بل من ثلاثة أجزاء. الأول ، الذي يحسب من سطح المعدن ، يسمى طائرة هيلمهولتز الداخلية ؛ يحتوي فقط على أيونات نشطة السطح (شحنة المستوى q 1) أو ، إذا لم تكن في محلول ، جزيئات المذيبات (q 1 = 0) ؛ يُشار إلى إمكاناتها ، المشار إليها في الحل ، بواسطة y 1. يسمى التالي ، بعيدًا عن السطح المعدني على مسافة يمكن أن تقترب منها الأيونات (مراكز شحنتها) ، طائرة هيلمهولتز الخارجية ؛ شحنتها الإجمالية تساوي q 2 وإمكانات المستوى y 2. خلف مستوى هيلمهولتز الخارجي توجد طبقة منتشرة بإمكانية تتراوح من y 2 إلى صفر وبكثافة شحنة تتزامن مع q 2.
يعكس نموذج جراهام السمات الرئيسية والسمات الهيكلية للمحلول الكهربائي المعدني DEL. يسمح للشخص بحساب منحنيات السعة التفاضلية لأي تركيز لإلكتروليت معين ، إذا كان هناك منحنى تجريبي لواحد على الأقل من حلوله. ومع ذلك ، فإن هذا النموذج لا يغطي جميع جوانب المشكلة.
العمل الكهربائي يساوي ناتج الجهد (فرق الجهد) وكمية الكهرباء التي يتم تمريرها. تحت ظروف متساوية الضغط (عند درجة حرارة وضغط ثابتين) ، أقصى عمل كهربائي خلية جلفانيةيمكن الحصول عليها عند أقصى فرق محتمل للأقطاب الكهربائية. أقصى فرق الجهد ΔE ، يساوي الفرق في إمكانات التوازن الكهربائي للكاثود (Eل ) والأنود (Eلكن ) يسمى العنصر EMF للخلية الجلفانية
ΔE = E. ل - إي لكن
إذا كانت الأقطاب الكهربائية في ظروف قياسية ، إذن
ΔE 0 = هـ ل 0 - إي لكن 0 ,
أينΔЕ 0 – معيار emf للعنصر ، لكنه إلى 0 وهـ أ 0 – جهود القطب القياسية الكاثود والأنود ، على التوالي.
إذا خضع مول واحد من مادة لتحول في القطب ، إذن ، وفقًا لقانون فاراداي ، تتدفق كمية من الكهرباء عبر النظام تساوي nF، أين نهو عدد مولات المكافئات في مول واحد من مادة. وبالتالي ، فإن أقصى عمل كهربائي لخلية جلفانية أثناء تحويل مول واحد من مادة هو:
أ ماكس الكهربائية = ن  ΔE (1)
ΔE (1)
في نفس الوقت ، أقصى قدر من العمل المفيدلكن الأعلى. الإجمالي ، والتي يمكن للنظام أن يؤديها عندما يستمر التفاعل عند درجة حرارة وضغط ثابتين ، تساوي طاقة جيبس للتفاعل:
ماكس. الإجمالي \ u003d - ΔG P (2)
منذ A max. الإجمالي = الحد الأقصى للكهرباء. ، ومن بعد:
ΔE= - ΔG P / nF. (3)
في ظل ظروف قياسية
ΔE 0 = - ΔGР 0 / nF ، (4)
أين ΔE 0 و Δ جي ا - معيار EMF وطاقة جيبس للتفاعل.
لذلك ، مع القيم المعروفة لطاقة جيبس للتفاعل ، من الممكن حساب EMF للعنصر ، والعكس صحيح. توضح المعادلة (4.3) العلاقة بين الطاقة الكيميائية والطاقة الكهربائية. تعتمد طاقة جيبس في التفاعل على الأنشطة . على سبيل المثال ، لرد فعل:
أأ (د) + ب (د)  cC (d) + dD (d)
cC (d) + dD (d)
 G =
G =  G o + RT
G o + RT
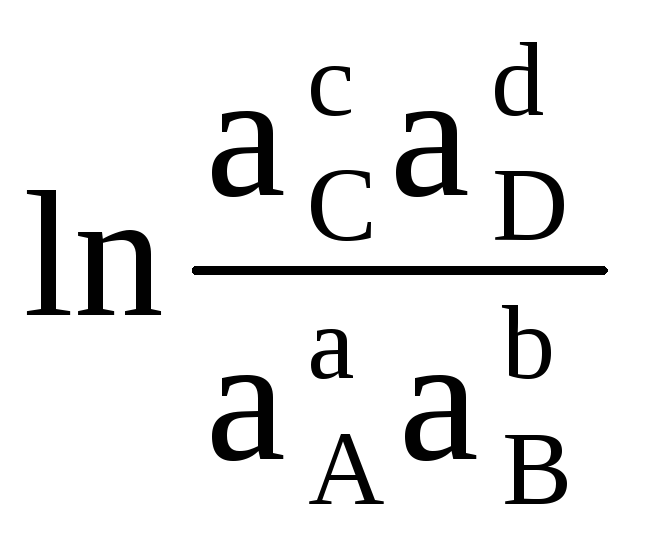 =
=
 اذهب
-
RT
اذهب
-
RT
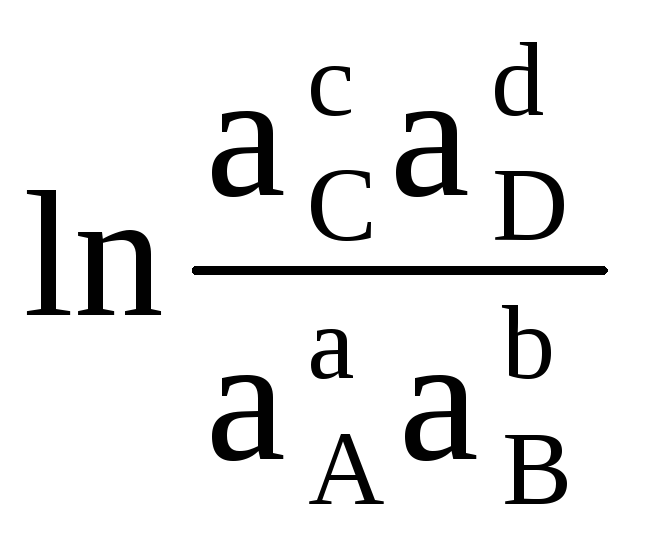 (5)
(5)
 G =
G =  G o + RT
G o + RT
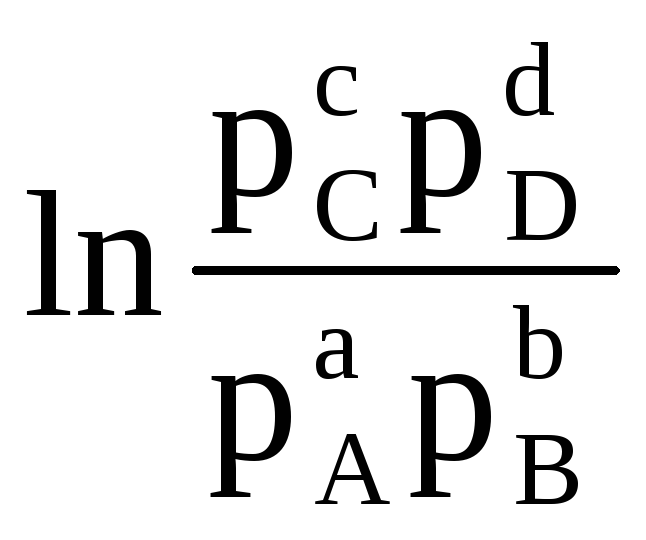 =
=
 Go-RT
Go-RT 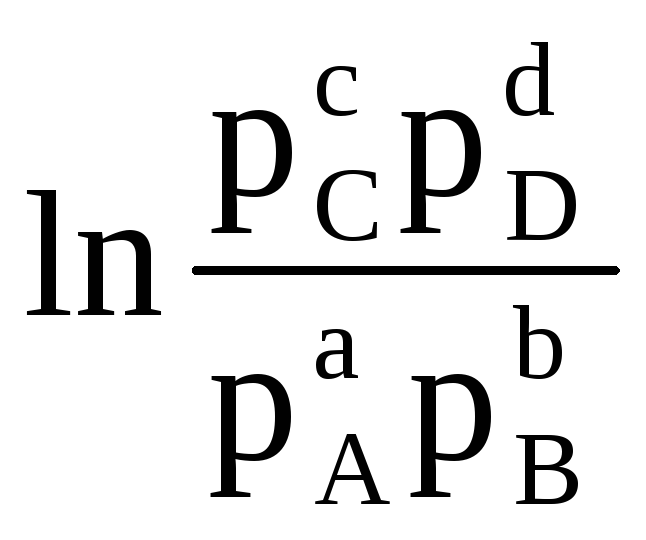 (6)
(6)
استبدال المعادلة (4.5) في المعادلة (4.3) ، نحصل على:
ΔE
=
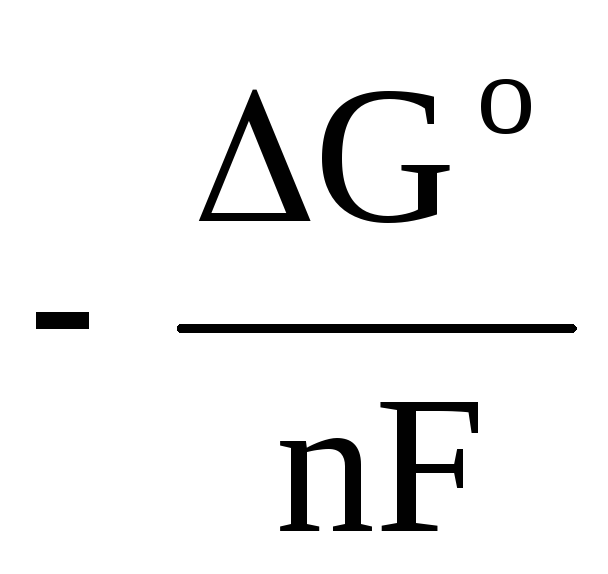 +
+
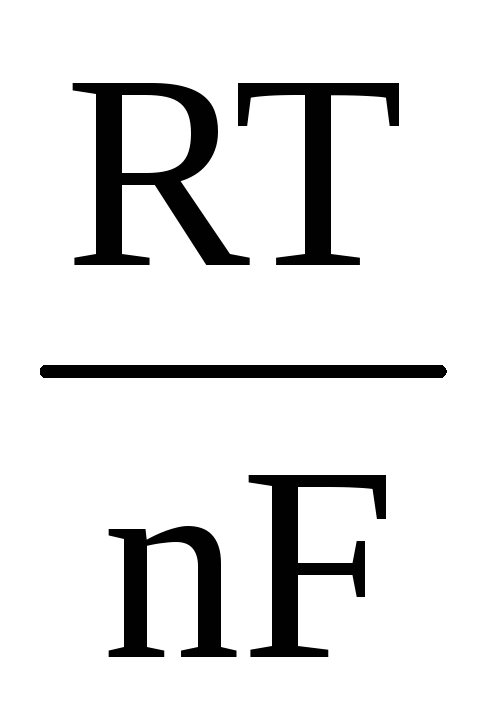
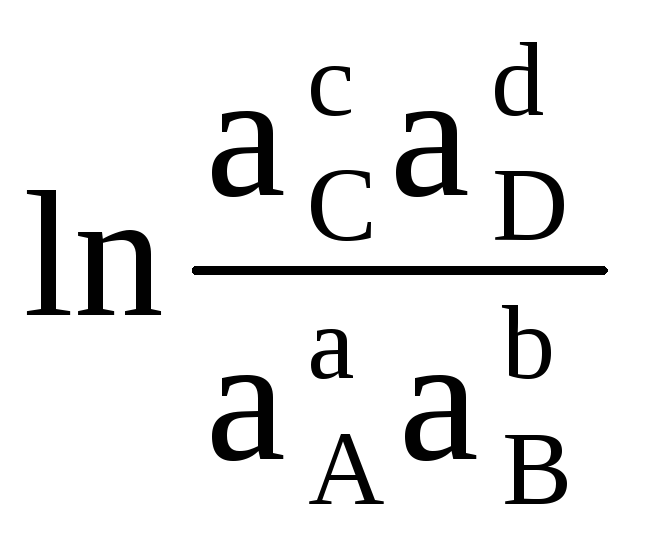 (7)
(7)
(في ظل ظروف قياسية ، أي مع أنشطة جميع المشاركين في رد الفعل تساوي واحدًا ، ΔE = ΔE 0 ). إذا شاركت المواد الغازية في التفاعل ، فيتم استبدال الأنشطة في المعادلة (4.7) بضغوط جزئية للمواد المقابلة.
في هذا الطريق، يسمى قياسي EMF عنصر إذا كانت الأنشطة (أو الضغوط الجزئية) للمواد الأولية ومنتجات التفاعل تساوي واحدًا.قيمة معيار emf ( ΔE 0 ) لخلية كلفانية يمكن حسابها بالمعادلة (4.4) إذا كانت قيمة طاقة جيبس القياسية للتفاعل معروفة. من السهل حساب الأخير ، مع معرفة طاقة جيبس لتكوين منتجات التفاعل والمواد الأولية.
كمثال ، دعنا نكتب المعادلة لحساب EMF لعنصر Daniel-Jacobi:
ΔE = ΔE 0
+
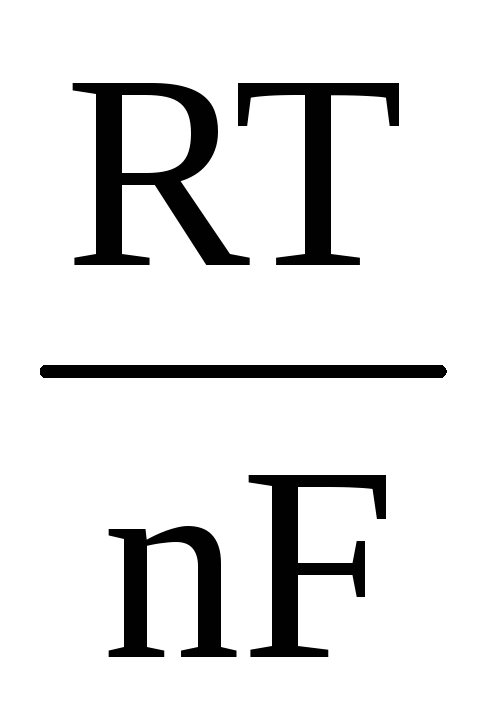
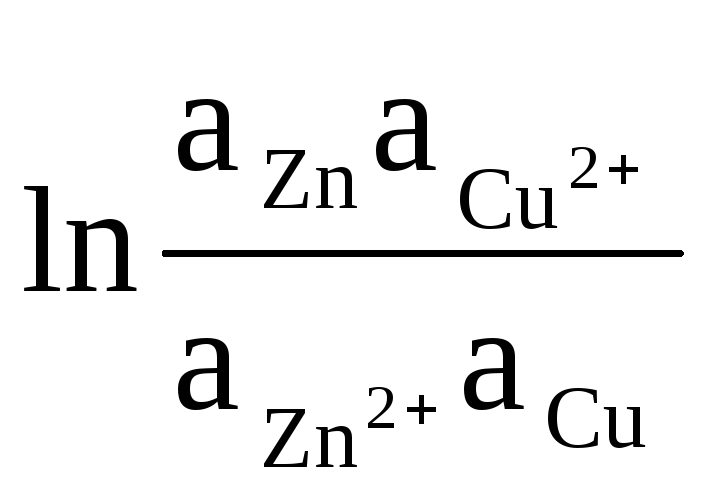 (8)
(8)
أنشطة الزنك الصلب والنحاس تساوي الوحدة (التفاعلات التي تحدث عند الأقطاب الكهربائية غير متجانسة). لذلك نحصل على:
ΔE = ΔE 0
+
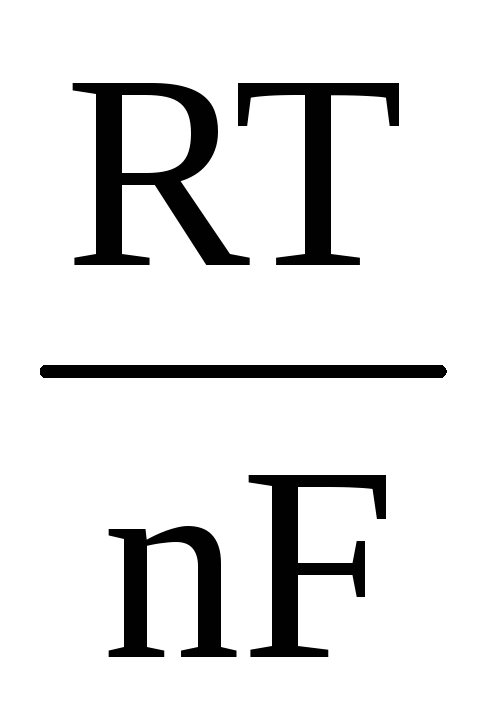
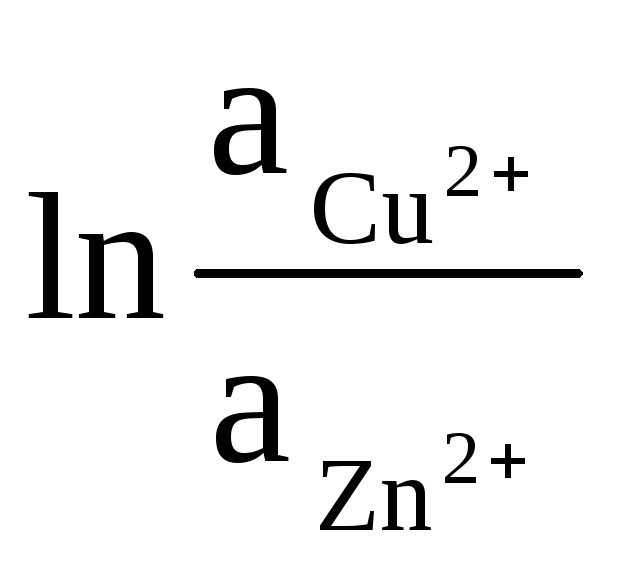 (9)
(9)
عند استبدال اللوغاريتم الطبيعي بآخر عشري واستبدال قيم التركيز المقابلة (a Me 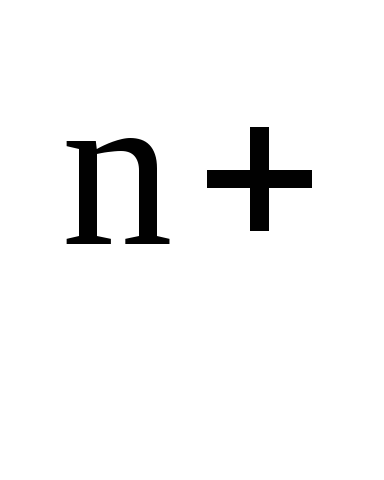
 ) ، وكذلك القيم العددية لـ R و F
ودرجة الحرارة القياسية 298 كلفن ، تصبح المعادلة (4.9) أبسط:
) ، وكذلك القيم العددية لـ R و F
ودرجة الحرارة القياسية 298 كلفن ، تصبح المعادلة (4.9) أبسط:
ΔE = ΔE 0
+
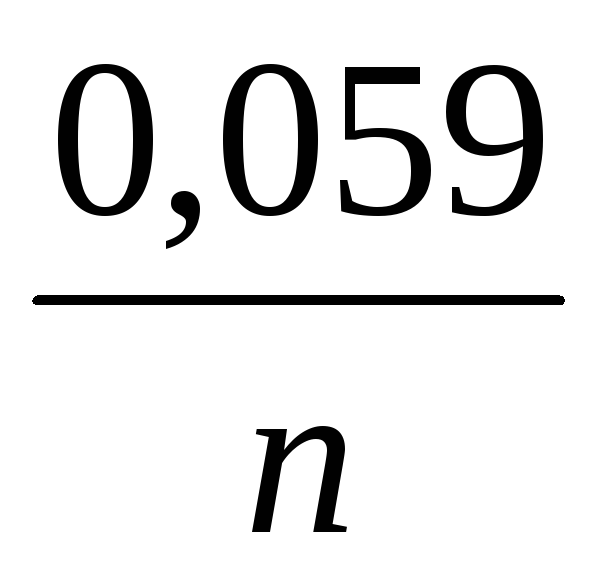
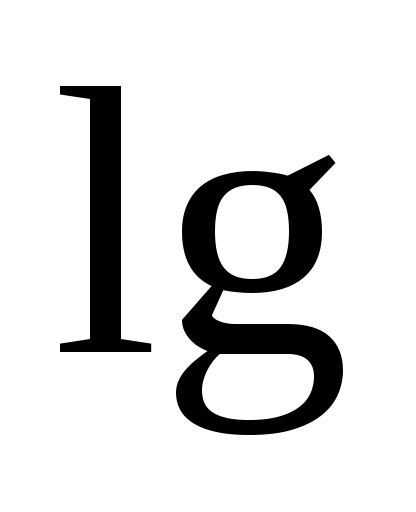
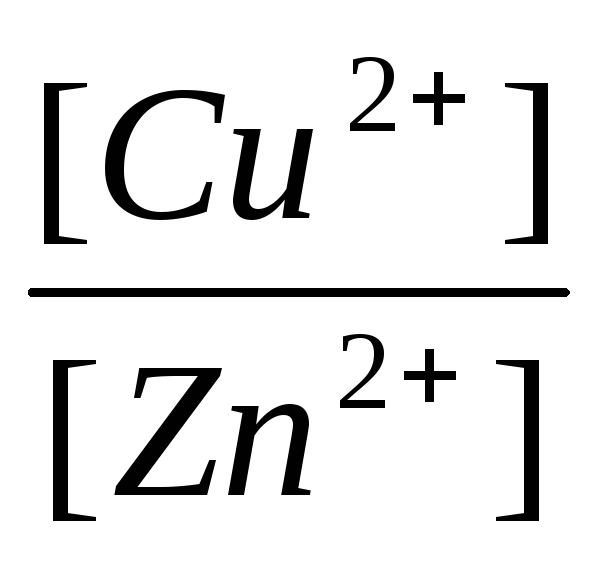 (10)
(10)
ΔE = ΔE 0
النحاس+2 / نحاس ΔE 0
Zn + 2 / Zn + 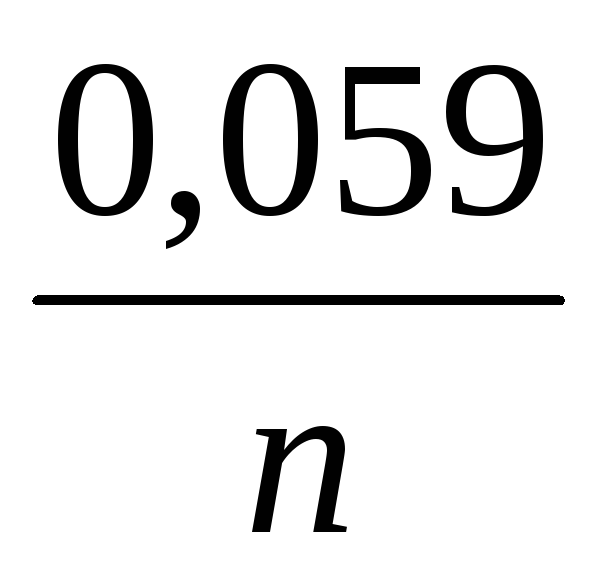
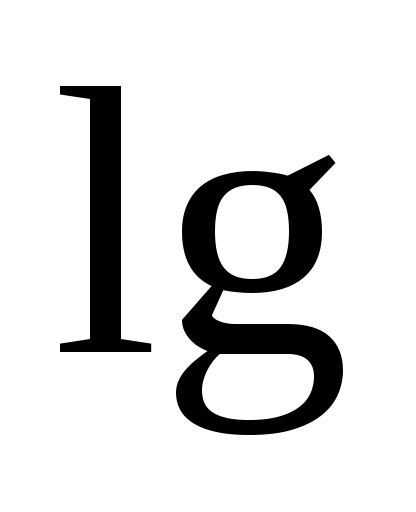
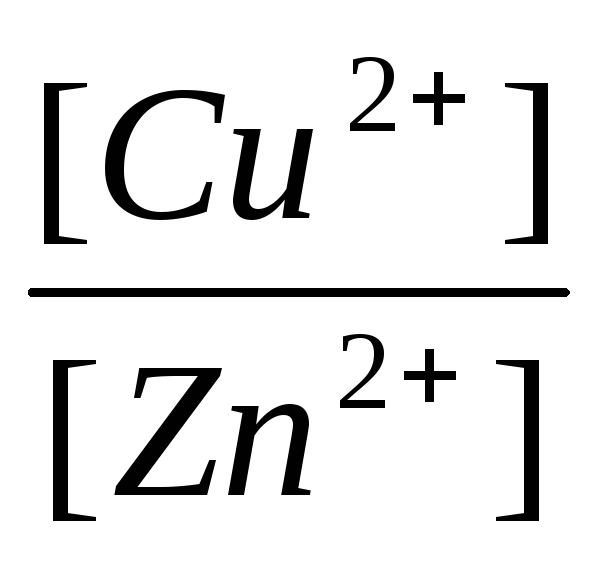 , (11)
, (11)
أين ن- عدد الإلكترونات المشاركة في عملية الأكسدة والاختزال ؛
ΔE 0 نحاس +2 / نحاس و ΔE 0 Zn +2 / Zn - جهد القطب القياسي بالفولت (V) ؛
ΔE 0 نحاس +2 / نحاس - ΔE 0 Zn +2 / Zn = ΔE 0 - EMF قياسي لخلية كلفانية ؛
و - تركيزات أيونات النحاس والزنك ، على التوالي ، في محاليل CuSO4 و ZnSO4 ، بالمول / لتر.
قياس المجالات الكهرومغناطيسية للعناصر الجلفانية.من خلال القياس المباشر لفرق الجهد عند أطراف الخلية الجلفانية باستخدام مقياس الفولتميتر التقليدي ، يمكنك الحصول على قيمة الجهد U ، والتي لا تساوي EMF للخلية ، أي يو< ЭДС. Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока и другими эффектами. Поэтому قياس EMFيتم ذلك عادةً بواسطة طريقة التعويض ، حيث يكون التيار المتدفق عبر العنصر صفراً. للقيام بذلك ، يتم توفير EMF بعلامة معاكسة للعنصر من مصدر حالي خارجي. تشتمل دائرة القياس أيضًا على جلفانومتر لقياس التيار وفولتميتر لقياس الجهد. في الوقت الذي يكون فيه جهد الخرج لمصدر التيار الخارجي مساويًا لـ EMF للخلية الجلفانية (لحظة تعويض EMF) ، يكون التيار في الدائرة صفرًا (لا تنحرف إبرة الجلفانومتر). الجهد المقاس في هذه اللحظة بواسطة الفولتميتر عند أطراف الخلية الجلفانية يساوي EMF الخاص بها.
إذا قمنا بفصل عمليات الأكسدة والاختزال مكانيًا ، فيمكن استخدام تفاعل الأكسدة والاختزال لتوليد الطاقة الكهربائية.
الجهاز الذي الطاقة الكيميائيةيتحول إلى كهرباء خلية جلفانية. تتكون الخلية الجلفانية من معدنين مغموسين في محلول إلكتروليت. إذا قمت بتوصيل هذه المعادن بموصل من النوع الأول (سلك معدني) ، فسيتم تكوين تيار كهربائي يظهر نتيجة حدوث عملية الأكسدة والاختزال. الأنود في الخلية الجلفانية هو قطب كهربائي يكون جهده الكهربائي في محلول معين أكثر كهرسلبية. تحدث الأكسدة عند الأنود. الكاثود هو قطب كهربائي مصنوع من معدن أقل نشاطًا. يتم تقليل أيونات المعادن الموجبة أو أيونات الهيدروجين أو الجزيئات المحايدة عند الكاثود. في الخلية الجلفانية ، يُشار إلى القطب الموجب بعلامة ناقص ، والكاثود بعلامة زائد. تظهر الخلية الجلفانية في الشكل.
تُغمر صفيحة الزنك في محلول من كبريتات الزنك ، وتُغمر صفيحة نحاسية في محلول من كبريتات النحاس. تتصل الصفائح بسلك ، ويتم فصل المحاليل بواسطة قسم مسامي لمنع اختلاط المحاليل. تنتقل الإلكترونات على طول الدائرة الخارجية من القطب الموجب إلى الكاثود ، وعلى طول الدائرة الداخلية تتحرك SO4 2- الأنيونات في محلول من النحاس إلى الزنك ، مما يؤدي إلى إغلاق الدائرة الكهربائية للخلية الجلفانية.
تتم كتابة الخلية الجلفانية كدائرة كهروكيميائية:
أ (-) زنك | ZnSO 4 || CuSO4 | النحاس (+) ك
نظرًا لأن جهد القطب الكهربائي للزنك أقل من جهد القطب الكهربائي للنحاس ، سيكون الزنك هو القطب الموجب ، وسيكون النحاس هو القطب السالب. تتأكسد صفيحة الزنك ، ويتم تقليل النحاس من المحلول الموجود على سطح الصفيحة النحاسية.
يجب تسجيل العمليات التي تحدث أثناء تشغيل الخلية الجلفانية:
أ Zn - 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
يسمى أقصى فرق جهد الأقطاب الكهربائية التي يمكن الحصول عليها أثناء تشغيل الخلية الجلفانية القوة الدافعة الكهربائية(emf) للعنصر. إنه يساوي الفرق بين إمكانات التوازن للكاثود والأنود:
EMF = e K - e A
بالنسبة لخلية كهروكيميائية من النحاس والزنك في ظل الظروف القياسية:
EMF = 0.34 - (- 0.76) = 1.1 فولت
لا يتشكل فرق الجهد بين المعادن المختلفة فحسب ، بل أيضًا بين المعادن التي تحمل الاسم نفسه ، حيث يتم تحميلها في محاليل أملاحها بتركيزات مختلفة. تسمى هذه الخلية الجلفانية تركيز. على سبيل المثال ، خلية جلفانية بتركيز النيكل.
(-) ني | NiSO4 || NiSO4 | ني (+)
0.01 مول 0.1 مول
دعونا نكتب عمل مثل هذه الخلية الجلفانية التركيز.
e Ni 2+ / Ni \ u003d e 0 + (0.058 / n) lg (1 * 10-2) \ u003d -0.25 + (0.058 / 2) (-2) \ u003d -0.308 V
e Ni 2+ / Ni \ u003d e 0 + (0.058 / n) lg (1 * 10-1) \ u003d -0.25 + (0.058 / 2) (-1) \ u003d -0.28 V
EMF = -0.28 - (-0.308) = 0.028 فولت
العمليات على الأقطاب الكهربائية:
ج: Ni 0 - 2e - \ u003d Ni 2+
K: Ni 2+ + 2e - \ u003d Ni 0
مهام التحكم
48. احسب EMF لخلية جلفانية من الفضة والكادميوم ، إذا كان تركيز أيونات الفضة في المحلول 0.1 مول / لتر ، وأيونات الكادميوم 0.001 مول / لتر. اكتب معادلات التفاعلات التي تحدث على الأقطاب الكهربائية.
49. قم بعمل رسم بياني لخليتين جلفانيتين ، في إحداهما النيكل هو القطب السالب ، وفي الأخرى الأنود. اكتب معادلات التفاعلات التي تحدث أثناء تشغيل هذه العناصر.
50. احسب المجال الكهرومغناطيسي لخلية كلفانية مكونة من صفائح حديد ورصاص مغموسة في 0.1 مليون محلول من أملاحها. اكتب معادلات التفاعل.
51. احسب EMF لخلية تركيز نيكل جلفانية. تركيز أيونات المعادن في المحاليل هو 1 مول / لتر و 0.0001 مول / لتر. اكتب العمليات التي تحدث عند الأنود والكاثود.
52. ما هي العمليات التي تحدث عند الأقطاب الكهربائية لخلية جلفانية مركزة بالنحاس ، إذا كان أحد الأقطاب الكهربائية يحتوي على تركيز أيونات معدنية يساوي 1 مول / لتر ، والآخر 0.001 مول / لتر. في أي اتجاه تتحرك الإلكترونات في الدائرة الخارجية. ما هو المجال الكهرومغناطيسي؟
53. قم بعمل رسم تخطيطي لخلية كلفانية تتكون من صفائح الزنك والحديد المغمورة في محاليل أملاحها. اكتب معادلات العمليات التي تحدث على أيونات الحديد بحيث يصبح المجال الكهرومغناطيسي للعنصر صفراً عند تركيز أيونات الزنك بمقدار 0.0001 مول / لتر.
54. صفائح الحديد والفضة متصلة بواسطة موصل خارجي ومغمورة في محلول حامض الكبريتيك. قم بعمل رسم تخطيطي لهذه الخلية الجلفانية ، واكتب معادلات التفاعلات التي تحدث على الألواح.
55. ارسم مخططًا لخلية جلفانية تتكون من قطب فضي مغمور في محلول 1M من نترات الفضة وقطب هيدروجين قياسي. اكتب معادلات عمليات القطب. ما هي المجالات الكهرومغناطيسية للعنصر؟
56. في أي اتجاه سوف تتحرك الإلكترونات في الدائرة الخارجية للخلايا الجلفانية التالية
أ) ملغ | مغ 2 + | | Pb 2+ | الرصاص
ب) الرصاص | Pb 2+ | | النحاس 2+ | النحاس
ج) النحاس | النحاس 2+ | | حج 2+ | اي جي
إذا كانت جميع محاليل الإلكتروليت أحادية المولي؟ أي معدن سوف يذوب في كل من هذه الحالات.
57. قم بعمل رسم تخطيطي لخلية كلفانية على أساس التفاعل الجاري وفقًا للمعادلة:
Ni + Pb (NO 3) 2 \ u003d Ni (NO 3) 2 + Pb.
اكتب المعادلات الإلكترونية لعمليات الأنود والكاثود ، واحسب EMF لهذا العنصر في ظل الظروف القياسية.
58. EMF لخلية جلفانية تكونت من صفيحة نحاسية مغمورة في محلول ملح بها تركيز أيونات النحاس يساوي 0.001 مول / لتر والكروم المغمور في محلول ملحها هو 1.05 فولت. تحديد تركيز أيونات الكروم في محلول ملحها. قم بعمل رسم تخطيطي لخلية كلفانية واكتب المعادلات الإلكترونية لعمليات القطب.
59. قم بعمل رسم تخطيطي ، واكتب معادلات عمليات القطب وحساب EMF لخلية كلفانية تتكون من ألواح الكادميوم والمغنيسيوم مغمورة في محاليل أملاحها مع تركيز أيونات معدنية يساوي 1 مول / لتر. هل يتغير EMF لهذه الخلية الجلفانية إذا تم تقليل تركيز كل من الأيونات إلى 0.01 مول / لتر.
60. الكهرومغناطيسي للخلية الجلفانية المكونة من قطب هيدروجين قياسي وقطب كهربائي مغمور في محلول ملح رصاص 1M هو 126mV. عندما يتم إغلاق العنصر ، تتحرك الإلكترونات في الدائرة الخارجية من الرصاص إلى قطب الهيدروجين. ما هي إمكانات قطب الرصاص. ارسم مخططًا لخلية جلفانية واكتب العمليات التي تحدث على الأقطاب الكهربائية.
61. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية الرصاص.
62. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية من النيكل والكادميوم.
63. ما هي العمليات التي تتم على الأقطاب الكهربائية عند شحن وتفريغ بطارية من الحديد والنيكل.
64. قم بعمل رسم تخطيطي لخليتين جلفانيتين في إحداهما يكون الكروم هو الأنود ، وفي الأخرى - الكاثود. اكتب لكل عنصر من هذه العناصر المعادلات الإلكترونية للتفاعلات التي تحدث على الأقطاب الكهربائية.
65. ارسم رسم تخطيطي لخلية كلفانية تتكون من قطب ألومنيوم، مغمورة في محلول 1M من نترات الألومنيوم وقطب هيدروجين قياسي. اكتب معادلات عمليات القطب وحساب EMF للخلية الجلفانية.
66. في أي اتجاه ستتحرك الإلكترونات في الدائرة الخارجية لخلية جلفانية من الألومنيوم والزنك. تركيزات الأيونات في المحاليل 0.1 مول / لتر. قم بعمل رسم تخطيطي لخلية كلفانية ، واكتب المعادلات للعمليات التي تحدث على الأقطاب الكهربائية ، وحساب EMF.
67- في عنصر الفضة والزنك المستخدم لتشغيل معدات مختلفة ، يحدث تفاعل
التحليل الكهربائي
عن طريق التحليل الكهربائيتسمى مجموعة من العمليات التي تحدث عندما يمر تيار كهربائي مباشر عبر نظام يتكون من قطبين ومحلول مصهور أو إلكتروليت. أثناء التحليل الكهربائي ، تتحرك الأيونات الموجبة الشحنة نحو القطب السالب المتصل بالقطب السالب لمصدر تيار مستمر خارجي ، وتتحرك الأيونات سالبة الشحنة إلى القطب الموجب المتصل بالقطب الموجب لمصدر التيار المستمر. على سطح الكاثود هناك عملية اختزال ، على الأنود - الأكسدة.
ضع في اعتبارك التحليل الكهربائي لمصهور كلوريد الصوديوم.
عندما يتم غمر قطبين من الجرافيت المتصلين بمصدر تيار في ذوبان يتكون من أيونات الصوديوم والكلوريد ، ستبدأ حركة موجهة للأيونات في الإلكتروليت ، وستحدث عمليات الأكسدة والاختزال على الأقطاب الكهربائية.
مخطط التحليل الكهربائي لذوبان الصوديوم:
كلوريد الصوديوم \ u003d Na + + Cl -
كاثود (-) (+) أنود
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
معادلة التفاعل العام:
2Na + 2Cl - التحليل الكهربائي 2 Na + Cl 2
التحليل الكهربائي 2NaCl 2Na + Cl 2
في التحليل الكهربائي للمحاليل المائية للشواردتنجذب جزيئات الماء القطبية إلى كل من الكاثود والأنود ، ويمكنها أيضًا المشاركة في العمليات على الأقطاب الكهربائية.
العمليات في الكاثود
يعتمد تسلسل اختزال الأيونات عند الكاثود أثناء التحليل الكهربائي للحلول على قيم جهود القطب القياسية. كلما زادت قيمة جهد القطب الكهربائي للعنصر ، كان استعادته أسهل.
أول ما يتم اختزاله عند الكاثود هو أيونات تلك المعادن التي تكون إمكاناتها هي الأكثر إيجابية. على سبيل المثال ، حل مع أيونات Ag + و H +. يتم استعادة Ag أولاً:
Ag + + e - = Ag 0 e 0 = +0.8 B
لا يتم استرداد الهيدروجين ، لأن إمكاناته أقل.
تعتمد إمكانات المعادن والهيدروجين على تركيزها في المنحل بالكهرباء. لذلك ، ليس من الممكن دائمًا الحكم على تقليل أيونات H + من قيم الإمكانات القياسية. في محلول متعادل ، يكون تركيز أيونات الهيدروجين 10-7 مول / لتر. ووفقًا لصيغة Nernst:
وبالتالي ، يمكن إطلاق الهيدروجين من المحاليل المحايدة فقط عند جهد أقل من -0.41 فولت ، وسيتم إطلاق المعادن الموجودة على الكاثود فقط تلك التي تكون إمكاناتها أكثر إيجابية من الجهد المحتمل -0.41 فولت.
من الناحية العملية ، يتم إطلاق العديد من المعادن (Zn ، Fe ، Cr ، إلخ) من محاليل الهيدروجين ، وتكون قيمة جهود القطب أقل من -0.41V.
هذا بسبب الجهد الزائد للهيدروجين ، أي على سطح معظم المعادن ، يتم إطلاق الهيدروجين بصعوبة. يعتمد حجم الجهد الزائد للهيدروجين على خصائص المعدن وكثافة التيار ودرجة حرارة المنحل بالكهرباء. الجهد الزائد- هذا هو فرق الجهد بين الإمكانات العملية لتطور الهيدروجين والإمكانات النظرية.
مثال.
احتمال إطلاق الزنك في المنحل بالكهرباء متعادل –0.76V ، الهيدروجين –0.41V. يبلغ الجهد الزائد للهيدروجين على الزنك حوالي -0.72 فولت. وبالتالي ، سيتم إطلاق الهيدروجين على الزنك فقط بإمكانية –0.41 + (- 0.72) = - 1.13 فولت. إذا قارنا إمكانات تفريغ الزنك (-0.76 فولت) بإمكانية تفريغ الهيدروجين على الزنك (-1.13 فولت) ، فمن الواضح أنه سيتم إطلاق الزنك. في الواقع ، هذا صحيح ، أثناء التحليل الكهربائي لمحلول محايد من ملح الزنك ، يتم إطلاق الزنك وكمية صغيرة من الهيدروجين.
من خلال عملية معممة على الكاثود ، اعتمادًا على موقع المعدن في سلسلة جهود القطب القياسية ، يتم تمييز ثلاث حالات:
1) أيونات معدنية ، يكون جهد القطب فيها أقل من -1.18 فولت (من Li إلى Mn). يتم استعادة أيونات الهيدروجين:
2 H + 2e - \ u003d H 2 PH< 7
2 H 2 O + 2e - \ u003d H 2 + 2OH - PH> = 7
2) أيونات المعادن التي يتراوح جهد القطب الكهربائي فيها من -1.18 فولت إلى 0.00 فولت (من Mn إلى H) وفي هذه الحالة يتم تقليل أيونات المعادن وأيونات الهيدروجين في وقت واحد:
أنا n + + ne - = أنا 0
2H + 2e - = H 2 PH<7
2H 2 O + 2e - = H 2 + 2OH - PH> = 7
3) أيونات معدنية ، يكون جهد القطب فيها أكبر من 0.0 فولت (من H إلى Au). في هذه الحالة ، يتم تقليل أيونات المعادن فقط
أنا n + + ne - = أنا 0
العمليات في الأنود
للتحليل الكهربائي ، يتم استخدام الأنودات القابلة للذوبان (النشطة) وغير القابلة للذوبان (الخاملة). أثناء التحليل الكهربائي ، تذوب الأنودات القابلة للذوبان والأيونات المعدنية - يمر الأنود إلى المحلول. تصنع الأنودات القابلة للذوبان عادة من المعدن الذي يتعرض ملحه للتحليل الكهربائي.
الأنودات غير القابلة للذوبان لا تشارك في تفاعلات الأكسدة والاختزال. عادة ما تكون هذه الأنودات مصنوعة من الجرافيت والذهب والبلاتين. تتأكسد الأنيونات ذات الإمكانات السلبية على سطحها. هذه هي الأيونات التي لا تحتوي على الأكسجين ، مثل J - و Br - و Cl - و S 2- وغيرها (باستثناء F -)
إذا كان المحلول يحتوي على Cl - ، Br - أيونات ، فإن Br - أيونات سوف تتأكسد على أنود خامل.
2Br - - 2e - = Br 2
2H 2 0-4e - \ u003d O 2 + 4H + (PH<=7)
4OH - 4e - \ u003d 2H 2 O + O 2 (PH> 7)
دعونا ننظر في العديد من حالات التحليل الكهربائي للمحاليل المائية.
مثال.
مخطط التحليل الكهربائي لمحلول مائي من كلوريد النحاس مع الأنود الخامل CuCl 2 \ u003d Cu 2+ + 2Cl -
H 2 O \ u003d H + \ u003d OH -
كاثود (-) Cu 2+ H + (H 2 O) Cl - ، OH - (H 2 O) (+) أنود
نحاس 2 + + 2 هـ - = نحاس 0 2 كلوريد - -2 هـ - = كلوريد 2
النحاس لديه إمكانات أكبر من 0 ، لذلك يتم تقليل المعدن عند الكاثود ، وتتأكسد بقايا الحمض الخالية من الأكسجين عند الأنود.
مثال.
مخطط التحليل الكهربائي لمحلول كبريتات البوتاسيوم مع الأنود الخامل. K 2 SO 4 \ u003d 2K + + SO 4 2
H 2 O \ u003d H + + OH -
كاثود (-) 2K + ، H + (H 2 O) SO 4 2- ، OH (H 2 O) (+) الأنود
2H 2 O + 2e - \ u003d H 2 + 2OH - 2H 2 O - 4e - \ u003d O 2 + 4H +
K + + OH - \ u003d KOH 2H + + SO 4 2- \ u003d H 2 SO 4
نظرًا لأن البوتاسيوم في سلسلة جهود القطب القياسية أقدم بكثير من الهيدروجين ، يتم تقليل الهيدروجين عند الكاثود وتتراكم أيونات OH -
عند الأنود ، ستتأكسد جزيئات الماء وتتراكم أيونات H +. وهكذا ، في الفضاء الكاثودي ، سيكون المنتج الثانوي قلويًا ، وفي الفضاء الأنوديك ، سيكون حمضًا.
مثال.
التحليل الكهربائي لمحلول مائي من كبريتات النيكل مع أنود نشط. Ni SO 4 \ u003d Ni 2+ \ u003d SO 4 2-
H 2 O H + OH -
كاثود (-) Ni 2+ ، H + (H 2 O) SO 4 2- ، OH - (H 2 O) (+) الأنود
Ni 2 + + 2e - = Ni 0 Ni - 2e - = Ni 2+
e 0 Ni \ u003d -0.25V أكبر من احتمال اختزال أيونات الهيدروجين من الماء (-0.41V) ، وبالتالي ، يتم تقليل المعدن ، ويتأكسد معدن الأنود عند الأنود ، نظرًا لأن جهد النيكل يكون أقل بكثير من جهد أكسدة الماء (+ 1.23 فولت).
قوانين التحليل الكهربائي
تتناسب كتلة المنحل بالكهرباء الخاضع للتحول الكيميائي ، وكذلك كتل المواد المنبعثة على الأقطاب وفقًا لقوانين فاراداي ، بشكل مباشر مع كمية الكهرباء التي تمر عبر الإلكتروليت والكتل المولية لمكافئات المواد:
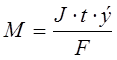 ، أين
، أين
م هي كتلة المنحل بالكهرباء المعرض للتحليل الكهربائي أو كتلة المواد المنبعثة على الأقطاب الكهربائية ، ز ؛
J - القوة الحالية ، أ ؛
الكتلة المولية الإلكترونية لمكافئات المادة ، جم / مول ؛
رقم F من فاراداي - 96500 درجة مئوية ؛
ر هو وقت التحليل الكهربائي ، ث ؛
مهام التحكم
68. عمل معادلات للعمليات التي تحدث أثناء التحليل الكهربائي من NaOH و NiCl 2 يذوب بأقطاب كهربائية خاملة.
69. عمل رسم تخطيطي للتحليل الكهربائي للمحاليل المائية لحمض الكبريتيك ، كلوريد النحاس ، نترات الرصاص مع أقطاب البلاتين.
70. اكتب معادلات عمليات القطب التي تحدث أثناء التحليل الكهربائي للمحاليل المائية لكلوريد الباريوم وكلوريد الحديد (II) مع أقطاب الكربون.
71. قم بعمل رسم تخطيطي للتحليل الكهربائي لمحلول مائي من كلوريد الزنك ، إذا: أ) الأنود هو الزنك ؛ ب) أنود الكربون.
72. ما هو حجم الهيدروجين الذي سينطلق عندما يمر تيار 3 أ خلال محلول مائي من حمض الكبريتيك لمدة ساعة واحدة.
73. أثناء التحليل الكهربائي لمحلول مائي من SnCl 2 ، تم إطلاق 4.48 لتر في الأنود. الكلور (ظروف طبيعية). ما هي المادة وبأي كمية تم إطلاقها عند الكاثود.
74. في أي تسلسل سيتم إطلاق المعادن أثناء التحليل الكهربائي لمحلول يحتوي على كبريتات من النيكل والفضة والنحاس في نفس التركيز. اكتب معادلات العمليات على الأقطاب الكهربائية.
75. قم بعمل رسم تخطيطي للعمليات التي تحدث على أقطاب النحاس أثناء التحليل الكهربائي لمحلول مائي من نترات البوتاسيوم.
76. النحاس غير المكرر يحتوي على شوائب من الفضة والزنك. ماذا يحدث لهذه الشوائب أثناء التنقية الإلكتروليتية للنحاس. اكتب معادلات العمليات على الأقطاب الكهربائية.
77. كم من الوقت سيستغرق تحلل 2 مول من الماء بتيار 2A.
78. مرت محاليل ملح الطعام وفوسفات الصوديوم لبعض الوقت العاصمة. هل سيغير هذا كمية الملح في كلتا الحالتين. حفز إجابتك عن طريق تجميع المعادلات الإلكترونية للعمليات التي تجري على القطب السالب والأنود.
79. أثناء التحليل الكهربائي لمحلول من كبريتات النحاس (II) ، تم إطلاق 0.168 لترًا من الغاز عند القطب الموجب (الظروف العادية) ، وقم بتكوين المعادلات الإلكترونية للعمليات وحساب كمية النحاس التي سيتم إطلاقها عند الكاثود.
80. يؤلف المعادلات الإلكترونية للعمليات التي تحدث أثناء التحليل الكهربائي لمحلول وذوبان KOH.
81. ما هي المواد وبأي كمية سيتم إطلاقها على أقطاب الكربون أثناء التحليل الكهربائي لمحلول NaI لمدة 2.5 ساعة إذا كانت القوة الحالية 6 أ.
82. كم جرام من حامض الكبريتيك يتكون بالقرب من القطب الموجب أثناء التحليل الكهربائي لمحلول كبريتات الصوديوم ، إذا تم إطلاق 1.12 لتر من الأكسجين (عدد غير معروف) عند الأنود ، احسب كتلة المادة المنبعثة عند الكاثود.
83. أثناء التحليل الكهربائي لمحلول نترات الفضة عند الأنود ، تم إطلاق 0.28 لتر من الأكسجين. كم غراما من الفضة برزت عند الكاثود.
84- تذوب أملاح الألومنيوم والزنك والنحاس في الماء بتركيز كاتيونات 1 مول / لتر. يؤلف المعادلات الإلكترونية للعمليات على الأقطاب الكهربائية ويشير إلى تسلسل التفاعلات على القطب السالب.
85- ما هي المنتجات التي يمكن الحصول عليها عن طريق التحليل الكهربائي لمحلول NaNO 3 ، إذا كانت مسافات الأنود والكاثود:
أ) مفصولة بقسم مسامي ؛
ب) لا يتم فصلها ويتم تقليب المحلول.
86. ما هي المنتجات التي سيتم إطلاقها على الكاثود والأنود في المقام الأول أثناء التحليل الكهربائي للمحاليل المائية باستخدام أقطاب الجرافيت ، إذا كان الإلكتروليت يحتوي على خليط من كبريتات النحاس (II) وكلوريد البوتاسيوم.
87- تُغمس صفائح النحاس والفضة في محلول مائي من نترات الفضة. إلى أي قطب من المصدر الحالي يجب توصيل صفيحة نحاسية لتغطيتها بالفضة. اكتب مخططًا لعملية التحليل الكهربائي.
تآكل المعادن
تآكليسمى التدمير التلقائي للمعدن تحت تأثير البيئة. التآكل هو عملية غير متجانسة الأكسدة والاختزال تحدث في الواجهة. وفقًا لآلية عملية التآكل ، يتم تمييز التآكل الكيميائي والكهروكيميائي. التآكل الكيميائيتسمى أكسدة المعدن ولا يصاحبها ظهور تيار كهربائي في النظام. يتم ملاحظة هذه الآلية في تفاعل المعادن مع الغازات العدوانية في درجة حرارة عالية(تآكل الغاز) والسوائل العضوية - غير المنحل بالكهرباء (التآكل في غير المنحل بالكهرباء).
التآكل الكهروكيميائي يسمى تدمير المعدن في بيئة المنحل بالكهرباء ، مصحوبًا بظهور تيار كهربائي داخل النظام.
تحتوي المعادن المستخدمة في الهندسة على شوائب من معادن أخرى ، لذلك ، عند ملامستها لمحلول إلكتروليت ، يتم الحصول على عدد كبير من الخلايا الدقيقة التي تعمل باستمرار على سطحها. يتأكسد المعدن الأكثر نشاطًا ، الأنود ، لتكوين كاتيونات معدنية أو منتجات غير قابلة للذوبان مثل الصدأ. تنتقل الإلكترونات المحررة إلى القطب السالب ، حيث يتم تقليل العامل المؤكسد. الأكسجين المذاب وأيونات الهيدروجين ، أهم العوامل المؤكسدة المسببة للتآكل ، تسمى مزيلات الاستقطاب الكاثودية. يعتمد نوع عملية الاختزال التي ستحدث على الكاثود على تكوين الإلكتروليت.
مثال.
عندما يتلامس الحديد والنحاس في محلول حمض الهيدروكلوريك ، تتشكل خلية جلفانية دقيقة:
AFe | حمض الهيدروكلوريك | النحاس ك
ه 0 Fe / Fe2 + = -0.44B
ه 0 نحاس / نحاس 2 + = + 0.34 ب
الحديد - المعدن الأكثر نشاطًا سيكون الأنود ، والنحاس - الكاثود. يمكن التعبير عن التفاعلات التي تحدث عند الأنود والكاثود على النحو التالي:
1 أ: Fe -2e \ u003d Fe 2+
1 K: 2H + 2e = H 2
تلخيصًا لعمليات الأنوديك والكاثودية ، نحصل على تفاعل الأكسدة والاختزال ، والذي يتسبب حدوثه التلقائي في تآكل المعدن:
Fe + 2H + = Fe 2+ + H 2
Fe + 2HCl \ u003d FeCl 2 + H 2
مثال.
مع تآكل في بيئة محايدةفي حالة عدم وجود الأكسجين المذاب في الماء ، يحدث استقطاب الهيدروجين للكاثود بنفس الطريقة كما في المثال السابق.
دعنا نكتب مخطط الخلية الجلفانية ومعادلات التفاعلات التي تحدث في هذه الخلية الجلفانية:
أ Fe | H 2 O | النحاس ك
1 أ: Fe - 2e \ u003d Fe 2+
1 K: 2H 2 O + 2e \ u003d H 2 + 2OH -
Fe + 2H 2 0 \ u003d Fe 2+ + H 2 + 2OH -
أو في شكل جزيئي: Fe + 2H 2 O = Fe (OH) 2 + H 2
مثال.
عندما يتلامس الحديد مع النحاس في الهواء الرطب ، تتشكل خلية كلفانية.
AFe | H 2 O + O 2 | النحاس ك
ويتم التعبير عن عملية التآكل بالمعادلات التالية:
أ: Fe - 2e = Fe 2+
K: O 2 + 2H 2 O + 4e \ u003d 4OH -
2Fe + O 2 + 2H 2 O \ u003d 2Fe (OH) 2
تحت تأثير الأكسجين الجوي ، يتأكسد الحديد (2) هيدروكسيد وفقًا للمعادلة
4Fe (OH) 2 + O 2 + 2H 2 O = 4Fe (OH) 3
كما يتضح من المثال ، في هذه الحالة يحدث استقطاب الأكسجين للكاثود.
يتم حساب إمكانية إجراء عملية الأكسدة والاختزال العفوية من المجالات الكهرومغناطيسية
EMF = عامل الاختزال - عامل مؤكسد
إذا كان EMF للعملية أكبر من الصفر ، فإن العملية ممكنة.
يمكن أن تتكون الدائرة الكهروكيميائية من قطبين - خلية كلفانية يتم فيها توليد الطاقة الكهربائية بسبب تدفق التفاعلات الكهروكيميائية على الأقطاب الكهربائية. يتم نقل الشحنة عبر حدود الطور (التيار الكهربائي) في مثل هذا النظام بسبب تفاعل كهروكيميائي يحدث تلقائيًا. يسمى القطب الذي يحدث عنده الإلكترود بالكاثود ، ويسمى القطب الذي يحدث فيه الأكسدة الكهربائية بالقطب الموجب.
يسمى القطب الواحد في الخلية الجلفانية أحيانًا نصف الخلية. السمة الكهربائية الرئيسية للدائرة الكهروكيميائية هي اختلاف الجهد الكهربائي بين الأقطاب الكهربائية. يؤدي توصيل الأقطاب الكهربائية بموصل خارجي إلى ظهور تيار كهربائي في الدائرة.
يجب أن تنتهي الدائرة الكهروكيميائية المفتوحة بشكل صحيح ، والتي يمكن في نهايتها قياس فرق الجهد الكهربائي ، بنفس الطريقة دائمًا. التركيب الكيميائيالمعادن . عادة ما يتم تحقيق ذلك ببساطة عن طريق توصيل الأسلاك النحاسية بالمعادن M 1 و M 2 . إن تضمين موصل معدني ثالث بين موصلين معدنيين ، وفقًا لقانون فولتا ، لا يغير فرق الجهد في نهايات الدائرة.
تكون الدائرة الكهروكيميائية في حالة توازن بشرط ملاحظة التوازن الكهروكيميائي عند كل حدود طور ، وفرق الجهد في نهايات الدائرة هيتم تعويضه بالفرق المحتمل من مصدر تيار خارجي.
عند التسجيل التخطيطي لدائرة كهروكيميائية:
1. يتم كتابة القطب الأيسر بترتيب عكسي (يشار إلى المواد الموجودة في المحلول على يمين الشريط العمودي ، بينما يشار إلى المواد التي تشكل مرحلة مختلفة أو مادة القطب إلى اليسار). يتم تسجيل القطب الأيمن بالطريقة المعتادة وفقًا لقواعد التسجيل التخطيطي للأقطاب ؛
2. يتم فصل حلول كلا القطبين بواسطة خط منقط عمودي إذا كانا على اتصال مع بعضهما البعض (لم يتم استبعاد إمكانية الانتشار) أو بواسطة خطين عموديين منقطين إذا تم التخلص من إمكانية الانتشار بين المحلين (على سبيل المثال ، باستخدام جسر الملح).
في دائرة مفتوحة بشكل صحيح ، في نهايات التدوين الشرطي للعنصر ، يتم تسجيل نفس المعدن في الطبيعة. للتبسيط ، غالبًا ما يتم حذفه من تدوين السلسلة.
وفقًا لقاعدة كتابة تفاعل قطب كهربائي ، تتم كتابة الشكل المؤكسد للمادة والإلكترونات على اليسار. ، هو الفرق بين التفاعلات على القطبين الأيمن والأيسر. ثم ، إذا كان فرق الجهد للعنصر بأكمله موجبًا ، فإن التفاعل الكلي والتيار الكهربائي في الخلية الجلفانية يتدفقان من اليسار إلى اليمين ، إذا كان سالبًا ، ثم في الاتجاه المعاكس.
بالنظر إلى أن الامتصاص الكهربائي يحدث عند القطب السالب ، والأكسدة الكهربية تحدث عند الأنود ، ثم في الخلية الجلفانية (عند حدوث عمليات عفوية) ، سيكون القطب السالب قطبًا أكثر حساسية للكهرباء ، ويكون القطب الموجب أكثر كهربيًا. إذا كان العنصر متصلاً بمصدر تيار خارجي وتسبب في عمليات كهروكيميائية قسرية (التحليل الكهربائي) ، فسيكون الكاثود قطبًا كهربيًا أكثر ، وسيكون القطب الموجب كهربائيًا أكثر. لتجنب الالتباس ، غالبًا ما يتم استخدام المصطلحين الكاثود والأنود عند التفكير في التحليل الكهربائي ، وعند التفكير في الخلايا الجلفانية ، يتم استخدام المصطلحين "زائد" و "ناقص" بشكل أكثر شيوعًا لتعيين الكاثود والأنود ، على التوالي.
لنفكر في ثلاث حالات كمثال.
1. كلا القطبين لهما حل مشترك:
نقطة ، ح 2 (د) | حمض الهيدروكلوريك (عبد القدير) | AgCl | اي جي
(1) AgCl + e Ag + Cl - (aq) ؛
(2) 2H + (aq) + 2 e H 2 (d).
التفاعل الكلي الذي يحدث في العنصر
AgCl + 0.5H 2 (د) Ag + HCl (عبد القدير).
إذا كان EMF لهذا العنصر موجبًا ، فسيستمر التفاعل الكلي في الاتجاه الأمامي ، وسيكون القطب الأيمن أكثر إيجابية - زائد (كاثود) ، والقطب الأيسر - أكثر سلبية - ناقص (الأنود).
2. تختلف المحاليل الكهربية وتتصل ببعضها البعض من خلال الغشاء (لا يتم التخلص من إمكانية الانتشار) ؛
قرص مضغوط | Cd (NO 3) 2 (aq) ¦ NaCl (aq) | AgCl | اي جي
تحدث التفاعلات التالية على الأقطاب الكهربائية:
(1) AgCl + e - Ag + Cl - (aq) ؛
(2) قرص مضغوط 2+ (aq) + 2 قرص مضغوط.
AgCl + 1 / 2Cd Ag + 1 / 2Cd 2+ (aq) + Cl - (aq).
3. إن حلول القطب الكهربي مختلفة ومترابطة بواسطة جسر ملح (يتم التخلص من إمكانية الانتشار).
نقطة | ح 2 (د) | حمض الهيدروكلوريك (عبد القدير) || كلوريد الصوديوم (عبد القدير) | AgCl | اي جي
تحدث التفاعلات التالية على الأقطاب الكهربائية:
(1) AgCl + e Ag + Cl - (aq) ؛
(2) 2H + (aq) + 2e - H2 (d).
رد الفعل العام الذي يحدث رسميًا في العنصر
AgCl + 1 / 2H 2 (d) Ag + H + (aq) + Cl - (aq).
تسمى القيمة المحددة للاختلاف في الجهود الكهربائية عندما يميل التيار عبر العنصر إلى الصفر بالقوة الدافعة الكهربائية (EMF) ويُشار إليها بواسطة E.
يتكون المجال الكهرومغناطيسي للخلية الجلفانية من قفزات محتملة عند حدود جميع المراحل التي تشكل الخلية (الشكل 4).
فرق الجهد في نهايات هذه الدائرة هو مجموع ثلاث جهود كلفانية:
![]() . (3.32)
. (3.32)
بشكل عام ، في تكوين المجال الكهرومغناطيسي للخلية الجلفانية ، لا تشارك فقط القفزات المحتملة بين أطوار الأقطاب الكهربائية ، ولكن أيضًا فرق الجهد بين المعادن التي تشكل مرحلة توصيل الإلكترون للأقطاب الكهربائية - ما يسمى جهد الاتصال ، وكذلك فرق الجهد بين مراحل حلول القطب - جهد الانتشار.
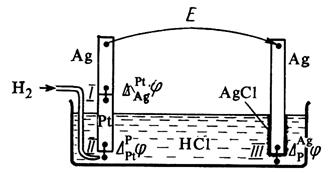
أرز. 4. خلية جلفانية مكونة من الهيدروجين
وأقطاب كلوريد الفضة.
تنشأ إمكانية الانتشار عند حدود حلين بسبب التنقلات المختلفة للأيونات الموجودة في محاليل الإلكترود و / أو تركيزاتها. قد تحتوي الخلية الجلفانية على محلول إلكتروليت مشترك لكلا القطبين. في هذه الحالة ، سيكون احتمال الانتشار غائبًا. في حالات أخرى ، عند إجراء القياسات الكهروكيميائية ، يحاولون التخلص من جهد الانتشار قدر الإمكان. هناك عدة طرق للقضاء على إمكانية الانتشار. أبسطها هو استخدام جسر ملح مملوء بمحلول ملح لتوصيل محاليل من قطبين ، الكاتيونات والأنيونات التي لها نفس القدرة على الحركة تقريبًا (KCl ، KNO 3).
تحدث إمكانية التلامس عندما تكون مراحل توصيل الإلكترون للأقطاب الكهربائية مصنوعة من معادن مختلفة. نظرًا لحقيقة أنه في الوقت الحالي لا توجد طرق تجريبية وحسابية مباشرة لتحديد الجهود الجلفانية عند حدود الطور في خلية كلفانية ، يتم حساب قيمة القوة الدافعة الكهربائية للخلية الجلفانية على أنها الفرق بين إمكانات القطب الشرطي:
ه = هف - هل ، (3.33)
أين هع هو جهد القطب الأيمن ، ه l هي إمكانات اليسار.
سلاسل كيميائية
الخلايا الجلفانية من النوع الأول - الدوائر الكيميائية هي عناصر مكونة من أقطاب كهربائية تحدث عليها تفاعلات كهروكيميائية مختلفة.
يعتمد تشغيل أي عنصر كهروكيميائي على تفاعلات الأكسدة والاختزال العفوية التي تحدث بشكل منفصل: على القطب السالب (الأنود) - الأكسدة ، على القطب الأكثر إيجابية (الكاثود) - الاختزال.
يؤدي توصيل الأقطاب الكهربائية بموصل خارجي إلى ظهور تيار كهربائي في الدائرة. على سبيل المثال ، يتكون عنصر Daniel-Jacobi من قطبين من النوع الأول ، الزنك والنحاس. يوضح الرسم التخطيطي تسلسل اتصالهم:
النحاس | زن | ZnSO 4 (aq) ¦ CuSO 4 (aq) | النحاس.
(1) Cu 2+ (aq) + 2e - Cu ؛
(2) Zn 2+ (aq) + 2e - Zn.
التفاعل الكلي الذي يحدث في العنصر
Zn + Cu 2+ (aq) Cu + Zn 2+ (aq).
EMF لهذا العنصر
أين ![]() .
.
توجد سلاسل كيميائية تحتوي على إلكترولايتين وواحد. تشمل الخلايا الكهروكيميائية التي تحتوي على إلكتروليتين عنصر دانيال جاكوبي الذي تمت مناقشته أعلاه.
يمكن أن تكون الدوائر الكيميائية التي تحتوي على إلكتروليت واحد من نوعين.
في سلاسل من النوع الأول ، يكون أحد الأقطاب الكهربائية قابلاً للانعكاس فيما يتعلق بالكاتيون ، والآخر بالنسبة إلى الأنيون. على سبيل المثال ، العنصر
قرص مضغوط | CdCl 2 (aq) | AgCl | اي جي
يتم استخدامه لتحديد متوسط معامل نشاط المنحل بالكهرباء CdCl 2. احسب EMF لهذا العنصر.
أين هو متوسط نشاط محلول CdCl 2.
في الخلايا الجلفانية من النوع الثاني (مع إلكتروليت واحد) ، يكون كلا القطبين قابلين للانعكاس فيما يتعلق بأحد الأيونات. مثال على ذلك سيكون العنصر
hg | Hg 2 Cl 2 | بوكل (عبد القدير) | الكل 2 (ز) | نقطة
تعبير EMF لهذا العنصر هو:
إذا أنشأت شروطًا بموجبها ، فسيكون EMF لهذا العنصر مساويًا لـ EMF القياسي. يستخدم هذا النوع من الخلايا الجلفانية لتحديد القوة الدافعة الكهربائية القياسية (Eº) للخلية بدقة.
أمثلة على حل المشكلات
مثال 1حدد علامات الأقطاب الكهربائية ونوعها ، واكتب معادلات عمليات الأنود والكاثود ، وإجمالي المعادلات الجزيئية والجزيئية الأيونية للعمليات التي تحدث في خلية كلفانية ، مخططها هو:
Ni½NiSO 4 aq║ CoSO 4 aq½Co.
احسب emf لهذا العنصر إذا كان a = 0.001 م ، أ \ u003d 1 م. الإمكانات القياسية للأقطاب الكهربائية متساوية على التوالي: \ u003d - 0.25 فولت ؛ = - 0.28 V. هل سيعمل هذا العنصر تلقائيًا؟
1. نظرًا لأن الجهد القياسي للقطب الكهربي أكثر إيجابية من الجهد الكهربائي ، فإن علامات الأقطاب الكهربائية هي:
(+) Ni½NiSO 4 aq║ CoSO 4 aq½Co (-).
هذه أقطاب كهربائية من النوع الأول.
2. على قطب كهربائي ذو جهد أكثر إيجابية () ، يتم إطلاق الإلكترونات ، أي عملية الأكسدة. هذا القطب يسمى الأنود.
على قطب يحتوي على جهد أكثر سلبية () ، يتم قبول الإلكترونات ، أي عملية الاسترداد. هذا القطب يسمى الكاثود.
العمليات التي تحدث على الأقطاب الكهربائية في الخلية الجلفانية:
_______________________________
المعادلة الجزيئية:.
3. emf للعنصر هو:
E \ u003d E + - E- \ u003d -.
= + = - 0.28 + (0.059 / 2) lg1 = - 0.28 فولت.
= + = - 0.25 + (0.059 / 2) lg0.001 = - 0.34 فولت.
E \ u003d - 0.28 - (- 0.34) \ u003d 0.06 فولت.
نظرًا لأن EMF للعنصر قيمة موجبة ، يعمل العنصر تلقائيًا منذ ذلك الحين.
مثال 2. مهل يمكن أن يحدث رد الفعل بشكل عفوي؟
ارسم مخططًا للخلية الجلفانية التي يحدث فيها هذا التفاعل. اكتب معادلات العمليات الأنودية والكاثودية ، بالإضافة إلى إجمالي المعادلات الجزيئية والجزيئية الأيونية. حدد EMF لهذا العنصر عندما يكون نشاط الأيونات في المحلول مساويًا 1.
1. لنصنع خلية كلفانية من قطبين من النوع الأول و. وفقًا لبيانات الأدبيات = +0.22 V ، a = -0.40 V ، لذلك تبدو دائرة الخلية الجلفانية كما يلي:
Cd½ CdCl 2 (aq) || BiCl 2 (aq) ثنائية.
2. في الخلية الجلفانية ، على القطب السالب () ، يستمر تفاعل أكسدة الكادميوم ، وفي القطب الموجب () ، يتم إجراء عملية اختزال أيون البزموت:
المعادلة الأيونية الجزيئية:.
المعادلة الجزيئية:.
3. نظرًا لأن أنشطة الأيونات تساوي واحدًا ، فإن جهود القطب الكهربائي ستكون مساوية لإمكانات القطب القياسية. المجالات الكهرومغناطيسية للعنصر هي:
E \ u003d - \ u003d + 0.22 - (-0.40) \ u003d + 0.62 V \ u003e 0.
الدكتور جي = – zFE.لذلك ، د ص جي> 0 ورد الفعل المدروس
قد تحدث بشكل عفوي.
مثال 3احسب عند 298 كلفن EMF للعنصر التالي:
Zn ½ZnCl 2 aq ║ СdCl 2 aq ½Cd
C ¢ \ u003d 0.005 م² \ u003d 2 م
جهد القطب القياسي Cd 2+ ½Cd و Zn 2+ Zn هما على التوالي (-0.402) و (-0.763) V. متوسط معاملات النشاط لـ CdCl 2 و ZnCl 2 في محاليل التركيزات المحددة هي 0.044 و 0.789. هل من الممكن تغيير اتجاه التيار في الخلية عن طريق تغيير تركيز أيونات الكادميوم والزنك في المحاليل؟
المحلول: توجد خلية كهروكيميائية مكونة من قطبين مختلفين من النوع الأول. بمقارنة قيم إمكانات القطب القياسية لهذه الأقطاب الكهربائية ، نرى أن قطب الزنك في هذه الدائرة سالب (E 0 \ u003d - 0.763 V) ، وقطب الكادميوم موجب (E 0 \ u003d - 0.402 V) .
تحدث التفاعلات التالية على الأقطاب الكهربائية:
(-) Zn \ u003d Zn 2+ +2 ،
(+) Cd 2+ +2 = قرص مضغوط.
التفاعل الكلي الذي يحدث أثناء تشغيل عنصر كهروكيميائي:
Zn + Cd 2+ = Zn 2+ + Cd.
القيم المحتملة لكل قطب كهربي تساوي:
![]() ;
;
![]() .
.
قيمة EMF للعنصر هي:
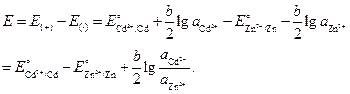
دعونا نستبدل القيم العددية ، مع الأخذ في الاعتبار أن أنشطة الأيونات تساوي متوسط النشاط e للإلكتروليتات المقابلة
أين .
لتغيير اتجاه التيار في العنصر ، من الضروري أن يصبح E (-) أكبر من E (+) ، أي بحيث هأصبحت سلبية. دعونا نحسب أولاً ما هي نسبة أنشطة أيونات الكادميوم والزنك في المحلول ، فإن إمكانات الأقطاب الكهربائية ستصبح متساوية. في هذه الحالة ، سيأخذ EMF قيمة تساوي صفرًا.
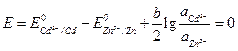 .
.
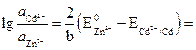
![]() .
.
بالتالي:
 أو .
أو .
تظهر نتيجة الحساب أنه حتى المساواة المحتملة لا يمكن تحقيقها عن طريق تغيير التركيزات ، حيث يجب أن يكون نشاط أيونات الزنك أكبر من 10 12 مرة من نشاط أيونات الكادميوم في المحلول. يكاد يكون من المستحيل تنفيذ مثل هذه الشروط.
مثال 4يُرج محلول مخفف من FeCl 3 في 0.5 مولار هيدروكلوريد (f ± HCl = +0.757) بالزئبق (عند 298 كلفن) ، ويستمر التفاعل
Fe 3+ + Hg + Cl - = Fe 2+ + 1/2 Hg 2 Cl 2
تحديد نسبة الأنشطة / بعد إنشاء التوازن في هذا التفاعل ، إذا كانت جهود القطب القياسية Cl - / Hg 2 Cl 2 ، Hg و
Fe 3+ ، Fe 2+ / Pt نسبة إلى قطب الهيدروجين القياسي هي 0.268 و 0.771 فولت.
المحلول. دعونا نكوّن عنصرًا كهروكيميائيًا يستمر فيه التفاعل الذي تتطلبه الحالة. دعونا نختار أقطاب الحديد كالوميل والاختزال. وفقًا للقيم العددية لإمكانات القطب القياسية ، نستنتج أن قطب الكالوميل سيكون سالبًا وأن قطب أكسدة الحديد سيكون موجبًا. لنكتب السلسلة:
(-) زئبق ، زئبق 2 CI 2 | الكلور - || Fe 3+ ، Fe 2+ | نقطة (+)
تفاعلات القطب التي تحدث في هذا العنصر الكهروكيميائي
(-) Hg + Cl - \ u003d 1/2 Hg 2 Cl 2 + e -
(+) Fe 3+ + e - \ u003d Fe 2+
والتفاعل الكلي الذي يحدث أثناء تشغيل العنصر الكهروكيميائي الذي قمنا بتجميعه ،
Hg + Fe 3+ + Cl - \ u003d Fe 2+ + Hg 2 Cl 2.
بمقارنة هذا التفاعل مع التفاعل المشار إليه في حالة المشكلة والذي يحدث في القارورة عند اهتزاز FeCl3 في HC1 مع الزئبق ، نستنتج أن التفاعلات متطابقة.
لنكتب التعبيرات الخاصة بإمكانيات القطب الكهربي ومجال الكهرومغناطيسي للعنصر:
![]()
 .
.
وفقًا لظروف المشكلة ، يلزم إيجاد نسبة أنشطة أيونات الحديد بعد إنشاء التوازن. نأخذ في الاعتبار أن العنصر الكهروكيميائي يعمل حتى يتم الوصول إلى التوازن ، بينما تصبح EMF مساوية للصفر:

دعونا نعبر عن نسب أنشطة أيونات الحديد من هنا:

بالنظر إلى أن نشاط أيونات الكلوريد يساوي متوسط نشاط كلوريد الهيدروجين
أين ل HCl. من هنا

أسئلة لضبط النفس
1. حدد مصطلح جهد القطب القياسي واشرح سبب اختلاف الجهد بين معدن ومحلول من أملاحه.
2. في مصدر تيار كيميائي
Pt½Fe +2 ، Fe +3 ║ Ag + Ag
رد الفعل يحدث:
Fe +2 (sol.) + Ag + (sol.) = Fe +3 (sol.) + Ag (tv).
ما هو التأثير (الزيادة أو النقصان أو عدم وجود تأثير) الذي يجب أن تحدثه التغييرات التالية على جهد المصدر الحالي:
أ) زيادة تركيز الحديد +3 (سول) ؛
ب) زيادة متزامنة في تركيز Fe +3 (محلول) و Fe +2 (محلول) في نفس العدد من المرات ؛
ج) إضافة الفضة الصلبة.
د) إضافة كمية معينة من كلوريد الصوديوم إلى محلول يحتوي على أيونات الفضة.
3. كيف تحدد اتجاه التحول الكيميائي العفوي في سياق العمليات في عنصر كهروكيميائي؟ أعط إجابة معقولة في أي اتجاه سيستمر رد الفعل تلقائيًا:
4. اشرح معنى علامتي الفصل (½ و) في التمثيل التخطيطي لمصدر تيار كيميائي:
Zn ½ZnSO 4 aq ║ CuSO 4 aq ½Cu
أين هو القطب الموجب في هذه الدائرة وأين هو الكاثود؟ اشرح معنى المصطلحين الأنود والكاثود ووضح على الرسم التخطيطي اتجاه تدفق الإلكترون في الدائرة الخارجية.
5. ماذا يجب أن يحدث عند إدخال الأيونات (على شكل أملاح) في محلول يحتوي على فائض من حامض الكبريتيك المخفف؟ للحصول على شرح ، استخدم قيم إمكانات الأكسدة والاختزال القياسية للأقطاب الكهربائية: = 0.76 فولت ؛ \ u003d 1.52 فولت.
سلاسل التركيز
الخلايا الجلفانية من النوع الثاني - دوائر التركيز هي عناصر مكونة من أقطاب تحدث عليها نفس التفاعلات الكيميائية ، لكن تراكيز المواد المتفاعلة على الأقطاب الكهربائية مختلفة. يتم توليد الطاقة الكهربائية في خلايا التركيز من خلال معادلة تراكيز المواد.
توجد سلاسل تركيز بدون نقل ومع نقل. تسمى العناصر التالية سلاسل التركيز بدون نقل:
أ) بنفس الأقطاب الكهربائية ، ولكن بتركيزات مختلفة من الإلكتروليت في حالة عدم وجود اتصال مباشر بين المحاليل ؛
ب) مع إلكترودات مصنوعة من سبيكة (ملغم) متطابقة في طبيعتها ولكنها مختلفة في التركيز ومغمورة في محلول إلكتروليت واحد ؛
ج) مع أقطاب غاز ، متطابقة في طبيعتها ، ولكن بضغط غاز مختلف (بمحلول إلكتروليت واحد).
مثال على سلسلة التركيز بدون نقل سلسلة تركيز الملغم:
حيث تمثل a1 و a2 أنشطة الكادميوم في الملغم.
تحدث التفاعلات الكهروكيميائية التالية على أقطاب عنصر التركيز هذا:
رد الفعل الكلي في العنصر - ![]() .
.
يتم إنشاء emf لهذا العنصر من خلال معادلة نشاط الكادميوم في الملغم ():
سلاسل التركيز مع النقل هي عناصر التركيز التي يوجد فيها حد اتصال مباشر بين الحلول. عند الحد الفاصل بين محاليل إلكتروليت متطابقة بتركيزات مختلفة ، نتيجة التنقل المختلف للكاتيونات والأنيونات ، ينشأ ما يسمى بقدرة الانتشار
علي سبيل المثال،
النحاس | CuSO 4 ¦ CuSO 4 | النحاس
أين وتوجد الأنشطة المختلفة لأيونات النحاس على الأقطاب الكهربائية ، j D هي إمكانية الانتشار التي تحدث عند حدود الحلول.
لنكتب جهود كلا القطبين:
![]() . (3.38)
. (3.38)
ثم سيكون emf للعنصر
كقاعدة عامة ، يكون الاختلاف في تركيزات المواد على الأقطاب الكهربائية المختلفة لعناصر التركيز صغيرًا ، لذا فإن إمكانات الانتشار تساهم بشكل كبير في إجمالي المجالات الكهرومغناطيسية. هناك العديد من العلاقات لحساب المجالات الكهرومغناطيسية للخلية الجلفانية ، مع مراعاة إمكانية الانتشار.
1. إذا كانت الأقطاب الكهربائية قابلة للانعكاس فيما يتعلق بالكاتيون ، فإن القوة الدافعة الكهربائية للخلية الجلفانية ستكون مساوية لـ:
![]() , (3.40)
, (3.40)
حيث t هو رقم نقل الأنيون ، n هو الإجمالي هعدد جسيمات الصيغة التي تشكل إلكتروليتًا معينًا (العدد الإجمالي للأيونات التي يتحلل فيها الإلكتروليت) ، n + هو عدد جزيئات الصيغة من الكاتيونات (عدد الكاتيونات التي ينفصل فيها الإلكتروليت) التي تشكل هذا المنحل بالكهرباء .
يتم حساب إمكانات الانتشار في هذه الحالة بالعلاقة:.

حيث من 1 \ u003d 0.68 م.
أسئلة لضبط النفس
1. كم عدد الأقطاب الكهربائية التي يمكن تضمينها في عنصر التركيز؟
2. ما هو الفرق بين عناصر التركيز مع النقل الأيوني وعناصر التركيز بدون النقل الأيوني؟
3. يبدو عنصر التركيز كما يلي:
K (Hg) | KCl (aq) | AgCl ، Ag ، AgCl | KCl (aq) | K (Hg)
كم عدد الخلايا الجلفانية التي تحتوي عليها؟ قم بتقييم علامات العناصر التي تضمن التشغيل التلقائي للعنصر. كيف تحسب emf لهذا العنصر؟
4. يشبه عنصر التركيز:
Hg ، HgO | KOH (aq) | KOHaq) | HgO ، Hg.
ما هو نوع عنصر التركيز هذا؟ تقييم علامات الأقطاب الكهربائية التي تضمن التشغيل التلقائي للعنصر. كيف تحسب emf لهذا العنصر؟
5. كيف ترتبط المجالات الكهرومغناطيسية لعنصر بثوابت تفكك الإلكتروليتات CH 3 COOH و HCOOH ؟. ما نوع العناصر الجلفانية التي ينتمي إليها هذا العنصر ولماذا؟
H 2، Pt | CH 3 COOH (aq) | HCOOH (aq) | نقطة ، H2 ،
مختبر # 9
تحديد جهود القطب الكهربائي للمعادن والمجالات الكهرومغناطيسيةالعناصر الجلفانية.
أنا.الأقسام بالطبع النظريبالنسبة التكرار.
ظهور قفزة محتملة عند الواجهات المعدنية - الماء ، المعدن - محلول الملح المعدني. قطب هيدروجين قياسي. مفهوم الخلايا الجلفانية والعمليات التي تحدث على الأقطاب الكهربائية. إمكانات القطب القياسية للمعادن. عدد من جهود القطب القياسية. استنتاجات من موقف المعدن على التوالي. معادلة نرنست. أقطاب كهربائية قابلة للعكس ولا رجوع فيها. أقطاب معدنيةالنوع الأول والثاني ، أقطاب الأكسدة والاختزال ، أقطاب الغاز. أقطاب مرجعية. العناصر الجلفانية الكيميائية والتركيزية. القوة الدافعة الكهربائية(EMF) للخلايا الجلفانية. العمليات التي تحدث على الأقطاب الكهربائية أثناء تشغيل الخلية الجلفانية.
3. أسئلة وتمارين.
1. ما هي احتمالية قطب كهربائي فضي مغمور في محلول ملح فضي مع تركيز
سم = 10-2 مول / لتر؟
2. كيف تعتمد قيمة جهد الهيدروجين على الرقم الهيدروجيني للوسط؟ ما هي إمكانات قطب الهيدروجين عند الرقم الهيدروجيني = I ؛ الرقم الهيدروجيني = 7 ، الرقم الهيدروجيني = 10؟
3. احسب جهد القطب الفضي القياسي فيما يتعلق بما يلي:
أ) قطب كالوميل مشبع ،
ب) النحاس المشبع - قطب الكبريتات ،
ج) قطب كلوريد الفضة المشبع؟
4. قم بعمل مخططات للخلايا الجلفانية التي تحدث فيها التفاعلات:
أ) 2اي جي+ + النحاس 0 → اي جي 0 + النحاس+2
ب)قرص مضغوط 0 + CuSO4 → CdSO4 + النحاس
5. تحديد قيمة المجالات الكهرومغناطيسية وبيان العمليات التي تحدث على الأقطاب الكهربائية في الخلايا الجلفانية التالية:
لكن)Zn / ZnSO4 //CDSO4 / C.د
ب)صب/ صب(رقمح) 2) //AgNO3 /اي جي
6. احسب EMF للخلية الجلفانية ذات التركيز التالي:
لكن)Zn/ ZnCI2 // ZnCI2 / Zn
0.01 مول / لتر 1.0 مول / لتر
أي قطب هو الأنود وما هو الكاثود؟
3. جزء تجريبي
1. تحديد قيمة جهد القطب القياسي للزنك.
قم بتجميع قطب الزنك (Zn/ ZnSO4 ) ، عن طريق غمر قضيب زنك جيد الصنفرة في محلول ملحي بتركيز أيون الزنك I mol / l.
أرز.أنا. مخطط التثبيت لتحديد قيمة الجهد الكهربائي للمعدن.
1 - فحص قطب كهربائي (زنك ، نحاس ، إلخ)
2 - مرجع كلوريد الفضة القطب
3 - مقياس الجهد.
4 - كأس من محلول كلوريد البوتاسيوم المشبع
وفقًا للشكل 1 ، قم بتجميع خلية كلفانية من قطب الزنك الذي تم فحصه (Zn/ ZnSO4 ) والقطب المرجعي المشبع من كلوريد الفضة (بوكل/ AgCl/ اي جي) :
التدوين الشرطي لهذه الخلية الجلفانية:
(-) Zn / ZnSO4 // KCl / AgCl / Ag(+)
للقيام بذلك ، يتم غمر فوهات الأقطاب الكهربائية في كوب بمحلول من كلوريد البوتاسيوم ، ويتم توصيل الأقطاب الكهربائية نفسها بالمطاريف المقابلة لمقياس الجهد باستخدام أسلاك توصيل.
تبلغ احتمالية القطب المرجعي لكلوريد الفضة المشبع فيما يتعلق بإلكترود الهيدروجين القياسي + 0.201V.
اكسل. سر. نحن.= + 0.201V أو 201mV.
وفقًا للتعليمات الخاصة بإجراء القياس ، باستخدام مقياس جهد مناسب ، حدد EMF للخلية الجلفانية المكونة وإمكانات قطب الزنك باستخدام قطب كلوريد الفضة المشبع.
معرفة قيمة جهد القطب المرجعي ، وحساب قيمة الجهد الكهربائي للزنك بالنسبة لقطب الهيدروجين القياسي. قارن القيمة الناتجة بقيمة الجدول:
ه0 = - 0,76 ب.
اكتب القيم التي تم العثور عليها:
القيمة المقاسة لـ E.D.S. خلية جلفانية ، تتكون من قطب كهربائي قياسي من الزنك وقطب مرجعي مشبع من كلوريد الفضة:
د. (Zn/ ZnSO4 // بوكل/ AgCl/ اي جي) =
القيمة التجريبية لإمكانات قطب زنك قياسي فيما يتعلق بقطب مرجعي مشبع بكلوريد الفضة:
ه ( ) بالكلور - تشبع الفضة .. =
القيمة التجريبية لإمكانات قطب الزنك القياسي فيما يتعلق بإلكترود مرجعي للهيدروجين القياسي:
ه ( ) وفقًا لمعيار الهيدروجين. =
انتباه! نظرًا للسمية العالية لأملاح المعادن الثقيلة ، لا يتم تصريف جميع المحاليل المستهلكة في الحوض ، ولكن يتم تسليمها إلى مساعد المختبر للتخلص منها لاحقًا.
2. تحديد قيمة جهد القطب القياسي للنحاس.
كما في الخطوة الأولى ، قم بتجميع القطب النحاسي عن طريق غمر قضيب النحاس المجرد في محلول كبريتات النحاس IM.
يؤلف خلية كلفانية من القطب النحاسي الذي تم فحصه وقطب مرجعي مشبع من كلوريد الفضة.
حدد المجالات الكهرومغناطيسية للخلية الجلفانية. أعط تدوينًا شرطيًا لهذه الخلية الجلفانية.
ما هو جهد القطب النحاسي عبر القطب المشبع بكلوريد الفضة؟
احسب إمكانات القطب النحاسي فيما يتعلق بقطب الهيدروجين القياسي وقارنه بقيمة الجدول لإمكانات القطب النحاسي القياسي:
ه0 = 0,34 ب
اكتب القيم التي تم العثور عليها:
د. (منش/ CuSO4 // بوكل/ AgCl/ اي جي) =
ه() بالكلور - تشبع الفضة .. =
ه() بواسطة قطب الهيدروجين القياسي =
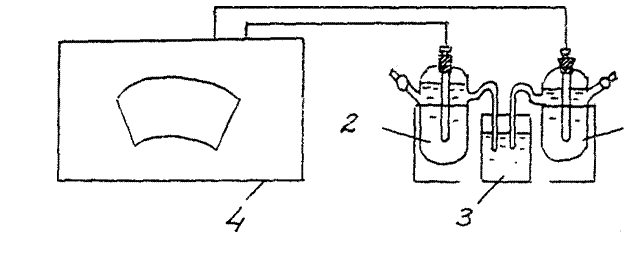
3. التعريف مادة كيميائية EMFعنصر كلفاني. (عنصر جلفاني من النحاس والزنك).
قم بتجميع خلية كلفانية مكونة من أقطاب كهربائية قياسية من الزنك والنحاس (الشكل 2).
(جش/ CuSO4 // Zn/ ZnSO4 ) إكسب. = ……… ..
قارن القيمة التي تم الحصول عليها في التجربة مع القيمة المحسوبة (النظرية) قيمة EMFلخلية النحاس والزنك الجلفانية:
نظرية EMF. =ه الكاثود- الأنود الكهربائي =
= E0 (Cu + 2 / Cu0) - E0 (Zn + 2 / Zn0) = 0.34 - (- 0.76) = 1.1B.
 الشكل 2 مخطط التركيب لتحديد المجالات الكهرومغناطيسية لخلية كيميائية كلفانية:
الشكل 2 مخطط التركيب لتحديد المجالات الكهرومغناطيسية لخلية كيميائية كلفانية:
1- قطب نحاسي 2- قطب من الزنك
3 - مفتاح كهربائيا (زجاج به محلول كلوريد البوتاسيوم) ،
4 - مقياس الجهد
اكتب معادلات العمليات التي تحدث على القطب السالب والأنود لخلية جلفانية معينة أثناء تشغيلها.
4. تحديد المجالات الكهرومغناطيسية لخلية كلفانية تركيز.
قم بتجميع خلية كلفانية مكونة من قطب كهربي قياسي من الزنك (قطب كهربائي مغمور في محلول ملح الزنك بتركيز 1 مول / لتر) وقطب كهربي من الزنك مغمور في محلول ملح الزنك بتركيز C = 10-2 مول / لتر (تين. 3).
Zn/ ZnSO4 // Zn/ ZnSO4
سم = 10-2 مول / لتر سم = 10-2 مول / لتر
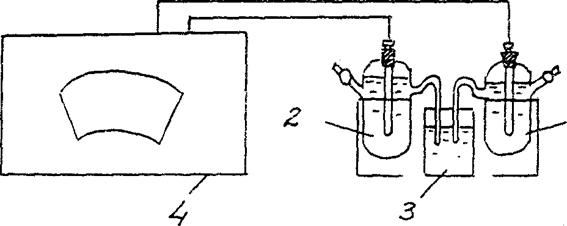
الشكل 2 مخطط التثبيت لتحديد EMF لخلية تركيز كلفانية:
1 - قطب الزنك في محلول ملحي مع سم = 10-2 مول / لتر ,
2 - قطب الزنك في محلول ملحي مع سم = 1 مول / لتر
3 - مفتاح التحليل الكهربائي (محلول كلوريد البوتاسيوم) ،
4 - مقياس الجهد
وفقًا للتعليمات الخاصة بترتيب القياسات باستخدام مقياس الجهد المناسب ، حدد EMF لهذه الخلية الجلفانية.
(جش/ CuSO4 // Zn/ ZnSO4 ) إكسب. = ……… ..
قارن القيمة التي تم الحصول عليها في التجربة مع قيمة EMF المحسوبة (النظرية) لخلية جلفانية بتركيز معين.




