Фенолът се образува чрез взаимодействие. Получаване на фенол
1. Феноли- производни на ароматни въглеводороди, в молекулите на които хидроксилната група (-ОН) е директно свързана с въглеродните атоми в бензеновия пръстен.
2. Класификация на фенолите
Има едно-, дву-, три-атомни феноли в зависимост от броя на ОН групите в молекулата:
В съответствие с броя на кондензирани ароматни цикли в молекулата се разграничават самите феноли (един ароматен пръстен - производни на бензол), нафтоли (2 кондензирани пръстена - нафталинови производни), антраноли (3 кондензирани пръстена - антраценови производни) и фенантрол:
3. Изомерия и номенклатура на фенолите
Има 2 вида изомерия:
- изомерия на позицията на заместителите в бензеновия пръстен
- изомерия на страничната верига (структури на алкиловия радикал и брой радикали)
За фенолите широко се използват тривиални имена, които са се развили исторически. Префикси се използват и в имената на заместени моноядрени феноли орто-,мета-и двойка -,използвани в номенклатурата на ароматните съединения. За по-сложни съединения атомите, които изграждат ароматните пръстени, са номерирани и позицията на заместителите се обозначава с помощта на цифрови индекси.
4. Структурата на молекулата
Фениловата група C6H5- и хидроксил-OH взаимно си влияят
- самотната електронна двойка на кислородния атом е привлечена от 6-електронния облак на бензеновия пръстен, поради което връзката O–H е още по-поляризирана. Фенолът е по-силна киселина от водата и алкохолите.
- В бензоловия пръстен симетрията на електронния облак се нарушава, електронната плътност нараства в позиции 2, 4, 6. Това прави връзките С-Н в позиции 2, 4, 6 по-реактивни и - връзките на бензеновия пръстен.
5. Физични свойства
Повечето едноатомни феноли при нормални условия са безцветни кристални вещества с ниска точка на топене и характерна миризма. Фенолите са слабо разтворими във вода, лесно разтворими в органични разтворители, токсични и постепенно потъмняват при съхранение на въздух в резултат на окисляване.
Фенол C6H5OH (карболова киселина ) - безцветно кристално вещество се окислява във въздуха и става розово, при обикновени температури е слабо разтворимо във вода, над 66 ° C се смесва с вода във всяко съотношение. Фенолът е токсично вещество, причинява изгаряния на кожата, е антисептик.
6. Токсични свойства
Фенолът е отровен. Причинява дисфункция на нервната система. Прах, пари и разтвор на фенол дразнят лигавиците на очите, дихателните пътища и кожата. Веднъж попаднал в тялото, фенолът се абсорбира много бързо дори през непокътнати кожни участъци и след няколко минути започва да действа върху мозъчната тъкан. Първо, има краткотрайно възбуждане, а след това парализа на дихателния център. Дори при излагане на минимални дози фенол се наблюдават кихане, кашлица, главоболие, виене на свят, бледност, гадене и загуба на сила. Тежките случаи на отравяне се характеризират с безсъзнание, цианоза, задух, нечувствителност на роговицата, бърз, едва забележим пулс, студена пот, често гърчове. Често фенолът е причина за рак.
7. Приложение на феноли
1. Производство на синтетични смоли, пластмаси, полиамиди
2. Лекарства
3. Оцветители
4. ПАВ
5. Антиоксиданти
6. Антисептици
7. Експлозиви
8. Получаване на фенол в индустрия
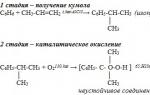
едно). Кумолен метод за производство на фенол (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Предимства на метода: безотпадна технология (добив на полезни продукти > 99%) и икономичност. В момента методът на кумола се използва като основен в световното производство на фенол.

2). От каменовъглен катран (като страничен продукт - нисък добив):
C 6 H 5 ONa + H 2 SO 4 (razb) → C 6 H 5 - OH + NaHSO 4
натриев фенолат
(изображение на продуктаботуши от смоласода каустик)
3). От халобензоли :
От 6 H5-Cl + NaOH т , стр→ C6H5 - OH + NaCl
4). Сливане на соли на ароматни сулфонови киселини с твърди основи :
C6H5-SO3Na + NaOH т → Na2SO3 + C6H5 - OH
натриева сол
бензенсулфонови киселини
9. Химични свойства на фенола (карболовата киселина)
аз . Свойства на хидроксилната група
Киселинни свойства- са по-изразени от тези на наситените алкохоли (цветът на индикаторите не се променя):
- с активни метали-
2C 6 H 5 -OH + 2Na → 2C 6 H 5 -ONa + H 2
натриев фенолат
- С алкали-
C6H5-OH + NaOH (воден разтвор)↔ C 6 H 5 -ONa + H 2 O
! Фенолати - соли на слаба карболова киселина, разложени от въглеродна киселина -
C6H5-ONa + H2O +СO 2 → C 6 H 5 -OH + NaHCO 3
По киселинни свойства фенолът е 10 пъти по-добър от етанола. В същото време той е по-нисък от оцетната киселина със същото количество. За разлика от карбоксилните киселини, фенолът не може да измести въглеродната киселина от нейните соли.
° С 6 Х 5 - ох + NaHCO 3 = реакцията не протича - тъй като е напълно разтворим във водни разтвори на алкали, той всъщност не се разтваря във воден разтвор на натриев бикарбонат.
Киселинните свойства на фенола се засилват под въздействието на електроноотвличащи групи, свързани с бензоловия пръстен ( НЕ 2 - , Бр - )
2,4,6-тринитрофенолът или пикриновата киселина е по-силна от въглеродната
II . Свойства на бензоловия пръстен
1). Взаимното влияние на атомите в фенолната молекула се проявява не само в поведението на хидроксилната група (виж по-горе), но и в по-голямата реактивност на бензеновия пръстен. Хидроксилната група увеличава електронната плътност в бензеновия пръстен, особено в орто-и двойка-разпоредби (+ М-ефект на OH-групата):
Следователно фенолът е много по-активен от бензола в реакциите на електрофилно заместване в ароматния пръстен.
- Нитриране. Под действието на 20% азотна киселина HNO 3 фенолът лесно се превръща в смес орто-и двойка-нитрофеноли:
При използване на концентрирана HNO 3 се образува 2,4,6-тринитрофенол ( пикринова киселина):
- Халогениране. Фенолът лесно взаимодейства с бромната вода при стайна температура, за да образува бяла утайка от 2,4,6-трибромофенол (качествена реакция за фенол):
- Кондензация с алдехиди. Например:
2). Фенолно хидрогениране
C6H5-OH + 3H2 Ni, 170º° С→ C6H11 - OH циклохексил алкохол (циклохексанол)
феноли -органични вещества, чиито молекули съдържат фенилов радикал, свързан с една или повече хидроксо групи. Точно като алкохолите феноли класифициратпо атомност, т.е. по броя на хидроксилните групи.
Едноатомни фенолисъдържат една хидроксилна група в молекулата:

Многовалентни фенолисъдържат повече от една хидроксилна група в молекулите:

Съществуват и многовалентни феноли, съдържащи три или повече хидроксилни групи в бензеновия пръстен.
Нека се запознаем по-подробно със структурата и свойствата на най-простия представител на този клас - фенол C 6 H 5 OH. Името на това вещество е в основата на името на целия касов апарат - феноли.
Физични свойства на фенола
Фенолът е твърдо безцветно кристално вещество, точка на топене=43°C, точка на кипене=181°C, с остра характерна миризма.Отровен.Фенолът се разтваря леко във вода при стайна температура. Водният разтвор на фенол се нарича карболова киселина. При контакт с кожата причиняваизгаряния, следователно с фенол трябва да се работи много внимателно!
Химични свойства на фенола
 Фенолите са по-активни в повечето реакции на O–H връзки, тъй като тази връзка е по-полярна поради изместването на електронната плътност от кислородния атом към бензеновия пръстен (участие на самотната електронна двойка на кислородния атом в p-конюгирането система). Киселинността на фенолите е много по-висока от тази на алкохолите. За фенолите реакциите на разкъсване на C-O връзката не са типични, тъй като кислородният атом е здраво свързан с въглеродния атом на бензеновия пръстен поради участието на неговата самотна електронна двойка в системата за конюгиране. Взаимното влияние на атомите в молекулата на фенола се проявява не само в поведението на хидроксилната група, но и в по-голямата реактивност на бензеновия пръстен. Хидроксилната група увеличава електронната плътност в бензеновия пръстен, особено в орто и пара позиции (ОН групи)
Фенолите са по-активни в повечето реакции на O–H връзки, тъй като тази връзка е по-полярна поради изместването на електронната плътност от кислородния атом към бензеновия пръстен (участие на самотната електронна двойка на кислородния атом в p-конюгирането система). Киселинността на фенолите е много по-висока от тази на алкохолите. За фенолите реакциите на разкъсване на C-O връзката не са типични, тъй като кислородният атом е здраво свързан с въглеродния атом на бензеновия пръстен поради участието на неговата самотна електронна двойка в системата за конюгиране. Взаимното влияние на атомите в молекулата на фенола се проявява не само в поведението на хидроксилната група, но и в по-голямата реактивност на бензеновия пръстен. Хидроксилната група увеличава електронната плътност в бензеновия пръстен, особено в орто и пара позиции (ОН групи)
Киселинни свойства на фенола
Водородният атом на хидроксилната група е кисел. Защото Тъй като киселинните свойства на фенола са по-изразени от тези на водата и алкохолите, фенолът реагира не само с алкални метали, но и с основи, за да образува фенолати:

Киселинността на фенолите зависи от естеството на заместителите (донор или акцептор на електронна плътност), позицията спрямо ОН групата и броя на заместителите. Най-голямо влияние върху OH-киселинността на фенолите оказват групите, разположени в орто- и пара-положения. Донорите увеличават силата на O-H връзката (като по този начин намаляват подвижността на водорода и киселинните свойства), акцепторите намаляват силата на O-H връзката, докато киселинността се увеличава:

Въпреки това, киселинните свойства на фенола са по-слабо изразени от тези на неорганичните и карбоксилните киселини. Така например киселинните свойства на фенола са около 3000 пъти по-ниски от тези на въглеродната киселина. Следователно, чрез преминаване на въглероден диоксид през воден разтвор на натриев фенолат, може да се изолира свободен фенол.

Добавянето на солна или сярна киселина към воден разтвор на натриев фенолат също води до образуването на фенол:

Качествена реакция към фенол
Фенолът реагира с железен(3) хлорид, за да образува интензивно лилаво комплексно съединение. Тази реакция позволява да бъде открита дори в много ограничени количества. Други феноли, съдържащи една или повече хидроксилни групи в бензеновия пръстен, също дават ярък синьо-виолетов цвят в реакция с железен(3) хлорид.
Реакции на бензоловия пръстен на фенола
Наличието на хидроксилен заместител значително улеснява протичането на реакциите на електрофилно заместване в бензеновия пръстен.
- Бромиране на фенол.За разлика от бензола, фенолното бромиране не изисква добавяне на катализатор (желязо(3) бромид). В допълнение, взаимодействието с фенола протича селективно (селективно): бромните атоми се изпращат до орто-и двойка-позиции, заместващи разположените там водородни атоми. Селективността на заместването се обяснява с особеностите на електронната структура на фенолната молекула, обсъдени по-горе.
Така че, когато фенолът взаимодейства с бромна вода, се образува бяла утайка от 2,4,6-трибромофенол:

Тази реакция, както и реакцията с железен(3) хлорид, служи за качествено откриване на фенол.
2.Нитриране на фенолсъщо се случва по-лесно от нитрирането на бензола. Реакцията с разредена азотна киселина протича при стайна температура. Резултатът е смес орто-и paroизомери на нитрофенол:

При използване на концентрирана азотна киселина, 2,4,6, тринитрифенол-пикринова киселина, се образува експлозив:

3. Хидрогениране на ароматния пръстен на фенолав присъствието на катализатор преминава лесно:

4.Поликондензация на фенол с алдехиди,по-специално, с формалдехид се случва с образуването на реакционни продукти - фенол-формалдехидни смоли и твърди полимери.
Взаимодействието на фенол с формалдехид може да се опише по схемата:

Молекулата на димера задържа „подвижни“ водородни атоми, което означава, че реакцията може да продължи по-нататък с достатъчно количество реагенти:

Реакция поликондензация,тези. реакцията на производство на полимер, протичаща с освобождаването на нискомолекулен страничен продукт (вода), може да продължи по-нататък (докато един от реагентите не се изразходва напълно) с образуването на огромни макромолекули. Процесът може да бъде описан с общото уравнение:

Образуването на линейни молекули става при обикновена температура. Провеждането на същата реакция по време на нагряване води до факта, че полученият продукт има разклонена структура, той е твърд и неразтворим във вода.В резултат на нагряване на линейна фенол-формалдехидна смола с излишък от алдехид, твърди пластични маси с уникални се получават свойства. Полимерите на базата на фенолформалдехидни смоли се използват за производството на лакове и бои, пластмасови изделия, които са устойчиви на нагряване, охлаждане, вода, алкали, киселини.Имат високи диелектрични свойства. Полимерите на базата на фенолформалдехидни смоли се използват за направата на най-критичните и важни части на електрически уреди, корпуси на силови агрегати и машинни части, полимерна основа на печатни платки за радиоустройства. Лепилата на базата на фенол-формалдехидни смоли са в състояние да свързват надеждно части от различно естество, поддържайки най-високата якост на свързване в много широк температурен диапазон. Такова лепило се използва за закрепване на металната основа на осветителните лампи към стъклена крушка.По този начин фенолът и продуктите на негова основа са широко използвани.
Използването на феноли
Фенолът е твърдо вещество с характерна миризма, която причинява изгаряния, когато влезе в контакт с кожата. Отровен. Разтваря се във вода, разтворът му се нарича карболова киселина (антисептик). Тя беше първият антисептик, въведен в хирургията. Широко се използва за производство на пластмаси, лекарства (салицилова киселина и нейните производни), багрила, експлозиви.
фенол, химикал с органичен произход, принадлежи към групата на ароматните въглеводороди.
През 1842 г. френският органичен Огюст Лоран успява да изведе формулата на фенола (C6H5OH), състояща се от бензенов пръстен и хидрокси група ОН. Фенолът има няколко имена, които се използват както в научната литература, така и в разговорната реч и произлизат от състава на това вещество. По този начин фенолът често се нарича оксибензолили карболова киселина.
Фенолът е отровен. Прах и разтвор на фенол дразнят лигавиците на очите, дихателните пътища и кожата. Притежава леко киселинни свойства, под действието на алкали образува соли - фенолати. Под действието на брома се образува трибромофенол, който се използва за получаване на антисептик - ксероформ. Бензеновото ядро и ОН групата, комбинирани в молекулата на фенола, си влияят взаимно, увеличавайки значително реактивността на другия. От особено значение са реакциите на кондензация на феноли с алдехиди и кетони, в резултат на които се получават полимерни продукти.
Физични свойства на фенола
Химични свойства на фенола
Фенолът е бяло кристално вещество с характерна остра сладкаво-сладка миризма, която лесно се окислява при излагане на въздух, като първо става розово, а след известно време и наситен кафяв цвят. Характеристика на фенола е неговата отлична разтворимост не само във вода, но и в алкохол, алкална среда, бензол и ацетон. Освен това фенолът има много ниска точка на топене и лесно се втечнява при +42°C, а също така има слаби киселинни свойства. Следователно, когато взаимодейства с основи, фенолът образува соли, наречени фенолати.
В зависимост от производствената технология и предназначението, фенолът се произвежда в три класа: A, B и C съгласно GOST 23519-93. По-долу са техническите му спецификации.
Технически характеристики на фенола съгласно GOST 23519-93
|
Име на индикатора |
смисъл | ||
| Клас А | Марк Б | Степен Б | |
| Външен вид | Бяла кристална вещество |
Бял кристал - чески в-в. Позволен розово или жълтеникав оттенък |
|
| Температура на кристализация, °С, не по-ниска | 40,7 | 40,6 | 40,4 |
| Масова част на нелетливия остатък, %, макс | 0,001 | 0,008 | 0,01 |
| Оптическа плътност на воден разтвор на фенол (8,3 g марка A, 8,0 g марка B, 5,0 g марка C в 100 cm3 вода) при 20 °C, не повече |
0,03 | 0,03 | 0,03 |
| Оптична плътност на сулфонирания фенол, не повече от | 0,05 | Не рационирайте | |
| Цветът на фенолната стопилка според платина-кобалт скала, единици на Hazen: |
|||
| от производителя, не повече | 5 | Не рационирайте | |
| при потребителя: | |||
| по време на тръбопроводен транспорт и резервоари от неръждаема стомана, не повече |
10 | Един и същ | |
| при транспортиране в резервоари, изработени от въглерод стомана и поцинкована, не повече |
20 | >> | |
| Масова част на водата, %, не повече | 0,03 | Не рационирайте | |
| Масова част от общите органични примеси, %, макс | 0,01 | Не рационирайте | |
| включително мезитил оксид, %, не повече | 0,0015 | 0,004 | Не рационирайте |
| суми от -метилстирол и изопропилбензен (кумол), %, макс | Не рационирайте | 0,01 | Един и същ |
Методи за получаване на фенол
В чиста форма фенолът не се среща в природата, той е изкуствен продукт на органичната химия. В момента има три основни начина за получаване на фенол в промишлен мащаб. Основният дял от производството му пада върху така наречения cumpole метод, който включва окисляване на ароматното органично съединение изопропилбензен с въздух. В резултат на химическа реакция се получава кумпол хидропероксид, който при взаимодействие със сярна киселина се разлага до ацетон, последвано от утаяване на фенол под формата на кристална утайка. За производството се използва и метилбензол (толуен), в резултат на чието окисляване се образува този химикал и бензоена киселина. Освен това в някои отрасли, като производството на металургичен кокс, фенолът се отделя от каменовъглен катран. Този метод на производство обаче е нерентабилен поради повишената консумация на енергия. Сред най-новите постижения на химическата индустрия са производството на фенол чрез взаимодействието на бензол и оцетна киселина, както и окислителното хлориране на бензола.
За първи път в промишлени обеми фенолът е получен от немската компания BASF през 1899 г. чрез сулфониране на бензол със сярна киселина. Технологията на неговото производство се състоеше във факта, че впоследствие сулфоновата киселина беше подложена на алкално топене, в резултат на което се образува фенол. Този метод се използва повече от 100 години, но през втората половина на 20-ти век химическата индустрия е принудена да го изостави поради огромното количество отпадъци от натриев сулфит, който е страничен продукт от органичния синтез на фенол.
През първата половина на 20-ти век американската компания Dow Chemical въвежда друг метод за производство на фенол чрез хлориране на бензол, наречен процес на Рашиг. Методът се оказа доста ефективен, тъй като специфичното тегло на полученото вещество достигна 85%. Впоследствие същата компания въвежда метода за окисляване на метилбензол с последващо разлагане на бензоена киселина, но поради проблемното дезактивиране на катализатора днес той се използва от около 3-4% от химическата индустрия.
Най-ефективният е cumpole методът за производство на фенол, който е разработен от съветския химик Пьотър Сергеев и пуснат в производство през 1942 г. Първият завод за кумпол, построен през 1949 г. в град Дзержинск, област Горки, успя да осигури една трета от търсенето на фенол в СССР.
Обхват на фенола
Първоначално фенолът се използва за производство на различни видове багрила, поради способността му да променя цвета си по време на окисляване от бледорозов до кафяв оттенък. Този химикал се намира в много видове синтетични бои. Освен това свойството на фенола да унищожава бактерии и микроорганизми е възприето в кожената индустрия при дъбене на животински кожи. По-късно фенолът се използва успешно в медицината като едно от средствата за дезинфекция и дезинфекция на хирургически инструменти и помещения, и като 1,4% воден разтвор - като аналгетик и антисептик за вътрешна и външна употреба. Освен това фенолът на салициловата киселина е в основата на аспирина, а нейното производно, парааминосалициловата киселина, се използва за лечение на пациенти с туберкулоза. Фенолът също е част от мощно слабително лекарство – пурген.
В момента основното предназначение на фенола е химическата промишленост, където това вещество се използва за производството на пластмаси, фенол-формалдехидни смоли, изкуствени влакна като найлон и найлон, както и различни антиоксиданти. Освен това фенолът се използва за производството на пластификатори, добавки за масла и е един от компонентите, които съставляват продуктите за растителна защита. Фенолът се използва активно и в генното инженерство и молекулярната биология, като средство за пречистване и изолиране на ДНК молекули.
Вредните свойства на фенола
Почти веднага след получаването на фенол учените установиха, че този химикал не само има полезни свойства, което му позволява да се използва в различни области на науката и производството, но е и мощна отрова. Така че вдишването на фенолни пари за кратко време може да доведе до дразнене на назофаринкса, изгаряния на дихателните пътища и последващ белодробен оток с фатален изход. Когато разтвор на фенол влезе в контакт с кожата, се образуват химически изгаряния, които впоследствие се трансформират в язви. Ако повече от 25 процента от кожата се третира с разтвор, това може да причини смърт на човек. Поглъщането на фенол в организма с питейна вода води до развитие на пептична язва, мускулна атрофия, нарушена координация на движенията и кървене. Освен това учените са установили, че фенолът е причина за рак, допринася за развитието на сърдечна недостатъчност и безплодие.
Поради свойството на окисляване, изпаренията на този химикал напълно се разтварят във въздуха след около 20-25 часа. Когато се отдели в почвата, фенолът запазва токсичните си свойства през целия ден. Въпреки това, във вода, неговата жизнеспособност може да достигне 7-12 дни. Следователно, най-вероятният път за навлизане на това токсично вещество в човешкото тяло и върху кожата е замърсената вода.
В състава на пластмасите фенолът не губи своите летливи свойства, поради което използването на фенолни пластмаси в хранително-вкусовата промишленост, производството на предмети за бита и детски играчки днес е строго забранено. Използването им също не се препоръчва за довършване на жилищни и офис помещения, където човек прекарва поне няколко часа на ден. Като правило фенолът се отделя от тялото с пот и урина в рамките на 24 часа, но през това време успява да причини непоправими щети на човешкото здраве. Поради вредните свойства в много страни по света има ограничение за употребата на това вещество за медицински цели.
Условия за транспортиране и съхранение
Съществуват международни стандарти за транспортиране на фенол, предназначени да избягват изпускането на веществото в околната среда.
Фенолът се транспортира по железопътен транспорт в съответствие с правилата за превоз на товари в цистерни, оборудвани с нагревателно устройство. Резервоарите трябва да бъдат изработени от неръждаема хром-никелова стомана, поцинкована въглеродна стомана или въглеродна стомана. Фенолът, предназначен за производство на медицински продукти, се транспортира в железопътни цистерни, изработени от неръждаема хром-никелова стомана и въглеродна стомана с цинково покритие. Фенолът също се транспортира през нагрят тръбопровод, изработен от неръждаема хром-никелова стомана.
Фенолът в разтопено и твърдо състояние се съхранява в херметични резервоари, изработени от неръждаема хром-никелова стомана, поцинкована въглеродна стомана или въглеродна стомана, както и в резервоари от твърд алуминий. Позволява се да се съхранява фенол в разтопено състояние под азот (обемната част на кислорода в азота не трябва да надвишава 2%) при температура (60 ± 10) °C в продължение на 2-3 дни. когато се съхранява в алуминиеви съдове, температурата трябва да се контролира стриктно, за да се избегне разтварянето на алуминия в продукта.
Съединения с една или повече хидроксилни групи, свързани към бензеновия пръстен; се наричат феноли. Най-важният от тях е самият фенол:
Фенолът е открит през 1834 г., когато е изолиран от каменовъглен катран. Първоначално се наричаше карболова киселина и това име се използва и днес за течен фенол, съдържащ 5% вода. Фенолът получава днешното си име през 1841 г.
Всички най-прости феноли при нормални условия са твърди вещества с ниска точка на топене. Фенолът е безцветно кристално вещество с точка на топене 43°C. Има характерна миризма. Подобно на алкохолите, фенолите имат по-високи точки на кипене, отколкото би се очаквало от тяхното относително молекулно тегло. Това се дължи на образуването на междумолекулни водородни връзки във фенолите. Вече беше отбелязано по-горе, че 2-нитрофенолът има по-ниска точка на кипене от 4-нитрофенол. Това се обяснява със съществуването на вътрешномолекулна водородна връзка в първото от тези съединения, докато второто съединение има междумолекулни водородни връзки, което го прави по-малко летливо (виж раздел 2.2).
Фенолите са слабо разтворими във вода, но силно разтворими в органични разтворители, по-специално алкохоли и етери. Фенолът се смесва ограничено с вода само при температури под 66°C. Над 66°C фенолът се смесва с вода във всякаква пропорция (виж Фигура 6.22 и Раздел 6.2).
Лабораторни методи за получаване
За да се получи фенол в лабораторни условия, безводна натриева сол на бензенсулфонова киселина се кондензира при 300-350 ° C с твърд натриев хидроксид и след това към сместа се добавя разредена солна киселина:

Бензолсулфоновата киселина се получава чрез сулфониране на бензол (вижте раздел 18.2). Неутрализацията на тази киселина с натриев хидроксид води до образуването на нейната натриева сол.
Фенолът се получава и чрез нагряване над 10 ° C на воден разтвор на фенилдиазониев хлорид:

Фенилдиазониев хлорид се получава чрез диазотиране на фениламина (вж. Раздел 19.4).
Химични свойства на фенолите
Реакции на хидроксилната група. киселинност. Фенолът има константа на киселинност от 9,95. По този начин той има свойствата на слаба киселина, макар и по-силна от метанола, етанола и водата (виж табл. 19.4). Фенолацията, образувана в резултат на йонно разцепване, се стабилизира поради делокализация
отрицателен заряд:

Може да се разглежда като хибрид на посочените резонансни форми (виж раздели 2.1 и 18.2).
Подобно на алкохолите, фенолът реагира със силно електроположителни метали като натрий, за да освободи водород:

Въпреки това, за разлика от алкохолите, фенолите реагират с натриев хидроксид:

Фенолът не е толкова кисел, колкото карбоксилните киселини. Карбоксилните киселини, като оцетна или бензоена, са в състояние да изместят въглеродния диоксид от натриев бикарбонат или натриев карбонат, но фенолът не. Тази реакция се използва за аналитични цели за разграничаване на карбоксилни киселини от феноли.
Образуването на естери. Въпреки че фенолът не реагира с карбоксилни киселини, за да образува естери, той реагира с хлориди на карбоксилни киселини в алкални разтвори:

Този тип реакция се нарича ацилиране.
Образуването на етери. Фенолът реагира с халоалкани в алкална среда, образувайки етери:

Тази реакция е пример за синтеза на Уилямсън (вижте предишния раздел).
Реакция с фосфорен пентахлорид. За разлика от алкохолите, фенолът не реагира с водородни халогениди и фосфорни трихалогениди. Въпреки това, той реагира бавно с фосфорен пентахлорид, за да образува хлоробензен с нисък добив:

Реакция с железен (III) хлорид. Когато неутрален разтвор на железен (III) хлорид се добави към фенол, се образува комплекс, който има лилав цвят. Тази реакция се използва като аналитичен тест за фенол. Тази реакция е характерна за съединения, съдържащи енолна група.

Реакция в бензоловия пръстен. Бензоловият пръстен в фенолната молекула претърпява електрофилно заместване по-лесно от самия бензен. Това се дължи на факта, че несвързващите електрони на кислородния атом се изтеглят в бензоловия пръстен и по този начин го активират. Хидроксилната група на фенола има 2,4-насочващ ефект върху електрофилните заместители (вж. раздел 18.2).
Халогениране. Халогенирането на фенолите се извършва при много по-меки условия от халогенирането на бензол. Например, когато бромната вода се добави към воден разтвор на фенол, се образува бяла утайка от 2,4,6-трибромофенол:

В сек. 18.2 беше посочено, че бромирането на бензола изисква наличието на катализатор.
Нитриране. Фенолът може да се нитрира с разредена азотна киселина. В този случай се образува смес от 2-нитрофенол и 4-нитрофенол:

Нека отново сравним тези меки условия с условията за съответната реакция на бензол. Нитрирането на бензола трябва да се извърши в смес от концентрирана азотна киселина и сярна киселина (вижте раздел 18.2).
2-нитрофенолът и 4-нитрофенолът са по-силни киселини от фенола. И двете се характеризират със стойности, приблизително равни на 7,2. Повишената киселинност на нитрофенолите се обяснява с факта, че нитрогрупата привлича електрони към себе си. В резултат на това бензоловият пръстен изтегля електроните по-силно от кислородния атом на хидроксилната група.
Сулфониране. Реакцията на фенол с концентрирана сярна киселина води до образуването на смес от хидроксибензенсулфонови киселини:

Хидроксибензенсулфонова киселина (добив 85%)
И двата продукта от тази реакция реагират с концентрирана азотна киселина, образувайки 2,4,6-тринитрофенол - жълто кристално вещество, известно с тривиалното име "пикринова киселина":

Поради общото електроноотвличащо действие на трите нитрогрупи, пикринова киселина е относително силна киселина. Характеризира се с константа на киселинност близка до 1 и при взаимодействие с разтвор на натриев карбонат измества въглеродния диоксид от него.
Комбинирани реакции. Алкалният разтвор на фенол реагира с разтвор на фенилдиазониев хлорид, което води до образуването на оранжева утайка от 4-хидроксифенилазо-бензен:

Този продукт е азо багрило. Реакция от този тип се нарича реакция на свързване (в този случай азо свързване).
ОПРЕДЕЛЕНИЕ
феноли- производни на ароматни въглеводороди, в чиито молекули хидроксилните групи са директно свързани с въглеродните атоми на бензеновия пръстен. Функционалната група, подобно на алкохолите, е ОН.
Фенолът е твърдо безцветно кристално вещество, ниска точка на топене, много хигроскопично, с характерна миризма. Във въздуха фенолът се окислява, така че кристалите му първоначално придобиват розов оттенък (фиг. 1), а при продължително съхранение потъмняват и стават по-червени. При стайна температура е слабо разтворим във вода, но се разтваря бързо и добре при 60 - 70 o C. Фенолът е топим, температурата му на топене е 43 o C. Отровен.
Ориз. 1. Фенол. Външен вид.
Получаване на фенол
В промишлен мащаб фенолът се получава от каменовъглен катран. Сред най-често използваните лабораторни методи са следните:
– хидролиза на хлорбензол
C6H5Cl + NaOH→C6H5OH + NaCl (kat = Cu, t 0).
— алкално топене на соли на аренсулфоновите киселини
C 6 H 5 SO 3 Na + 2NaOH → C 6 H 5 OH + Na 2 SO 3 + H 2 O (t 0).
– кумолен метод (окисление на изопропилбензен)
C 6 H 5 -C (CH 3) H-CH 3 + O 2 → C 6 H 5 OH + CH 3 -C (O) -CH 3 (H +, t 0).
Химични свойства на фенола
Химичните трансформации на фенола протичат главно с разделяне:
1) O-N връзки
- взаимодействие с метали
2C6H5OH + 2Na→ 2C6H5ONa + H2.
- взаимодействие с алкали
C6H5OH + NaOH → C6H5ONa + H2O.
— взаимодействие с анхидриди на карбоксилни киселини
C 6 H 5 -OH + Cl-C (O) -O-C (O) -CH 3 → C 6H 5 -O-C (O) -CH 3 + CH 3 COOH (t 0).
- взаимодействие с халогениди на карбоксилни киселини
C 6 H 5 -OH + Cl-C (O) -CH 3 → C 6H 5 -O-C (O) -CH 3 + HCl (t 0).
- взаимодействие с FeCl 3 (качествена реакция към фенол - появата на лилав цвят, който изчезва при добавяне на киселина)
6C 6 H 5 OH + FeCl 3 → (C 6 H 5 OH) 3 + 3Cl -.
2) връзки C sp 2 -H предимно в относно- и н-провизии
- бромиране
C6H5-OH + 3Br2 (aq) →Br3-C6H2-OH ↓ + 3HBr.
- нитриране (образуване на пикринова киселина)
C6H5-OH + 3HONO2 (конц.) → (NO 2) 3 -C6H2-OH + 3H2O (H+).
3) единичен 6π-електронен облак на бензоловия пръстен
– хидрогениране
C 6 H 5 OH + 3H 2 → C 6 H 11 -OH (kat = Ni, t 0 = 130 - 150, p = 5 - 20 atm).
Приложение на фенол
Фенолът се използва в големи количества за производството на багрила, фенолформалдехидни пластмаси и медицински вещества.
От двуатомните феноли резорцинолът се използва в медицината като антисептик и вещество за някои клинични тестове, а хидрохинонът и други двуатомни феноли се използват като проявители при обработката на фотографски материали.
В медицината лизолът, който включва различни феноли, се използва за дезинфекция на помещения и мебели.
Някои феноли се използват като антиоксиданти – вещества, които предотвратяват развалянето на храната при продължително съхранение (мазнини, масла, хранителни концентрати).
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Воден разтвор, съдържащ 32,9 g фенол, се третира с излишък от бром. Изчислете масата на полученото бромо производно. |
| Решение | Нека напишем уравнението на реакцията за взаимодействието на фенол с бром: C 6 H 5 OH + 3Br 2 → C 6 H 2 Br 3 OH + 3HBr. В резултат на това взаимодействие се образува 2,4,6-трибромофенол. Изчислете количеството фенолно вещество (моларна маса е 94 g / mol): n (C6H5OH) \u003d m (C6H5OH) / M (C6H5OH); n (C 6 H 5 OH) = 32,9 / 94 = 0,35 mol. Съгласно уравнението на реакцията n(C6H5OH) :n(C6H2Br3OH) = 1:1, т.е. n (C 6 H 2 Br 3 OH) = n (C 6 H 5 OH) = 0,35 mol. Тогава масата на 2,4,6-трибромофенола ще бъде равна на (моларна маса -331 g / mol): m (C 6 H 2 Br 3 OH) = 0,35 × 331 = 115,81 g. |
| Отговор | Масата на полученото бромо производно е 115,81 g. |
ПРИМЕР 2
| Упражнение | Как да получите фенол от йодобензен? Изчислете масата на фенола, която може да се получи от 45,9 g йодобензен. |
| Решение | Пишем уравнението на реакцията за получаване на фенол от йодобензен: C 6 H 5 I + NaOH → C 6 H 5 OH + NaI (kat = Cu, t 0). |