Формула за химическа реакция на Eds. Галванични елементи и ЕДС
3.5.1 Електрически потенциали на фазовите граници
Когато проводник от първи вид (електрод) влезе в контакт с полярен разтворител (вода) или електролитен разтвор на границата електрод-течност, се получава т.нар. електрически двоен слой (DES). Като пример помислете за меден електрод, потопен във вода или в разтвор на меден сулфат.
Когато меден електрод е потопен във вода, част от медните йони, разположени във възлите на кристалната решетка, в резултат на взаимодействие с водни диполи, ще преминат в разтвор. Отрицателният заряд, възникващ в същото време върху електрода, ще задържи йоните, преминали в разтвора в околоелектродното пространство - образува се двоен електрически слой (фиг. 3.12а; за модели на DEL структурата, вижте раздел 4.2 .4). Отрицателният заряд на електрода ще предотврати по-нататъшното преминаване на медни йони в разтвора и след известно време ще се установи динамично равновесие, което може да се характеризира недвусмислено с потенциала на DEL електрическото поле Φ, в зависимост от заряда на електрод, или чрез някаква равновесна концентрация на йони в близо електродния слой C o . Когато меден електрод е потопен в разтвор на CuSO 4, съдържащ медни йони с концентрация C, са възможни три случая:
Ориз. 3.12Схема на двоен електрически слой на интерфейса електрод-разтвор
1. В< С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в повърхностен слойразтвор на катиони ще бъде повече от аниони (фиг. 3.9а).
2. C > C o . Тъй като концентрацията на медни йони в повърхностния слой е по-голяма от равновесната, ще започне преходът на йони от разтвора към електрода; върху електрода възниква положителен заряд и в повърхностния слой преобладават SO 4 2- аниони (фиг. 3.12b).
3. C \u003d C o. Тъй като концентрацията на медни йони в повърхностния слой е равна на равновесната (такива разтвори се наричат нула), на електрода не възниква заряд и не се образува двоен електрически слой.
3.5.2 Галванична клетка. ЕМП на галванична клетка
Помислете за най-простата галванична клетка на Даниел-Якоби, състояща се от две полуклетки - цинкови и медни пластини, поставени съответно в разтвори на цинк и меден сулфат, които са свързани помежду си с помощта на електролитен ключ - например лента хартия, навлажнена с разтвор на малко електролит. Схематично този елемент е изобразен, както следва:
Zn / Zn2+ // Cu2+ / Cu
На повърхността на всеки от електродите има динамично равновесие на прехода на метални йони от електрода към разтвора и обратно, характеризиращо се с EDL потенциала (заряд на електрода q). Ако свържете медни и цинкови електроди с метален проводник, незабавно ще настъпи преразпределение на зарядите - електроните ще започнат да се движат от електрод с по-отрицателен заряд (в нашия случай цинк) към електрод с по-положителен заряд (мед ), т.е в проводника ще тече електрически ток. Промяната в стойността на заряда на всеки от електродите нарушава баланса - на цинковия електрод ще започне процесът на преход на йони от електрода към разтвора (окисляване на метал), на медния електрод - от разтвора към електрода (намаляване на метал); в този случай протичането на процеса на единия електрод води до едновременното протичане на противоположния процес на другия:
Zn o ––> Zn 2+ + 2е -
Cu 2+ + 2e - ––> Cu o
Нарича се електродът, върху който протича процесът на окисление по време на работа на галванична клетка анод, електродът, върху който протича процеса на възстановяване - катод. Със схематично изображение галванични клеткианодът е изписан отляво, катодът е изписан отдясно (стандартният водороден електрод винаги е изписан отляво). Общият редокс процес, протичащ в галванична клетка, се изразява със следното уравнение:
Cu 2+ + Zn o ––> Cu o + Zn 2+
По този начин, галваничната клетка може да се определи като устройство за преобразуване на химическата енергия на окислително-редукционната реакция в електрическа енергия поради пространственото разделяне на процесите на окисление и редукция. Работата, която електрически ток, генериран от галванична клетка, може да извърши, се определя от разликата в електрическите потенциали между електродите (обикновено наричана просто потенциална разлика) ΔΦ и количеството електричество, преминало през веригата q:
Работата на тока на галваничната клетка (и следователно потенциалната разлика) ще бъде максимална по време на нейната обратима работа, когато процесите върху електродите протичат безкрайно бавно и силата на тока във веригата е безкрайно малка. Максималната потенциална разлика, която възниква по време на обратимата работа на галваничния елемент е електродвижеща сила(EMF) на галванична клетка .
3.5.3 Потенциал на електрода. Уравнение на Нернст
ЕМП на галванична клетка Е удобно се представя като разлика на някои величини, характеризиращи всеки от електродите - електродни потенциали; обаче, за да се определят точно тези стойности, е необходима референтна точка - точно известен електроден потенциал на всеки електрод. Потенциал на електрода ε e се нарича елемент emf, съставен от този електрод и стандартен водороден електрод (виж по-долу), чийто електроден потенциал се приема за равен на нула. В този случай знакът на електродния потенциал се счита за положителен, ако изпитваният електрод в такава галванична клетка е катодът, и отрицателен, ако изпитваният електрод е анодът. Трябва да се отбележи, че понякога електродният потенциал се определя като "потенциалната разлика на интерфейса електрод-разтвор", т.е. считат го за идентичен с DEL потенциала, което не е напълно правилно (въпреки че тези количества са взаимосвързани).
Стойност електроден потенциална металния електрод зависи от температурата и активността (концентрацията) на металния йон в разтвора, в който е потопен електродът; математически тази зависимост се изразява Уравнение на Нернст (тук F е константата на Фарадей, z е йонният заряд):
В уравнението на Нернст ε ° – стандартен електроден потенциал , равен на потенциала на електрода при активността на металния йон, равен на 1 mol/l. Стандартните електродни потенциали на електродите във водни разтвори са поредица от напрежения. Стойността на ε ° е мярка за способността на окислената форма на елемент или йон да приема електрони, т.е. Възстанови. Понякога разликата между концентрацията и активността на йон в разтвора се пренебрегва и концентрацията на йони в разтвора се появява под знака на логаритъма в уравнението на Нернст. Големината на електродния потенциал определя посоката на процеса, протичащ върху електрода по време на работа на галваничната клетка. На полуклетка, чийто електроден потенциал има по-голяма (понякога казват - по-положителна) стойност, процесът на възстановяване ще продължи, т.е. този електрод ще бъде катодът.
Помислете за изчисляването на ЕМП на елемента Даниел - Якоби с помощта на уравнението на Нернст. EMF винаги е положителна стойност и е равна на разликата между електродните потенциали на катода и анода:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
Както се вижда от уравнение (III.45), ЕМП на елемента Даниел - Якоби зависи от концентрацията (по-точно активността) на медни и цинкови йони; при равни концентрации, ЕМП на елемента ще бъде равна на разликата в стандартните електродни потенциали:
![]() (III.46)
(III.46)
Анализирайки уравнение (III.45), е възможно да се определи границата на необратимата работа на галваничния елемент. Тъй като цинкът се окислява на анода, концентрацията на цинкови йони постоянно нараства по време на необратимата работа на галваничния елемент; концентрацията на медни йони, напротив, намалява. Съотношението на концентрациите на медни и цинкови йони непрекъснато намалява и логаритъмът на това съотношение при [Сu 2+ ]< становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) обяснява и изпълнението на т.нар. концентрационни вериги – галванични елементи, състоящи се от два еднакви метални електрода, потопени в разтвори на тази метална сол с различна активност a 1 > a 2 . В този случай катодът ще бъде електрод с по-висока концентрация, т.к стандартните електродни потенциали на двата електрода са равни; за ЕМП на концентрирана галванична клетка получаваме:
![]() (III.47)
(III.47)
Единственият резултат от работата на концентриращия елемент е прехвърлянето на метални йони от по-концентриран разтвор в по-малко концентриран. По този начин работата на електрическия ток в концентрационна галванична клетка е работа на дифузионен процес, който се осъществява обратимо в резултат на пространственото му разделяне на два противоположни по посока обратими електродни процеса.
Copyright © С. И. Левченков, 1996 - 2005.
ТЕРМОДИНАМИКА
ГАЛВАНИЧНА КЛЕТКА
към лабораторна работа No18
Самара 2010г
Съставител: Ю.П. Коврига, Б. М. СТИФАТОВ, В. В. СЛЕПУШКИН
Термодинамика на галванична клетка:Метод. указ. към лабораторията. работа. /на себе си. състояние технология un-t; Комп.: Ю.П.Коврига, Б.М. Стифатов, В.В. Слепушкин.- Самара, 2010. 16 с.
Разгледани са теоретични основи и експериментално определяне на термодинамичните характеристики на електрохимичните реакции, протичащи при работа на галваничен елемент.
Инструкциите са предназначени за студенти по химия и други специалности, изучаващи електрохимия в курс по физическа химия.
Раздел. 1. Болно 2. Библиография: 6 заглавия.
Публикувано по решение на редакционно-издателския съвет на СамСТУ.
Обективен– изследване на теорията и практиката на термодинамичните изчисления за електрохимични реакции, протичащи при работа на обратими галванични елементи въз основа на резултатите от измерването на електродвижещата сила.
1. ТЕОРЕТИЧНО ВЪВЕДЕНИЕ
Термодинамични характеристики
Галванична клетка
галваничен елементнаречена система от два електрода, в която енергията на химическа реакция се преобразува спонтанно в електрическа енергия. Състои се от две електроди (половин клетки),потопени в електролитни разтвори. Между тези разтвори се установява контакт с помощта на пореста преграда или електролитен мост,сифонна тръба, пълна с наситен разтвор на KCl или NH4NO3. Пореста преграда или електролитен мост осигурява електрическа проводимост между електродните разтвори, но предотвратява тяхната взаимна дифузия. В някои случаи и двата електрода са потопени в един и същ разтвор.
Ако свържете електродите с метален проводник, на един от тях възниква реакция окисляване,и то е отрицателно заредено и се нарича анод, а от друга - реакцията възстановяване,то е положително заредено и се нарича катод.
Темодинамикае клон на науката, който изучава взаимните трансформации на топлина в работа и обратно. Химическа термодинамикае клон на физичната химия, който изучава физични и химични процеси, придружени от освобождаване или усвояване на енергия. Галваничната клетка принадлежи към физикохимичните системи. Следователно, работата на галванична клетка, както всяка друга термодинамична система, се характеризира с термодинамични стойности на промяната на енергията на Гибс Δ г,енталпия Δ H,ентропия Δ Си равновесната константа К аза електрохимични реакции, протичащи по време на работа на обратими галванични елементи.
Колкото по-голямо е съпротивлението на проводника, свързващ електродите, толкова по-бавно протичат реакциите върху електродите. По принцип е възможно да се затворят електродите с проводник с безкрайно съпротивление и реакцията ще протича безкрайно бавно, т.е. обратимо.
Когато химическата реакция се извършва изотермично и обратимо, работата е най-голяма: в този случай по-голямата част от топлината на реакцията се превръща в електрическа работа. Потенциалната разлика между електродите, измерена в този случай, се нарича електродвижеща сила(накратко - ЕМП) на галванична клетка.
електрическа работагалванична клетка ( НО) е равно на неговата ЕМП ( Е) умножено по прехвърлената такса ( q). Ако по време на реакцията настъпи редукция или окисление zмолни еквиваленти на вещество, то според закона на Фарадей ще бъдат прехвърлени q = zFкулони (А . в) електричество, където Ф- Число на Фарадей (96500 C/mol). Следователно максималната работа ( A" макс) чрез прехвърляне zFкулони електричество през потенциалната разлика ( ∆φ = E)електроди на галванична клетка е равна на
където E е ЕМП на галваничния елемент, V; E 0 - стандартна емфгалванична клетка с единични дейности на участниците в реакцията; a(OX 1),a(Red 1),a(OX 2),a(Red 2) - активни концентрации (активности) на редокс конюгирани двойки OX 1 / Red 1 и OX 2 /Red 2, образувани в резултат на реакция в разтвор.
Измерване на ЕМП на галванична клетка Еи се променя с температурата dE/dTви позволява да изчислите най-важните термодинамични количества за химическата редокс реакция, протичаща в елемента.
От уравнението на Гибс-Хелмхолц
Уравнение (8) предполага, че
Стойност д E/ д T се нарича температурен коефициент на електродвижещата сила на галваничен елемент.Температурен коефициент д E/ д T може да се определи от зависимостта на електродвижещата сила на галваничния елемент от температурата. Стойност д E/ д T може да бъде положителен, отрицателен или нула в зависимост от естеството на клетката.
В д E/ д T = 0, т.е. когато EMF на елемента не зависи от температурата, E = - ΔU/zF.В този случай работата на елемента се осъществява изцяло поради намаляването на вътрешната енергия на системата без отделяне или поглъщане на топлина.
В д E/ дт<0, т.е. когда ЭДС элемента уменьшается с повышением температуры, работа элемента совершается тоже за счет убыли внутренней энергии системы, но сопровождается выделением теплоты. В этом случае работа элемента и расход энергии на нагревание окружающей среды осуществляется за счет убыли внутренней энергии системы.
В д E/ д T >0, т.е. когато ЕМП на елемент се увеличава с повишаване на температурата, елементът работи чрез поглъщане на топлина. В този случай съотношението между ЕИ т . д E/ д T определя естеството на работата и посоката на промяна на вътрешната енергия на системата:
1) кога E = T d E/ д T, вътрешната енергия на работния елемент при постоянна температура не се променя: ΔU= 0. Работата на елемента се извършва изцяло благодарение на погълнатата от околната среда топлина;
2) кога E > T . д E/ дт , вътрешната енергия на елемента намалява по време на неговата работа, ΔU <0, и работа совершается частично за счет убыли внутренней энергий и частично за счет поглощения теплоты извне;
3) кога Е< Т . д E/ д T вътрешната енергия на елемента по време на неговата работа се увеличава, ΔU> 0, т.е. елементът абсорбира топлина в количество, надвишаващо извършената от него работа. Излишъкът от абсорбирана топлина се използва за увеличаване на вътрешната енергия на системата. Тук работата е свършена и процесът протича спонтанно, въпреки ендотермичния характер на химическата реакция.
Стойност д E/ д T може да се изчисли приблизително по формулата
| | (11) |
където E 1И E 2 -– Стойности на ЕМП на галваничен елемент при температури Т 1И Т 2. Изчислението ще бъде по-точно, колкото по-малко се различават един от друг. Т 1И Т 2, защото пристрастяване E \u003d f (T)близки до линейни само за малки температурни интервали.
Равновесната константа на химическа реакция К аможе да се изчисли от уравненията на изотермата на химична реакция при стандартни условия. от уравнение на изотерма на вант Хофстойността на максималната полезна работа за химическа реакция се изчислява като
| , | (14) |
където E 0 \u003d E 0 2 - E 0 1- стандартна ЕМП, равна на разликата на стандартните електродни потенциали.
Изчисляването на равновесната константа се извършва с помощта на референтни данни за стойностите на стандартните електродни потенциали на съответните електроди, дадени в справочника за физикохимични количества.
Измерване на ЕМП на галванични елементи
Промяната в термодинамичните стойности на електрохимичните реакции може да бъде определена много точно чрез измерване на електродвижещите сили на галваничните елементи, в които протичат тези реакции. Точността на този метод се обяснява с високата точност на измерванията на ЕМП на галванична клетка с потенциометър от типа R-307, работещ съгласно компенсаторен метод на Погендорф. Той осигурява измерване на ЕМП на галванична клетка при условия, когато през клетката протича безкрайно малък ток, което съответства на обратима галванична клетка. При измерване на EMF с обикновен волтметър, токът, генериран от елемента, протича през електродите, което води до изместване на електродните потенциали от равновесните стойности, на които съответства уравнението на Nernst.
Измерването на ЕМП на елемент в равновесни условия, окислително-редукционната реакция, протичаща върху неговите електроди, се постига чрез използване на метод на компенсация Poggendorf,реализирано с помощта на електрическата верига, показана на фиг. 2.
нормално) Килията на Уестън
Θ Сd(Hg) | CdSO 4 8/3H 2 O (насит.), Hg 2 SO 4 (t) | hg,
с постоянна и възпроизводима стойност на ЕМП. Тук анодът е кадмиева амалгама, а катодът е метален живак. Когато веригата е затворена, протичат полуреакции:
При 25 0 С ЕМП на елемента Уестън е 1,0183 V.
Измерването започва с градуирането на скалата на реохорда, която представлява линийка, градуирана в mm с опъната върху нея нихромова тел с постоянно напречно сечение.
Към веригата е свързана батерия, осигуряваща постоянен електрически ток във веригата. Превключвателят "P" въвежда стандартен елемент във веригата и премества мобилния контакт "C" по протежение на проводника на реохорда. Периодично, с кратко натискане на клавиша "K", те затварят веригата, като проверяват наличието на ток във веригата с помощта на галванометър, т.е. компенсация. В момента на компенсация сегментът ACпроводникът на реохорда съответства на съпротивлението, чието произведение и тока на батерията е равно на напрежението, което компенсира ЕМП на елемента Уестън. Познаване на дължината на сегмента AC(например, л Н), при който спадът на напрежението на батерията компенсира EMF (EN) на клетката Weston, можете да изчислите падането на напрежението на 1 mm реохорд като E N /l N, V/mm.
След това, изследваната галванична клетка с неизвестна стойност на ЕМП се включва във веригата E Xи повторете горните измервателни операции, като в момента на компенсация измерите дължината на теления сегмент на реохорда л X. От връзката
намери неизвестното Стойност на EMF.
За точно измерване на ЕМП на галванична клетка използвайте потенциометър с високо съпротивление R-307, горният панел на който е показан на фиг. 2.
Работата на устройството се основава на принципа на компенсация, когато в момента на измерване на ЕМП токът във веригата на изследваната галванична клетка има безкрайно малка стойност (нула на нулевия инструмент (галванометър)). При сглобяване на измервателната верига към клемите “B” се свързва 2,5 - 3,5 V батерия или токоизправител, нормален елемент на Weston към клемите “NE”, а изследваната галванична клетка към клемите X 1 или X 2. В този случай, във всички случаи, имайте предвид знаците за полярност "+" и "-" на арматурното табло и свързания източник постоянен ток. Галванометърът е свързан към съответните клеми "G". След това потенциометърът се свързва чрез токоизправител към електрическата мрежа.
Работата започва с калибриране на устройството според стандартния елемент Weston.
Превключвателят за вида работа (3) е поставен в положение “NE”. Копчетата за съпротивление (2) произвеждат "груба" и след това "фина" компенсация за ЕДС на елемента Weston, като периодично затварят измервателната верига с бутона 430 kOhm, след това с бутона "0". Правилната настройка съответства на липсата на ток във веригата на галванометъра по време на късо съединение (1-2 s) с неговия бутон "0".
В резултат на това към измервателните копчета (5) на потенциометъра от токоизправителя се подава работен ток, който осигурява напрежение, равно на EMF на елемента Weston, т.е. 1,0186 V.
|
||||
| Ориз. Фиг. 2. Изглед на горния панел на потенциометъра R-308: 1 - гнезда "X 1" и "X 2" за свързване на електродите на галваничната клетка; 2 - копчета за съпротивление "груби" "фини" за калибриране на потенциометъра; 3 - превключвател за работа на потенциометъра в норма (NE) или на изследвания елемент "NE" или "X 2"; 4 - гнезда "G" за свързване на галванометър; 5 - копчета за съпротивление (десетилетия) с прозорци за измерване на цифровите стойности на ЕМП; 6 - гнезда "X 1" за свързване на нормален елемент Weston; 7 - гнезда "B" и за свързване на батерията; 8 - нормален елемент на Weston; 9 - токоизправител променлив ток; 10 - галванометър; 11 - прозорци с цифрови стойности на ЕМП; 12 - бутони за затваряне на измервателната верига "430" и "0" и спиране на вибрациите на стрелката на галванометъра "Usp". |
Измервателните писалки се наричат десетилетия, тъй като всеки от тях има по 10 позиции. Всяка от позициите на първата декада (I) осигурява съпротивление, което, умножено по работния ток, дава стойност на компенсация на ЕМП от 0,1 V. Следователно копчето (I) позволява компенсация от 0,1 до 1 V. Декада (II) ви позволява да компенсирате от 0,01 до 0,1 V и т.н. Следователно измерената цифрова стойност на ЕМП, посочена в полето за първото десетилетие, трябва да се умножи по 0,1, за второто - по 0,01 и т.н.
След калибриране на устройството, превключвателят на вида работа (2) се поставя в положение X 1 или X 2 (в зависимост от това към кой извод е свързана изследваната галванична клетка) и дръжките на десетилетните превключватели I - VI балансират измерена ЕМП с последователно повишаване на чувствителността, като се постига липса на ток във веригата с късо съединение с бутона "0".
Стойността на измерената стойност се отчита от числата в полетата със съответните множители.
2. ЕКСПЕРИМЕНТАЛНА
Работен план
1. Запознайте се с теоретичните основи на термодинамиката на галваничния елемент.
2. Съберете изследваната галванична клетка и я поставете в гнездата на капака на термостата.
3. Свържете изследваната галванична клетка с свързващи проводници към потенциометъра R-308.
4. Калибрирайте потенциометъра P-308, като използвате стандартен елемент Weston.
5. Измерете ЕМП на изследваната галванична клетка в температурния диапазон, посочен в задачата, като промените температурата на термостата.
7. Подгответе отчет за извършената работа и направете заключение за съответствието на стойностите на изчислените стойности с процесите, протичащи в галваничната клетка.
8. Проверете резултатите от работата на учителя и подредете работното място.
Инструменти и реактиви
1. Платинени електроди със свързващи проводници (2 бр.).
2. Стъклени епруветки с широко гърло (2 бр.).
3. Термостат.
4. Потенциометър R-308.
5. AC токоизправител.
6. Стандартен елемент Weston.
7. Разтвори за приготвяне на галваничен елемент.
8. Солен мост от стъклена тръба.
9. Наситен разтвор на KCl.
10. Филтърна хартия за направата на солен мост.
Напредък на работата
1. Направете галваничната клетка, посочена в заданието. За да направите това, изсипете подходящите разтвори с дадена концентрация в две големи епруветки с широко гърло.
2. Потопете платинените електроди в съответните електролити.
3. Поставете епруветките с разтвори в процепите на капака на термостата.
4. Направете солен мост, като напълните U-образна стъклена тръба с наситен разтвор на KCl и запушете дупките, така че да няма въздушни мехурчета в солния мост.
5. Свържете тръбите със солен мост.
6. Калибрирайте потенциометъра P-308 с помощта на елемента Weston.
7. Измерете ЕМП на сглобената галванична клетка в температурния диапазон, посочен в заданието, като увеличите температурата на водата в термостата. Температурата в термостата се измерва точно от отделен термометър. Запишете измерената стойност на EMF и съответната температура.
9. Определете стандартните потенциали на електродите на изследваната галванична клетка от справочника и начертайте нейната верига. Напишете уравнение за полуреакции, протичащи на електродите и общо уравнение за редокс реакция. Изчислете стандартната стойност на ЕДС на елемента и намерете равновесната константа К асъгласно формула (14).
10. Въведете резултатите от експеримента и изчислените стойности в таблицата.
тестови въпроси
1. Връзка между енергията на Гибс на електрохимична реакция и ЕМП на галваничен елемент.
2. Извличане на формули за изчисляване на ΔG, ΔH, ΔSелектрохимична реакция.
3. Зависимост на ЕМП на галваничните елементи от температурата.
4. Понятието "температурен коефициент на ЕМП" и методи за определянето му.
5. Връзка между знака на температурния коефициент и естеството на електрохимичната реакция.
6. Принципът на действие на потенциометъра R-307.
7. Методика за извършване на работа.
ПРЕПРАТКИ
1. Семченко Д.П., Стромберг А.Г.. Физическа химия.- М.: Vyssh. училище, 2000. - 512 с.
2. Работилница по физическа химия / Изд. И.В. Кудряшов. - М.: По-високо. училище., 1999.- 400 с.
3. Работилница по физическа химия / Изд. В.В. Буданов,
Н.К. Воробьов. - М.: Химия, 2000. - 387 с.
4. Практическа работа по физическа химия: учеб. надбавка за университети / Изд. К.П. Мишченко, A.A. Равдел, А.М. Пономарева.- Санкт Петербург, издателство "Професия", 2002. - 384 с.
5. Кратък справочник за физични и химични величини / Изд. А.А. Равдел, А. М. Пономарева. - М.: Химия, 2002. - 327 с.
6. Киселева Е.В., Каретников Г.С., Кудряшов И.В.Колекция от примери и задачи по физическа химия. - М.: По-високо. училище, 2001. - 389 с.
Преобразуването на химическата енергия в електрическа се извършва в електрохимични системи, които се наричат галванични клетки.
Галваничната клетка е затворена електрохимична система, състояща се от два електрода.
Помислете за галванична клетка на Якоби-Даниел. Състои се от медна плоча, потопена в разтвор на CuSC4 и цинкова плоча, потопена в разтвор на ZnSC4. За да се предотврати директно взаимодействие между окислителя и редуктора, електродите са разделени един от друг чрез пореста преграда.
Схема на галванична клетка:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu
На повърхността на цинковата плоча се появява двоен електрически слой и се установява равновесие:
В резултат на този процес възниква електродният потенциал на цинка.
На повърхността на медната плоча също се появява двоен електрически слой и се установява равновесие:
Сu2+ + 2е « Сu, следователно възниква електроден потенциал от мед.
Потенциалът на цинковия електрод има по-отрицателна стойност от потенциала на медния електрод, следователно, когато външната верига е затворена, т.е., когато цинкът е свързан към мед с метален проводник, електроните ще се прехвърлят от цинк към мед.
По този начин, когато външната верига е затворена, възникват спонтанни процеси на разтваряне на цинк върху цинковия електрод и утаяване на мед върху медния електрод. Тези процеси ще продължат, докато потенциалите на електродите се изравнят или целият цинк се разтвори (или цялата мед се отложи върху медния електрод).
И така, по време на работата на елемента Якоби-Даниел се случват следните процеси:
1) реакция на окисление на цинк: Zn - 2е ® Zn2+.
Окислителните процеси в електрохимията се наричат анодни процеси, а електродите, върху които протичат окислителни процеси, се наричат аноди;
2) редукционна реакция на медни йони: Сu2+ + 2е « Сu.
Редукционните процеси в електрохимията се наричат катодни процеси, а електродите, върху които протичат редукционните процеси, се наричат катоди;
движението на електроните във външната верига;
движение на йони в разтвор: аниони (SO4-2) към анода, катиони (Cu2+, Zn2+) към катода. Движението на йони в разтвор затваря електрическата верига на галваничния елемент. Обобщавайки електродните реакции, получаваме:
Zn + Cu2+ = Zn2+ + Сu.
В резултат на тази химическа реакция в галванична клетка се осъществява движението на електрони във външната верига и йони вътре в клетката, т.е. образува се затворена електрическа система и в нея възниква електрически ток. Цялата химическа реакция, протичаща в галваничния елемент, се нарича генерираща ток.
Електрическият ток, който възниква в дадена електрохимична система, се характеризира числено с големината на електродвижещата сила (EMF) на елемента. Тя е равна на разликата между електродните потенциали на катода и анода:
При стандартни условия е възможна спонтанна химическа реакция, когато максималната полезна работа, извършена в резултат на тази реакция, е равна на отрицателната стойност на промяната в свободната енергия:
В галванична клетка максималната електрическа работа, извършена при стандартни условия, е равна на ЕМП на клетката, умножена по количеството електричество (nF), т.е.
A = nFE0, (7.5)
където n е броят на електроните, участващи в реакцията;
F е константата на Фарадей, равна на 96500 C/mol;
E0 - стандартна електродвижеща сила на галваничен елемент (T= 298 K, моларната концентрация на електролитите е 1 mol/dm3). Така максималната работа на една галванична клетка е равна на:
A \u003d -DG0 \u003d nFE0. (7.6)
Стандартната ЕМП на галванична клетка е:
Галваничните елементи, в зависимост от естеството на електродите и концентрацията на електролитите, се делят на химически и концентрационни.
Химическите галванични клетки са такива клетки, при които електродите и електролитите са различни. Пример за химическа галванична клетка е клетката на Якоби-Даниел.
Концентрационните галванични клетки са такива клетки, които се състоят от едни и същи електроди, но концентрациите на електролита са различни, например сребърни електроди, потопени в разтвори на сребърен нитрат с различни концентрации:
Ag | AgNO3 (0,01 mol/dm3) | | AgNO3 (0,1 mol/dm3) | Ag.
Пример 1. Галваничната клетка се състои от метален цинк, потопен в разтвор на цинков нитрат с моларна концентрация 0,1 mol/dm3, и метално олово, потопен в разтвор на оловен нитрат с моларна концентрация от 0,02 mol/dm3 елемент диаграма.
Решение. За да се определи ЕМП на елемент, е необходимо да се изчислят електродните потенциали с помощта на уравнението на Нернст (7.2):
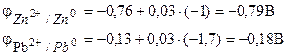
Намираме ЕДС на елемента по формулата (7.3).
Галванична клетка- устройство, което преобразува химична енергияв електрически. Един такъв елемент е елементът Даниел-Якоби. Този елемент се състои от два електрода: цинк и мед, потопени в съответните сулфатни разтвори, между които има пореста преграда:
Когато външната верига е затворена, електроните преминават от Zn към Cu, а цинкът дифундира в мед:
Ние образуваме електрохимична верига:
Анод - отрицателен електрод (вляво). Катодът е положителният електрод.
За да определите EMF на този елемент, трябва да сравните стандартните електродни потенциали на двата електрода. При записване на електродните реакции се приема, че окислената форма е от лявата страна, а редуцираната е от дясната страна на уравнението.
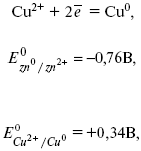
където Е 0 - електродвижеща сила (EMF) на галваничен елемент, когато всички реагенти са в стандартно състояние.
ЕДС на клетката се изчислява чрез изваждане на анодния потенциал от катодния потенциал.
ЕМП на елемента е +0,34 - (-0,76) \u003d 1,1 V; колкото повече електродните потенциали се различават един от друг, толкова по-голям е ЕМП. Ако металът е потопен в солен разтвор с по-висока концентрация, тогава потенциалът е нестандартен. Това означава, че концентрацията и температурата влияят върху величината на електродния потенциал. Тази зависимост е изразена Уравнение на В. Нернст.
където P -брой йони;
R е универсалната газова константа;
Т -температура;
ОТ -концентрация на активни йони в разтвор;
F-Число на Фарадей = 96500 V.
ХИТОВЕ- устройства, които се използват за директно преобразуване на енергията на химическа реакция в електрическа енергия. Попаденията се използват в различни области на технологиите. В средствата за комуникация: радио, телефон, телеграф; в електрическо измервателно оборудване; служат като източници на енергия за автомобили, самолети, трактори; използва се за задвижване на стартери и др.
Недостатъци на HIT:
1) цената на веществата, необходими за работа: Pb, Cd, е висока;
2) съотношението на количеството енергия, което един елемент може да даде към неговата маса, е малко.
Предимства на HIT:
1) Попаденията са разделени на две основни групи: обратими (батерии), необратими (галванични клетки). Батериите могат да се използват многократно, тъй като тяхната производителност може да бъде възстановена чрез преминаване на ток в обратна посока от външен източник, а в галваничните клетки те могат да се използват само веднъж, тъй като един от електродите (Zn в клетката на Daniel-Jacobi) е необратимо консумиран;
2) използват се електролити, абсорбирани от порести материали, те имат по-голямо вътрешно съпротивление;
3) създаване на горивни клетки, по време на чиято работа ще се консумират евтини вещества с ниска плътност ( природен газводород);
4) удобна работа, надеждност, високо и стабилно напрежение.
Помислете за технологичния процес, базиран на оловно-киселинна батерия с покрити електроди.
Обща схема: (–) активно вещество | електролит | активно вещество (+).
Активното вещество на отрицателния електрод е редуциращ агентдаряване на електрони. По време на разряда, отрицателният електрод е анод, тоест електрод, върху който протичат окислителни процеси. Активното вещество на положителния електрод е окислител. Активните вещества - окислител и редуциращ агент - участват в електрохимична реакция.
Електрохимична схема на оловно-киселинна батерия
Активните вещества на оловната батерия са гъбесто олово и PbO 2 . Създаването на активни маси в електродите е както следва: паста или смес от Pb оксиди се нанася върху електропроводимата рамка на конструкцията; при последващото образуване на плочи Pb оксидите се превръщат в активни вещества. Формиране– превръщане на незаредена маса в заредена маса. Такива плочи се подразделят в зависимост от вида на рамката на разпръснати и решетъчни. Повечето батерии са сглобени от измазани плочи. При производството им паста от оловни оксиди се намазва в клетките на профилирани решетки с дебелина 1–7 mm, отляти от сплав Pb–Sb. След втвърдяване пастата се държи върху решетката, гаранцията на такава батерия е 2-3 години. При избора на материалите за тококолектори на положителните акумулаторни електроди е важно да се осигури тяхната практическа пасивност (при запазване на електропроводимост) при условия на зареждане (до много високи потенциали с анодна поляризация). За тази цел Pb или неговите сплави се използват в разтвори на H2SO4. Корпусът и капакът на HIT могат да бъдат изработени от стомана или различни диелектрици, но при оловно-киселинните батерии корпусът е от ебонит, полипропилен и стъкло. Електролитът в оловно-киселинната батерия може да участва в цялостната реакция, генерираща ток. За токови кранове на отрицателния електрод се използват Cu, Ti, Al.
3. Регенериране и обезвреждане на ХИТ
Срокът на експлоатация на галваничните елементи приключва (разряд HIT) след пълно или частично използване на активни материали, чието действие след разреждане може да бъде възстановено чрез зареждане, тоест чрез преминаване на ток в посока, противоположна на посоката на тока по време на разряд: такива галванични елементи се наричат акумулатори. Отрицателният електрод, който е бил анод, когато батерията се разрежда, става катод при зареждане. условия най-добра употребаактивните материали са с ниска плътност на тока, високи температуридо нормата. Обикновено причината за неизправността на HITs е пасивиране на електрода– рязко намаляване на скоростта на електрохимичния процес по време на разряда, причинено от промяна в състоянието на повърхността на електрода по време на разряда поради образуването на оксидни слоеве или солни филми. Начинът за борба с пасивирането е да се намали истинската плътност на разрядния ток чрез използване на електроди с развити повърхности. Производството на HIT се отличава с използването на различни токсични вещества (силни окислители, Pb, Hg, Zn, Cd, Ni съединения, използвани във фино диспергирано състояние; киселини, основи, органични разтворители). За осигуряване на нормални условия на работа се планира автоматизиране на производствените процеси, рационални вентилационни системи, включително използване на локално засмукване от устройства с токсични емисии, уплътняващо оборудване, замяна на сухи методи за обработка на прашни материали с мокри, почистване на замърсен въздух и газове от аерозоли и пречистване на промишлени отпадъчни води. HIT е масова употреба национална икономикасвързани с екологични проблеми. Докато оловото от батериите най-вече може да бъде върнато в заводите за рециклиране от потребителите, унищожаването на първичния CIT в малки домакинства не е икономически жизнеспособно.
Всяка Hg-Zn батерия осигурява 5-7 дни работа на слуховия апарат.
Електрическите превозни средства се разработват с помощта на HIT вместо двигатели с вътрешно горене, които тровят атмосферата на градовете с отработени газове. По степен на отрицателно въздействие върху околната среда галваничното производство е на първо място. Причината за изключително негативното въздействие на галваничното производство е, че огромното мнозинство от предприятията в технологични процесисамо 10 - 30% от солите на тежките метали се използват полезно при нанасяне на покритието, докато останалата част попада в околната среда при незадоволителна работа. Изходът е да се сведе до минимум загубата на соли на цветни метали, тоест да се намали отстраняването на електролити от части от галванични вани. Това ще доведе до намаляване на концентрациите и обемите на отпадъчните води и по този начин ще създаде необходимите условияза технологии за приложение с ниско съдържание на отпадъци (LWT) и без отпадъци (LWT). галванични покрития. Първо трябва да изберете правилния електролит. Основен принцип на МОТ и BOT е да се намалят входящите химикали и да се доставят по-малко отрови на изхода от процеса.




