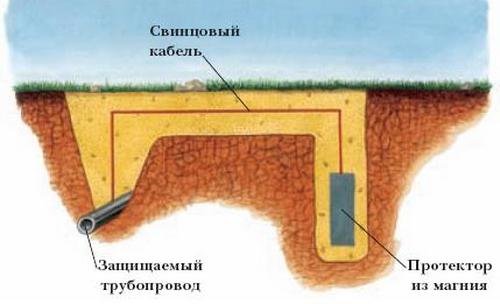
Схема протекторной защиты от коррозии. Переход в ряде конструкций от металлических. Негативное действие электрохимической коррозии
Электрохимическая защита – эффективный способ защиты готовых изделий от электрохимической коррозии . В некоторых случаях невозможно возобновить лакокрасочное покрытие или же защитный оберточный материал, тогда целесообразно использовать электрохимическую защиту. Покрытие подземного трубопровода или же днища морского суда очень трудоемко и дорого возобновлять, иногда просто невозможно. Электрохимическая защита надежно защищает изделие от коррозии , предупреждая разрушение подземных трубопроводов, днищ судов, различных резервуаров и т.п.
Из-за фундаментальной важности обсуждаемой проблемы началось исследование нового поколения дешевых хромостойких покрытий, которые могут быть широко использованы для защиты от высокотемпературной коррозии. Инновационность предлагаемого решения проявляется в покрытиях с низкой толщиной. Исследования окисления проводились при постоянной температуре, а также в условиях термического шока.
Покрытия хрома были получены с помощью магнетронного распыления. Было установлено, что поверхности модифицирующих клапанов стали устойчивы к окислению. Конференция проводилась на английском языке с одновременным переводом всего курса на польский язык.
Применяется электрохимическая защита в тех случаях, когда потенциал свободной коррозии находится в области интенсивного растворения основного металла либо перепассивации. Т.е. когда идет интенсивное разрушение металлоконструкции.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
В нем приняли участие более 150 специалистов по краскам и представители науки из 19 стран, в которых приняли участие более 100 учреждений, из которых более 80% были промышленными единицами. Приступая к работе, мы в основном фокусируемся на технических и финансовых аспектах проекта. При проведении антикоррозийной защиты экологические проблемы сводятся к минимуму загрязнения во время взрывных работ и при нанесении лакокрасочных покрытий. В случае антикоррозионных работ это очень важно из-за использования материалов, которые особенно опасны для окружающей среды.
В зависимости от того, в какую сторону (положительную или отрицательную) смещается потенциал металла, электрохимическую защиту подразделяют на анодную и катодную.
Катодная защита от коррозии
Катодная электрохимическая защита от коррозии применяется тогда, когда защищаемый металл не склонен к пассивации. Это один из основных видов защиты металлов от коррозии. Суть катодной защиты состоит в приложении к изделию внешнего тока от отрицательного полюса, который поляризует катодные участки коррозионных элементов, приближая значение потенциала к анодным. Положительный полюс источника тока присоединяется к аноду. При этом коррозия защищаемой конструкции почти сводится к нулю. Анод же постепенно разрушается и его необходимо периодически менять.
Однако мы не всегда знаем, что осуществление инвестиций может быть серьезно угрозой из-за окружающей природы, особенно из-за окрестности птиц. Инженерные сооружения являются привлекательным местом для создания новых мест обитания птиц. В связи с тем, что наилучший период проведения антикоррозийных работ в поле «совпадает» с периодом земли птиц, мы имеем дело с «конфликтом интересов». Очень часто птицы, населяющие инженерные объекты, принадлежат к охраняемым видам, что приведет к проблеме. Строительство новых инженерных сооружений Строительство новых инженерных сооружений - это предприятия, которые могут существенно повлиять на окружающую среду и в соответствии с Законом об охране окружающей среды в таком случае необходимо получить так называемые решения об условиях окружающей среды.
Существует несколько вариантов катодной защиты: поляризация от внешнего источника электрического тока; уменьшение скорости протекания катодного процесса (например, деаэрация электролита); контакт с металлом, у которого потенциал свободной коррозии в данной среде более электроотрицательный (так называемая, протекторная защита).
Обязательство получить это решение принадлежит инвестору и должно быть получено до принятия других решений, необходимых для осуществления инвестиций. Птицы являются важным элементом окружающей среды, которая окружает нас, что делает необходимым включение этого в экологическое решение. В статье представлено влияние бытовых сточных вод на бетонные кольца, которые использовались для строительства насосных станций. Испытания проводились на образцах бетонных и бетонных продуктов коррозии, которые были собраны из существующих и функционирующих канализационных колодцев.
Поляризация от внешнего источника электрического тока используется очень часто для защиты сооружений, находящихся в почве, воде (днища судов и т.д.). Кроме того данный вид коррозионной защиты применяется для цинка, олова, алюминия и его сплавов, титана, меди и ее сплавов, свинца, а также высокохромистых, углеродистых, легированных (как низко так и высоколегированных) сталей.
Проблема деградации бетона касалась нескольких колодцев всей системы очистки сточных вод и в этой неисправной вентиляции. Авторы указывают, что отсутствие надлежащей вентиляции может быть потенциальной причиной того, что микроклимат сильно агрессивный по отношению к бетону. В исследовании использовались исследования по химическому анализу бетона, а также микроскопические наблюдения. Кроме того, были проведены испытания на прочность бетона, чтобы определить эффекты и масштаб наблюдаемых изменений в результате биологической коррозии в аспекте изменений механических свойств.
Внешним источником тока служат станции катодной защиты, которые состоят из выпрямителя (преобразователь), токоподвода к защищаемому сооружению, анодных заземлителей, электрода сравнения и анодного кабеля.
Катодная защита применяется как самостоятельный, так и дополнительный вид коррозионной защиты.
Главным критерием, по которому можно судить о эффективности катодной защиты, является защитный потенциал . Защитным называется потенциал, при котором скорость коррозии металла в определенных условиях окружающей среды принимает самое низкое (на сколько это возможно) значение.
Ключевые слова: колодец, сульфатная коррозия, сульфатные бактерии. Покрытия характеризовались исследованием их морфологии, химического состава, толщины и шероховатости, а также коррозионного сопротивления поверхностно-модифицированного сплава. Было продемонстрировано положительное влияние присутствия фторида в оксидном слое на коррозионную стойкость образцов сплава. Покрытия были получены с помощью химического осаждения из паровой фазы с плазменной подложкой, созданной с использованием радиочастотных электромагнитных волн.
Следует подчеркнуть, что более высокая температура двигателей и использование альтернативных видов топлива значительно ускоряют деградацию отдельных компонентов двигателя и особенно выпускных клапанов двигателя. Хорошо известно, что он может быть подвержен проникновению хлоридов. Процесс хлорирования является предметом многих трудов. Основной темой этих исследований является: коррозия железобетонных арматур и влияние хлоридов химическое взаимодействие между клионами и цементной матрицей. Модификация по модификации по модификации сделанной по сделанной по сделанной по сделанной по сделанной по сделанной по сделанной по, Ключевые слова: физические свойства, бетон, известковые агрегаты, хлоридная среда, температура окружающей среды.
В использовании катодной защиты есть свои недостатки. Одним из них является опасность перезащиты . Перезащита наблюдается при большом смещении потенциала защищаемого объекта в отрицательную сторону. При этом выделяется. В результате – разрушение защитных покрытий, водородное охрупчивание металла, коррозионное растрескивание.
Известно, что цементный бетон может быть восприимчив к попаданию в хлорид. Описание этого явления для цементного бетона, выполненного из нереактивной гравийной руды, уже было предметом многочисленных работ. В работе были учтены преимущества метода и некоторые неудобства, которые до сих пор не устранены. Вышеупомянутые эффекты коррозии вызывают систематическое снижение несущей способности железобетонных элементов, поэтому важную роль играет оценка арматурной коррозии. После определения коррозионной опасности арматуры в испытанной конструкции вы должны принять немедленное решение о конкретной реабилитации.
Протекторная защита (применение протектора)
Разновидностью катодной защиты является протекторная. При использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом. При этом идет разрушение не конструкции, а протектора. Со временем протектор корродирует и его необходимо заменять на новый.
В дополнение к визуальной оценке также был определен количественный прогресс процесса коррозии. Введение Сталь является важным конструкционным материалом, применимым во многих отраслях промышленности. Однако во многих случаях важно правильно защитить стальные поверхности элементов от коррозии. Одним из способов защиты стали от коррозии является использование металлических покрытий с анодной природой.
В случае появления гальванической ячейки это покрытие представляет собой анод и подвергается процессам разрушающего окисления; подложка в этой системе является катодом и не корродирует. Некоторые из лучших анодных покрытий включают в себя электролитические цинковые покрытия с металлами из группы железа, то есть никелем, кобальтом и железом. Покрытия такого типа изготавливаются электролитически. В промышленности часто приходится маскировать части изделий из стали, нанося слой меди на поверхность. Этот слой затем чаще всего удаляется травлением в растворах хромовой кислоты, что создает огромную экологическую опасность.
Протекторная защита эффективна в случаях, когда между протектором и окружающей средой небольшое переходное сопротивление.
Каждый протектор имеет свой радиус защитного действия, который определяется максимально возможным расстоянием, на которое можно удалить протектор без потери защитного эффекта. Применяется протекторная защита чаще всего тогда, когда невозможно или трудно и дорого подвести к конструкции ток.
В работе была проанализирована возможность использования растворов, содержащих перекись водорода в качестве окислителя и соединений, содержащих комплексы меди. На основе анализа физико-химических данных этилендиаминтетрауксусная кислота была выбрана в качестве потенциального комплекса. Эксперименты показали, что растворы, содержащие это соединение, а также аммиак и перекись водорода, идеально подходят для травления меди со стальной поверхности. Скорость травления меди в их случае в несколько раз выше, чем в случае растворов хромовой кислоты, в то время как они не проявляют коррозионную активность по отношению к стали.
Протекторы используются для защиты сооружений в нейтральных средах (морская или речная вода, воздух, почва и др.).
Для изготовления протекторов используют такие металлы: магний, цинк, железо, алюминий. Чистые металлы не выполняют в полной мере своих защитных функций, поэтому при изготовлении протекторов их дополнительно легируют.
Эта обработка используется для получения поверхностного слоя высокой твердости при сохранении прочного сердечника. Чаще всего эти слои удаляются, а затем травлением в растворах хромовой кислоты, что вызывает проблемы окружающей среды. Возможность замены растворов хромовой кислоты на проблемы кислорода. Результаты были дополнены исследованиями микроструктуры полученных слоев и измерения шероховатости поверхности. Полученные результаты показали, что тип процесса нитроцементации влияет на микроструктуру и коррозионную стойкость полученных поверхностных слоев.
Железные протекторы изготавливаются из углеродистых сталей либо чистого железа.
Цинковые протекторы
Цинковые протекторы содержат около 0,001 – 0,005 % свинца, меди и железа, 0,1 – 0,5 % алюминия и 0,025 – 0,15 % кадмия. Цинковые проекторы применяют для защиты изделий от морской коррозии (в соленой воде). Если цинковый протектор эксплуатировать в слабосоленой, пресной воде либо почвах – он достаточно быстро покрывается толстым слоем оксидов и гидроксидов.
Ключевые слова: нитроцемесные слои, титановые сплавы, коррозионная стойкость, раствор Рингера Введение Хорошие механические свойства, очень хорошая коррозионная стойкость во многих агрессивных средах и биосовместимость позволяют использовать титан и его сплавы в многочисленных медицинские применения.
Он главным образом сделан из медицинских инструментов и костных и кардиальных имплантатов, но из-за присутствия ванадия в его химическом составе его дальнейшее использование подвергается сомнению. Ванадий широко признан аллергическим и канцерогенным элементом, который вызывает воспаление. Обсуждался метод и методика антикоррозионной защиты стальных элементов гидротехнических сооружений, эксплуатируемых в морской воде, особенно в зонах с переменным уровнем воды и брызгами. Выпуск представлен на основе защиты сваи стальных гидротехнических сооружений Северного порта в Гданьске.
Протектор магниевый
Сплавы для изготовления магниевых протекторов легируют 2 – 5 % цинка и 5 – 7 % алюминия. Количество в сплаве меди, свинца, железа, кремния, никеля не должно превышать десятых и сотых долей процента.
Протектор магниевый используют в слабосоленых, пресных водах, почвах. Протектор применяется с средах, где цинковые и алюминиевые протекторы малоэффективны. Важным аспектом является то, что протекторы из магния должны эксплуатироваться в среде с рН 9,5 – 10,5. Это объясняется высокой скоростью растворения магния и образованием на его поверхности труднорастворимых соединений.
Ключевые слова: морские гидротехнические сооружения, коррозия в зоне разного уровня воды и брызг, восстановление защиты от коррозии. Методология и технические характеристики антикоррозийной защиты воды, особенно в зонах прилива и разбрызгивания, являются описано. Порт находится в Северном порту в Гданьске, Польша. Ключевые слова: морские структуры, коррозия в зоне прилива, обновление защиты от коррозии Введение Стальные свай, используемые при строительстве гидротехнических сооружений в Северном порту в Гданьске, введены в эксплуатацию в течение полувека.
Магниевый протектор опасен, т.к. является причиной водородного охрупчивания и коррозионного растрескивания конструкций.
Алюминиевые протекторы
Алюминиевые протекторы содержат добавки, которые предотвращают образование окислов алюминия. В такие протекторы вводят до 8 % цинка, до 5 % магния и десятые-сотые доли кремния, кадмия, индия, таллия. Алюминиевые протекторы эксплуатируются в прибрежном шельфе и проточной морской воде.
Необходимо подчеркнуть, что антикоррозионная защита с самого начала эта свая произошла только на части поверхности в виде битумного покрытия, выполненного из стальных трубных свай. Представлена проблема дефектности антикоррозионной защиты в области окраски защитных и декоративных покрытий, выполненных на стальных элементах барьеров, ранее защищенных методом горячего цинкования. Используя примеры из разных объектов, проблема расслаивания лакокрасочных покрытий повторяется, независимо от типа используемых красок и значительного развития коррозии на открытой подложке из цинка.
Анодная защита от коррозии
Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах.
Внимание было также обращено на случаи нарушений, касающихся одних и тех же элементов, но связанные с отсутствием надлежащего надзора при осуществлении антикоррозийных работ. Ключевые слова: порошковая краска, полиэфирная порошковая краска, мостовой объект, барьер защиты моста, лакокрасочное покрытие на оцинкованной стали, дуплексная защита, дефекты лакокрасочного покрытия, ошибки внедрения элементы, выполненные на основе горячего цинкования, представлены в статье. Примеры, взятые из различных покрытий.
Признавая проблемы поверхности краски. Внимание также относится к другим случаям повреждения. Ключевые слова: мостовые краски, полиэфирные покрытия, мосты, покрытия, мосты, лакокрасочные покрытия на оцинкованной стали, защитные покрытия на мостовых конструкциях. Основным элементом большинства мостовых конструкций являются различные типы защитных барьеров.
При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии.
Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла.
Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией.
Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду.
При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле.
Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону.
Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта.
Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области.
Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина.
Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы.
Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально.
Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием:
Все сварные швы должны быть выполнены качественно;
В технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние;
Количество воздушных карманов и щелей должно быть минимальным;
На конструкции не должно присутствовать заклепочных соединений;
В защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе.
Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму.
Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников.
Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты.
Коррозией называют процесс самопроизвольного разрушения поверхности материалов вследствие взаимодействия с окружающей средой. Ее причиной является термодинамическая неустойчивость химических элементов к определенным веществам. Формально коррозии подвержены полимеры, дерево, керамика, резина, но к ним чаще применяют термин «старение». Наиболее серьезный ущерб наносит ржавление металлов, для защиты которых разрабатываются высокотехнологичные контрмеры. Но об этом мы поговорим позже. Учеными различается коррозия металлов химическая и электрохимическая.
Химическая коррозия
Она возникает обычно при воздействии на металлическую структуру сухих газов, жидкостей или растворов, не проводящих электрический ток. Суть этого типа коррозии - прямое взаимодействие металла с агрессивной средой. Элементы химически корродируют во время термической обработки или в результате длительной эксплуатации при достаточно высоких температурах. Это касается лопаток газовых турбин, арматуры плавильных печей, деталей двигателей внутреннего сгорания и так далее. В результате на поверхности образуются определенные соединения: оксиды, нитриды, сульфиды.
Она является следствием контакта металла с жидкой средой, способной проводить электрический ток. Вследствие окисления материал претерпевает структурные изменения, приводящие к образованию ржавчины (нерастворимого продукта), либо частицы металла переходят в раствор ионов.
Электрохимическая коррозия: примеры
Ее разделяют на:
- Атмосферную, которая возникает при наличии на поверхности металла жидкостной пленки, в которой газы, содержащиеся в атмосфере (например, О 2 , СО 2 , SO 2), способны растворяться с образованием электролитных систем.
- Жидкостную, которая протекает в токопроводящей жидкой среде.
- Грунтовую, что протекает под воздействием грунтовых вод.

Причины
Поскольку обычно любой металл, который используется для промышленных нужд, не является идеально чистым и содержит включения различного характера, то электрохимическая коррозия металлов возникает вследствие образования на поверхности железа большого количества короткозамкнутых локальных гальванических элементов.
Появление их может быть связано не только с наличием различных (особенно металлических) примесей (контактная коррозия), но и с неоднородностью поверхности, дефектами кристаллической решетки, механическими повреждениями и тому подобное.
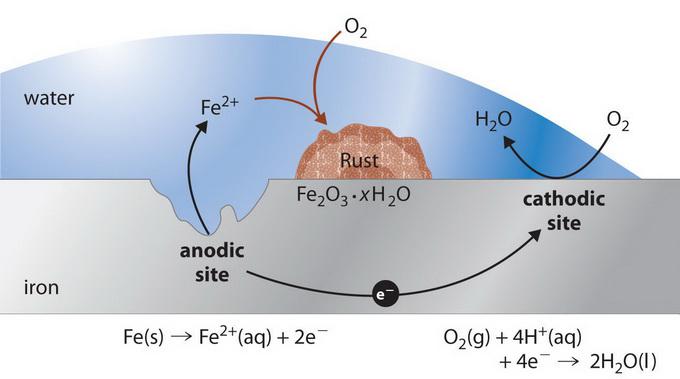
Механизм взаимодействия
Процесс электрохимической коррозии зависит от химического состава материалов и особенностей внешней среды. Если так называемый технический металл покрыт влажной пленкой, то в каждом из указанных гальванических микроэлементов, которые образуются на поверхности, протекают две независимые реакции. Более активный компонент коррозионной пары отдает электроны (к примеру, цинк в паре Zn-Fe) и переходит в жидкую среду в качестве гидратированных ионов (то есть корродирует) по следующей реакции (анодный процесс):
М + nH 2 O = M z + * nH 2 O + ze.
Эта часть поверхности является отрицательным полюсом локального микроэлемента, где металл электрохимически растворяется.
На менее активном участке поверхности, которая является положительным полюсом микроэлемента (железо в паре Zn-Fe), электроны связываются за счет протекания реакции восстановления (катодный процесс) по схеме:
Таким образом, наличие окислителей в водяной пленке, которые способны связывать электроны, обеспечивает возможность дальнейшего хода анодного процесса. Соответственно, электрохимическая коррозия может развиваться только при условии одновременного протекания как анодного, так и катодного процессов. Вследствие торможения одного из них скорость окисления уменьшается.

Процесс поляризации
Оба вышеуказанных процесса вызывают поляризацию соответствующих полюсов (электродов) микроэлемента. Какие здесь есть особенности? Обычно электрохимическая коррозия металлов более существенно замедляется поляризацией катода. Поэтому она будет усиливаться под влиянием факторов, которые предотвращают эту реакцию и сопровождаются так называемой деполяризацией положительного электрода.
Во многих коррозионных процессах катодная деполяризация осуществляется разрядом ионов водорода либо восстановлением молекул воды и соответствует формулам:
- В кислой среде: 2Н + + 2е = Н 2 .
- В щелочной: 2Н 2 О + 2е = Н 2 + 2ОН - .
Диапазон потенциалов
Потенциал, который соответствует этим процессам, в зависимости от природы агрессивной среды, может изменяться от -0,83 до 0 В. Для нейтрального водного раствора при температурах, близких к стандартной, он равен примерно -0,41 В. Следовательно, ионы водорода, содержащиеся в воде и в нейтральных водных системах, могут окислять только металлы с потенциалом, меньшим, чем -0,41 В (расположенные в ряду напряжений до кадмия). Учитывая то, что некоторые из элементов защищены оксидной пленкой, число металлов, подверженных окислению в нейтральных средах ионами водорода, незначительное.
Если влажная пленка содержит растворенный кислород воздуха, то он способен, в зависимости от характера среды, связывать электроны эффектом кислородной деполяризации. В этом случае схема электрохимической коррозии выглядит следующим образом:
- О 2 + 4е + 2Н 2 О = 4ОН - или
- О 2 + 4е + 4Н + = 2Н 2 О.
Потенциалы указанных электродных реакций при температурах, близких к стандартной, изменяются от 0,4 В (щелочная среда) до 1,23 В (кислая среда). В нейтральных средах потенциал процесса восстановления кислорода при указанных условиях соответствует значению 0,8 В. Значит, растворенный кислород способен окислять металлы с потенциалом меньше 0,8 В (расположенные в ряду напряжений до серебра).

Важнейшие окислители
Виды электрохимической коррозии характеризуются окислительными элементами, важнейшими из которых являются ионы водорода и кислород. При этом пленка, содержащая растворенный кислород, в коррозионном отношении значительно опаснее, чем влага, где кислорода нет, и которая способна окислять металлы исключительно ионами водорода, так как в последнем случае количество видов материалов, способных корродировать, значительно меньше.
Например, в стали и в чугуне присутствуют примеси углерода преимущественно в виде карбида железа Fe 3 C. В этом случае механизм электрохимической коррозии с водородной деполяризацией для указанных металлов выглядит следующим образом:
- (-) Fe - 2e + nH 2 O = Fe 2+ · nH 2 O (может образовываться ржавчина);
- (+) 2Н + + 2е = Н 2 (в подкисленной среде);
- (+) 2Н 2 О + 2е = Н 2 + 2ОН - (в нейтральной и щелочной среде).
Механизм коррозии железа, в котором содержатся примеси меди, в случае кислородной деполяризации катода описывается уравнениями:
- (-) Fe - 2e + nH 2 O = Fe 2+ ·nH 2 O;
- (+) 0,5О 2 + Н 2 О + 2е = 2ОН - (в подкисленной среде);
- (+) 0,5О 2 + 2Н + + 2е = Н 2 О (в нейтральной и щелочной среде).
Электрохимическая коррозия протекает с разной скоростью. Этот показатель зависит от:
- разности потенциалов между полюсами гальванического микроэлемента;
- состава и свойств электролитной среды (рН, наличие ингибиторов и стимуляторов коррозии);
- концентрации (интенсивности подачи) окислителя;
- температуры.
Методы защиты
Электрохимическая защита металлов от коррозии достигается следующими способами:
- Созданием антикоррозионных сплавов (легированием).
- Увеличением чистоты индивидуального металла.
- Нанесением на поверхность различных защитных покрытий.
Эти покрытия в свою очередь бывают:
- Неметаллическими (краски, лаки, смазочные материалы, эмали).
- Металлическими (анодные и катодные покрытия).
- Образованными специальной обработкой поверхностей (пассивация железа в концентрированных серной или азотной кислотах; железа, никеля, кобальта, магния в растворах щелочей; образование оксидной пленки, например, на алюминии).
Металлическое защитное покрытие
Наиболее интересной и перспективной является электрохимическая защита от коррозии другим видом металла. По характеру защитного воздействия металлизированные покрытия подразделяют на анодные и катодные. Остановимся на этом моменте более подробно.
Анодным называется покрытие, образованное более активным (менее благородным) металлом, чем тот, что защищают. То есть осуществляется защита элементом, который стоит в ряду напряжений до основного материала (например, покрытие железа цинком или кадмием). При местных разрушениях защитного слоя корродировать будет менее благородный металл-покрытие. В зоне царапин и трещин образовывается локальный гальванический элемент, катодом в котором является ограждаемый металл, а анодом - покрытие, которое окисляется. Целостность такой защитной пленки значения не имеет. Однако чем она толще, тем медленнее будет развиваться электрохимическая коррозия, дольше будет длиться полезный эффект.
Катодным называется покрытие металлом с большим потенциалом, который в ряду напряжений стоит после защищаемого материала (например, напыление низколегированных сталей медью, оловом, никелем, серебром). Покрытие должно быть сплошным, так как при его повреждении образовываются локальные гальванические элементы, в которых основной металл будет анодом, а защитный слой - катодом.

Как уберечь металл от окисления
Электрохимическая защита от коррозии подразделяется на два типа: протекторную и катодную. Протекторная аналогична анодному покрытию. К материалу, который нужно защитить, присоединяют большую пластину более активного сплава. Образуется гальванический элемент, основной металл в котором служит катодом, а протектор - анодом (он корродирует). Обычно для этого типа защиты применяют цинк, алюминий или сплавы на основе магния. Протектор постепенно растворяется, поэтому его нужно периодически заменять.
Много неприятностей в коммунальном хозяйстве и в промышленности в целом доставляет электрохимическая коррозия трубопроводов. В борьбе с ней наиболее подходит метод катодной поляризации. Для этого металлическая конструкция, которая защищается от разрушительных процессов окисления, подключается к отрицательному полюсу какого-либо внешнего источника постоянного тока (она после этого становится катодом, при этом возрастает скорость выделения водорода, а скорость коррозии снижается), а к положительному полюсу присоединяют малоценный металл.
Электрохимические методы защиты эффективны в токопроводящей среде (яркий пример - морская вода). Поэтому протекторы часто используют, чтобы защитить подводные части морских судов.
Обработка агрессивной среды
Этот метод является эффективным, когда электрохимическая коррозия железа протекает в небольшом объеме токопроводящей жидкости. Справиться с разрушительными процессами в этом случае можно двумя способами:
- Удалением из жидкости кислорода (деаэрация) в результате продувки инертным газом.
- Введением в среду ингибиторов - так называемых замедлителей коррозии. Например, в случае если поверхность разрушается в результате окисления кислородом, добавляют органические вещества, молекулы которых содержат определенные аминокислоты (имино-, тио- и другие группы). Они хорошо адсорбируются на поверхности металла и существенно снижают скорость электрохимических реакций, приводящих к разрушениям поверхностного контактного слоя.
Вывод
Безусловно, коррозия химическая и электрохимическая приносит значительный ущерб и в промышленности, и в быту. Если бы металл не корродировал, срок службы многих предметов, деталей, агрегатов, механизмов значительно увеличился бы. Сейчас ученые активно разрабатывают альтернативные материалы, способные заменить металл, не уступающие по эксплуатационным характеристикам, однако полностью отказаться от его применения в ближайшей перспективе, наверное, невозможно. В этом случае на передний план выходят передовые методы защиты металлических поверхностей от коррозии.