Гальванический элемент. Понятие ЭДС. Элемент Даниэля-Якоби
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию.
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).
Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO 4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO 4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода ![]() . Стандартный электродный потенциал медного электрода
. Стандартный электродный потенциал медного электрода ![]() . Так как
. Так как ![]() , то атомы цинка будут окисляться:
, то атомы цинка будут окисляться:
Электрод, на котором идет реакция восстановления или которыйпринимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO 4 2– к аноду, катионов Zn 2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
Схема гальванического элемента Даниэля – Якоби имеет вид:
Zn | ZnSO 4 || CuSO 4 | Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е . Она вычисляется по формуле;
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ∆G 0 связана с константой равновесия этой реакции К равн соотношением
| (9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными . Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
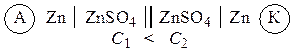
Пример 1. Составьте схему гальванического элемента, в основе которого лежит реакция: Mg + ZnSO 4 = MgSO 4 + Zn. Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
Решение
В таблице находим значения стандартных электродных потенциалов систем Zn/Zn 2+ и Mg/Mg 2+ :
![]()
![]()
Поскольку ![]() , то магниевый электрод выполняет функцию анода, а цинковый – катода. Схема гальванического элемента имеет вид:
, то магниевый электрод выполняет функцию анода, а цинковый – катода. Схема гальванического элемента имеет вид:
На аноде идет процесс окисления:
![]()
На катоде – восстановление катионов среды:
![]()
Стандартная ЭДС гальванического элемента
Е = φ 0 к – φ 0 а = –0,763 – (–2,37) = 1,607 В.
По уравнениям (9.5) и (9.6) вычислим константу равновесия токообразующей реакции:
Потенцируя, находим К равн = 3,5 ∙10 54 .
Поскольку К >>1, то токообразующая реакция практически необратима.
Пример 2. Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей. Концентрации ионов в растворах: C Zn 2+ = 0,1 моль/л, C Ag + = 0,01 моль/л. Укажите, какой электрод является катодом, а какой – анодом. Напишите уравнения реакций, протекающих на электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
Решение
Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствует значение температуры, то ее принимают равной стандартной температуре Т = 298 К. Поэтому будем использовать уравнение (9.2):
![]()
Подставим числовое значение концентрации в формулу Нернста, используя данные таблицы 9.1:
Из расчета видно, что ![]() . Поэтому цинковый электрод выполняет функцию анода, а серебряный – катода.
. Поэтому цинковый электрод выполняет функцию анода, а серебряный – катода.
Схема гальванического элемента:
Вычислим ЭДС элемента по формуле (9.4):
Е = φ к – φ а = 0,741 – (-0,789) = 1,530 В.
Теперь запишем электродные реакции. На аноде происходит процесс окисления:
![]()
а на катоде – процесс восстановления:
![]()
Складывая уравнения электродных процессов (с учетом равенства числа принимаемых и отдаваемых электронов), получаем суммарное уравнение токообразующей реакции: Zn + 2Ag + = Zn 2+ + 2Ag.
Задачи
221–226 Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. таблицу). На основании значений стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
| № задачи | Реакция | Ответ |
| Sn + PbCl 2 = SnCl 2 + Pb | К р = 2,0; E = 9∙10 – 3 B | |
| Zn + Pb(NO 3) 2 = Zn(NO 3) 2 + Pb | К р = 3,5∙10 21 ; E = 0,633 B | |
| Zn + 2AgNO 3 = Zn(NO 3) 2 + 2Ag | К р = 8,7∙10 52 ; E = 1,56 B | |
| Ni + 2AgNO 3 = Ni(NO 3) 2 + 2Ag | К р = 3,8∙10 35 ; E = 1,05 B | |
| Zn + CdSO 4 = ZnSO 4 + Cd | К р = 1,56∙10 12 ; E = 0,36 B | |
| Mg + Ni(NO 3) 2 = Mg(NO 3) 2 + Ni | К р = 1,7∙10 8 ; E = 8,23 B |
227–233 Рассчитайте значения электродных потенциалов металла, являющегося анодом, при различных концентрациях раствора: 10; 0,1; 0,01; 0,001 моль/л. Концентрация раствора, в который погружен катод, постоянна и равна 1 моль/л. Определите ЭДС.
Постройте график зависимости ЭДС гальванического элемента от логарифма концентрации раствора, в который погружен анод. Напишите уравнение токообразующей реакции, протекающей в гальваническом элементе.
234–236 Одним из электродов гальванического элемента является металл (см. таблицу), погруженный в раствор своей соли с концентрацией ионов 0,01 моль/л, а другим – водородный электрод. ЭДС этого элемента составляет Е , В. Напишите уравнения катодной и анодной реакций, приведите схему гальванического элемента. Рассчитайте потенциал водородного электрода и концентрацию ионов водорода в растворе. Т = 298 K.
237–240 Запишите уравнения электродных реакций и составьте схему гальванического элемента, работа которого выражается уравнением, представленным в таблице. Укажите, какой электрод является катодом и анодом. Рассчитайте значения электродных потенциалов при концентрациях растворов анода С 1 и катода С 2 (см. таблицу). Определите ЭДС этого элемента.
241–244 Составьте схему гальванического элемента, состоящего из двух металлов Ме 1 и Ме 2 , погруженных в раствор собственных солей с концентрацией ионов С 1 и С 2 (см. таблицу). Укажите, какой электрод является катодом и анодом. Напишите уравнения реакций, протекающих на данных электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
245 –247 Рассчитайте значения электродных потенциалов металлов, приведенных в условии задачи, при концентрациях растворов С 1 (для 1-го металла) и С 2 (для 2-го металла). Определите анод и катод. Вычислите ЭДС элемента.
Аналогичные расчеты проведите для концентраций растворов, уменьшенных в 10 раз. Изменится ли ЭДС?
Приведите уравнения электродных реакций.
248 Какой гальванический элемент называется концентрационным? Составьте его схему. Напишите уравнения анодного и катодного процессов, вычислите ЭДС. Гальванический элемент состоит из серебряных электродов, опущенных: первый в 0,01 М, а второй в 0,1 М растворы AgNO 3 .
Ответ: 0,059 В.
249 Составьте схему двух гальванических элементов, в одном из которых никель был бы анодом, в другом – катодом. Напишите для каждого из них уравнения реакций, протекающих на аноде и на катоде, и рассчитайте ЭДС гальванических элементов при стандартных условиях. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов уменьшить в 10 раз?
250 Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, проходящих на катоде и аноде.
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия – самопроизвольное разрушение металлов в результате взаимодействия с окислителями окружающей среды.
Это окислительно-восстановительный процесс, в котором металл выступает в качестве восстановителя. Первопричиной коррозии является термодинамическая неустойчивость металла в окружающей среде и возможность его перехода в более устойчивое (окисленное) состояние.
Иногда коррозию называют ржавлением. Ржавление – коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидроксидов железа разной степени гидратации, желто-коричневого цвета. Цветные металлы корродируют, но не ржавеют. По характеру разрушения коррозия делится на избирательную , сплошную (равномерную и неравномерную), локальную (пятнистую, питтинговую, или язвенную), коррозионное растрескивание и межкристаллическую коррозию. По виду среды, в которой протекает процесс, коррозия бывает почвенной, атмосферной, электролитической, газовой, под действием блуждающих токов. В зависимости от механизма протекания и внешних условий коррозию подразделяют на химическую и электрохимическую.
Химическая коррозия протекает в газовой среде при повышенных температурах (в отсутствие влаги) или в жидких неэлектролитах. Сущность процессов коррозии этого вида сводится к окислительно-восстановительной реакции, осуществляемой при непосредственном переходе электронов металла на окислитель. В качестве окислителя могут выступать такие газы, как O , SO , Cl , HCl и др. Коррозии способствует также H 2 S, CO . В результате реакции на поверхности металла образуются пленки оксидов, сульфидов, хлоридов и т. д.
Развитие коррозии происходит за счет переноса катионов металла, частиц окислителя или электронов через образовавшуюся пленку. Если пленка плотная, сплошная, хорошо сцепленная с металлом, то дальнейшее окисление металла протекает очень медленно. Такие пленки могут быть использованы для защиты металлов от коррозии. Наоборот, рыхлая пленка не способна защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Защитные свойства образовавшихся продуктов коррозии определяется на основании расчета фактора рыхлости Ф:
| | (10.1) |
где V – мольный (молярный) объем продуктов коррозии (оксида, хлорида, сульфида и др.);
V – мольный (молярный) объем металла, пошедшего на образование оксида;
М – молярная масса продуктов коррозии;
r – плотность металла;
n – число атомов металла в продукте коррозии;
А – атомная масса металла;
r – плотность продукта коррозии.
Если Ф < 1, то образуется пленка, частично покрывающая поверхность металла (рыхлая пленка). Сплошная пленка, обладающая защитным действием, получается лишь при условии 1< Ф < 2,5. Если фактор рыхлости Ф > 2,5, то в пленке возникают напряжения, разрушающие ее и нарушающие сплошность (пленка вспучивается и растрескивается).
Пример 1. При химической коррозии железа в атмосфере сухого воздуха, содержащего газообразные H 2 S и O 2 , образуются пленки FeS и FeO. Напишите уравнения образования этих соединений. Рассчитайте фактор рыхлости Ф и сделайте вывод о защитных свойствах пленок. Плотность r = 7,87; r = 4,7; r = 5,7 г/см .
Решение
Пленки образуются при взаимодействии металла с агрессивной средой в результате следующих реакций:
2Fe + 2H 2 S + O = 2FeS + 2H 2 O;
2Fe + O 2 = 2FeO.
Подставив числовые значения в (10.1), находим фактор рыхлости:
![]() ,
,
![]() .
.
Поскольку для сульфидной пленки Ф > 2,5, то возможно ее растрескивание и нарушение сплошности.
Критерий Ф для оксидной пленки лежит в интервале 1 < Ф < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами.
Электрохимическая коррозия – самопроизвольное разрушение металлов в присутствии электролита в результате образования гальванических пар при контакте разнородных металлов, например запорной арматуры и трубопровода, или множества микрогальванических элементов на поверхности металлического сплава. К числу важнейших типов электрохимической коррозии относится коррозия атмосферная, подземная, в морской и пресной воде, сероводородная, кислотная, щелочная, в расплавленных солях, в водно-органических и органических средах. Основное отличие электрохимической коррозии от химической заключается в пространственном разделении реакций окисления металла и восстановления окислителя, протекающих на катодных и анодных участках. При электрохимической коррозии процессы окисления и восстановления протекают на участках, имеющих различное химическое строение или физическое состояние поверхности, то есть химическую и энергетическую неоднородность. Эта неоднородность может возникать при неодинаковом фазовом и химическом составе металла и сплава, при наличии примесей в металле, при неодинаковой химической обработке, при неодинаковой концентрации окружающего электролита, при неоднородности и разной толщине пленок продуктов коррозии и т. д.
Количественно различную активность поверхностных участков можно охарактеризовать величиной электродного потенциала φ, который возникает на границе «металл – раствор» (табл. 9.1). Более активные участки поверхности имеют меньшее значение электродного потенциала (более отрицательное) и называются анодными участками. Участки с меньшей активностью называются катодными.
На анодных участках происходит окисление металла, то есть его разрушение:
Mе – nē → Mе ,
где Mе – катионы металла, переходящие в раствор;
Ме 0 – металл.
Электроны остаются внутри металла и перемещаются от анодных участков к катодным участкам, с которыми они непосредственно контактируют и на которых происходит восстановление ионов и молекул окислителя, находящихся в коррозионной среде . В зависимости от состава среды протекают следующие процессы:
– в кислой среде:
2Н + 2ē = Н ;
– в нейтральной или слабощелочной среде:
2Н 2 O + 2ē = Н + 2OH .
Наиболее вероятным катодным процессом в нейтральной среде при наличии растворенного в воде воздуха (атмосферная, почвенная коррозия, влажный воздух) является следующий:
O 2 + 2H 2 O + 4ē = 4OH .
Пример 2. Составьте электронные уравнения катодного и анодного процессов коррозии железного сплава с никелем в соляной кислоте и во влажном воздухе. Каков состав продукта коррозии?
Решение
Выпишем из таблицы 9.1 значения стандартных электродных потенциалов металлов: φ 0 = –0,44 В, φ 0 = –0,25 В. Поскольку φ 0 < φ 0 , то железо будет выполнять функцию анода, а никель – катода.
В кислой среде электронные уравнения процессов имеют вид:
– анодная реакция: Fе 0 – 2ē = Fе 2+ ;
– катодная реакция: 2Н + + 2ē = Н 0 2 .
Продуктами коррозии являются хлорид железа FeCl и водород.
Во влажном воздухе на катодном и анодном участках происходят следующие реакции:
– анодная реакция: Fе – 2ē = Fе ;
– катодная реакция: 2Н O + O + 4ē = 4OH .
Продукты коррозии Fе + 2OH = Fе(OH) .
В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния:
4Fе(OH) + 2Н O + O = 4Fе(OH) .
Для количественной оценки коррозионной стойкости металлов используют массовый (j ) и глубинный (П) показатели.
Скорость химической реакции определяется из соотношения:
где ∆m – изменение массы образца, г;
– время коррозии, час или год;
S – площадь поверхности коррозии, м 2 .
Глубинный показатель коррозии П равен:
| П = , мм/год, | (10.3) |
где ∆h – толщина металла, разрушенного в течение времени t.
Величины П и j связаны соотношением:
Если j измеряется в г/м 2. год,
Если j измеряется в г/м 2. ч,
где r – плотность металла, г /см 3 .
По вышеприведенным показателям оценивается, как правило, общая коррозия системы.
Защита от коррозии
Поскольку, как отмечалось выше, процесс электрохимической коррозии заключается в протекании взаимосвязанных катодной и анодной реакций, то замедление одной из них приводит к снижению скорости коррозионного процесса в целом.
Методы защиты от коррозии можно разделить на три группы:
– воздействие на металл;
– воздействие на агрессивную среду;
– комбинированные методы защиты.
К первой группе относятся:
а) легирование металлов – создание экранирующего поверхностного слоя или введение элементов, понижающих катодную или анодную активность сплава;
б) обработка поверхности металла – термическая обработка, напыление, механическая обработка (наклеп и т. п.), модифицирование ржавчины на поверхности;
в) нанесение защитных покрытий;
г) подбор коррозионно-стойких материалов;
д) рациональное конструирование – вывод отдельных узлов конструкции из агрессивных сред.
Вторая группа методов защиты включает:
а) применение ингибиторов коррозии;
б) деаэрация среды;
в) создание искусственных сред (обработка водных сред, применение нейтральных сред, осушение воздуха).
Третья группа методов защиты использует комбинацию вышеперечисленных методов.
Защитные покрытия можно подразделить на органические (битум, краски, эмали, лаки), неорганические (оксидные, фосфатные, нитридные и другие пленки) и гальванические (металлические, полученные путем электролиза).
Неорганические (химические) покрытия получают обработкой металла определенными химическими веществами. При взаимодействии этого вещества с поверхностью металла образуется пленка прочного неорганического соединения, которая предохраняет металл от разрушения.
Гальванические покрытия делятся на катодные и анодные (рис. 10.1) в зависимости от соотношения стандартных электродных потенциалов защищаемого материала j 0 и покрытия j 0 . Если j 0 > j 0 , то при нарушении целостности защитного покрытия анодом будет металл покрытия (анодное покрытие ), катодом – защищаемый металл.
Анодное покрытие очень эффективно, так как оно, разрушаясь, предохраняет защищаемый металл от разрушения. Примером анодного покрытия по отношению к железу являются цинковые и магниевые покрытия сталей. Если j 0 < j 0 , то при нарушении целостности покрытия защищаемый металл будет анодом, а металл покрытия – катодом (катодное покрытие ). Катодные покрытия защищают металл до тех пор, пока эти покрытия будут сплошными.
среда среда
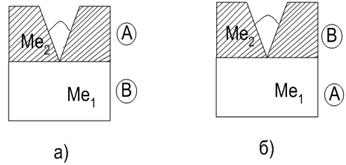
Рис. 10.1. Гальванические покрытия: а) анодное покрытие j 0 1 > j 0 2 ; б) катодное покрытие j 0 1 < j 0 2 . Ме 1 – защищаемый металл, Ме 2 – металл покрытия (А – анод, В – катод)
Электрохимическая защита подразделяется на катодную, протекторную и анодную. Первые два вида электрохимической защиты осуществляются с помощью создания гальванического элемента, в котором роль катода выполняет защищаемый металл. Это достигается с помощью контакта его с более активным металлом – протектором (имеющим меньшее значение стандартного электродного потенциала) или подключения изделия к отрицательному полюсу внешнего источника тока (катодная защита).
Анодная защита происходит при подключении металла к положительному полюсу источника тока и формированию на его поверхности прочного оксидного слоя за счёт анодного окисления под действием электролиза (и смещении его электродного потенциала в область пассивного состояния).
Ингибиторами называют добавляемые в небольших количествах в агрессивную среду вещества, которые накапливаются на границе «металл – электролит» и снижают скорость коррозии. Эффективность действия ингибиторов оценивается величинами коэффициента торможения К и степени защиты Z :
![]()
где ј – скорость коррозии в растворе без ингибитора;
ј – скорость коррозии в растворе с ингибитором.
Величина К показывает, во сколько раз снижается скорость коррозии металла при введении ингибитора. Величина Z характеризует относительное понижение скорости коррозии. На защитное действие ингибиторов существенное влияние оказывает ряд внешних и внутренних факторов коррозии: кислотность среды, температура, природа кислоты и защищаемого материала, природа растворителя и самого ингибитора, концентрация ингибитора, перемешивание и др.
Пример 3. Можно ли использовать цинковое покрытие для защиты стального изделия от коррозии во влажном воздухе? Составьте электронные уравнения катодного и анодного процессов коррозии, наблюдаемой при нарушении этого покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило 5 лет, если величина его глубинного показателя П равна 0,16 мм/год? Покрытие считается недействующим, если его остаточная толщина составляет 18 % от первоначального значения.
Решение
Сопоставляя электродные потенциалы j 0 Zn / Zn 2+ = –0,76 В и j 0 Fe / Fe 2+ = –0,44 В, видим, что j 0 Zn < j 0 Fe .Следовательно, цинк по отношению к железу является анодом. Цинковое покрытие – анодное покрытие. На аноде идет процесс окисления:
Zn – 2ē = Zn 2+ .
На катоде (Fe) – процесс восстановления частиц среды (во влажном воздухе это кислород и вода):
2Н O + O + 4ē = 4OH .
Продукты коррозии: Zn 2+ + 2OH - = Zn(OH) 2 .
При нарушении покрытия сталь не растворяется, следовательно, цинковое покрытие использовать можно.
Толщину покрытия ∆h можно найти из уравнения:
откуда ∆h = П×t = 0,16 . 5 = 0,8 мм.
Но коррозии подвержено 82 % первоначальной толщины. Тогда вся толщина покрытия должна быть равна 100 %:
![]()
Задачи
251 –255 Составьте электронные уравнения анодного и катодного процессов коррозии стального трубопровода (основной компонент стали – железо), содержащего примеси металла А, во влажной почве (присутствуют вода и кислород). Каков состав продуктов коррозии? Рассчитайте толщину стенок трубопровода (мм), который должен прослужить τ лет, если скорость его коррозии равна j . Остаточная толщина стенок трубопровода должна быть не меньше 25 % от первоначального значения. Плотность железа r = 7,87 г/см 3 .
256–259 Можно ли использовать предлагаемый материал в качестве протектора для защиты стального изделия от коррозии в природной воде, насыщенной кислородом (основной компонент стали – железо)? Составьте электронные уравнения анодного и катодного процессов коррозии. Каков состав продуктов коррозии? Определите возможный срок службы протектора сечением «а×в» , если скорость его коррозии j , г/м 2 ×год, а масса m , г.
260–262 Можно ли использовать предполагаемое покрытие для эффективной защиты стального изделия от коррозии во влажном воздухе? (Основной компонент стали – железо.)
Составьте электронные уравнения анодного и катодного процессов коррозии, возникающей при нарушении целостности покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило τ лет, если величина его глубинного показателя П, мм/год? Покрытие считается действующим до тех пор, пока его остаточная толщина не составит 15 % от первоначального значения.
263–266 При химической коррозии металлов Ме в атмосфере сухого воздуха, содержащего газообразные O 2 ; HCl; H 2 S, под воздействием высоких температур образуются пленки продуктов коррозии. Напишите уравнения образования соединений. Зная плотности металлов, их оксидов, хлоридов, сульфидов, определите, какие из пленок будут обладать защитным действием.
| № задачи | Металл, Ме | r , г/см 3 | Продукты коррозии и их плотности, г/см 3 |
| Fe | 7,87 | FeO –5,7; Fe 2 O 3 –5,25; FeCl 2 – 2,9; FeS 2 – 5,03; Fe 3 O 4 – 5,18 | |
| Cu | 8,94 | CuO – 6,46; Cu 2 O – 3,7; CuCl 2 – 3,05; Cu 2 S – 5,4; CuS – 4,68 | |
| Mn | 7,74 | MnO –5,18; Mn 2 O 3 – 4,3; Mn 3 O 4 – 7,42; MnCl 2 – 2,98; MnO 2 – 5,03 | |
| Ni | 8,91 | NiO – 7,45; Ni 2 S 3 – 5,82; NiCl 2 – 3,51; NiS – 4,12 |
267–270 Металлическое изделие, содержащее примесные включения А (см. таблицу), сильно корродирует в растворе HCl. Для замедления процесса в растворах кислот используют ингибиторы. Определите коэффициент торможения коррозии К и степень защиты Z , которые обеспечивает ингибитор, если за t часов потери массы изделия площадью S составляют m 0 граммов в отсутствие ингибитора и m граммов при его наличии. Составьте электронные уравнения анодного и катодного процессов коррозии изделия в кислоте. Каков состав продуктов коррозии?
Ответ: 267) 3,5; 71,2 %; 268) 8,0; 87,6 %; 269) 8,0; 87,6 %; 270) 2,6; 61,6 %.
ЭЛЕКТРОЛИЗ
Электролиз – совокупность окислительно-восстановительных процессов, происходящих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита .
Анод (А) – это электрод, на котором происходит процесс окисления. Катод (К) – электрод, на котором происходит процесс восстановления. При электролизе катод подключается к отрицательному полюсу источника тока, а анод – к положительному.
Рассмотрим сущность процесса на примере электролизарасплава NaОН с угольными электродами. В расплавах, как и в растворах, молекулы электролитов диссоциируют на ионы:
NaОН Á Na + + ОН – .
Прохождение электрического тока вызывает направленное перемещение ионов. Катионы натрия Na + движутся к катоду и принимают от него электроны:
Анионы ОН – подходят к аноду и отдают электроны:
Суммарная реакция электролиза расплава вещества NaОН представлена суммой двух электродных процессов и выражается уравнением:
Электролиз расплавов солей или оксидов используют в технике для получения активных металлов (Li, Na, K, Ca, Al).
В водных растворах , кроме ионов самого электролита, находятся молекулы воды, которые также могут участвовать в процессах окисления и восстановления на электродах.
Для определения результатов электролиза растворов можно пользоваться следующими правилами.
Катодные процессы
На катоде легче восстанавливаются катионы с бóльшим стандартным электродным потенциалом φ 0 .
Так, если стандартный электродный потенциал металла больше величины –0,41 В, то на катоде обычно восстанавливаются ионы этого металла. Если потенциал металла находится в интервале , то на катоде одновременно восстанавливаются и ионы металла, и вода. Если потенциал металла меньше величины –1,4 В, то на катоде восстанавливается только вода. Отмеченное выше можно представить в виде следующей схемы:
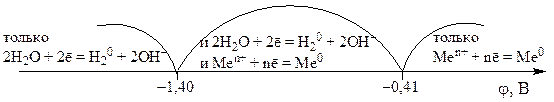
Анодные процессы
Аноды, используемые при электролизе, подразделяются на инертные (графит, уголь, платина, золото, иридий) и активные (остальные металлы).
На аноде в первую очередь окисляется система с меньшим окислительно-восстановительным потенциалом. Но в ряде случаев из-за сложности разряда кислородосодержащих ионов (NO – 3 , SO 2– 4 , PO 3– 4 , CO 2– 3 и т. д.) это правило не выполняется. Вид анодной реакции в общем случае определяется природой разряжающей частицы.
В случае использования активного (растворимого ) анода окисляется металл анода:
Ме 0 – nē = Ме n+ .
При электролизе с инертным анодом легко окисляются простые анионы бескислородных кислот, присутствующие в растворе (I – , Br – , Cl –).
Сложные ионы кислородсодержащих кислот (SO , CO , PO и др.) в водных растворах, как правило, не окисляются – вместо них окисляется вода:
2Н 2 О – 4ē = О 2 + 4Н + .
Последовательность процессов окисления на аноде можно представить следующей схемой:
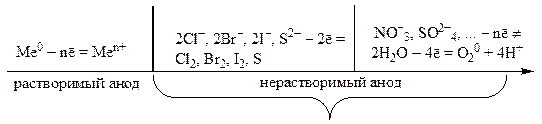
Пример 1. Составить уравнения катодного и анодного процессов, протекающих при электролизе водного раствора K 2 SO 4 на угольных электродах.
Решение
В водном растворе соль K 2 SO 4 диссоциирует: K 2 SO 4 Á 2К + + SO 2– 4 .
К катоду подходят катионы К + и молекулы Н 2 О, к аноду – ионы SO 2– 4 и молекулы Н 2 О. Поскольку потенциал системы ![]() (см. табл. 9.1) меньше, чем –1,4 В, на катоде будут восстанавливаться молекулы воды (см. вышеприведенную схему).
(см. табл. 9.1) меньше, чем –1,4 В, на катоде будут восстанавливаться молекулы воды (см. вышеприведенную схему).
Анионы SO 2– 4 – это сложные ионы, в водных растворах они не окисляются. Поэтому на аноде окисляются молекулы воды.
Раствор у катода подщелачивается (появляются ионы ОН –), у анода становится более кислым (появляются ионы Н +). Суммарное молекулярное уравнение реакции электролиза:
КОН и Н 2 SO 4 образуются из К + и ОН – , Н + и SO 2 – 4 , находящихся в растворе.
Пример 2. Составить уравнения катодного и анодного процессов, протекающих при электролизе раствора CuCl 2 с медным анодном.
Решение
В водном растворе соль CuCl 2 диссоциирует: CuCl 2 Á Сu 2+ + 2Cl – .
К катоду подходят катионы Сu 2+ и Н 2 О; к аноду – ионы Cl – и Н 2 О. Медный анод – растворимый, он принимает участие в электродной реакции. Потенциал φ 0 С u/ Cu2+ = 0,34 В, и на катоде, в соответствии с вышеприведенной схемой, будет восстанавливаться Сu 2+ . В анодном процессе участвует металл анода (Cu-растворимый анод):
В результате электролиза медь переносится с анода на катод, а соль оказывается не затронутой этим процессом и обеспечивает лишь электропроводность.
Количественная характеристика процессов электролиза даётся законами Фарадея . Им можно дать следующую общую формулировку:
масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Объединенный закон Фарадея выражается следующим уравнением:
где А – атомная масса вещества простого вещества, выделяющегося на электроде;
n – заряд иона или число электронов, принимающих участие в процессе электролиза;
I – сила тока в амперах, А;
t – время пропускания тока в секундах, с;
F – число Фарадея (F = 96 500 Кл/моль).
Эквивалентная масса вещества .
Поскольку обычно имеются конкурирующие процессы, законы Фарадея нуждаются в поправках.
Отношение массы фактически выделившегося на электроде вещества m пр. к массе вещества, которая должна была выделиться в соответствии с законом Фарадея, называется выходом по току h:
![]() .
.
Пример 3 . При прохождении электрического тока силой 1 А через раствор FeCl 2 (электроды инертные) в течение 1 ч выделилось 0,90 г железа. Определите выход по току. На какие процессы расходуется остальной ток?
Решение
Так как атомная масса Fe равна 56 г/моль, то в соответствии с законом Фарадея теоретическое значение массы железа, выделяющегося на катоде, составляет:
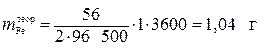 .
.
Выход по току:
Обратимся к схеме процессов на катоде. Поскольку величина ![]() лежит в области –1,4 В < φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
лежит в области –1,4 В < φ < –0,41 В, то на катоде идет совместное восстановление ионов железа Fe 2+ и молекул воды. Преимущественно восстанавливаются ионы Fe 2+ :
Fe 2+ + 2ē = Fe
и, частично, молекулы воды:
2Н 2 O + 2ē = Н 2 + 2OH – .
Таким образом, часть тока, протекающая через электролит, затрачивается на восстановление воды.
Пример 4. Электрический ток силой 1 А проходит в течение 1 часа через раствор ZnCl 2 (электроды инертные). Определить количество выделившегося на катоде за указанное время цинка, если выход по току hравен 64%. Объяснить, на какие процессы расходуется остальной ток.
Решение
Потенциал ![]() В (см. табл. 9.1) и лежит в области
В (см. табл. 9.1) и лежит в области
–1,4 В < j < -0,41 В. Следовательно, на катоде будет идти совместное восстановление катионов Zn 2+ и, частично, молекул воды:
Zn 2+ + 2ē = Zn
2H 2 O + 2ē = 2OH - + H 2 (частично, побочный процесс)
Для определения теоретического количества выделившегося на катоде цинка воспользуемся уравнением закона Фарадея:
Выход по току вычисляется по формуле
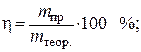
следовательно
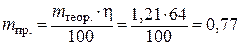 г.
г.
На получение цинка на катоде расходуется 64 % всего прошедшего через электролит тока, остальной ток тратится на восстановление воды.
Задачи
271–277
Масса твердого вещества, выделившегося на катоде при электролизе раствора вещества Б при прохождении тока I (А) в течение времени τ (ч), составляет m (г). Вычислите выход по току. Объясните, почему в ряде случаев не весь ток расходуется на выделение металла.
| № задачи | Соединения | Растворимый анод | I , А | τ, час | m , г | ||
| А | Б | В | |||||
| KCl | SnCl 2 | ZnSO 4 | Zn | 8,5 | 36,6 | ||
| FeCl 2 | ZnSO 4 | MgCl 2 | Mg | 1,5 | 11,3 | ||
| NaOH | FeCl 2 | MnSO 4 | Mn | 0,5 | 4,2 | ||
| PbCl 2 | Cu(NO 3) 2 | FeCl 2 | Fe | 7,1 | |||
| Ca(OH) 2 | NiCl 2 | AlCl 3 | Al | 9,3 | 18,8 | ||
| LiBr | MnSO 4 | CoCl 2 | Co | 10,5 | 0,5 | 3,0 | |
| SnCl 2 | FeSO 4 | Pb(NO 3) 2 | Pb | 8,8 | 14,2 |
Ответ:
271) 97 %; 272) 62 %; 273) 67 %; 274) 99 %; 275) 91,9 %;
276) 55,8 %; 277) 77,3 %.
278–284. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Вычислите время, необходимое для практического получения 100 г металла из раствора вещества Б при силе тока I , если выход по току h.
| № задачи | Вещества | Растворимый анод | I , A | h, % | ||
| А | Б | В | ||||
| SnCl 2 | Fe(NO 3) 2 | NiSO 4 | Ni | 66,7 | ||
| Ni(OH) 2 | CoCl 2 | Pb(NO 3) 2 | Pb | 9,5 | ||
| MgCl 2 | ZnSO 4 | NiSO 4 | Zn | 6,4 | ||
| ZnCl 2 | AgNO 3 | CuCl 2 | Cu | 14,8 | ||
| CuBr 2 | Cd(NO 3) 2 | AgNO 3 | Ag | 8,7 | ||
| NaOH | Pb(NO 3) 2 | NiCl 2 | Ni | 5,9 | ||
| PbCl 2 | CоSO 4 | Mg(NO 3) 2 | Mg |
Ответ: 278) 12 ч; 279) 10 ч; 280) 17,3 ч; 281) 1,7 ч; 282) 6,4 ч; 283) 4,7 ч; 284) 12,3 ч.
285–291 Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Как изменится масса анода после пропускания тока силой I (А) в течение времени τ (ч) через раствор В?
| № задачи | Вещества | Растворимый анод | I , A | τ , час | ||
| А | Б | В | ||||
| NaI | MgSO 4 | ZnCl 2 | Zn | 8,5 | ||
| CaCl 2 | Cu(NO 3) 2 | FeCl 2 | Fe | |||
| RbCl | AgNO 3 | CuSO 4 | Cu | 7,5 | 2,5 | |
| KOH | ZnCl 2 | CoCl 2 | Co | 3,7 | ||
| CuCl 2 | NaNO 3 | Pb(NO 3) 2 | Pb | 2,5 | ||
| NaOH | Bi(NO 3) 3 | NiCl 2 | Ni | 2,0 | 2,5 | |
| CaI 2 | H 2 SO 4 | Cd(NO 3) 2 | Cd | 6,8 | 0,8 |
Ответ:
285) 20,6 г; 286) 31,3 г; 287) 22,4 г; 288) 4,1 г; 289) 38,6 г;
290) 5,5 г; 291) 7,1 г.
292–300 Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Постройте график зависимости изменения массы растворимого анода m от силы тока I при времени электролиза 0,5 ч. Сила тока I равна 0,5; 1; 2; 3 и 5 А.
| № задачи | Соединения | Растворимый анод | ||
| А | Б | В | ||
| KOH | Na 2 SO 4 | NiCl 2 | Ni | |
| RbCl | Li 2 SO 4 | Pb(NO 3) 2 | Pb | |
| NaCl | Ni(NO 3) 2 | AgNO 3 | Ag | |
| AlCl 3 | Fe 2 (SO 4) 3 | CuSO 4 | Cu | |
| NaI | Cu(NO 3) 2 | ZnCl 2 | Zn | |
| SnCl 2 | CoSO 4 | CuSO 4 | Cu | |
| CoCl 2 | BiСl 3 | AgNO 3 | Ag | |
| № задачи | Соединения | Растворимый анод | ||
| А | Б | В | ||
| KCl | SnCl 2 | ZnSO 4 | Zn | |
| NaI | Cu(NO 3) 2 | PbCl 2 |
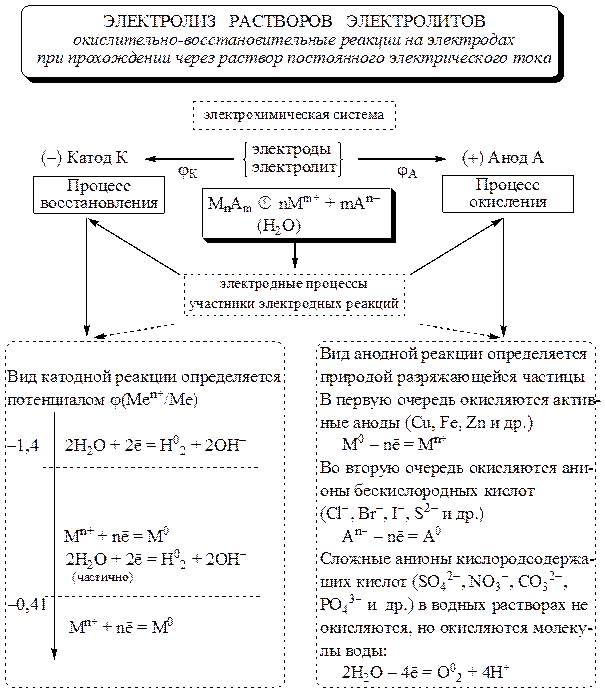
Рис. 11.1. Структурно-логическая схема взаимосвязи электродных процессов при электролизе
Гальванический элемент состоит из двух электродов — анода и катода. Его устройство и принцип работы рассмотрим на примере элемента Даниэля-Якоби. В этом элементе используют медный и цинковый электроды. Каждый электрод помещен в ёмкость с раствором электролита, катионы которых "одноимённый" материалу электрода. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO 4. При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления:
![]()
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал .
Между медным электродом и окружающем его раствором CuSO 4 идёт реакция восстановления:
![]()
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен .
Ещё раз подчеркну, что в гальваническом элементе окисление — отдача электронов — происходит на аноде (цинковый электрод), восстановление — приобретение электронов - на катоде (медном электроде).
Рекомендуется запомнить правило: окисление происходит на аноде, который заряжается отрицательно, — слова начинаются с гласных "о" и "а", восстановление наблюдается на положительно заряжённом катоде — слова начинаются с согласных "в" и "к".
Процесс на электродах:
Суммарная окислительно-восстоновительная реакция гальванического элемента.
Между двумя растворами — сульфата цинка и сульфата меди — находится солевой мостик (СМ) . Солевой мостик обычно выполняется в виде трубки, заполненной раствором хлорида калия (КСl) или нитрата аммония (NH 4 NO 3). На границе между насыщенным раствором солевого мостика и растворами электродов ZnSO 4 и CuSO 4 возникают два диффузионных потенциала, которые близки по абсолютному значению, но противоположны по знаку. Солевой мостик способствует значительному снижению диффузионного потенциала между растворами электролитов .
Характерной особенностью любого гальванического элемента является образование электрохимической цепи — последовательной совокупности всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Электрохимическую цепь медно-цинкового гальванического элемента с учётом возникших скачков потенциалов можно записать следующим образом:
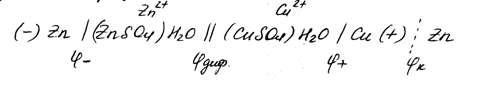 (1)
(1)
Одной вертикальной чертой обозначена граница между металлом и раствором электролита, на которой возникают электродные потенциалы и .
Двумя чертами обозначена граница между двумя электролитами, проходящая через солевой мостик ( . — диффузионный потенциал на этой границе). Вертикальной пунктирной линией показана граница между двумя металлами; на этой границе возникает контактный потенциал . Солевой мостик позволяет устранить диффузионный потенциал увеличивался бы по мере работы гальванического элемента.
Смысл записи электрической цепи, если её читать слева направо, следующий: анод, т.е цинковый электрод, погружён в раствор ZnSO 4 , содержащий ионы Zn 2+ ; солевой мостик соединят один раствор электролита с другим, содержанием ионы двух валентной меди; катод, погружённый в раствор CuSO 4, при диссоциации которого образуются ионы меди Cu 2+ . Во внешней цепи электроны перемещаются от анода к катоду (это перемещение показано на рис. стрелкой).
Условие (1) определяет работу гальванического элемента, когда его цепь замкнута. Это условие выполняется в результате присоединения к клеммам гальванического элемента потребляя или измерительных приборов.
ЭДС — это предельное значение разности потенциалов гальванического элемента, которое наблюдается в условиях равенства нулю тока во внешней цепи и когда устанавливаются все химические и локальные равновесия в фазах и на границы фаз, за исключением границы электрод - электрод.
Применительно к гальваническому элементу Даниэля — Якоби разомкнутая цепь гальванического элемента представлена условием (1) без границе разделаCu(+)/Zn, которая обозначена вертикальной пунктирной линией.
В соответствии с условием (1) ЭДС разомкнутого гальванического элемента равна алгебраической сумме скачков потенциалов на границе раздела фаз:
Если пренебречь диффузионным потенциалом (при наличии солевого мостика он ничтожно мал), а контактный потенциал незначителен (или равен нулю после присоединения потребителя), то ЭДС медно-цинкового гальванического элемента будет равна:
![]() или
или ![]()
ЭДС является количественной характеристикой работы гальванического элемента — она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую. Принято считать, что величина ЭДС всегда положительна.
Так как абсолютное значение потенциала нельзя измерить, то пользуются значением условного потенциала. Условный потенциал данного электрода — это ЭДС гальванического элемента, состоящего из стандартного водородного электрода ( = 0) и данного электрода на отрицательном полюсе гальванического элемента всегда идёт процесс окисления, на положительном- восстановления. полюс гальванического элемента определяется только по отношению ко второму электроду. На отрицательном полюсе гальванического элемента всегда идет процесс окисления, на положительном — восстановления. Полюс гальванического элементаопределяется только по отношению ко второму электроду.
Рассмотрим гальванический элемент Якоби-Даниэля . Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
Движение электронов во внешней цепи;
Движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток. Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента.
Она равна разности электродных потенциалов катода и анода:
В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии:
В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е.
А = nFE0, (7.5)
где n - число электронов, участвующих в реакции;
F - постоянная Фарадея , равная 96500 Кл/моль;
E0 - стандартная ЭДС гальванического элемента (T = 298 К, молярная концентрация электролитов равна 1 моль/дм3). Таким образом, максимальная работа гальванического элемента равна:
А = -DG0 = nFE0. (7.6)
Стандартная ЭДС гальванического элемента равна:
Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные.
Химические гальванические элементы - это такие элементы, где электроды и электролиты различны. Примером химического гальванического элемента является элемент Якоби-Даниэля.
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент
, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
![]()
Е 0 – ; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
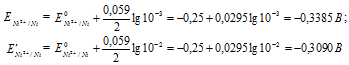
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb 2+ ] = [Мg 2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема данного гальванического элемента
Мg 0 - 2 = Mg 2+ (1)
Свинец, потенциал которой -0,127 В - катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb 2+ + 2 = Pb 0 (2)
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
![]()
Е 0 – стандартный электродный потенциал металла ; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
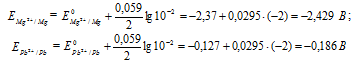
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Если концентрацию каждого из ионов Mg 2+ и Pb 2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
![]()
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 - 2 = Mg 2+ (1)
Никель, потенциал которой -0,25 В - катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni 2+ + 2 = Ni 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Ni 2+ = Mg 2+ + Ni 0
б) Схема гальванического элемента, в котором никель является анодом:
![]()
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni 0 - 2 = Ni 2+ (1)
Медь, потенциал которой (+0,34 В) - катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Fe + H 2 SO 4 = FeSO 4 + H 2
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
Fe 0 → Fe 2+ + 2
На катоде серебряной пластинке будут разряжаться ионы водорода:
2Н + + 2 → Н 2 0
Схема гальванического элемента имеет вид:
(-) Fe | Fe 2+ || 2H + | H 2 , Ag (+)
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg 2+ ] = = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс.
Электродвижущая сила гальванического элемента (ЭДС).
Электрическая работа, получаемая с помощью гальванического элемента, будет максимальной, когда элемент работает в условиях, наиболее близких к обратимым. Максимальная разность потенциалов электродов данного гальванического элемента, которая определяется в условиях равновесия, называется его электродвижущей силой (ЭДС). Она равна разности равновесных потенциалов катода и анода элемента. При стандартных условиях:
ЭДС 0 = D j 0 = j 0 катода - j 0 анода . (7.3)
Пример 10 . Вычислить ЭДС гальванического элемента, составленного из магниевого и свинцового электродов, в котором = 0,1 M; = 0,001 M.
Решение . j 0 Mg 2+ /Mg = -2,37 В; j 0 Pb 2+ /Pb = -0,13 B (табл. 7.1); j 0 магниевого электрода меньше, т.е. Mg является более активным металлом, поэтому в гальваническом элементе магний будет анодом, а свинец - катодом.
На электродах будут протекать следующие процессы:
А: Mg - 2e = Mg 2+ ,
К: Pb 2+ + 2e = Pb 0 .
Схема гальванического элемента записывается так: Mg½Mg 2+ ║Pb 2+ ½Pb.
Для расчета ЭДС необходимо найти электродные потенциалы. Согласно уравнению (7.2):
J 0 + ![]() -2,37 + 0,0295 . lg 0,1 = -2,4 B;
-2,37 + 0,0295 . lg 0,1 = -2,4 B;
0,13 + 0,0295 . lg 0,001 = -0,13 + 0,0295·(-3) = -0,22 В.
ЭДС = j кат - j ан = -0,25 - (-2,4) = 2,15 В.
Пример 11 . Определить ЭДС гальванического элемента, составленного из серебряных электродов, опущенных в 0,0001 М и 0,1 М растворы AgNO 3 .
Решение . Гальванический элемент может быть составлен не только из различных, но и одинаковых электродов, погруженных в растворы одного и того же электролита различной концентрации (концентрационные элементы ). Найдем электродные потенциалы по формуле Нернста (7.2):
j 1 Ag+ / Ag = j 0 + ×lg = 0,8 + 0,059×lg0,001 = 0,8 + 0,059×(-3) = 0,62 В,
j 2 Ag+ / Ag = 0,8 + 0,059×lg0,1 = 0,8 - 0,059 = 0,74 В.
Поскольку j 1 < j 2 , электрод, опущенный в 0,001 М раствор, будет являться анодом:
ЭДС = j кат - j ан = 0,74 - 0,62 = 0,12 В.
Схема такого гальванического элемента записывается так:
(-) Ag½ AgNO 3 (0,001М) ║ AgNO 3 (0,1М) ½ Ag(+) .
Как уже было показано на примере водородного электрода, электроды, а следовательно, и гальванические элементы могут быть созданы не только для реакции окисления-восстановления металлов, но и для любых веществ и окислительно-восстановительных реакций, происходящих в растворах или расплавах. Например, для реакции в растворе
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
процессы окисления и восстановления можно разделить в виде полуреакций:
на аноде: 5 ½ SO 3 2 - + H 2 0 = SO 4 2 - + 2H + + 2ē ; (0,17 В),
на катоде: 2 ½ MnO 4 - + 8H + + 5e = Mn 2+ + 4H 2 O (1,51 В).
Суммируем:
2MnO 4 - + 5SO 3 2 - + 6H + + 10ē = 2Mn 2+ + 5SO 4 2 - + 3H 2 O + 10ē.
Токообразующая реакция:
2MnO 4 - + 5SO 3 2 - + 6H + = 2Mn 2+ + 5SO 4 2 - + 3H 2 O.
Для осуществления таких реакций обычно используют катализатор, который одновременно является проводником электронов, например платину (рис. 7.3).
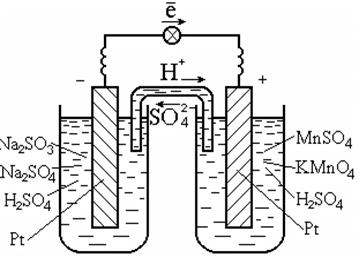
Рис. 7.3. Гальванический элемент на окислительно-восстановительной
реакции в растворе
Схема гальванического элемента:
Pt | SO 3 2 - , SO 4 2 - , H + || MnO 4 - , Mn 2+ , H + | Pt .
Значения стандартных электродных потенциалов полуреакций приводятся в справочниках.
ЭДС такого элемента при стандартных условиях можно определить как разность потенциалов для полуреакций восстановления (окислителя) и окисления (восстановителя).
ЭДС = Dj 0 = j 0 (MnО 4 - / Mn 2+) - j 0 (SO 4 2 - / SO 3 2 -) =
1,51 - 0,17 = 1,34 B.
Если при этом ЭДС положительна, то реакция возможна при стандартных условиях, так как DG реакции и электрическая работа (ЭДС) связаны между собой соотношением:
где F - постоянная Фарадея (заряд, переносимый одним молем элементарных зарядов (F = 96485, или »96500Кул/моль экв);
n - заряд, переносимый одной частицей (для Zn 2+ и Cu 2+ n = 2);
Dj = j катода - j анода = j ок-ля - j восст-ля.
Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто химических экспериментальных данных. В случае нестандартных условий потенциал электрода и ЭДС элемента рассчитывается по формуле Нернста (7.1). Например, для рассматриваемой реакции:
(n = 10). Так как концентрации реагентов находятся под знаком логарифма, то зависимость Dj от них слабая.




