Процесс гальваники – один из лучших способов защиты от коррозии. Методы нанесения гальванических покрытий
Гальванопластика и гальваностегия
Гальванопластика - электрохимический способ копирования (получение точных копий изделий). Широко используется в технике при изготовлении матриц в полиграфии, пресс-форм для прессования грампластинок и т.п. Этим способом изготовляют металлические сетки, ювелирные изделия, копии скульптур, гравюр, детали сложной конфигурации. Способ отличается исключительно высокой точностью воспроизведения рельефа изделия.
Гальваностегия - электрохимический процесс покрытия одного металла другим, более устойчивым в механическом и химическом отношении, например, стальные детали покрывают хромом, никелем; медные - никелем, серебром или другими металлами.
В принципе гальванопластика не отличается от гальваностегии. Однако гальваностегические и гальванопластические процессы имеют свои особенности и отличаются прежде всего методами подготовки поверхности перед осаждением на нее металла. В гальваностегии поверхность подготавливается так, чтобы покрытие прочно держалось на ней. В гальванопластике, наоборот, покрытие должно легко отделяться. Поэтому в последнем случае уделяется большое внимание нанесению токопроводящих слоев (в случае покрытия непроводников) и разделительных слоев (если копия получается с металла). Далее, в то время как для гальваностегических покрытий используют многие металлы и сплавы (серебро, цинк, олово, никель, медь, хром и их сплавы), в гальванопластике обычно применяют лишь отложения меди, никеля и серебра и значительно реже - других металлов. В связи с тем, что гальванопластические отложения отличаются от гальваностегических значительно большей толщиной, составы электролитов и режимы, применяемые в гальванопластике, также несколько отличаются от принятых в гальваностегии. В гальванопластике металл обычно наращивают не на металл, а на тонкий токопроводящий слой, нанесенный на поверхность непроводника, или на разделительный, плохо проводящий слой, нанесенный на металл, поэтому в технологический процесс вводят дополнительную по сравнению с гальваностегией операцию "затяжки" металлом - первичное наращивание металла на токопроводящий слой до полного закрытия его. Составы электролитов для ванн затяжки и режим работы несколько отличаются от обычных. Оборудование для гальваностегии ничем не отличается от оборудования, применяемого для гальванопластики.
В качестве гальванической ванны может быть использована любая стеклянная байка такого размера, чтобы покрываемый металлом предмет свободно в ней размещался и при этом не находился слишком близко от анодных пластин. Удобнее всего пользоваться четырехугольными стеклянными банками (рис. 1).
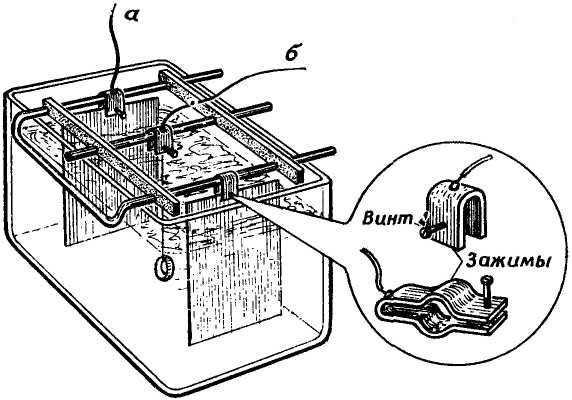
Рис. 1. Гальваническая ванная в четырехугольной стеклянной банке.
Из толстой медной проволоки или трубок делают поперечные перекладины, из которых две (а) служат для подвешивания никелевых или медных пластин - анодов, а третья (б) - для никелируемых или омедняемых предметов. В круглой банке анодную пластину приходится сгибать в виде цилиндра (с) (рис. 2).

Рис. 2. Гальваническая ванна в круглой банке.
Покрываемые предметы подвешивают на медных проволоках. Анодных пластин должно быть две. Важно, чтобы покрываемые предметы были обращены к анодам своими наибольшими площадями и находились с ними примерно в параллельных плоскостях. Перекладины, к которым подвешиваются аноды и покрываемые предметы, необходимо снабдить клеммами для удобства и надежности соединения (см. рис. 1). Проволоки, которыми прикреплен анод к перекладине, должны находиться выше уровня электролита, особенно если они сделаны из другого металла. Анодные пластины включаются между собой параллельно и присоединяются обязательно к клемме "плюс" источника тока (аккумулятора или выпрямителя).
Аноды должны быть тщательно очищены от окислов, грязи и обезжирены, так же как и предметы, предназначенные для покрытия металлом. Важным условием успешного никелирования и меднения является чистота. Если в электролите появилась легкая муть или образовался осадок, электролит необходимо профильтровать.

Рис. 3. Схема гальванической ванны.
На рис. 3 показана схема включения гальванической ванны. В качестве источника можно использовать автомобильный аккумулятор или выпрямитель (напряжением 6-12 В), питающийся от сети переменного тока напряжением 127-220 В. К. схеме необходимо подключать вольтметр и амперметр. Если поверхность покрываемого предмета менее 2 дм 2 , можно использовать миллиамперметр на 500 мА. Сопротивление реостата должно быть порядка 8-10 ом, чтобы можно было изменять ток в пределах долей ампера. При сборке электрической цепи ванны очень важно не спутать полюсы у аккумулятора или выпрямителя, так как анодные пластины должны быть обязательно подключены к положительному полюсу, а деталь (предмет) - к отрицательному. При неправильном включении будет "растворяться" металл детали или предмета, что приведет к порче электролита. Ровное плотное покрытие предмета никелем или медью зависит от величины электрического тока, не превосходящей известного предела и зависящей от площади поверхности предмета. Например, если норма плотности тока равна 0,5 А на 1 дм 2 и предмет имеет общую поверхность около 0,5 дм 2 , то ток не должен превышать 0,5 х 0,5=0,25 А. При большем токе никель или медь будут откладываться темным, непрочным, легко отделяющимся слоем. Если предмет имеет заостренные части, плотность тока следует уменьшить в 2-3 раза. Предметы погружают в ванну под напряжением. Для этого их сначала подвешивают на медных голых проводниках диаметром 0,8-1 мм к перекладине (медная трубка), подключают к источнику электрического тока (при этом реостат включают на полное сопротивление) и опускают в ванну с электролитом. Затем, уменьшая сопротивление реостата, доводят ток до нормы. Во время гальванизации деталь или предмет два-три раза вынимают из ванны на короткое время и осматривают. Если металл откладывается неравномерно, изменяют положение предмета, повернув его к аноду той стороной, на которой слой металла получается тоньше.
При правильном процессе никелирования никель откладывается матовым, повсюду ровным, серебристым слоем. Появление темных пятен свидетельствует о плохом обезжиривании. Тонкий слой металла откладывается на детали или предмете за 20-30 мин, толстый слой - за несколько часов. Предмет, вынутый из ванны, как бы хорошо он ни был предварительно отполирован, имеет матовую поверхность. Для придания блеска его полируют тончайшим мелом (зубным порошком) при помощи суконки. Можно также полировать крокусом, но очень осторожно, чтобы не повредить слой никеля.
Примечание
В любительских конструкциях широко применяется алюминий. Анодирование можно выполнять переменным током 12-24 В. Деталь (лист) полируют до зеркального блеска, протирают ацетоном и химически обезжиривают в растворе едкого натра 50 г/л. Время обезжиривания 3-5 мин, температура раствора 50°С. Анодирование переменным током заключается в следующем. Если анодируется деталь (лист), то она является первым электродом, а вторым может быть обработанная алюминиевая болванка или лист. Контакты токоподводов обязательно должны быть алюминиевые. Электролитом служит 20-процентный раствор серной кислоты.
Условия анодирования следующие:
1. Для алюминия и плакированного дюралюминия плотность тока 1,5-2 А/дм 2 при напряжении 12 В. Время анодирования 25-30 мин, температура электролита не выше 25°С.
2. Для неплакированного дюралюминия плотность тока 2-3 А/дм 2 при напряжении 12-20 В. Время анодирования 20-25 мин, температура электролита - около 25°С.
Электролитический способ копирования барельефов и декоративных украшений
С копируемого предмета или изделия прежде всего снимают отпечаток, т. е. делают форму из легкоплавкого металла, воска, пластилина или гипса. Копируемый предмет, натертый мылом, кладут в картонную коробку и заливают легкоплавким сплавом Вуда или другими легкоплавкими сплавами.
После отливки предмет вынимают и полученную форму обезжиривают и подвергают омеднению в электролитической ванне. Для того что бы металл не откладывался на тех сторонах формы, где нет оттиска, их покрывают при помощи кисточки расплавленным воском или парафином, После омеднения легкоплавкий металл расплавляют в кипящей воде и получают матрицу. Матрицу заливают гипсом или свинцом, и копия готова.
Для изготовления форм применяют следующую восковую композицию:
Воск …………………… 20 в. ч.
Парафин ……………. 3 в. ч.
Графит ………………. 1 в. ч.
Если форму изготовляют из диэлектрика (воск, пластилин, парафин, гипс), ее поверхность покрывают электропроводным слоем. Проводящий слой может быть нанесен способом восстановления некоторых металлов (серебра, меди, никеля) или механическим путем — втиранием в поверхность формы чешуйчатого графита мягкой волосяной кистью. Графит тщательно растирают в фарфоровой ступке, просеивают через сито или марлю и наносят на поверхность изделия мягкой кистью или ватным тампоном. Графит лучше прилипает к пластилину. Формы из гипса, дерева, стекла, пластмассы и папье-маше покрывают раствором воска в бензине. На поверхность, не успевшую высохнуть, наносят графитную пудру, а лишний, неприлипший графит сдувают. Гальваническое покрытие легко отделяется от формы, покрытой графитом. Если форма выполнена из металла, то на ее поверхности необходимо создать электропроводящую пленку оксида, сульфида или другой нерастворимой соли, например, на серебре — хлорида серебра, на свинце — сульфида свинца, чтобы форма хорошо отделялась от покрытия.
Медные, серебряные и свинцовые поверхности обрабатывают 1%-ным раствором сульфида натрия, в результате чего на них образуются нерастворимые сульфиды.
Осаждение металла на поверхности формы. Подготовленную форму погружают в ванну, схема которой находится под током, чтобы не растворилась разделяющая пленка. Сначала проводят «затяжку» (покрытие) проводящего слоя меди при малой плотности тока в растворе такого состава:
Сернокислая медь (медный купорос) … 150-200 г.
Серная кислота …………………………………….. 7-15 г
Этиловый спирт ……………………………………. 30-50 мл
Вода ………………………………………………………… 1000 мл
Рабочая температура электролита 18-25° С, плотность тока 1-2 А/дм 2 .
Спирт необходим для повышения смачиваемости поверхности. После того как вся поверхность «затянется» слоем меди, форму переносят в электролит, предназначенный для гальванопластики.
Для гальванопластнческих работ (омеднение) рекомендуется следующий состав:
Сернокислая медь (медный купорос) …… 340 в. ч.
Серная кислота ………………………………………… 2 в. ч.
Вода …………………………………………………………. 1000 в. ч.
Температура электролита 25-28°С. Плотность тока 5-8 А/дм 2 .
Способ металлизации растений, насекомых и других неметаллических предметов
Чтобы изготовить металлические листья растений, со свежих листьев снимают отпечатки на восковой композиции следующим образом. В формочку из плотной бумаги заливают восковую композицию, дают ей остыть почти до полного отвердения, но с таким расчетом, чтобы поверхность ее была эластичной. Затем на поверхность воска накладывают листья и прижимают их стеклом. Когда стекло и листья снимают, на восковой композиции остается четкий отпечаток листьев.
После полного затвердения воска форму с отпечатком осторожно графитируют мягкой кистью. Установив проводники на форме, подвешивают груз и опускают ее в гальваническую ванну.
Для покрытия металлом насекомых (бабочек, жуков и т. п.) их соответствующим способом подготавливают: насекомых выдерживают в 1,5%-ном растворе сулемы, высушивают, покрывают лаком или тонким слоем воска. Затем поверхность нужно сделать токопроводящей, для этого ее при помощи кисточки смазывают жидкой кашицей из графита, разведенного на спирте или водке. После высыхания излишки графита удаляют.
После этого предмет подвешивают на нескольких тонких медных проволочках диаметром 0,1-0,2 мм, перекручивая или перевязывая их неоднократно крест-накрест (см. рис. 4), и помещают в гальванопластическую ванну.

Рис. 4.
Подвешивание жука для омеднения (а).
Вид жука, покрытого металлом (б).
Для устранения плавучести в электролите бабочку, жучка и т. п. прикрепляют парафином к стеклу или кусочку пластмассы. Металл начинает откладываться прежде всего около медных проволочек, распространяясь очень медленно на всю остальную поверхность. Поэтому в начале процесса ток должен быть в несколько раз меньше нормального, когда же вся поверхность окажется «затянутой» металлом, доводят его до нормы. Продолжительность процесса — несколько часов. Толщина покрытия может колебаться от 0,1 до 2 мм.
Используя метод гальванопластики, можно металлизировать кружева для декоративно-художественного украшения различных предметов.
Кружева растягивают на рамке и пропитывают парафином. Затем их проглаживают утюгом между листами бумаги для удаления излишков парафина. Далее наносят электропроводящий слой мелкого графита, избыток его тщательно сдувают с кружев. Проложив проводники по краю кружева, их крепят на пластмассовой рамке или рамке из толстого провода с хлорвиниловой изоляцией, вместе с которой кружева погружают в электролит.
Кружева, покрытые медью, обрабатывают латунной щеткой. Паяют их оловянно-свинцовым припоем.
Гальваностегическая отделка металлизированных кружев заключается в нанесении декоративного слоя серебра или золота или в оксидировании.
Способ изготовления мемориальных досок
Способ изготовления мемориальных досок ничем не отличается от способа изготовления копий с медалей, барельефов и т. п.
На таких досках обычно имеется текст, рама, часто барельефное изображение (см. рис. 5).
|
Рис. 5. Образцы мемориальных досок.
Мемориальную доску или просто доску с надписью обычно изготовляют следующим образом. На ровный деревянный планшет натягивают ватманскую бумагу, размер которой несколько больше размера изготовляемой доски, края бумаги приклеивают к планшету; затем бумагу увлажняют водой, и после высыхания она сильно натягивается. На бумаге размечают расположение текста, рамы, барельефа и других деталей, композиции мемориальной доски.
Все детали композиции доски изготовляют отдельно в соответствии с ее размерами. Барельеф и раму выполняют гальванопластическим способом и обрезают по контуру. Буквы для текста выпиливают из пластмассы, не деформирующейся при 60-70°С (температура заливаемого воска). По разметке на ватманской бумаге буквы наклеивают на нее нитролаком. Барельеф предварительно заливают с обратной стороны воском для создания ровной плоскости и тоже приклеивают его нитролаком. Так же устанавливают и раму доски. Под барельефом и другими деталями доски не должно быть воздуха, так как он образует раковины на поверхности восковой формы.
Затем лист ватманской бумаги с наклеенными деталями протирают подсолнечным или касторовым маслом, чтобы не прилипал воск.
Вокруг подготовленной таким образом модели доски устанавливают обечайку в виде обычной деревянной рамы, высота стенок которой должна настолько превышать высоту рельефа модели, чтобы получилась достаточно массивная, толстая и прочная форма, не подвергающаяся деформации.
Стык между обечайкой и доской тщательно промазывают глиной или пластилином во избежание протекания воска.
Приготовленную модель заливают восковым композитом. После затвердения воска обечайку разбирают, восковую форму снимают, переворачивают лицевой стороной вверх и осторожно извлекают из нее сформованные, детали. Для удаления из восковой формы деталей, особенно пластмассовых букв, лучше всего пользоваться тонким шилом или ножом с узким концом. Затем форму осматривают, устраняют дефекты, подрезают края.
Подготовленную форму укладывают на лист пластмассы толщиной 10-15 мм, в котором имеются отверстия для закрепления формы. После зарядки и нанесения на форму электропроводящего слоя ее помещают в гальваническую ванну.
Простейшая гальваническая ванна для электрохимического окрашивания металлических деталей в любой цвет
Для электрохимического окрашивания деталей из стали, латуни или меди необходимо собрать гальваническую ванну и электрическую схему, как показано на рисунке 6.
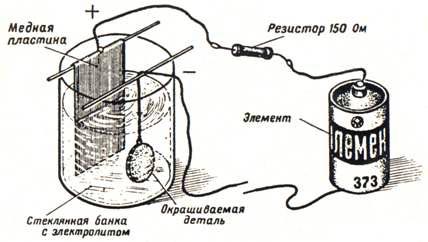
Рис. 6. Простейшая гальваническая ванна.
Электрод, подключенный к плюсовому зажиму элемента, делают из листовой меди. Минус элемента подключают к окрашиваемой детали. Необходимо следить за тем, чтобы детали не касались медной пластинки. В банку заливают специальный электролит и замыкают электрическую цепь. Через 2-3 мин начнется окрашивание. Вначале деталь станет коричневой, потом фиолетовой и т. д.
Все будет зависеть от времени:
2 минуты — коричневый цвет,
3 минуты — фиолетовый,
3-5 минут — синий,
5-6 минут — голубой,
8-12 минут — желтый,
12-13 минут — оранжевый,
13-15 минут — красный,
17-21 минут — зеленый цвет.
На 1 л электролита требуется:
Медного купороса — 60 г
Сахара рафинада — 90 г
Едкого натра — 45 г
Приготовляют электролит следующим образом. В раствор медного купороса объемом 200-300 мл добавляют 90 г сахара и тщательно размешивают. Отдельно в 250 мл воды растворяют 45 г едкого натра и к нему небольшими порциями, постоянно помешивая, приливают раствор медного купороса с сахаром. Затем добавляют воду, чтобы получился 1 л раствора.
При работе с едким натром необходимо соблюдать осторожность! Чтобы цвета были более контрастными, в готовый электролит добавляют 20 г безводной соли углекислого натрия. После окрашивания деталь промывают водой, сушат и покрывают бесцветным лаком.
Рецепты электролитов для гальванических ванн
Электролит для быстрого омеднения
Сернокислая медь (медный купорос) — 250 г
Серная кислота концентрированная — 20 г
Хромовый ангидрид — 2 г
Вода — до 1 л
Электролит для матового никелирования
Сернокислый никель — 217,5 г
Хлористый никель — 46,5 г
Борная кислота — 31 г
Вода — до 1 л
Рабочая температура ванны 50-70°С, плотность тока 1,5-5 А/дм 2 , рН 5,2-5.8.
Электролит для никелирования (твердое покрытие)
Сернокислый никель — 150 г
Хлористый аммоний — 20 г
Борная кислота — 25 г
Вода — до 1 л
Рабочая температура ванны 50-60°С, плотность тока 2,5-5 А/дм 2 , рН 5,6-5.9.
Электролит для декоративного хромирования
Хромовый ангидрид — 400 г
Серная кислота концентрированная — 4 г
Вода — до 1 л
Электролит для хромирования (твердое покрытие)
Хромовый ангидрид — 250 г
Серная кислота концентрированная — 2,5 г
Вода — до 1 л
Рабочая температура 25-65°С, плотность тока 20-50 А/дм 2 .
Электролит для лужения
Оловяннокислый натрий — 75 г
Едкий натр — 11,5 г
Уксуснокислый натрий — 25 г
Вода — до 1 л
Рабочая температура 65-70°С, плотность тока 2-4 А/дм 2 .
Электролит для серебрения
Хлористое серебро — 40 г
Железосинеродистый калий (красная кровяная соль) — 200 г
Поташ — 20 г
Вода — до 1 л
Температура электролита 20-80°С, плотность тока 1-1,5 А/дм 2 . Анод из серебра.
Концентрация раствора характеризуется количеством того или иного вещества, растворенного в единице объема воды или другой жидкости. Концентрация раствора в подавляющем большинстве случаев должна быть строго определенной. Поэтому следует отказаться от составления растворов на глазок.
Концентрация растворов выражается:
1) в частях (например, 100 частей воды, 37 частей серной кислоты и 16 частей двухромовокислого калия) или
2) в процентах (например, 21-процентный водный раствор едкого калия).
Иногда концентрация раствора выражается отношением (например, водный раствор серной кислоты 1:10; это означает, что нужно взять 1 часть серной кислоты и 10 частей воды).
Во всех случаях (части и проценты) имеются в виду весовые соотношения веществ.
Для определения весовых количеств воды можно пользоваться мензуркой, считая число кубических сантиметров соответствующим числу граммов, а для химикалиев - аптекарскими весами (достаточна точность до 0,5 г).
Перерасчет водных растворов с процентов по весу на части
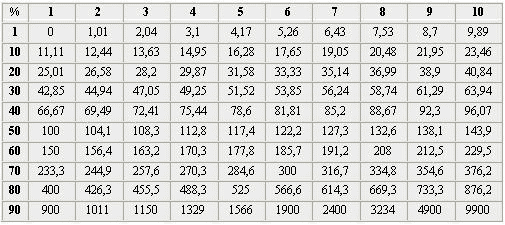
При составлении растворов, концентрация которых дана в процентах в таблице, вес раствора принимается за 100%. Поэтому, например, для приготовления 21-процентного раствора едкого кали отмеряют 21 часть этого вещества и 79 частей воды. Такие отвешивания не всегда удобны, поскольку чаще всего приходится исходить из объема или веса необходимого раствора, чтобы не приготовлять его в излишке. Тогда делают арифметические перерасчеты. Однако их можно избежать, если воспользоваться приведенной таблицей, которая позволяет определить, какое количество по весу вещества нужно на 100 частей или 100 см 3 воды, если известна концентрация в процентах. Например, на 100 см 3 21-процентного водного раствора едкого кали приходится 26,58 части едкого кали.
Что необходимо знать о несовместимости химических веществ
Несовместимость химических веществ проявляется в том, что при случайном смешивании, а иногда и при хранении рядом они вступают в реакцию. Если реакция сопровождается выделением большого количества тепла, то может произойти взрыв или самовозгорание. В других случаях воздействие веществ друг на друга приводит к соединению их и потере первоначальных свойств, в результате чего вещества становятся непригодными к употреблению. Вот некоторые несовместимые химические вещества:
Азотная кислота несовместима с глицерином, спиртом, эфирными маслами, смолами, сахаром, фенолом, опилками, ватой.
Алюминиевые квасцы несовместимы с едкими щелочами (едкий натр, едкое кали, нашатырный спирт), клеем и желатиной.
Аммиак (нашатырный спирт) и нашатырь несовместимы с формалином (формальдегидом) и йодом.
Бура несовместима с квасцами, нашатырем, серной кислотой, соляной кислотой.
Йод несовместим с аммиаком (нашатырным спиртом).
Кислоты несовместимы с мылом и щелочами (содой, поташом, известью и др.).
Марганцовокислый калий несовместим с органическими веществами - эфирами, винным спиртом, глицерином, танином, а также с аммиаком, нашатырем, серой, йодом, углем.
Сера несовместима с марганцовокислым калием, хлорной известью.
Серная кислота (купоросное масло) несовместима со скипидаром, спиртом и бензином.
Спирт несовместим с хромовой кислотой, марганцовокислым калием, клеем, желатиной, казеином.
Обезжиривание в ваннах с растворителями
Сильно загрязненные детали можно грубо обезжирить промывкой в керосине или скипидаре. После этого детали промывают в техническом бензине, техническом бензоле, ксилоле или толуоле. Тщательное и окончательное обезжиривание достигается погружением или промывкой в чистом бензине, трихлорэтилене или других растворителях.
Недостатком этих веществ является их огне- и взрывоопасность (бензин, бензол, ксилол, толуол) и ядовитость паров (трихлорэтилен, бензин, бензол, ксилол, толуол). Поэтому с ними разрешается работать только в хорошо вентилируемых помещениях.
В настоящее время широко применяются фреоны. В отличие от вышеуказанных веществ фреон не взрывоопасен, не ядовит, не разрушает пластмассы, лакокрасочные покрытия и т.п.
Фреон-113 (трихлортрифторэтан) - самое лучшее обезжиривающее средство из группы фреонов. Это легкоподвижная прозрачная жидкость с низкой температурой кипения (47,6°С). Иногда фреон-113 смешивают с другими растворителями - ацетоном, спиртом и т.д.
Иногда фресковые обезжиривающие ванны снабжают ультразвуковыми излучателями или используют кипящий фреон, что максимально ускоряет растворение жиров. Фреон не имеет широкого применения из-за высокой стоимости.
Химический раствор для обезжиривания цветных металлов:
Жидкое стекло — 26 г
Тринатрийфосфат — 8 г
Углекислый натрии безводный — 4 г
Вода — до 1 л
Все вещества растворяют в воде и доводят объем до 1 л.
Удаление металлических покрытий с изделий электролитическим способом (реставрация)
Удалить металлические покрытия с металлизированных деталей и изделий можно электролитическим способом, погружая детали и изделия в электролит. Действие электролита можно усилить подключением источника электрического тока к изделию, подвешенному в ванне с электролитом в качестве анода.
Ниже приведено несколько рецептов электролитов для снятия металлических покрытий с деталей и изделий. Указанные вещества растворяют в 500-600 мл воды, а затем объем раствора (электролита) доводят до 1 л.
Электролит для снятия никелевых покрытий со стальных изделий
Хромовый ангидрид — 240 г
Борная кислота — 30 г
Вода — до 1 л
Рабочая температура электролита 85°С, плотность тока 1 А/дм 2 .
Электролит для снятия никелевых покрытий с изделий из меди и латуни
Соляная кислота — 14 г
Вода — до 1 л
Рабочая температура электролита 18-20°С, плотность тока не более 2 А/дм 2 . Используется постоянный ток при регулярном изменении полярности. Катод угольный.
Электролит для снятия хромовых покрытий с изделий из стали, никеля и сплавов магния
Едкий натр — 90 г
Вода — до 1 л
Рабочая температура электролита 20°С, плотность тока 2 А/дм 2 .
Электролит для снятия оловянных покрытий с изделий из стали, меди и латуни
Едкий натр — 120 г
Вода — до 1 л
Рабочая температура электролита 18-20°С. Применяется постоянное напряжение 6 В при регулярном изменении полярности источника тока.
Полирование металлов электролитическим способом
Полируемые предметы подвешивают в электролитической ванне как аноды, т.е. к ним подводят положительный потенциал от источника постоянного тока, выпрямителя или аккумулятора.
Ниже приводятся рецепты для полирования.
Электролит для полирования стали, железа и его сплавов
Серная кислота концентрированная — 300 мл
Ортофосфорная кислота концентрированная — 600 мл
Вода — 100 мл
Электролит готовят в стеклянной или фарфоровой посуде. Температура ванны около 70°С, плотность тока 60-70 А/дм 2 . Полирование длится 1-5 мин. Отполированные детали после извлечения из ванны промывают в проточной воде, погружают в 10%-ный раствор углекислого натрия и снова промывают в проточной воде. Сушат детали в струе теплого воздуха.
Электролит для полирования меди и ее сплавов
Серная кислота концентрированная — 10 г
Уксусная кислота — 12,5 г
Хромовый ангидрид — 12,5 г
Двухромовокислый натрий — 37,5 г
Вода — 1 л
Рабочая температура электролита 60-75°С, плотность тока 25-50 А/дм 2 .
Электролит для полирования алюминия
Этиловый спирт денатурированный — 576 мл
Хлористый аммоний — 40 г
Хлористый цинк — 180 г
Бутиловый спирт — 64 г
Вода — 128 мл
Полирование производится при напряжении 20-14 В. Рекомендуется через 1 мин деталь из ванны вынуть (при этом прекращается пассивация) и снова погрузить, повторив это в течение полирования несколько раз.
Декоративная отделка изделий из алюминия и его сплавов
Детали конструкции из алюминия и его сплавов можно окрасить в любой цвет.
С этой целью алюминий и его сплавы подвергают анодному оксидированию с последующей адсорбиционной окраской различными красителями. Делают это следующим образом. Отполированные до зеркального блеска детали подвергают обезжириванию в растворе, состоящем из тринатрийфосфата (50 г), едкого натрия (10 г) и жидкого стекла (силикатного клея) (30 г). Перечисленные химикаты растворяют в 1 л теплой воды в железной посуде (можно в кастрюле), затем детали, которые нужно окрасить, помещают на 1-2 мин в этот раствор, нагретый до 50-60°С.
Если указанные химикаты достать не удастся, обезжирить детали можно обыкновенным хозяйственным мылом с теплой водой. Детали тщательно обрабатывают щетинной щеткой в течение 10 мин.
Обезжиренные детали промывают холодной водой, затем для удаления пленки окислов погружают их на 2-3 мин в 50%-ную азотную кислоту. После чего детали снова тщательно промывают сильной струей воды и немедленно подвешивают в ванну для анодирования.
Электролитом для ванны анодирования служит раствор серной кислоты с удельным весом 1,12-1,13 при температуре 20°С. При смешивании кислоты с водой раствор сильно разогревается, поэтому кислоту следует подливать в воду небольшими порциями, все время перемешивая раствор стеклянной палочкой.
При попадании кислоты на кожу или на одежду необходимо немедленно смыть ее сильной струей воды и промыть крепким раствором соды.
Очень хорошим и более безопасным является электролит, приготовленный из бисульфата натрия (натрий сернокислый кислый), 250-300 г которого растворяют в 1 л воды. Рабочая температура электролита должна быть также не более 20°С. В качестве рабочей ванны можно использовать эмалированные кастрюли, керамические, стеклянные или пластмассовые бачки.
Для катодов при анодировании применяют листовой свинец, а анодом служит обрабатываемая деталь, которую подвешивают между двумя свинцовыми катодами на расстоянии 70-80 мм от них. Электролиз длится 40-50 мин, плотность постоянного тока 1-1,5 А/дм 2 . Источником тока может служить аккумулятор достаточной емкости или выпрямитель, собранный на диодах типа Д303 или Д305. Следует помнить, что анодируются детали только из алюминия или его сплавов. Подвески для деталей изготовляют только из алюминия. Все соединения и контакты должны быть надежными, так как от этого зависит качество анодирования. Загружать детали в ванну и выгружать их следует только под током. После 40-50-минутного пребывания деталей в ванне их выгружают, тщательно промывают холодной водой и опускают в водный раствор анилинового красителя, подогретый до 50-60°С. Раствор красителя следует предварительно профильтровать, так как небольшие крупинки нерастворившегося красителя образуют пятна на поверхности окрашенного металла. Цвет окраски зависит от времени пребывания анодированной детали в красителе, которое не должно превышать 15-20 мин.
Анилиновые красители (порошки для крашения тканей) можно приобрести в хозяйственных магазинах.
После анодирования поверхность чистого алюминия остается блестящей, а некоторые алюминиевые сплавы приобретают матовый, темный оттенок, что зависит от электрического режима анодирования.
Для окрашивания применяют 5-10%-ные водные растворы следующих красителей:
в черный цвет - анилиновый черный М или анилиновый прямой черный-3;
в коричневый - основной коричневый;
в золотисто-желтый - прямой желтый 2Ж или ализариновый желтый;
в красный - красный ализариновый или кислотный рубиновый;
в синий - кислотный синий антрахиноновый или прямой синий М;
в голубой - анилиновый голубой или метиленовый голубой;
в зеленый - прямой зеленый ЖХ или основной ярко-зеленый;
в фиолетовый - основной фиолетовый.
"Краситель оранжевый 2Ж", "Краситель основной фиолетовый" и т.д. - торговые термины.
Имитация под золото заслуживает особого внимания.
Окрашенные детали только по весу можно отличить от натурального золота. Окраска получается прочной и светостойкой. Раствор для крашения готовят так. 1 г красителя оранжевого 2Ж растворяют в 0,5 л горячей воды, в раствор добавляют 0,1 г красителя желтого-3 и 0,5 г кальцинированной соды. После охлаждения раствор фильтруют. Отдельно в 0,5 л горячей воды растворяют 0,1 г красителя черного М. Этот раствор также фильтруют. Перед крашением оба раствора смешивают и нагревают до 50-60°С. В зависимости от времени пребывания деталей в этом растворе можно получить окраску под любую пробу золота.
Окрашивать анодированные детали из алюминия и его сплавов можно не только в указанных растворах органических красителей. Для этой цели можно пользоваться и перечисленными ниже цветными неорганическими соединениями, которые образуются непосредственно в порах анодированного металла после последовательного погружения его сначала в водный раствор "а", затем в водный раствор "б".
Например, для окрашивания в белый цвет
применяют растворы:
а) свинец уксуснокислый, 10%-ный раствор,
б) сульфат натрия (глауберова соль), 10%-ный раствор;
в синий или голубой цвет:
а) железосинеродистый калий, 50%-ный раствор,
б) хлорное железо, 5-10%-ный раствор;
в золотисто-желтый:
а) гипосульфит, 5%-ный раствор,
б) свинец уксуснокислый, 5%-ный раствор;
в оранжевый:
а) калий хромовокислый, 2-3%-ный раствор,
б) азотнокислое серебро, 5-10%-ный раствор;
в желтый:
а) двухромовокислый калий, 2-5%-ный раствор,
б) свинец уксуснокислый, 10-15%-ный раствор;
в коричневый:
а) железосинеродистый калий, 2-5%-ный раствор,
б) медный купорос, 5-10%-ный раствор.
После адсорбиционного окрашивания детали промывают горячей водой и погружают на 2-3 мин в расплавленный воск или парафин, затем, еще горячие, протирают марлей.
Простейшая установка для гальванического покрытия металлических поверхностей
В ремонтной и любительской практике с успехом можно использовать миниатюрную безванновую гальваническую установку (см. рис. 7).
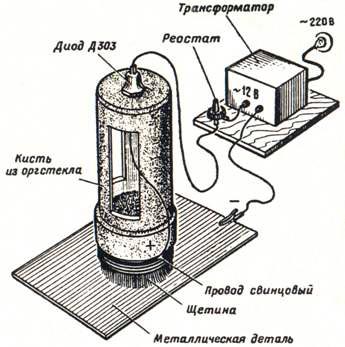
Рис. 7. Миниатюрная гальваническая установка.
Она состоит из специальной кисти со щетиной (диаметр кисти 20-25 мм, корпус ее выполнен из органического стекла толщиной 5-6 мм, внутрь которого заливается электролит), понижающего трансформатора на напряжение 12 В и ток 0,8-1 А или аккумулятора и соединительного шнура. Щетину кисти обматывают свинцовым (в крайнем случае облуженным медным) проводом. Полупроводниковый диод типа Д303—Д305 устанавливают на корпусе кисти. Один из проводов понижающей обмотки трансформатора соединяют с анодом диода, другой с помощью зажима «крокодил» — с покрываемой деталью. Катод диода соединяют с проводом обмотки кисти. Если применяется аккумулятор, диод не нужен.
Покрываемые детали очищают от ржавчины, грязи и жира, протирают сухой чистой тканью и обезжиривают в растворе, содержащем 100-150 г едкого натра, 40-50 г кальцинированной соды и 3-5 г жидкого стекла (силикатный клей) на 1 л. В зависимости от степени загрязнения детали выдерживают в обезжиривающем составе, нагретом до 80-100°С, от 15 мин до 1 ч. Чем ровнее и чище поверхность, тем прочнее будет гальваническое покрытие. Подготовленную деталь соединяют с обмоткой трансформатора, в кисть заливают электролит и включают питание. Равномерно перемещая кисть по поверхности детали, покрывают ее металлом, осаждающимся из электролита. Для получения покрытия достаточной толщины необходимо пройти кистью по одному, и тому же месту 20-25 раз. Электролит доливают в кисть по мере его расходования. После нанесения покрытия деталь промывают в проточной воде и полируют в смоченной воде тканью, затем еще раз промывают и сушат.
Для каждого вида покрытия приготовляют специальный электролит, составленный по следующим рецептам (в граммах на 1 л раствора):
Электролит для меднения
Медный купорос (сернокислая медь) — 200
Серная кислота — 50
Этиловый спирт или фенол — 1-2
Электролит для никелирования
Сернокислый никель — 70
Сернокислый натрий — 40
Борная кислота — 20
Хлористый натрий — 5
Электролит для хромирования
Хромовый ангидрид — 250
Серная кислота (уд. в. 1,84) — 2,5
Электролит для цинкования
Сернокислый цинк — 300
Сернокислый натрий — 70
Алюминиевые квасцы — 30
Борная кислота — 20
Электролит для серебрения
Хлористое серебро свежеосажденное — 3-15
Железосинеродистый калий — 6-30
Электролит для золочения
Хлорное золото — 2,65
Железосинероднстый калий — 15-50
Сода кальцинированная — 20-25
В 200-300 мл дистиллированной воды растворяют первое по порядку вещество, потом второе, третье и т. д., а затем доливают воду до 1 л.
Следует иметь в виду, что, хотя растворы и не содержат сильно ядовитых веществ, обращаться с ними во избежание ожогов и отравления следует с осторожностью. Растворы лучше всего хранить в темной стеклянной посуде с притертой пробкой.
Необходимо также учитывать, что не все покрытия хорошо ложатся на различные металлы. Например, для того чтобы покрыть никелем стальную деталь, ее предварительно покрывают тонким слоем меди, хром же хорошо сцепляется с никелированной поверхностью. Подслой меди перед никелированием или серебрением желательно осадить и на деталях, изготовленных из бронзы. Медные и латунные детали серебрят без подслоя меди.
Статья составлена по публикациям В.Г. Бастанова
Автор-составитель.
Патлах В.В. 1996 г.
© "Энциклопедия Технологий и Методик" Патлах В.В. 1993-2007 гг.
Гальваника в домашних условиях
Создание гальванических покрытий в домашних условиях
Гальванические декоративно-защитные либо технологические покрытия на металлических изделиях представляют собой тонкий поверхностный слой другого металла, обладающего более лучшими технологическими или антикоррозионными свойствами и хорошим эстетическим видом (например, никель, хром, серебро,цинк). При подготовке к выполнению гальванических работ мастер-любитель должен иметь мощный заземленный источник питания постоянным током с плавной регулировкой выходной мощности с максимальным током 20 А. Это может быть выпрямитель заводского производства либо простой, но мощный выпрямитель самостоятельного изготовления.
Одним из самых важных условий получения качественного гальванического покрытия является предварительнаяподготовка пескоструйка, шлифовка, обезжиривание и изделия.
Шлифовку осуществляют механическим способом с помощью карцовочной щетки, шлифовочных паст и наждачных шкурок.
Обезжиривание подготавливаемых деталей производят в органических растворителях: спирте, бензине, ацетоне, бензоле, трихлорэтилене. Подготавливаемую деталь тщательно промывают в растворителях, обращая внимание на труднодоступные места к которым сложно подобраться. Показатель качественного обезжиривания - хорошее смачивание водой поверхности детали. Изделия из чугуна и стали очень хорошо обезжириваются с помощью указанных растворов:
Едкий натр...................... 10-20 г Кальцинированная сода... 50 г Жидкое стекло................ 5-15 г Вода................................. 1000 г
Едкий натр...........................50 г Кальцинированная сода......30 г Фосфорнокислый натрий.......30 г Жидкое стекло.....................5 г Вода....................................... 1000 г
Температура для растворов при обработки детали должна быть 60÷90 град. С. Работы нужно выполнять в защитных перчатках и фартуке, не допускать, чтобы капли раствора попадали на кожу и в глаза.
Для изделий из цветных металлов существуют следующие растворы:
Фосфорнокислый натрий... 10-20 г Хозяйственное мыло...... 10-20 г Вода................................. 1000 г
Едкий натр...........................10 г Фосфорнокислый натрий....... 50-60 Вода....................................... 1000 г
Рабочая температура первого раствора - 90град. С, а второго - 60град. С.
Декапирование – процесс снятия окисной пленки с поверхности металлической детали перед гальванической обработкой. В домашней мастерской можно применять такие декапирующие растворы:
Концентрированная серная кислота.... 70-80 Хромпик............................................. 2-3 Вода..................................................... 100
Соляная или серная кислота......5 Вода........................ 100
Количество компонентов указано в массовых частях. Время обработки деталей первым раствором составляет 20 с, а вторым - 60 с.
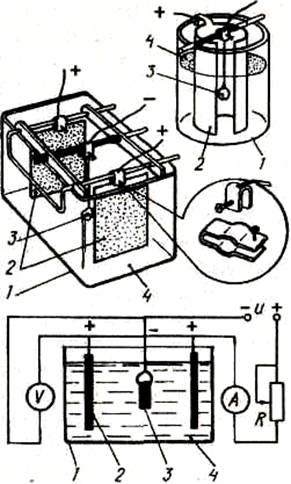
Рис. :Схема и оборудование для получения гальванических покрытий 1- емкость из химически нейтрального материала, например, стекла; 2- аноды; 3- обрабатываемая деталь (катод); 4- электролит
Теперь рассмотрим технологию создания гальванических покрытий.
Никелирование применяют для получения декоративных покрытий, и для формирования промежуточных слоев при многослойных покрытиях (например, при хромировании). Никелевые покрытия отличаются красивым внешним видом, стойкостью к атмосферным воздействиям, не вызывают трудностей при нанесении на металлические детали.
Оборудование для никелирования (а также и для всех других покрытий) показано на рисунках.
Никелируют в слабокислом электролите, с следующим составом:
Сернокислый никель 140 г Сернокислый натрий 50 г Сернокислый магний 30 г Хлористый натрий (чистая поваренная соль) 5 г Борная кислота 20 г Вода 1000 г
Температура электролита – 18÷25ºС, плотность тока – 0,8÷1,2 А/дм2.
Если у Вас отсутствует сернокислый магний и натрий количество сернокислого никеля в электролите увеличивают до 250 г, хлористый натрий – до 25 г, борной кислоты – до 30 г, при этом никелирование необходимо вести при температуре электролита 50÷60ºС и плотности тока 3÷5 А/дм2.
Химикаты, входящие в электролит, растворяют в воде по отдельности, растворы тщательно фильтруют, потом смешивают. Качество покрытия зависит от кислотности электролита (рН). Для нашего случая – рН 4÷5. При такой кислотности лакмусовая бумага окрашивается в красный цвет. Если кислотность электролита выше, в него добавляют в небольших количествах водный раствор аммиака. Неполадки в никелировании вызывают, уменьшение плотности тока, которое приводит к образованию серого осадка, а увеличение плотности тока – к появлению хрупкого неоднородного слоя никеля. При использовании электролита с рН выше б на покрытии возникают белые пятна, а меньше 4 – покрытие получается неоднородным. Слой никеля толщиной 1 мкм при плотности тока 0,15 А/дм2 оседает за 20 мин, а при 0,1 А/дм2 – за 30 мин.
После того как процесс никелирования закончен изделие промывают в воде, высушивают и тщательно полируют на войлочном круге с использованием полирующих паст.
Хромирование металлических деталей применяют для повышения твердости(функциональности) и антикоррозионной стойкости, получения отражающих поверхностей, декоративного эффекта. Хочу отметить, что хромовые покрытия пористые, поэтому под ними, на поверхности черных металлов следует использовать промежуточный слой меди либо никеля, если этим пренебречь то под слоем хрома будут происходить коррозионные процессы. Во избежание этого применяют многослойные гальванические покрытия, например медь-никель-хром или никель-медь-никель-хром. Качество хромовых покрытий зависит от концентрации электролита, плотности тока и температуры электролита. С помощью регулирования температуры электролита можно получать различные оттенки покрытий: при температуре 35÷55ºС покрытие блестящее; при 55÷80ºС – молочное; при температуре ниже 35ºС – матовое.
Что касается анодов, обеспечивающих, как свидетельствует практика, самые стабильные процессы хромирования, то можно рекомендовать их изготовление из следующего сплава: свинец – 81÷86 %, олово – 10÷15 %, сурьма – 4 %. Однако не всегда удается найти такие аноды, в таком случае можно воспользоваться полностью свинцовыми анодами или анодами из сплава 93 % свинца и 7 % сурьмы.
В зависимости от состава электролита возможно получать довольно широкую гамму покрытий, разных по цвету и физическим параметрам.
Декоративное хромовое покрытие получаеться при использовании электролита следующего состава, электролит состоит из; 350 массовых частей (м.ч.) хромового ангидрида, 3,5 м.ч. серной кислоты и 100 м.ч. воды. Температура электролита при хромировании должна быть 35÷40град. С, а плотность тока – 10÷15 А/дм2.
Износостойкое хромовое покрытие применяется для обработки деталей двигателей, редукторов, гидравлики и прочих механизмов. Его получают используя электролит следующего состава: 150 м.ч. хромового ангидрида, 1,5 м.ч. серной кислоты и 100 м.ч. воды. Температура электролита 50÷55ºС, плотность тока 45÷100 А/дм2.
Темно-голубое декоративно-защитное покрытие получается, используя электролит такого состава: 350 м.ч. хромового ангидрида, 3,5 м.ч. серной кислоты, 1 м.ч. желтой кровяной соли и 100 м.ч. воды. Температура электролита 25÷30ºС, плотность тока 5÷10 А/дм2.
Агатовое, темно-синее декоративно-защитное покрытие получается если применять электролит, состоящий из 40 м.ч. хромового ангидрида, 10 м.ч. уксуснокислого бария и 100 м.ч. воды. Температурный режим электролита 15ºС, плотность тока 25 А/дм2.
Черное декоративно-защитное покрытие получается если использовать электролит следующего состава: 250 м.ч. хромового ангидрида, 8 м.ч. уксуснокислого кальция и 100 м.ч. воды. Температурный режим электролита 25÷30ºС, плотность тока до 100 А/дм2.
Мягкое декоративное покрытие получается при обработке в электролите следующего состава: состоящем из 250 м.ч. хромового ангидрида, 7÷10 м.ч. сернокислого хрома, 3 м.ч. борно-фтористоводородной кислоты, 100 м.ч. воды, однако можно применять и другой состав: 250 м.ч. хромового ангидрида, 3,5 м.ч. фтористого натрия и 100 м.ч. воды. Для обоих электролитов плотность тока составляет 4÷5 А/дм2, а температура 18÷20ºС.
Электролиты нельзя долго хранить, поскольку при этом теряются первоначальные качества.
Чугунные и стальные изделия перед обработкой подогревают до рабочей температуры электролита, медные и латунные – предварительно прогревают в горячей воде, а затем под напряжением погружают в гальваническую ванну.
Алюминий и его сплавы перед хромированием покрывают прочной пленкой другого металла. Для этого нужно изделие, поверхность которого приготовлена для хромирования, погрузить в раствор такого состава: хлорное железо – 25÷35 г, концентрированная соляная кислота – 15÷20 г, вода – 1000 г. Деталь выдерживают в этом растворе 1÷2 мин, затем промывают водой и тут же приступают к хромированию. Так же можно еще воспользоваться другим раствором: сернокислый цинк - 200 г, едкий натр – 200 г, вода – 1000 г. В таком растворе алюминиевую деталь необходимо выдержать 2÷3 мин, после этого промыть водой. В таком случае на поверхности изделия образуется тонкий промежуточный слой цинка, который обеспечит хорошее сцепление хромового покрытия с деталью.
Иногда нужно обновить хромовое покрытие на изделии. Для этого изделие нужно погрузить в электролит и на протяжении 30 с пропускать ток обратного направления. При этом поверхность старого хромового покрытия слегка растворяется и будущее хромовое покрытие надежно сцепляется со старым. При нанесении хромовых покрытий плотность тока доводят до расчитаной на протяжении 3÷5 мин.
После того как гальванический процесс завершен, изделие вынимают из электролита, промывают в теплой воде, потом нейтрализуют в 3 %-ном растворе пищевой соды, после этого снова промывают в горячей воде и сушат. Если же нанесено твердое износостойкое покрытие, то изделие необходимо обязательно прокипятить в течение 1÷1,5 ч в большом объеме дистиллированной воды, в завершении его помещают на 2÷4 часа в сушильный шкаф с температурой 110÷130ºС.
При окончании хромирования обязательно проводят механическое полирование с использованием полировальных паст.
Цинкование , как правило, применяется для создания защитных антикоррозионных или декоративных покрытий на поверхности черных металлов. Цинк сильно сцепляется с поверхностью других металлов, а с течением времени на цинковых покрытиях образуется тонкая пленка окислов, обладающая хорошими защитными свойствами. Для гальванического цинкования применяется электролит такого состава: сернокислый цинк –200 г, сернокислый аммоний – 50 г, уксуснокислый натрий – 15 г, вода – 1000 г. Рабочая температура электролита – 18÷25ºС, плотность тока – 1,5 А/дм2 .
Цинкатирование Широкое распространение получило цинкатирование. Для цинкатирования используют электролит такого состава: окись цинка – 4÷5 г, едкий калий – 85÷100 г, хлористое олово или хлорное олово – 0,15÷0,25 г, перекись водорода -2т, вода - 1000 г. Рабочая температура электролита – 50ºС, плотность тока – 0,5 А/дм2.
Электролиты для цинкатирования приготавливаются в такой последовательности: сначала растворяется в воде едкий калий, используя 1/10 объема всей воды, нагревается раствор до температуры 90÷100ºС и растворяют в нем окись цинка. Раствор разводится горячей водой до половины объема ванны и тщательно перемешивается. Соль цинка, которая при этом образуется, долго отстаивают, а потом аккуратно сливают в рабочую ванну. Хлористое или хлорное олово растворяют в воде отдельно и вливают в электролит уже в процессе гальванической обработки.
После обработки оцинкованному изделию в декоративных целях можно придать блеск. Для этого изделие опускают на 2÷3 с в раствор такого состава: хромпик – 100÷150 г, серная кислота – 3÷4 г, вода – 1000 г. Можно также для этих целей воспользоваться 2÷3 %-ным раствором азотной кислоты. После обработки изделие тщательно промывается водой.
Меднение металлических деталей производят в защитных целях и перед хромированием, а так же для создания на поверхности металла токопроводящего слоя с минимальным сопротивлением. Для качественного покрытия черных металлов слоем меди применяют цианистые электролиты, работа с которыми в домашних условиях недопустима. Поэтому стальные и чугунные детали сначала никелируют гальваническим способом, а уж затем на никель осаждают медь. При меднении никелированных изделий можно применить электролит такого состава: сернокислая медь (медный купорос) - 200 г, концентрированная серная кислота - 30-50 г, вода - 1000 г. Рабочая температура электролита - 18- 25ºС, плотность тока - 1-2 А/дм2.
При покрытии алюминиевых изделий слоем меди так же необходимо провести предварительную подготовку. После декапирования алюминиевое изделие оксидируют в течение 10-15 мин в электролите такого состава: концентрированная серная кислота - 109 г, вода - 1000 г, при температуре 18-25ºС и плотности тока 1 А/дм2. Затем изделие травят в водном растворе соды (30 г на 1000 г воды) на протяжении 3-4 мин при температуре 50-55ºС. После травления деталь тщательно промывают водой и погружают в гальваническую ванну с электролитом следующего состава: медный купорос - 188 г, серная кислота - 49 г, вода - 1000 г. Рабочая температура электролита - 15-20ºС, плотность тока - 1 А/дм2. Как анод используют медную пластину.
Латунное гальваническое покрытие является чем-то промежуточным между меднением и цинкованием. Для электролита используются реактивы, применяемые как при меднении, так и при цинковании: сернокислая медь (медный купорос) - 5 г, сернокислый цинк - 8,5 г, щавелевая кислота - 30 г, концентрированная кислота - 20 г, желатин - 0,2 г, вода - 1000 г. Рабочая температура электролита - 18-25град. С, плотность тока - 2-3 А/дм2.
Гальваническое серебрение применяется при создании на поверхности металлов декоративных защитных и электропроводящих слоев. Посеребренные изделия имеют также хорошую отражающую способность. При серебрении деталей из черных металлов первоначально путем гальванического никелирования создают промежуточный слой никеля, на который осаждают серебро. Электролит для гальванического серебрения состоит из следующих компонентов: хлористое серебро - 10- 15 г, желтая кровяная соль (железоцианистый калий) - 15-35 г, кальцинированная сода - 15-35 г, вода (желательно дистиллированная) - 1000 г. Температура работы электролита - 18-20град. С, плотность тока - 0,1 А/дм2. Как анод используются графитовые пластины. Каждый компонент входящий в состав электролита растворяют отдельно в кипящей воде. Хлористое серебро растворяют в темном месте. Растворы желтой кровяной соли и кальцинированной соды вливают в раствор хлористого серебра и кипятят вместе в течение 1,5-2 ч, после чего все фильтруют. Готовый электролит имеет светло-желтый оттенок и не включает в себя осадок.
Нанесение гальванических покрытий методом натирания позволяет обойтись без гальванических процессов, особенно ценен при обработке деталей, имеющих большие размеры. Для реализации данного метода мастеру-любителю необходимо изготовить небольшое устройство. Необходимо иметь понижающий трансформатор с
 Рис. Приспособление
для нанесения гальванических покрытий
методом натирания
Рис. Приспособление
для нанесения гальванических покрытий
методом натирания
выходным напряжением 5-15 В (желательно с плавной регулировкой) и током до 2х А, диодный мост (могут использоваться диоды ДЗОЗ-Д305), щетку диаметром 20-30мм, соединительные провода. Гальваническая щетка универсальный инструмент для создания гальванических покрытий из любых металлов. Ручка гальванической щетки изготовляется с применением диэлектрических материалов. Можно использовать отрезок пластиковой трубы подходящего диаметра. Сверху ручка должна плотно закрываться пластмассовой крышкой, а снизу - вставкой из щетины или любого синтетического ворса. Вставка должна упираться в решетчатое дно, находящееся на 20 мм выше нижнего среза пластмассовой трубки. Щетинистую вставку сильно обматывают металлической проволокой что бы получилось наподобие толстой кисти. Эта проволока исполняет функцию анода. Для цинкования, хромирования, никелирования, серебрения и золочения используется проволока из нержавеющей стали, но при никелировании под нее подкладывают еще изогнутую пластинку из никеля, а при хромировании - из свинца. При меднении используют обычную медную проволоку. В домашней мастерской необходимо иметь несколько щетинистых вставок различного диаметра, использующихся для покрытия различными металлами. Проволока на вставке подсоединяется с помощью соединительных проводов к положительному гнезду источника питания. Пучок щетины диаметром в полтора два раза больший, чем диаметр пластиковой ручки, перевязывают капроновой нитью. Поверх нее наматывают соответствующую проволоку, пока не образуется поясок, в который будет упираться трубчатая ручка. Между ручкой и пояском закладывают резиновую прокладку в виде полоски толщиной 1-1,5 мм и соответствующей длины. При изготовления вставки можно использовать щетину малярной кисти. Если в кисти щетина соединена эпоксидным клеем у основания, то эту часть придется отрезать, так как слой клея станет препятствовать проникновению электролита в рабочую зону. Длина щетины должна составлять 45-60мм, из которых 20 мм станет заходить внутрь ручки, 10 мм скроются под проволочной обмоткой, 15-20 мм составят свободный конец. В случае необходимости торец щетки стачивают на наждачном круге до получения ровной поверхности. Для работы в ручку заливается электролит, вставка соединяется с положительной клеммой +, а обрабатываемое изделие - с отрицательной клеммой источника питания--. Инструмент равномерно передвигают по поверхности изделия, не отрывая от него. Периодически в ручку доливают электролит (не допускается полное опорожнение ручки). Для получения хорошего покрытия на определенном участке поверхности изделия необходимо сделать 15-30 проходов гальванической щетки. Так же можно воспользоваться и более простым в изготовлении приспособлением. Для этого медную, свинцовую, цинковую, никелевую или из нержавеющей стали пластинку, в зависимости от необходимого вида покрытия, соединяют проводом с положительной клеммой источника питания, затем оборачивают ее фланелевой тканью слоем в 4-5 мм, фланель смачивают электролитом и натирают обезжиренный и декапированный предмет, к которому подсоединяют отрицательный вывод источника питания. Пластинку во фланели необходимо гораздо чаще смачивать в электролите. Работать надо, в очках и в защитных резиновых перчатках. Электролиты для гальванических покрытий методом натирания могут быть те же, что и при классической гальванической обработке, но все же лучше использовать следующие составы:
Меднение Медный купорос..............200 г Концентрированная серная кислота.................50 г Этиловый спирт или фенол..............1-2 г Вода...................................1000 г
Хромирование Хромовый ангидрид........250 г Концентрированная серная кислота.................. 2,5 г Вода................................... 1000 г
Никелирование Сернокислый никель.......70 г Сернокислый натрий.......40 г Борная кислота................20 г Хлористый натрий...........5 г Вода................................... 1000г
Цинкование Сернокислый цинк.......... 300 г Сернокислый натрий......70 г Борная кислота................ 20 г Вода................................... 1000 г
Серебрение Хлористое серебро (свежеосажденное).............. 10-15 г Желтая кровяная соль.......................................... 15-30 г Кальцинированная сода....................................... 15-30 г Вода....................................................................... 1000 г После нанесения покрытия изделие тщательно промывают водой, сушат и полируют с применением полировочных паст.
Методы нанесения гальванических покрытий
Все гальванические процессы происходят по довольно простой схеме. Имеется система, состоящая из изделия, на которое наносится какое либо покрытие, раствор, в который это изделие помещается (электролит). И третий компонент, это пластина, на которую подается положительный заряд и она называется анодом. Изделие в свою очередь выступает в роли катода и на него подают отрицательный заряд. При подключении такой системы к источнику питания металл из которого состоит анод растворяется в электролите, а на изделие наносится металл, растворенный в электролите. Электролит выступает в роли переносчика металла с анода на наше изделие. Размеры ванн, куда налит электролит, могут быть самыми разными, объемом от долей литра до десятков тонн. Сами размеры и форма ванн диктуются размерами изделий, для покрытия которых они предназначены. В ваннах кроют изделия, которые можно завесить на подвески. Через них на изделие будет подводиться минус от источника питания, и они будут удерживать изделие на весу в объеме электролита.
Если изделия совсем мелкие и их много, прибегают к помощи немного видоизмененных ванн, которые называются барабанами. В барабанах покрывают сразу несколько изделий, и контакт с минусом источника питания обеспечивается за счет их взаимного соприкосновения. В барабанах изделия одновременно с нанесением покрытия еще и галтуются. Сам барабан с изделиями вращается в ванне с электролитом, в которой также находится анод.
Аналогично устроены и колокольные ванны наливного типа. В них засыпаются и изделия, заливается электролит и туда же вставляется анод. Они приводятся в медленное вращение и детали, пересыпаясь в электролите, медленно наращивают покрытие.
Все эти три метода обеспечивают полное покрытие изделий со всех сторон. Но есть еще один метод нанесения покрытия методом гальваники, и называется он трибогальваникой, стилогальваникой, нанесением «внатирку» и т.д. Смысл его в том, что на изделие как обычно подают минус источника питания, на анод плюс, но вся эта система не погружается в электролит. Электролитом лишь пропитывается тряпка или тампон, намотанный на анод. Анодом, который держат в руке под напряжением, как бы натирают изделие, и через некоторое время на изделии появляется покрытие. Электролиты для такого метода нанесения очень часто называют гелями. Это просто загущенные электролиты для того чтобы они поменьше стекали с тампона по изделию. С помощью этого метода можно покрывать крупные изделия, правда, очень долго, но зато наносить покрытие не на все изделие, а лишь на требуемые участки поверхности. Минусом такого метода является сильный разброс в толщине наносимого покрытия и оно, как правило, получается очень тонким. Такое покрытие резко уступает по качеству покрытиям, нанесенным в ваннах, хуже держится, неоднородно по цвету.
Отдельно, но очень близко к гальваническим, стоят методы химического и иммерсионногого нанесения металлических покрытий. В электролитах для протекания восстановления атомов металла на поверхности изделия необходимо протекание электрического тока. При химическом нанесении создается система, в которую вводится восстановитель. Именно он, окисляясь, восстанавливает металл покрытия на поверхности изделия. Это так называемая автокаталитическая реакция, которая идет только на поверхности металлического катализатора. А катализатором служит именно тот же металл, который и наносится. Происходит это вкратце так: приготовляется раствор (иногда нагревается), туда опускается подготовленное активированное изделие и происходит нанесение. Однако запустить такую реакцию не всегда просто, иногда она сама запускается на более активных металлах, а иногда её надо запускать принудительно, с помощью катализатора, например наночастиц палладия. И вот тут самое главное! Таким образом, можно покрывать не только металлические детали из различных сплавов, но и не проводящие материалы, например пластики. Иммерсионный метод в отличие от химического идет в виде обменной реакции на поверхности металлического изделия. Раствор для например, иммерсионного золочения растравливает металл на поверхности изделия и взамен укладывает золото. Это просто обменная реакция. Она идет до тех пор, пока на поверхности не останется только золото и не будет более оголенного, иного металла основы.
Именно на химических процессах нанесения металлов базируется технология металлизации непроводников, пластмасс, тканей, и т.д. По такой реакции создается токопроводный слой, а уже на него обычными гальваническими методами наносятся все остальные покрытия, включая финишное.
Все остальные методы нанесения металлических покрытий, такие как вакуумное и плазменное напыление не являются гальваническими методами.
Нанесение на железо слоя цинка – самый распространенный способ его защиты от коррозии. Гальваническое цинкование получило наиболее широкое распространение благодаря преимуществам технологии и получаемых защитных покрытий.
1 Особенности защитных цинковых покрытий
Цинкование – самый распространенный способ защиты железа поверхностной металлизацией от . Для этих целей расходуется около 40 % от общего объема мировой годовой добычи цинка. Цинкование получило широкое распространение благодаря анодному характеру создаваемой из цинка защиты.
Значение электрохимического потенциала цинка составляет – 0,763 В, что меньше такого же параметра для черных металлов (железа, стали, чугуна), поэтому он защищает последние от коррозии электрохимическим способом. Причем защитные свойства покрытий из цинка проявляются даже в случае незначительной их толщины и при наличии обнаженных участков, пор. Известно много примеров протекторного характера защиты цинком непокрытых им, оголенных фрагментов стальных изделий (например, обрезанные проволока в поперечном сечении и края , резьба гайки без покрытия, навинченной на оцинкованный болт).
Анодный характер взаимодействия цинкового покрытия с сталью и внешней средой в ряде случаев может смениться на катодный и тогда коррозионные процессы в железе происходят очень интенсивно. Подобное наблюдается, например, при воздействии на оцинкованные изделия горячей воды, нагретой до 70 °С и выше (в автоклавах, котельных установках).
Сам цинк, принимая "удар" на себя от воздействия внешней среды, защищается следующим образом: при окислении этого металла на его поверхности образуется тонкая плотная оксидная пленка, препятствующая проникновению кислорода дальше вглубь цинка. Благодаря этому его окисление останавливается. У железа образующиеся при окислении оксиды имеют объем больший, чем первоначальный металл, и поэтому пленка из них сразу разрушается, становится рыхлой и пропускает кислород к неокисленному материалу. Так возникает ржавчина.
У цинковых покрытий химическая стойкость снижается при воздействии на них летучих продуктов, которые выделяются при старении следующих органических материалов:
- олифы;
- синтетических смол;
- хлорированных углеводородов.
Покрытия подвержены легкому разрушению, если они контактируют или находятся в закрытом объеме с промасленными или свежеокрашенными деталями.

Большое влияние на быстроту корродирования цинка оказывает показатель рН среды. При рН 7–12 (щелочная среда) этот металл практически не растворяется. Отклонение от указанных величин приводит к возрастанию скорости его коррозии. Особенно высока скорость коррозии цинковых покрытий в атмосфере тропиков и промышленных городов.
2 Гальванический способ цинкования металлов
Защитное действие покрытий из цинка в первую очередь определяется их толщиной, устанавливаемой исходя из конкретных условий эксплуатации металлических изделий и равномерности их нанесения. Возможности различных способов цинкования неодинаковы и позволяют получать толщину покрытия от 5 мкм (гальваническое) до 1,5 мм. В случае гальванического способа металлизации качество защитного слоя во многом зависит от характера используемого электролита для цинкования.

Защитные свойства цинка можно значительно увеличить разными способами, самые распространенные из которых следующие:
- пассивирование (хроматирование) – создание на его поверхности хроматных пленок химической обработкой изделий в растворах с хромовой кислотой либо ее солями;
- фосфатирование - образование на его поверхности фосфатной пленки посредством обработки оцинкованных заготовок в растворах солей фосфорной кислоты;
- покраска – нанесение лакокрасочных покрытий (лучшие результаты после предварительного фосфатирования).
Гальваническое цинкование представляет собой электролитический метод нанесения тонкого защитного слоя цинка на изделие, поверхность которого должна быть предварительно подготовлена. Этот способ позволяет получать покрытия толщиной 5–40 мкм.

В условиях масштабного , листа, штрипса толщина может быть увеличена до 500 мкм (0,5 мм). Непосредственно сам процесс образования покрытия заключается в осаждении на катоде (изделие, которое покрывают) положительно заряженных частиц (ионов) цинка из водных растворов его соединений (электролитов) при пропускании постоянного электротока через раствор. Применяемые аноды должны быть из цинка, так как их основное назначение – восполнять в электролите разряжающиеся на изделиях ионы. В зависимости от выбранного режима ток имеет катодную плотность в диапазоне 1–5 А/дм 2 .
3 Преимущества и недостатки цинкования гальваническим методом
Электролитический способ нанесения цинка в сравнении с другими методами цинкования наиболее распространен и обладает следующими преимуществами:
- высокой производительностью;
- низкой себестоимостью;
- получение достаточно высокого уровня защиты изделий;
- равномерностью покрытия без потеков, капель, с сохранением формы и размеров изделия;
- возможностью нанесения цинка на все участки изделий с любой сложной формой, включая различные поры;
- получение декоративных защитных покрытий (гладких, блестящих), не требующих дополнительной обработки.

Основным недостатком является низкая адгезия (сцепление) образуемого покрытия с изделием, требующая особой тщательности подготовки (очистки) поверхности последнего. Еще следует отметить вероятность наводораживания защищаемого металла, особенно при несоблюдении режимов гальваники цинкования, что приводит к водородной хрупкости изделия и непривлекательному виду его поверхности. Существенным недостатком этого метода является образование ядовитых и вредных для окружающей среды отходов, которые необходимо подвергать тщательной очистке.

4 Технология и оборудование гальванического цинкования на производстве
На производстве электролитическое цинкование включает следующие технологические процессы, производимые с изделиями:
- Очистка их от окалины, ржавчины, смазочно-охлаждающих и лакокрасочных составов. Химическая обработка в обезжиривающих и щелочных растворах.
- Промывка водой в проточной ванне.
- Электролитическое обезжиривание.
- Промывка.
- Травление в растворе воды и соляной кислоты. Позволяет удалить оставшиеся окалину и ржавчину без растворения основного металла. При этом происходит декапирование поверхности – активация перед цинкованием.
- Промывка.
- Само цинкование.
- Промывка.
- Может проводиться осветление в растворе воды с азотной кислотой для снятия окисной пленки.
- Промывка.
- Может проводиться фосфатирование.
- Промывка.
- Может проводиться пассивация электролитическим хроматированием (и/или хроматирование распылением).
- Сушка.

В зависимости от типа изделия и соответствующей технологии некоторые этапы промывки могут проводиться щеточно-моечным способом. Могут быть дополнительные операции. Например, гальваническое цинкование полосы начинают с ее разматывания, сварки концов, а затем правки. Заканчивают – промасливанием и сматыванием.
В соответствии с типом покрываемых изделий и объемом производства применяют различные гальванические линии и сопутствующее им дополнительное оборудование. Эти линии представляют из себя определенную последовательность промывочных и технологических ванн, необходимых для создания однослойных либо многослойных цинковых покрытий с требуемыми функциональными свойствами. Все гальваническое оборудование по степени механизации классифицируется на:
- механизированные линии с полностью автоматическим управлением;
- с возможностью частичного ручного управления;
- линии с полностью ручным обслуживанием;
- мини-линии.

В комплект поставки линии, в зависимости от ее модели, помимо ванн входят:
- транспортные системы (автооператоры, манипуляторы);
- промышленное и локальное оборудование очищения сточных вод;
- вспомогательное оборудование: приспособления для цинкования (подвески, колокола, барабаны), катодные и анодные штанги, теплообменники, ТЭНы, другое;
- дополнительное оборудование: система вентиляции, выпрямительные агрегаты, компрессоры и воздуходувки, холодильное оборудование, сушильные камеры и шкафы, насосы, оборудование получения демиводы, фильтровальные установки;
- и другое.
5 Электролиты, используемые при гальваническом цинковании
На гальваническом производстве, исходя из назначения изделия, применяют различные электролиты для цинкования. Их условно делят на 2 основные группы:
- Простые кислые (хлоридные, сульфатные, борфтористоводородные) – в них цинк представляет собой гидротированные ионы.
- Сложные комплексные (цинкатные, цианидные, пирофосфатные, аммиакатные и другие) – цинк присутствует в составе комплексных ионов, которые заряжены положительно или отрицательно. Эти электролиты для цинкования делятся на кислые и щелочные.
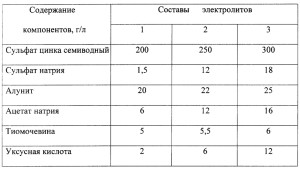
От состава и природы электролитов для цинкования зависят скорость осаждения и качество осадков цинка на катоде.
Самый востребованный метод металлизации – в слабокислых простых электролитах для цинкования. Они допускают использование тока большей плотности, чем комплексные, и, соответственно, отличаются более высокой скоростью процесса наращивания покрытий. Гальванике с этими электролитами для цинкования также характерны высокий уровень укрываемости и хороший внешний вид получаемых покрытий. Сталь при их использовании менее подвержена наводороживанию, приводящему к хрупкости деталей. Но эти электролиты пригодны только для заготовок простой конфигурации, проволоки, ленты. Качество покрытий не очень высокое.

Осаждение цинка из комплексных электролитов для цинкования протекает в условиях высокого рассеивания ионов, с снижением выхода металла и увеличением выделения водорода при возрастании плотности тока. Поэтому эти растворы используют с малой плотностью тока. Их применение позволяет получать мелкозернистые, равномерные, очень качественные покрытия на изделиях и простой, и сложной формы.





