Протекторная защита. Как перехитрить ржавчину, используя электрохимические способы защиты
Коррозия - это химическая и электрохимическая реакция металла с окружающей средой, вызывающая его повреждение. Она протекает с разной скоростью, которую можно уменьшить. С практической точки зрения интерес представляет антикоррозионная катодная защита металлических сооружений, контактирующих с землей, с водой и с транспортируемыми средами. Особенно повреждаются наружные поверхности труб от влияния грунта и блуждающих токов.
Внутри коррозия зависит от свойств среды. Если это газ, он должен быть тщательно очищен от влаги и агрессивных веществ: сероводорода, кислорода и др.
Принцип работы
Объектами процесса электрохимической коррозии являются среда, металл и границы раздела между ними. Среда, которой обычно является влажный грунт или вода, обладает хорошей электропроводностью. На границе раздела между ней и металлической конструкцией происходит электрохимическая реакция. Если ток положительный (анодный электрод), ионы железа переходят в окружающий раствор, что приводит к потере массы металла. Реакция вызывает коррозию. При отрицательном токе (катодный электрод) этих потерь нет, поскольку в раствор переходят электроны. Способ используется в гальванотехнике для нанесения на сталь покрытий из цветных металлов.
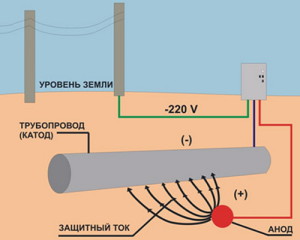
Катодная защита от коррозии осуществляется, когда к объекту из железа подводят отрицательный потенциал.
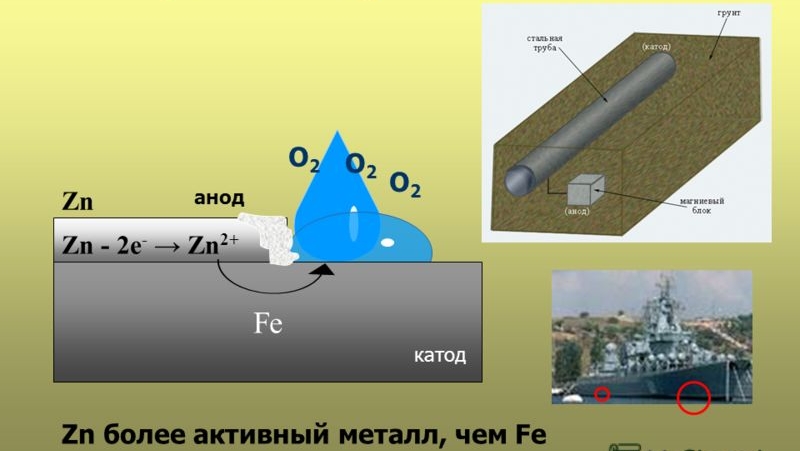
Для этого в грунте размещают анодный электрод и подключают к нему положительный потенциал от источника питания. Минус подается на защищаемый объект. Катодно-анодная защита приводит к активному разрушению от коррозии только анодного электрода. Поэтому его следует периодически менять.
Негативное действие электрохимической коррозии
Коррозия конструкций может происходить от действия блуждающих токов, попадающих из других систем. Они полезны для целевых объектов, но наносят существенный вред близкорасположенным сооружениям. Блуждающие токи могут распространяться от рельсов электрифицированного транспорта. Они проходят по направлению к подстанции и попадают на трубопроводы. При выходе из них образуются анодные участки, вызывающие интенсивную коррозию. Для защиты применяют электродренаж - специальный отвод токов от трубопровода к их источнику. Здесь также возможна Для этого необходимо знать величину блуждающих токов, которую измеряют специальными приборами. 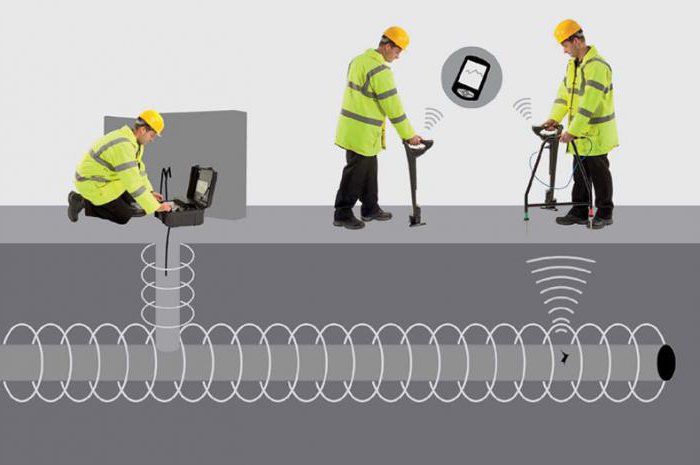
По результатам электрических измерений выбирается способ защиты газопровода. Универсальным средством является пассивный способ от контакта с грунтом с помощью изолирующих покрытий. Катодная защита газопровода относится к активному способу.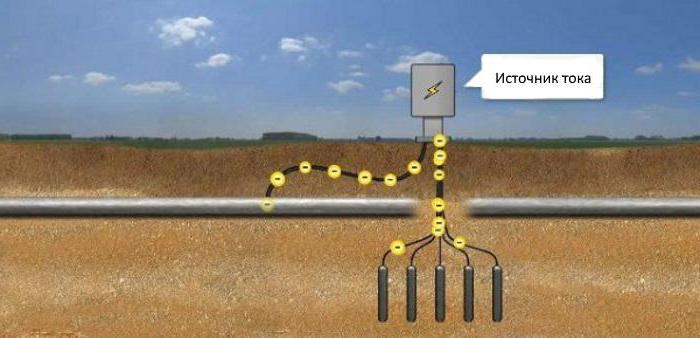
Защита трубопроводов
Конструкции в земле защищают от коррозии, если подключить к ним минус источника постоянного тока, а плюс - к анодным электродам, закопанным рядом в грунт. Ток пойдет к конструкции, защищая ее от коррозии. Таким образом производится катодная защита трубопроводов, резервуаров или трубопроводов, находящихся в грунте.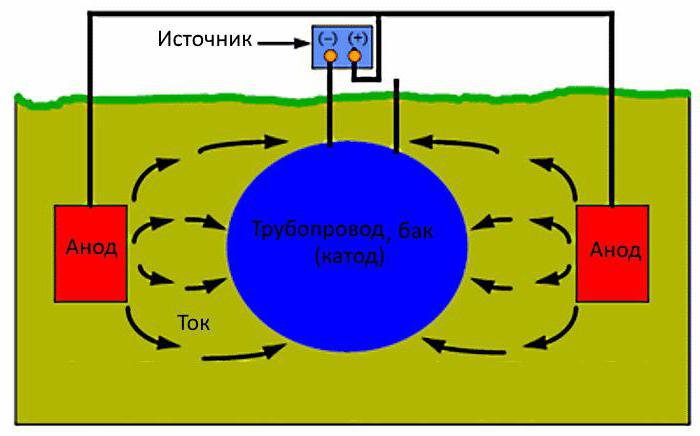
Анодный электрод будет разрушаться, и его следует периодически менять. Для бака, заполненного водой, электроды размещают внутри. При этом жидкость будет электролитом, через которую ток пойдет от анодов к поверхности емкости. Электроды хорошо контролируются, и их легко заменить. В грунте это делать сложней.
Источник питания
Возле нефте- и газопроводов, в сетях отопления и водоснабжения, для которых необходима катодная защита, устанавливают станции, от которых подается напряжение на объекты. Если они размещаются на открытом воздухе, степень их защиты должна быть не ниже IP34. Для сухих помещений подходит любая.
Станции катодной защиты газопроводов и других крупных сооружений имеют мощность от 1 до 10 кВт.
Их энергетические параметры прежде всего зависят от следующих факторов:
- сопротивление между почвой и анодом;
- электропроводность грунта;
- длина защитной зоны;
- изолирующее действие покрытия.
Традиционно преобразователь катодной защиты представляет собой трансформаторную установку. Сейчас на смену ей приходит инверторная, обладающая меньшими габаритами, лучшей стабильностью тока и большей экономичностью. На важных участках устанавливают контроллеры, обладающие функциями регулирования тока и напряжения, выравнивания защитных потенциалов и др.
Оборудование представлено на рынке в различных вариантах. Для конкретных нужд применяется обеспечивающее лучшие условия эксплуатации.
Параметры источника тока
Для защиты от коррозии для железа защитный потенциал составляет 0,44 В. На практике он должен быть больше из-за влияния включений и состояния поверхности металла. Максимальная величина составляет 1 В. При наличии покрытий на металле ток между электродами составляет 0,05 мА/м 2 . Если изоляция нарушится, он возрастает до 10 мА/м 2 .
Катодная защита эффективна в комплексе с другими способами, поскольку меньше расходуется электроэнергии. Если на поверхности конструкции есть лакокрасочное покрытие, электрохимическим способом защищаются только места, где оно нарушено.
Особенности катодной защиты
- Источниками питания служат станции или мобильные генераторы.
- Расположение анодных заземлителей зависит от специфики трубопроводов. Способ расстановки может быть распределенным или сосредоточенным, а также располагаться на разной глубине.
- Материал анода выбирается с низкой растворимостью, чтобы его хватило на 15 лет.
- Потенциал защитного поля для каждого трубопровода рассчитывается. Он не регламентируется, если на конструкциях отсутствуют защитные покрытия.
Стандартные требования "Газпрома" к катодной защите
- Действие в течение всего срока эксплуатации средств защиты.
- Защита от атмосферных перенапряжений.
- Размещение станции в блок-боксах или в отдельно стоящей в антивандальном исполнении.
- Анодное заземление выбирается на участках с минимальным электрическим сопротивлением грунта.
- Характеристики преобразователя выбираются с учетом старения защитного покрытия трубопровода.
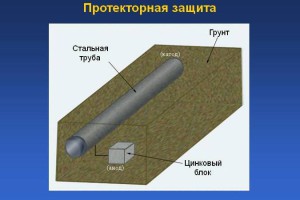
Протекторная защита
Способ представляет собой вид катодной защиты с подключением электродов из более электроотрицательного металла через электропроводную среду. Отличие заключается в отсутствии источника энергии. Протектор берет коррозию на себя, растворяясь в электропроводной окружающей среде.
Через несколько лет анод следует заменить, поскольку он вырабатывается.
Эффект от анода увеличивается со снижением у него переходного сопротивления со средой. Со временем он может покрываться коррозионным слоем. Это приводит к нарушению электрического контакта. Если поместить анод в смесь солей, обеспечивающую растворение продуктов коррозии, эффективность повышается.
Влияние протектора ограничено. Радиус действия определяется электрическим сопротивлением среды и разностью потенциалов между
Протекторная защита применяется при отсутствии источников энергии или когда их использование экономически нецелесообразно. Она также невыгодна при применении в кислых средах из-за высокой скорости растворения анодов. Протекторы устанавливают в воде, в грунте или в нейтральной среде. Аноды из чистых металлов обычно не делают. Растворение цинка происходит неравномерно, магний корродирует слишком быстро, а на алюминии образуется прочная пленка окислов.
Материалы протекторов
Чтобы протекторы обладали необходимыми эксплуатационными свойствами, их изготавливают из сплавов со следующими легирующими добавками.
- Zn + 0,025-0,15 % Cd+ 0,1-0,5 % Al - защита оборудования, находящегося в морской воде.
- Al + 8 % Zn +5 % Mg + Cd, In, Gl, Hg, Tl, Mn, Si (доли процента) - эксплуатация сооружений в проточной морской воде.
- Mg + 5-7 % Al +2-5 % Zn - защита небольших конструкций в грунте или в воде с низкой концентрацией солей.
Неправильное применение некоторых видов протекторов приводит к негативным последствиям. Аноды из магния могут быть причиной растрескивания оборудования из-за развития водородного охрупчивания.
Совместная протекторная катодная защита с антикоррозионными покрытиями повышает ее эффективность.
Распределение защитного тока улучшается, а анодов требуется значительно меньше. Один магниевый анод защищает покрытый битумом трубопровод на длину 8 км, а без покрытия - всего на 30 м.
Защита кузовов автомобилей от коррозии
При нарушении покрытия толщина кузова автомобиля может уменьшиться за 5 лет до 1 мм, т. е. проржаветь насквозь. Восстановление защитного слоя важно, но кроме него есть способ полного прекращения процесса коррозии с помощью катодно-протекторной защиты. Если превратить кузов в катод, коррозия металла прекращается. Анодами могут быть любые токопроводящие поверхности, расположенные рядом: металлические пластины, контур заземления, корпус гаража, влажное дорожное покрытие. При этом эффективность защиты возрастает с ростом площади анодов. Если анодом является дорожное покрытие, для контакта с ним применяется "хвост" из металлизованной резины. Его помещают напротив колес, чтобы лучше попадали брызги. "Хвост" изолируется от корпуса.
К аноду подключается плюс аккумуляторной батареи через резистор 1 кОм и последовательно соединенный с ним светодиод. При замыкании цепи через анод, когда минус соединен с кузовом, в нормальном режиме светодиод еле заметно светится. Если он ярко горит, значит, в цепи произошло короткое замыкание. Причину надо найти и устранить.
Для защиты последовательно в цепи нужно установить предохранитель.
При нахождении автомобиля в гараже его подключают к заземляющему аноду. Во время движения подключение происходит через "хвост".
Заключение
Катодная защита является способом повышения эксплуатационной надежности подземных трубопроводов и других сооружений. При этом следует учитывать ее негативное воздействие на соседние трубопроводы от влияния блуждающих токов.
Протекторная защита трубопроводов и других металлических изделий от коррозии представляет собой один из вариантов предохранения разнообразных конструкций от негативных коррозионных явлений.
1 Суть протекторной защиты металлов от коррозии
Данная подразумевает присоединение к предохраняемой металлической поверхности специального протектора – металла с более электроотрицательными характеристиками. При растворении под действием воздуха такой протектор начинает выполнять свою функцию, которая состоит в предохранении основного изделия от разрушения.
По сути, протекторная защита трубопроводов и иных магистралей от коррозии является одним из видов катодной электрохимической методики.
Описываемый способ антикоррозионной обработки оптимален для ситуаций, когда у предприятия нет возможности возвести специальные электрические линии для организации эффективной катодной защиты от либо их строительство признается экономически нецелесообразным. Протектор полностью выполняет свои задачи при условии, что величина переходного сопротивления между средой, окружающей обрабатываемый объект, и этим самым объектом невелика.
Протекторная защита изделий из металла от коррозии является результативной лишь на каком-либо конкретном расстоянии. Для того, чтобы установить данное расстояние, вводится понятие радиуса антикоррозионного действия используемого протектора. Он указывает на наибольшее удаление металла-защитника от предохраняемой конструкции.

Сущность коррозии металлов такова, что менее активный из них при взаимодействии станет присоединять к своим ионам электроны более активного, которые будут производиться активным компонентом системы. В результате происходит сразу два одновременных процесса:
- восстановление менее активного металла (он является катодом);
- окисление менее активного металла-анода, благодаря чему и происходит антикоррозионная защита газопровода, иной магистральной сети, какой-либо металлоконструкции.
Через определенное время действие протектора заканчивается (из-за утраты контакта с предохраняемым металлом либо при полном растворении "защитника"), после чего потребуется выполнить его замену.
2 Антикоррозионная защита при помощи протекторов – особенности методики
Применение протекторной защиты от коррозии трубопроводов и конструкций из металла в кислых средах не имеет смысла, что обусловлено повышенным темпом саморастворения протектора. Она рекомендуется для использования в нейтральных средах, будь то обычный грунт, речная или морская вода.
По отношению к железу более активными являются следующие металлы – магний, хром, кадмий, цинк и некоторые другие. Теоретически именно их следует применять для защиты газопровода либо другой конструкции. Но здесь имеется ряд нюансов, которые обуславливают технологическую нецелесообразность использования чистых металлов в качестве "защитников".
Магний в чистом виде, например, характеризуется повышенной скоростью собственного ржавления, на алюминии очень быстро появляется оксидная толстая пленка, а цинк без каких-либо примесей ввиду своей дендритной крупнозернистой структуры имеет свойство растворяться крайне неравномерно. Чтобы нивелировать все эти негативные явления, в чистые металлы, предназначенные для защиты трубопроводов и металлоконструкций от коррозии, добавляют легирующие компоненты. Другими словами, антикоррозионная защита, например, газопровода, подземного резервуара в большинстве случаев выполняется при помощи различных сплавов.
Часто используются сплавы на основе магния. В них вводят алюминий (от 5 до 7 процентов) и цинк (от 2 до 5 процентов), а также незначительные количества (буквально сотые либо десятые доли) никеля, свинца, меди. Защита от коррозии магниевыми сплавами применяется тогда, когда конструкция из металла (элементы трубопроводов, газопровода и так далее) функционирует в средах с показателем рН не более 10,5 (обычный грунт, водоемы с пресной или слабосоленой водой).
Такое ограничение связано с тем, что магний сначала очень быстро растворяется, а затем на его поверхности формируются соединения, характеризуемые затрудненным растворением. Стоит сказать отдельно об опасности использования магниевых композиций для защиты от коррозии – они могут стать причиной растрескивания изделий из металла, а также их охрупчивания (водородного).
Для металлоконструкций, установленных в соленой воде, газопровода, проложенного по морскому дну, рекомендуется использование протекторов на базе цинка, которые содержат:
- кадмий (от 0,025 до 0,15 %);
- алюминий (не более 0,5 %);
- медь, свинец, железо (от 0,001 до 0,005 % в сумме).

Протекторная защита трубопроводов в морской воде цинковыми составами будет гарантированно эффективной и длительной. Если же такие протекторы применять в грунте или пресных водоемах, они практически мгновенно покрываются гидроксидами и оксидами, что сводит на нет все антикоррозионные мероприятия.
А вот в соленой проточной воде, на прибрежном морском шельфе обычно эксплуатируются алюминиевые защитники от коррозии. В них содержится таллий, кадмий, кремний, индий (суммарно до 0,02 %), магний (не более 5 %) и цинк (не более 8 %). Данный состав не дает возможности появляться на алюминии окислам. Протекторная защита из алюминиевых составов используется в тех же условиях, что и из магниевых.
Цинковые протекторы обычно применяются для антикоррозионной защиты тех металлоконструкций, для которых должна быть обеспечена максимальная пожарная и взрывобезопасность (в частности, разнообразных трубопроводов для транспортировки потенциально горючих материалов, например, газопровода). Также цинковые защитные композиции не создают при анодном растворении загрязняющих соединений. За счет этого им практически нет замены, когда речь идет о защите от коррозии трубопроводов, по которым перемещают нефть, а также нефтеналивных и грузовых судов и танкеров.
3 Совместное применение лакокрасочных составов и протекторов
Нередко защита нефте- либо газопровода, той или иной конструкции из металла от коррозионных проявлений выполняется комбинацией протекторной и лакокрасочной защиты. Последняя по своей сути причисляется к пассивному методу предохранения от коррозии. По-настоящему высоких результатов она не обеспечивает, но зато позволяет в сочетании с протектором:

- нивелировать возможные изъяны покрытия трубопроводов и металлических конструкций, которые возникают по естественным причинам (отслаивание металла, его вспучивание, набухание, появление трещин и так далее), а также при их использовании (нет такого газопровода или танкера, покрытие которого в процессе эксплуатации не претерпевает определенных изменений);
- снизить (иногда весьма существенно) расход достаточно дорогостоящих протекторных материалов, повысив при этом их эксплуатационный срок;
- обеспечить распределение по металлической поверхности трубопроводов защитного тока максимально однородно (равномерно).

Добавим, что лакокрасочные слои во многих случаях довольно-таки сложно нанести на некоторые участки уже функционирующего резервуара, газопровода или водного судна. Тогда лучше, конечно же, не усложнять процесс и применять исключительно протекторы.
Электрохимическая защита конструкций из металла от коррозионных проявлений базируется на наложении на предохраняемое изделие отрицательного потенциала. Высокий уровень эффективности она демонстрирует в тех случаях, когда металлоконструкции подвергаются активному электрохимическому разрушению.
1 Суть антикоррозионной электрохимической защиты
Любая конструкция из металла с течением времени начинает разрушаться в результате коррозионного воздействия. По этой причине металлические поверхности перед эксплуатацией в обязательном порядке покрывают специальными составами, состоящими из различных неорганических и органических элементов. Такие материалы в течение определенного периода надежно предохраняют металл от окисления (ржавления). Но через некоторое время их необходимо обновлять (наносить новые составы).
Тогда, когда защитный слой не удается возобновить, защита от коррозии трубопроводов, кузова автомобиля и других конструкций выполняется при помощи электрохимической методики. Она незаменима для предохранения от ржавления резервуаров и емкостей, работающих под землей, днищ морских кораблей, разнообразных подземных коммуникаций, когда потенциал коррозии (ее называют свободной) находится в зоне перепассивации основного металла изделия или активного его растворения.
Суть электрохимической защиты заключается в том, что к конструкции из металла подключают извне постоянный электроток, который формирует на поверхности металлоконструкции поляризацию катодного типа электродов микрогальванопар. В итоге на металлической поверхности наблюдается преобразование анодных областей в катодные. После такого превращения негативное влияние среды воспринимает анод, а не сам материал, из которого изготовлено защищаемое изделие.

Электрохимическая защита может быть либо катодной, либо анодной. При катодной потенциал металла смещается в отрицательную сторону, при анодной – в положительную.
2 Катодная электрозащита – как она действует?
Механизм процесса, если разобраться в нем, достаточно прост. Погруженный в электролитический раствор металл является системой с большим количеством электронов, которая включает в себя разделенные в пространстве катодные и анодные зоны, электрически замкнутые друг с другом. Подобное положение вещей обусловлено гетерогенной электрохимической структурой металлических изделий (например, подземных трубопроводов). Коррозионные проявления образуются на анодных областях металла из-за его ионизации.

При присоединении материала с большим потенциалом (отрицательным) к основному металлу, находящемуся в электролите, наблюдается образование общего катода за счет процесса поляризации катодных и анодных зон. Под большим потенциалом при этом понимают такую его величину, которая превосходит потенциал анодной реакции. В сформированной гальванопаре материал с малым потенциалом электрода растворяется, что приводит к приостановке коррозии (так как ионы предохраняемого металлического изделия не могут попадать в раствор).
Требуемый для защиты кузова автомобиля, подземных резервуаров и трубопроводов, днищ кораблей электрический ток может поступать от внешнего источника, а не только от функционирования микрогальванической пары. В подобной ситуации предохраняемая конструкция подключается к "минусу" источника электротока. Анод же, сделанный из материалов с малой степенью растворимости, подсоединяют к "плюсу" системы.
Если ток получают только от гальванопар, говорят о процессе с расходуемыми анодами. А при использовании тока от внешнего источника речь идет уже о защите трубопроводов, деталей транспортных и водных средств при помощи наложенного тока. Применение любой из этих схем обеспечивает качественную защиту объекта от общего коррозионного распада и от ряда особых его вариантов (селективная, питтинговая, растрескивающая, межкристаллитная, контактная ).
3 Как работает анодная методика?
Данная электрохимическая методика предохранения металлов от коррозии применяется для конструкций из:
- углеродистых сталей;
- пассивирующихся разнородных материалов;
- высоколегированных и ;
- титановых сплавов.
Анодная схема предполагает смещение потенциала предохраняемой стали в положительную сторону. Причем этот процесс ведется до тех пор, пока система не входит в устойчиво пассивное состояние. Такая защита от коррозии возможна в средах, хорошо проводящих электрический ток. Преимущество анодной методики состоит в том, что она существенно замедляет скорость окисления защищаемых поверхностей.

Кроме того, подобная защита может осуществляться посредством насыщения специальными компонентами-окислителями (нитраты, бихроматы и другие) коррозионной среды. В этом случае ее механизм примерно идентичен традиционному методу анодной поляризации металлов. Окислители значительно увеличивают на поверхности стали эффект от катодного процесса, но они обычно негативно влияют на окружающую среду, выбрасывая в нее агрессивные элементы.
Анодная защита используется реже, чем катодная, так как к предохраняемому объекту выдвигается множество специфических требований (например, безупречное качество сварных швов трубопроводов или кузова автомобиля, постоянное нахождение электродов в растворе и пр.). Катоды при анодной технологии располагают по строго определенной схеме, которая принимает во внимание все особенности металлоконструкции.

Для анодной методики используются малорастворимые элементы (из них делают катоды) – платину, никель, нержавеющие высоколегированные сплавы, свинец, тантал. Сама же установка для такой защиты от коррозии состоит из следующих компонентов:
- защищаемая конструкция;
- источник тока;
- катод;
- специальный электрод сравнения.
Допускается применять анодную защиту для емкостей, где хранятся минеральные удобрения, аммиачные составы, серная кислота, для цилиндрических установок и теплообменников, эксплуатируемых на химических предприятиях, для резервуаров, в которых выполняют химическое никелирование.
4 Особенности протекторной защиты стали и металла
Достаточно часто применяемым вариантом катодной защиты является технология использования специальных материалов-протекторов. При подобной методике электроотрицательный металл подсоединяется к конструкции. На протяжении заданного временного промежутка коррозия воздействует именно на протектор, а не на предохраняемый объект. После того, как протектор разрушается до определенного уровня, вместо него ставят нового "защитника".
Протекторная электрохимическая защита рекомендована для обработки объектов, находящихся в грунте, воздухе, воде (то есть в нейтральных с точки зрения химии средах). При этом эффективной она будет лишь тогда, когда между средой и материалом-протектором имеется некоторое переходное сопротивление (его величина варьируется, но в любом случае является небольшой).

На практике протекторы используют при экономической нецелесообразности либо физической невозможности подвести требуемый заряд электрического тока к объекту из стали или металла. Стоит отдельно отметить тот факт, что защитные материалы характеризуются определенным радиусом, на который распространяется их положительное действие. По этой причине следует правильно высчитывать дистанцию для удаления их от металлоконструкции.
Популярные протекторы:
- Магниевые. Применяются в средах с рН 9,5–10,5 единиц (земля, пресная и малосоленая вода). Производятся из сплавов на основе магния с дополнительным легированием алюминием (не более 6–7 %) и цинком (до 5 %). Для экологии такие протекторы, защищающие объекты от коррозии, потенциально небезопасны из-за того, что они могут стать причиной растрескивания и водородного охрупчивания металлических изделий.
- Цинковые. Данные "защитники" незаменимы для конструкций, функционирующих в воде с большим содержанием соли. В других средах применять их нет смысла, так как на их поверхности появляются гидроксиды и оксиды в виде толстой пленки. В составе протекторов на базе цинка имеются незначительные (до 0,5 %) добавки железа, свинца, кадмия, алюминия и некоторых других химических элементов.
- Алюминиевые. Их используют в морской проточной воде и на объектах, находящихся на прибрежном шельфе. В алюминиевых протекторах имеется магний (около 5 %) и цинк (около 8%), а также в очень малых количествах таллий, кадмий, кремний, индий.

Кроме того, иногда применяются железные протекторы, которые производят из железа без каких-либо добавок либо из обычных углеродистых сталей.
5 Как выполняется катодная схема?
Температурные перепады и ультрафиолетовые лучи наносят серьезный вред всем внешним узлам и составным частям транспортных средств. Защита кузова автомобиля и некоторых других его элементов от коррозии электрохимическими методами признается весьма эффективным способом продления идеального внешнего вида машины.
Принцип действия такой защиты ничем не отличается от схемы, описанной выше. При предохранении от ржавления кузова автомобиля функцию анода может выполнить почти любая поверхность, которая способна качественно проводить электроток (влажное покрытие автодороги, металлические пластины, сооружения из стали). Катодом при этом является непосредственно корпус транспортного средства.

Элементарные способы электрохимической защиты кузова автомобиля:
- Подключаем через монтажный провод и дополнительный резистор к плюсу АКБ корпус гаража, в котором стоит машина. Данная защита от коррозии кузова автомобиля особенно продуктивна в летний период, когда в автогараже присутствует парниковый эффект. Этот эффект как раз и предохраняет наружные части авто от окисления.
- Монтируем специальный заземляющий металлизированный "хвост" из резины в задней части транспортного средства так, чтобы на него во время движения в дождливую погоду попадали капли влаги. При высокой влажности между автотрассой и кузовом автомобиля образуется разность потенциалов, которая и предохраняет наружные части ТС от окисления.
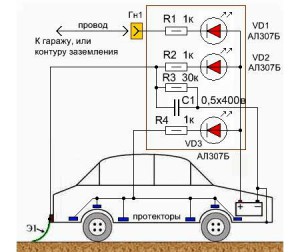
Также защита кузова автомобиля осуществляется при помощи протекторов. Их крепят на порогах машины, на днище, под крыльями. Протекторами в данном случае являются небольшие пластинки из платины, магнетита, карбоксила, графита (неразрушающиеся с течением времени аноды), а также из алюминия и "нержавейки" (их следует менять каждый несколько лет).
6 Нюансы антикоррозионной защиты трубопроводов
Системы труб в настоящее время защищаются посредством дренажной и катодной электрохимической методики. При предохранении трубопроводов от коррозии по катодной схеме используются:
- Внешние источники тока. Их плюс подключат к анодному заземлению, а минус – к самой трубе.
- Аноды-защитники, использующие ток от гальванических пар.

Катодная методика предполагает поляризацию предохраняемой стальной поверхности. При этом осуществляется подключение подземных трубопроводов к "минусу" комплекса катодной защиты (по сути, он представляет собой источник тока). "Плюс" подключают к добавочному внешнему электроду при помощи специального кабеля, который изготавливается из проводящей резины или графита. Данная схема позволяет получать электроцепь замкнутого типа, включающую в себя следующие компоненты:
- электрод (наружный);
- электролит, находящийся в почве, где выполнена прокладка трубопроводов;
- непосредственно трубы;
- кабель (катодный);
- источник тока;
- кабель (анодный).
Для протекторной защиты трубопроводов применяют материалы на основе алюминий, магния и цинка, коэффициент полезного действия которых равняется 90 % при использовании протекторов на базе алюминия и цинка и 50 % для протекторов из магниевых сплавов и чистого магния.

Для дренажной защиты систем труб применяется технология отвода в грунт блуждающих токов. Существует четыре варианта дренажной трубопроводов – поляризованный, земляной, усиленный и прямой. При прямом и поляризованном дренаже между "минусом" блуждающих токов и трубой ставят перемычки. Для земляной защитной схемы необходимо произвести посредством добавочных электродов заземление. А при усиленном дренаже трубных систем в цепь добавляют преобразователь, который необходим для повышения величины дренажного тока.
Существует две основные группы методик предотвращения разрушения (или снижения его интенсивности) металлов под воздействием внешних факторов (в первую очередь, влаги) – активная и пассивная. К первой относится защита электрохимическая. С одним из таких способов борьбы с коррозией – протекторным (гальваническим) – читатель сможет ознакомиться в данной статье.
Принцип функционирования
Цель протекторной защиты – максимальное снижение потенциала основного материала, чем и обеспечивается предохранение его от разрушения корозией. Это осуществляется присоединением к нему специального электрода, который нередко именуется «жертвенным анодом». Он подбирается из металла более активного по отношению к базовому. Таким образом, коррозии в первую очередь подвергается протектор, следовательно, повышается долговечность того или иного конструкционного элемента, с которым он соединяется ().
Эффективность протекторной защиты
Считается очень высокой. При том, что эн/затраты на реализацию протекторной защиты от коррозии сравнительно небольшие. Если использование магниевого анода с соответствующими параметрами предохраняет разрушение металла трубопровода на протяжении, к примеру, порядка 7,5 км, то без него – всего лишь на 25 – 30 м.
Когда следует использовать протекторную защиту
Способов борьбы с коррозией достаточно, и выбор всегда есть. Применение «жертвенного анода» целесообразно:
- если у предприятия нет необходимых мощностей для реализации иных, более эн/затратных методик;
- при необходимости защиты малогабаритных конструкций;
- для предохранения от коррозии металлоизделий (объектов) с поверхностным покрытием (изоляцией). Те же трубопроводные магистрали.
Максимальная эффективность протекторной защиты достигается, если она используется в средах, называемых электролитическими. Например, морская вода.
Какие металлы используются в качестве протекторов
Как правило, в основном подразумевается протекторная защита изделий из железа и его сплавов (стали). По сравнению с ними более активными являются такие металлы, как цинк, хром, алюминий, кадмий, магний. Хотя это и не единственно возможные варианты.
Особенность изготовления «жертвенных анодов» в том, что для их производства указанные материалы в чистом виде не берутся. В качестве сырья используются различные сплавы на их основе. При этом учитывается специфика применения протекторов. В первую очередь, в какой среде планируется обеспечивать защиту от коррозии.
Например, если цинковый электрод поместить в сухой грунт, то эффективность его действия будет практически нулевой. Поэтому выбор того или иного протектора определяется местными условиями.
Различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия . Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора , либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией . Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ - ингибиторов . Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
А (-)Cr | H 2 O, O 2 | Fe (+) К
на аноде:Cr - 2e → Cr 2+
на катоде:2 H 2 O + O 2 + 4e → 4 OH -
Cr 2+ + 2 OH - → Cr (OH) 2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr (OH) 3:
4 Cr(OH) 2 + 2H 2 O + O 2 → 4 Cr(OH) 3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия . У катодного покрытия стандартный электродный потенциал более положителен , чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента , возникающего в этом случае.
А (-)Fe | H 2 O, O 2 | Sn (+) К
на аноде: Fe - 2e → Fe 2+
на катоде:2 H 2 O + O 2 + 4e → 4 OH -
Fe 2+ + 2 OH - → Fe (OH) 2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
3) Электрохимическая защита . Различают два вида электрохимической защиты: катодная и протекторная . В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Протекторная защита . Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента , в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 8.3).




