Чему равна электродвижущая сила гальванического элемента. Большая энциклопедия нефти и газа. Определение величины стандартного электродного потенциала меди
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом . Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов. Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление. Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Определение величины стандартного электродного потенциала меди
Гальваническая ячейка - это простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию. Гальванические ячейки состоят из двух отдельных отсеков, называемых полуэлементами, содержащими растворы электролита и электроды, которые могут быть соединены в цепи. Два разнородных металла погружены в электролит. Если металлы соединены внешним контуром, один металл уменьшается, а другой металл окисляется.
В приведенном выше примере медь восстанавливается и окисляется цинк. Разница в потенциалах окисления двух металлов обеспечивает электрическую мощность ячейки. Вольтовая ячейка может быть построена с использованием простых символов. На диаграмме электроды находятся на внешней стороне диаграммы, а вертикальная линия используется для отделения электрода от раствора электролита, находящегося в отсеке. Обычно на диаграмме виды, окисленные, записываются слева от двойной косой черты. Вот пример ячейки Даниэля.
Цинковая пластинка опущена в раствор сульфата цинка, медная - в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO 4 2- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
Вопросы и упражнения
Имена относятся к итальянским ученым 18-го века Алессандро Вольте и Луиджи Гальвани. Ячейка Даниэлла состояла из стеклянной банки, содержащей медные и цинковые электроды, каждая из которых погружалась в их соответствующие кислые сульфатные растворы. Два раствора разделяли сепаратором пористого глинистого цилиндра. Это была гальваническая ячейка, в которой спонтанное электроразведка цинка и гальванопокрытие меди обеспечивали электрический ток.
Электрохимическая ячейка - это устройство, которое преобразует химическую энергию в электрическую или наоборот, когда происходит химическая реакция в клетке. Он состоит из двух электропроводящих фаз, связанных ионически проводящей фазой. По мере прохождения электрического тока он должен перейти от электронного тока к ионному току и обратно к электронному току.
Гальванический элемент записывается в виде электрохимической схемы:
A(-) Zn | ZnSO 4 || CuSO 4 | Cu (+)K
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:
Существенной особенностью электрохимической ячейки является то, что одновременно происходящие реакции окисления-восстановления пространственно разделены. Например, при спонтанной химической реакции при окислении водорода кислородом в воду электроны пропускаются непосредственно из водорода в кислород.
Напротив, при спонтанной электрохимической реакции в гальванической ячейке водород окисляется на аноде, перенося электроны на анод, а кислород восстанавливается на катоде, принимая электроны от катода. Ионы, полученные в электродных реакциях, в этом случае положительные ионы водорода и отрицательные гидроксильные ионы будут рекомбинировать в растворе с образованием конечного продукта реакции: вода. Во время этого процесса электроны проводят от анода к катоду через внешнюю электрическую цепь, где электрический ток может приводить в движение двигатель, зажигать лампочку и т.д. реакцию можно также изменить: вода может быть разложена на водород и кислород посредством применение электрической мощности в электролитической ячейке.
A Zn – 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
ЭДС= е K - е A
Для медно-цинкового гальванического элемента в стандартных условиях:
Топливный элемент - это устройство, которое преобразует химическую энергию в электрическую. Он отличается от батареи тем, что преобразование энергии продолжается до тех пор, пока топливо и окислитель подаются в топливный элемент; то есть в принципе на неопределенный срок. Это гальваническая ячейка, где на электродах возникают спонтанные химические реакции. Топливо окисляется на аноде, а окислитель уменьшается на катоде. В настоящее время наиболее часто используемым топливом является водород. Более традиционные виды топлива должны быть преобразованы в водород до их использования в топливном элементе.
ЭДС = 0,34-(-0,76)=1,1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным . Например, никелевый концентрационный гальванический элемент.
(-)Ni | NiSO 4 || NiSO 4 | Ni (+)
0,01моль 0,1моль
Реакции, электроны передаются от одного вида к другому. Если реакция спонтанная, энергия высвобождается, которая затем может быть использована для полезной работы. Чтобы использовать эту энергию, реакцию необходимо разделить на две отдельные половины реакции: реакции окисления и восстановления. Реакции помещаются в два разных контейнера, и провод используется для управления электронами с одной стороны на другую.
Примеры решения задач
Когда происходит окислительно-восстановительная реакция, электроны переносятся от одного вида к другому. Если реакция спонтанная, энергия выделяется, что может быть использовано для работы. В этой реакции медный электрод помещают в раствор, содержащий ионы серебра.
Запишем работу такого концентрационного гальванического элемента.
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -2) = -0.25 + (0,058/2)(-2) = -0.308 В
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -1) = -0.25 + (0,058/2)(-1) = -0.28 В
ЭДС = -0,28 – (-0,308) = 0,028 В
Процессы на электродах:
А: Ni 0 - 2е - = Ni 2+
К: Ni 2+ + 2е - = Ni 0
КОНТРОЛЬНЫЕ ЗАДАНИЯ
48. Вычислить ЭДС кадмиево – серебряного гальванического элемента, если концентрация ионов серебра в растворе равна 0,1 моль/л, а ионов кадмия 0,001 моль/л. Напишите уравнения реакций протекающих на электродах.
Эта реакция высвобождает энергию. Однако, когда твердый медный электрод помещается непосредственно в раствор нитрата серебра, энергия теряется как тепло и не может использоваться для работы. Чтобы использовать эту энергию и использовать ее полезную работу, мы должны разделить реакцию на две отдельные половины реакций; Реакции окисления и восстановления. Провод соединяет две реакции и позволяет электронам течь от одной стороны к другой.
Вольтовая ячейка представляет собой электрохимическую ячейку, которая использует спонтанные окислительно-восстановительные реакции для выработки электроэнергии. Он состоит из двух отдельных полуэлементов. Две половинные ячейки соединены друг с другом проволокой, идущей от одного электрода к другому. Солевой мост также соединяется с половинчатыми ячейками.
49. Составьте схемы двух гальванических элементов в одном из которых никель – катод, а в другом анод. Напишите уравнения реакций протекающих при работе этих элементов.
50. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1М растворы их солей. Напишите уравнения реакций.
Функции этих частей обсуждаются ниже. Электрод представляет собой полосу металла, на которой происходит реакция. В вольтовой ячейке окисление и восстановление металлов происходит на электродах. В вольтовой ячейке есть два электрода, по одному в каждой полуэлементе. Катод - это то, где происходит редукция, и окисление происходит на аноде.
Благодаря электрохимии эти реакции взаимодействуют с металлическими поверхностями или электродами. Установлено равновесие восстановления окислов между металлом и веществами в растворе. Когда электроды погружены в раствор, содержащий ионы того же металла, его называют полуэлементом. Электролиты представляют собой ионы в растворе, обычно жидкости, который проводит электричество через ионную проводимость. Между атомами металла на электроде и ионными растворами могут возникать два возможных взаимодействия.
51. Рассчитайте ЭДС концентрационного никелевого гальванического элемента. Концентрация ионов металла в растворах равна 1 моль/л и 0,0001 моль/л. Написать процессы, протекающие на аноде и катоде.
52. Какие процессы происходят у электродов медного коцентрированного гальванического элемента, еслиу одного из электродов концентрация ионов металла равна 1 моль/л, а у другого 0,001 моль/л. в каком направлении движутся электроны во внешней цепи. Чему равна ЭДС?
Процессы на аноде
Это означает, что ионы уменьшаются. . Когда электрод окисляется в растворе, он называется анодом и когда электрод уменьшается в растворе. он называется катодом.
- Анод: Анод - это место реакции окисления.
- Другими словами, здесь металл теряет электроны.
- Именно здесь металлический электрод получает электроны.
Когда дело доходит до окислительно-восстановительных реакций, важно понять, что означает, что металл «окисляется» или «восстанавливается». Солевой мост является жизненно важным компонентом любой вольтовой ячейки. Цель солевого моста состоит в том, чтобы сохранить решения электрически нейтральными и обеспечить свободный поток ионов из одной ячейки в другую. Без солевого моста положительные и отрицательные заряды будут накапливаться вокруг электродов, что приведет к остановке реакции.
53. Составьте схему гальванического элемента, состоящего из пластин Zn и Fe погруженных в растворы их солей. Напишите уравнения процессов, протекающих на ионы железа, чтобы ЭДС элемента стала равной нулю при концентрации ионов цинка 0,0001 моль/л.
54. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите уравнения реакций, протекающих на пластинах.
Электроны всегда текут от анода к катоду или от половины ячейки окисления до получастицы восстановления. Диаграмма клеток представляет собой представление электрохимической ячейки. На рисунке ниже показана диаграмма ячеек для вольтайза, показанная на рисунке 1 выше.
На рисунке ниже показана схема ячейки для вольтайза, показанная на рисунке 1. При построении диаграммы ячеек мы выполняем следующие соглашения. Анод всегда располагается слева, а катод - с правой стороны. Различие в фазе элемента представлено одной вертикальной линией, а изменения состояний окисления представлены запятыми.
55. Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 1М раствор нитрата серебра и стандартного водородного электрода. Напишите урaвнения электродных процессов. Чему равна ЭДС элемента?
56. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов
Процессы на катоде
Когда просят построить диаграмму ячейки, следуйте этим простым инструкциям. Рассмотрим следующую реакцию. Шаг 1: Напишите две полуреакции. Шаг 2: Определите катод и анод. \\ набирает электроны, поэтому уменьшается; редукция происходит на катоде. Шаг 3: постройте диаграмму ячейки.
Анод всегда идет слева и катод справа. Отсутствие концентраций указывает, что растворы находятся в стандартных условиях. Показания вольтметра дают напряжение реакции на ячейку или разность потенциалов между двумя двумя полуэлементами. Напряжение ячейки также известно как или электродвижущая сила, и оно отображается как символ \\.
а) Mg | Mg 2+ | | Pb 2+ | Pb
б) Pb | Pb 2+ | |Cu 2+ | Cu
в) Cu | Cu 2+ | | Ag 2+ | Ag
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев.
57. Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO 3) 2 = Ni(NO 3) 2 + Pb .
Напишите электронные уравнения анодного и катодного процессов, вычислите ЭДС этого элемента при стандартных условиях.
Эти значения называются стандартными редукционными потенциалами. Каждая полуреакция имеет другой потенциал восстановления, разница двух восстановительных потенциалов дает напряжение электрохимической ячейки. Рассмотрим следующие две реакции. Разделите реакцию на половинные реакции и определите их стандартные восстановительные потенциалы.
- Укажите, какой будет анод и катод.
- Постройте диаграмму ячейки для следующих реакций.
- Определите \\ для вольтовой ячейки, образованной каждой реакцией.
- Генриальная химия: принципы и современность Приложения 9-й ред.
58. ЭДС гальванического элемента, образованного медной пластинкой, погруженной в раствор ее соли с концентрацией ионов меди, равной 0,001 моль/л и хромом, погруженным в раствор его соли равна 1,05 В. определите концентрацию ионов хрома в растворе его соли. Составьте схему гальванического элемента и напишите электронные уравнения электродных процессов.
Следовательно, электроны спонтанно протекают от ионов цинка к меди, образуя ионы цинка и металлическую меди. Подобно тому, как вода протекает спонтанно под гору, которую можно заставить работать, заставляя водяное колесо, поток электронов от более высокой потенциальной энергии к нижней может быть также использован для выполнения работы.
Поскольку потенциальная энергия валентных электронов сильно отличается от одного вещества к другому, напряжение гальванической ячейки частично зависит от идентичности реагирующих веществ. Измеренный потенциал клетки также сильно зависит от концентраций реагирующих веществ и температуры системы. Чтобы разработать шкалу относительных потенциалов, которая позволит нам предсказать направление электрохимической реакции и величину движущей силы реакции, потенциалы для окисления и сокращения различных веществ должны измеряться в сопоставимых условиях.
59. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенные в растворы своих солей с концентрацие ионов металлов, равной 1 моль/л. изменится ли ЭДС этого гальванического элемента, если концентрацию каждого из ионов уменьшить до 0,01 моль / л.
Измерение стандартных электродных потенциалов
Измеренные окислительно-восстановительные потенциалы зависят от потенциальной энергии валентных электронов, концентраций видов в реакции и температуры системы. Физически невозможно измерить потенциал одного электрода: можно измерить только разницу потенциалов двух электродов. Это позволяет измерить разность потенциалов между двумя разнородными электродами. Фактически, это точно потенциал, измеренный в стандартных условиях, если ячейка сконструирована со следующей схемой ячейки. Следовательно, стандартный потенциал ячейки является разницей между табличными потенциалами восстановления двух полуреакций, а не их суммой.
60. ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1М раствор соли свинца равна 126мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода. Составьте схему гальванического элемента и напишите процессы, протекающие на электродах.
61. Какие процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
62. Какие процессы протекают на электродах при зарядке и разрядке кадмиево-никелевого аккумулятора.
63. Какие процессы протекают на электродах при зарядке и разрядке железно-никелевого аккумулятора.
64. Составьте схемы двух гальванических элементов в одном из которых хром был бы анодом, а в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
65. Составьте схему гальванического элемента, состоящего из алюминиевого электрода, погруженного в 1М раствор нитрата алюминия и стандартного водородного электрода. Напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента.
66. В каком направлении будут перемещаться электроны во внешней цепи алюминий – цинкового гальванического элемента. Концентрации ионов в растворах равны 0,1 моль/л. Составьте схему гальванического элемента, напишите уравнения процессов, протекающих на электродах, вычислите ЭДС.
67. В серебряно-цинковом элементе, применяемом для питания различной аппаратуры, протекает реакция
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисление.
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na + и Cl - , двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия:
NaCl = Na + + Cl -
Катод (-) (+) анод
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
Суммарное уравнение реакции:
2Na + + 2Cl - электролиз 2 Na + Cl 2
2NaCl электролиз 2Na + Cl 2
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Первыми на катоде восстанавливаются ионы тех металлов, потенциал которых самый положительный. Например, раствор с ионами Ag + и H + . Первым восстанавливается Ag:
Ag + + e - = Ag 0 e 0 = +0,8 B
Водород не восстанавливается, так как его потенциал меньше.
Потенциалы металлов и водорода зависят от их концентрации в электролите. Поэтому по значениям стандартного потенциала судить о восстановлении ионов Н + не всегда можно. В нейтральном расторе концентрация ионов водорода равна10 -7 моль/л. и по формуле Нернста:
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0,41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0,41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0,41В.
Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – зто разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
Пример .
Потенциал выделения цинка в нейтральном электролите –0.76В, водорода –0.41В. перенапряжение водорода на цинке около –0.72В. Таким образом, водород на цинке будет выделяться лишь при потенциале –0.41+(-0.72)=-1.13В. Если сравнить потенциал разряда цинка (-0.76 В) с потенциалом разряда водорода на цинке (-1.13В), ясно, что будет выделяться цинк. На деле так и есть, при электролизе нейтрального раствора соли цинка выделяется цинк и малое количество водорода.
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18В (от Li до Mn). Восстанавливаются ионы водорода:
2 Н + + 2е - = Н 2 РН < 7
2 Н 2 О + 2е - = Н 2 + 2ОН - РН >= 7
2) ионы металлов, электродный потенциал которых от –1.18В до 0.00В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Me n+ + ne - = Me 0
2H + + 2e - = H 2 PH<7
2H 2 O + 2e - = H 2 + 2OH - PH>=7
3) ионы металлов, электродный потенциал которых больше 0.0В (от H до Au). В этом случае восстанавливаются только ионы металлов
Ме n+ + ne - = Me 0
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. На их поверхности окисляются анионы с более отрицательными потенциалами. Это ионы не содержащие кислорода, такие как J - , Br - , Cl - , S 2- и др. (исключение F -)
Если в растворе имеются ионы Cl - , Br - , то окисляться на инертном аноде будут ионы Br - .
2Br - - 2e - = Br 2
2H 2 0 - 4e - = O 2 +4H + (PH<=7)
4OH - 4e - = 2H 2 O + O 2 (PH>7)
Рассмотрим несколько случаев электролиза водных растворов.
Пример.
Схема электролиза водного раствора хлорида меди с инертным анодом CuCl 2 = Cu 2+ +2Cl -
H 2 O = H + = OH -
Катод(-) Cu 2+ H + (H 2 O) Cl - , OH - (H 2 O) (+)анод
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
У меди потенциал больше 0, поэтому на катоде восстанавливается металл, на аноде окисляется бескислородный кислотный остаток.
Пример.
Схема электролиза раствора сульфата калия с инертным анодом. K 2 SO 4 = 2K + + SO 4 2
H 2 O = H + + OH -
Катод(-) 2K + ,H + (H 2 O) SО 4 2- , OH(H 2 O) (+)анод
2H 2 O + 2e - = H 2 + 2OH - 2H 2 O – 4e - = O 2 + 4H +
K + + OH - = KOH 2H + + SO 4 2- = H 2 SO 4
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода и накопление ионов ОН -
У анода будет идти окисление молекул воды и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример .
Электролиз водного раствора сульфата никеля с активным анодом. Ni SO 4 = Ni 2+ = SO 4 2-
H 2 O H + + OH -
Катод(-) Ni 2+ , H + (H 2 O) SO 4 2- , OH - (H 2 O) (+)анод
Ni 2+ +2e - = Ni 0 Ni – 2e - = Ni 2+
e 0 Ni = -0.25B больше потенциала восстановления ионов водорода из воды(-0,41В), поэтому восстанавливается металл, а на аноде происходит окисление анода-металла, так как потенциал никеля намного меньше потенциала окисления воды (+1,23В).
Законы электролиза
Масса электролита, подверженная химическому превращению, а также массы веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
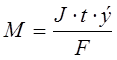 , где
, где
m -масса электролита, подвергшаяся электролизу или масса веществ, выделившаяся на электродах, г;
J -сила тока, А;
э-молярная масса эквивалентов вещества, г/моль;
F-число Фарадея – 96500 Кл;
t-время электролиза, с;
КОНТРОЛЬНЫЕ ЗАДАНИЯ
68. Составьте уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl 2 с инертными электродами.
69. Составьте схемы электролиза водных растворов серной кислоты, хлорида меди, нитрата свинца с платиновыми электродами.
70. Напишите уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и хлорида железа (II) с угольными электродами.
71. Составьте схемы электролиза водного раствора хлорида цинка, если а) анод цинковый; б) анод угольный.
72. Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
73. При электролизе водного раствора SnCl 2 на аноде выделилось 4,48 л. хлора (условия нормальные). Какое вещество и в каком количестве выделилось на катоде.
74. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди. Напишите уравнения процессов на электродах.
75. Составьте схему процессов, происходящих на медных электродах при электролизе водного раствора нитрата калия.
76. Неочищенная медь содержит примеси серебра и цинка. Что происходит с этими примесями при электролитическом рафинировании меди. Напишите уравнения процессов на электродах.
77. Сколько времени потребуется для полного разложения 2 молей воды током силой 2А.
78. Через растворы поваренной соли и фосфата натрия пропустили в течение некоторого времени постоянный ток. Изменится ли от этого количество соли в том и в другом случае. Ответ мотивируйте, составив электронные уравнения процессов идущих на катоде и аноде.
79. При электролизе раствора сульфата меди (II) на аноде выделилось 0,168 л газа (нормальные условия) составьте электронные уравнения процессов и вычислите, какая масса меди выделится на катоде.
80. Составьте электронные уравнения процессов происходящих при электролизе раствора и расплава КОН.
81. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течении 2,5 часов если сила тока равна 6 А.
82. Сколько граммов серной кислоты образуется возле анода при электролизе раствора сульфата натрия, если на аноде выделится 1,12л кислорода (н.у.) вычислить массу вещества, выделившегося на катоде.
83. При электролизе раствора нитрата серебра на аноде выделилось 0,28 л кислорода. Сколько граммов серебра выделилось на катоде.
84. В воде растворены соли алюминия, цинка и меди с концентрацией катионов 1 моль/л. составьте электронные уравнения процессов на электродах и укажите последовательность реакций на катоде.
85. Какие продукты могут быть получены при электролизе раствора NaNO 3 , если анодное и катодное пространства:
а) разделены пористой перегородкой;
б) не разделены и раствор перемешивается.
86. Какие продукты будут выделяться на катоде и аноде в первую очередь при электролизе водных растворов с графитовыми электродами, если в электролите находится смесь сульфата меди (II) и хлорида калия.
87. В водный раствор нитрата серебра опущены медная и серебряная пластинки. К какому полюсу источника тока должна быть присоединена медная пластинка для покрытия ее серебром. Напишите схему процесса электролиза.
КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется самопроизвольное разрушение металла под действием окружающей среды. Коррозия представляет собой окислительно-восстановительный гетерогенный процесс, происходящий на поверхности раздела фаз. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химической коррозией называется окисление металла, не сопровождающееся возникновением электрического тока в системе. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими жидкостями – неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности получается большое количество непрерывно действующих микрогальванических элементов. Более активный металл – анод окисляется с образованием катионов металла или нерастворимых продуктов, например, ржавчины. Освобождающиеся электроны перемещаются к катоду, на котором происходит восстановление окислителя. Растворенный кислород и ионы водорода – важнейшие окислители вызывающие коррозию, называют катодными деполяризаторами. Какой именно процесс восстановления будет протекать на катоде зависит от состава электролита.
Пример .
При контакте железа и меди находящихся в растворе хлороводородной кислоты образуется микрогальванический элемент:
A Fe| HCl | Cu K
e 0 Fe/Fe2+ = -0,44B
e 0 Cu/Cu2+ = +0,34B
Железо - более активный металл будет анодом, а медь – катодом. Реакции, протекающие на аноде и катоде, могут быть выражены:
1 A: Fe -2e = Fe 2+
1 K: 2H + + 2e = H 2
Суммирую анодные и катодные процессы, получим окислительно-восстановительную реакцию, самопроизвольное протекание которой обуславливает коррозию металла:
Fe + 2H + = Fe 2+ + H 2
Fe + 2HCl = FeCl 2 + H 2
Пример.
При коррозии в нейтральной среде, в отсутствие растворенного в воде кислорода происходит так же водородная деполяризация катода, как и в предыдущем примере.
Запишем схему гальванического элемента и уравнения реакций, протекающих в этом гальваническом элементе:
A Fe|H 2 O| Cu K
1 A: Fe – 2e = Fe 2+
1 K: 2H 2 O + 2e = H 2 + 2OH -
Fe + 2H 2 0 = Fe 2+ + H 2 + 2OH -
Или в молекулярном виде: Fe + 2H 2 O = Fe(OH) 2 + H 2
Пример .
При контакте железа с медью во влажном воздухе процессы образуется гальванический элемент
A Fe| H 2 O + O 2 | Cu K
И процесс коррозии выражается следующими уравнениями:
A: Fe – 2e = Fe 2+
K: O 2 + 2H 2 O + 4e = 4OH -
2Fe + O 2 + 2H 2 O = 2Fe(OH) 2
Под влиянием кислорода воздуха, гидроксид железа(2) окисляется дальше по уравнению
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
Как видно из примера, в этом случае происходит кислородная деполяризация катода.
Возможность протекания самопроизвольного окислительно-восстановительного процесса рассчитывается по ЭДС
ЭДС= е восстановителя – е окислителя
Если ЭДС процесса больше нуля, то процесс возможен.
ЛАБОРАТОРНАЯ РАБОТА № 9
Определение электродных потенциалов металлов и ЭДС гальванических элементов.
I. Разделы теоретического курса для повторения.
Возникновение скачка потенциала на границах раздела металл - вода, металл - раствор соли металла. Стандартный водородный электрод. Понятие о гальванических элементах и процессах, протекающих на электродах. Стандартные электродные потенциалы металлов. Ряд стандартных электродных потенциалов. Выводы из положения металла в ряду. Уравнение Нернста. Обратимые и необратимые электроды. Металлические электроды I и II рода, окислительно-восстановительные электроды, газовые электроды. Электроды сравнения. Химические и концентрационные гальванические элементы. Электродвижущая сила (ЭДС) гальванических элементов. Процессы, протекающие на электродах при работе гальванического элемента.
3. Вопросы и упражнения.
1. Чему равен потенциал серебряного электрода, погруженного в раствор соли серебра с концентрацией
См = 10-2 моль/л?
2. Как зависит величина потенциала водородного электрода от рН среды? Чему равен потенциал водородного электрода при рН = I; рН = 7, рН = 10?
3. Рассчитайте потенциал стандартного серебряного электрода по отношению к:
а) насыщенному каломельному электроду,
б) насыщенному медно - сульфатному электроду,
в) насыщенному хлорсеребряному электроду?
4. Составьте схемы гальванических элементов, в которых протекают реакции:
а) 2 Ag + + Cu 0 → Ag 0 + Cu +2
б) Cd 0 + CuSO 4 → CdSO 4 + Cu
5. Определите величину ЭДС и укажите процессы, протекающие на электродах в следующих гальванических элементах:
а) Zn / ZnS О4 // CdS О4 / С d
б) Р b / Р b (NO з)2) // AgN О3/ Ag
6. Рассчитайте ЭДС следующего концентрационного гальванического элемента:
а) Zn / ZnCI 2 // ZnCI 2 / Zn
0,01 моль/л 1,0 моль/л
Какой из электродов является анодом , а какой - катодом?
3. Экспериментальная часть
1. Определение величины стандартного электродного потенциала цинка.
Соберите цинковый электрод (Zn / ZnSO 4 ) , погрузив хорошо зачищенный наждачной бумагой цинковый стержень в раствор соли с концентрацией ионов цинка I моль/л.
Рис. I . Схема установки для определения величины электродного потенциала металла.
1 - исследуемый электрод (цинковый, медный и др.)
2 - хлорсеребряный электрод сравнения
3 - потенциометр.
4 - стаканчик насыщенным раствором хлорида калия
В соответствии с рис.1, соберите гальванический элемент из исследуемого цинкового электрода (Zn / ZnSO 4 ) и насыщенного хлорсеребряного электрода сравнения (KCl / AgCl / Ag ) :
Условная запись этого гальванического элемента:
(-) Zn/ZnSO4//KCl/AgCl/Ag (+)
Для этого носики электродов погружают в стаканчик с раствором хлорида калия, а сами электроды с помощью соединительных проводов подключают к соответствующим клеммам потенциометра.
Потенциал насыщенного хлорсеребряного электрода сравнения по отношению к стандартному водородному электроду равен +0,201В.
Ехл. сер. нас. = +0,201В или 201мВ.
В соответствии с инструкцией о порядке измерений при использовании соответствующего потенциометра определите ЭДС составленного гальванического элемента и потенциал цинкового электрода по насыщенному хлорсеребряному электроду.
Зная величину потенциала электрода сравнения, рассчитайте величину потенциала цинкового электрода по отношению к стандартному водородному электроду. Сравните полученное значение с табличным значением:
E 0 = - 0,76 B .
Запишите найденные значения:
Измеренное значение Э. Д.С. гальванического элемента, составленного из стандартного цинкового электрода и насыщенного хлорсеребряного электрода сравнения:
Э. Д.С. (Zn / ZnSO 4 // KCl / AgCl / Ag ) =
Экспериментальное значение потенциала стандартного цинкового электрода по отношению к насыщенному хлорсеребряному электроду сравнения:
E () по хлор - серебряному насыщ.. =
Экспериментальное значение потенциала стандартного цинкового электрода по отношению к стандартному водородному электроду сравнения:
E () по стандартному водородному. =
Внимание! Учитывая высокую токсичность солей тяжелых металлов, все отработанные растворы не сливаются в раковину, а сдаются лаборанту для последующей утилизации.
2. Определение величины стандартного электродного потенциала меди.
Аналогично п. I, соберите медный электрод, погрузив зачищенный медный стержень в I M раствор сульфата меди.
Составьте гальванический элемент из исследуемого медного электрода и насыщенного хлорсеребяного электрода сравнения.
Определите ЭДС гальванического элемента. Приведите условную запись для данного гальванического элемента.
Чему равен потенциал медного электрода по насыщенному хлорсеребряному электроду?
Рассчитайте потенциал медного электрода по отношению к стандартному водородному электроду и сравните его с табличным значением стандартного электродного потенциала меди:
E 0 = 0,34 B
Запишите найденные значения:
Э. Д.С. (С u / CuSO 4 // KCl / AgCl / Ag ) =
E () по хлор - серебряному насыщ.. =
E () по стандартному водородному электроду =
3. Определение ЭДС химического гальванического элемента. (Медно – цинковый гальванический элемент).
Соберите гальванический элемент, составленный из стандартного цинкового и стандартного медного электродов (рис.2).
Э. Д.С.(С u / CuSO 4 // Zn / ZnSO 4 )эксп. =………..
Сравните полученное в эксперименте значение с расчетным (теоретическим) значением ЭДС для медно - цинкового гальванического элемента:
ЭДС теорет. = E катода –Е анода =
= E0(Cu+2/Cu0) - E0(Zn+2/Zn0) = 0,34 –(- 0,76) = 1,1B.
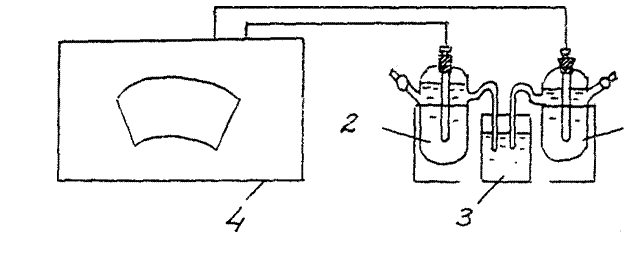 Рис.2 Схема установки для определения ЭДС химического гальванического элемента:
Рис.2 Схема установки для определения ЭДС химического гальванического элемента:
1 – медный электрод, 2 – цинковый электрод
3 - электролитический ключ (стаканчик с раствором хлорида калия),
4 - потенциометр
Напишите уравнения процессов, протекающих на катоде и аноде данного гальванического элемента при его работе.
4. Определение ЭДС концентрационного гальванического элемента.
Соберите гальванический элемент, составленный из стандартного цинкового электрода (цинковый электрод, погружен в раствор соли цинка с концентрацией 1 моль/л) и цинкового электрода, погруженного в раствор соли цинка с концентрацией См = 10-2 моль/л (рис.3).
Zn / ZnSO 4 // Zn / ZnSO 4
См = 10-2 моль/л См = 10-2 моль/л
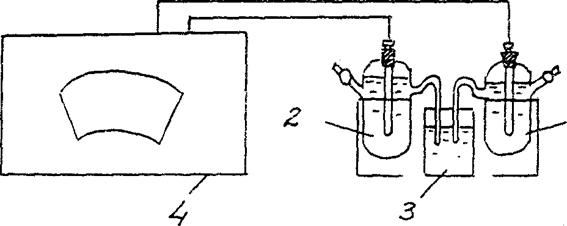
Рис.2 Схема установки для определения ЭДС концентрационного гальванического элемента:
1 – цинковый электрод в растворе соли с См = 10-2 моль/л ,
2 – цинковый электрод в растворе соли с См = 1 моль/л
3 - электролитический ключ (раствор хлорида калия),
4 - потенциометр
В соответствии с инструкцией о порядке измерений с использованием соответствующего потенциометра, определите ЭДС данного гальванического элемента.
Э. Д.С.(С u / CuSO 4 // Zn / ZnSO 4 )эксп. =………..
Сравните полученное в эксперименте значение с расчетным (теоретическим) значением ЭДС для данного концентрационного гальванического элемента.




