Как составить уравнение эдс пример химия. Измерение эдс гальванических элементов
Гальванический элемент – прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов: цинкового и медного, – погруженных в соответствующие сульфатные растворы, между которыми пористая перегородка:
При замыкании внешней цепи электроны переходят от Zn к Cu, происходит диффузия цинка в медь:
Образуем электрохимическую схему:
Анод – отрицательный электрод (слева). Катод – положительный электрод.
Для определения ЭДС этого элемента нужно сравнить стандартные электродные потенциалы обоих электродов. При записи электродных реакций принято, что окисленная форма находится в левой части, а восстановленная – в правой части уравнения.
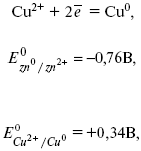
где E 0 – электродвижущая сила (ЭДС) гальванического элемента, когда все реагенты в стандартном состоянии.
ЭДС элемента вычисляется вычитанием из потенциала катода потенциала анода.
ЭДС элемента равна +0,34 – (–0,76) = 1,1 В; чем больше электродные потенциалы отличаются друг от друга, тем больше ЭДС. Если погрузить металл в раствор соли большей концентрации, то потенциал нестандартный. Значит, на величину электродного потенциала влияет концентрация и температура. Такая зависимость выражается уравнением В. Нернста .
где п – число ионов;
R – универсальная газовая постоянная;
Т – температура;
С – концентрация активных ионов в растворе;
F – число Фарадея = 96500 В.
ХИТы – устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую. ХИТы применяются в различных областях техники. В средствах связи: радио, телефон, телеграф; в электроизмерительной аппаратуре; они служат источниками электропитания для автомобилей, самолетов, тракторов; применяются для приведения в действие стартеров и др.
Недостатки ХИТ:
1) стоимость веществ, необходимых для работы: Pb, Cd, – высока;
2) отношение количества энергии, которую может отдать элемент, к его массе, мало.
Преимущества ХИТ:
1) ХИТы делятся на две основные группы: обратимые (аккумуляторы), необратимые (гальванические элементы) . Аккумуляторы можно использовать многократно, так как их работоспособность может быть восстановлена при пропускании тока в обратном направлении от внешнего источника, а в гальванических элементах допускают лишь однократное использование, поскольку один из электродов (Zn в элементе Даниэля – Якоби) необратимо расходуется;
2) применяются электролиты, поглощенные пористыми материалами, они имеют большее внутреннее сопротивление;
3) создание топливных элементов, при работе которых расходовались бы дешевые вещества с малой плотностью (природный газ, водород);
4) удобство в работе, надежность, высокие и стабильные напряжения.
Рассмотрим процесс технологии на основе свинцово-кислотного аккумулятора с намазными электродами.
Общая схема: (–) активное вещество | электролит | активное вещество (+).
Активным веществом отрицательного электрода служит восстановитель , отдающий электроны. При разряде отрицательный электрод является анодом, т. е. электродом, на котором протекают окислительные процессы. Активное вещество положительного электрода – окислитель . Активные вещества – окислитель и восстановитель – участвуют в электрохимической реакции.
Электрохимическая схема свинцово-кислотного аккумулятора
Активными веществами свинцового аккумулятора являются: губчатый свинец и PbO 2 . Создание активных масс в электродах заключается в следующем: на электропроводящий каркас конструкции наносят пасту или смесь оксидов Pb; при последующем формировании пластин оксиды Pb превращаются в активные вещества. Формирование – перевод незаряженной массы в заряженную. Такого рода пластины подразделяются в зависимости от типа каркаса на намазные и решетчатые. Большинство аккумуляторов собирают из намазных пластин. При их изготовлении пасту из оксидов свинца вмазывают в ячейки профилированных решеток толщиной 1 – 7 мм, отлитых из Pb – Sb сплава. После затвердевания паста удерживается на решетке, гарантия такого аккумулятора – 2 – 3 года. При выборе материалов токоотводов положительных электродов аккумуляторов важно обеспечить их практическую пассивность (при сохранении электрической проводимости) в условиях заряда (до весьма высоких потенциалов при анодной поляризации). Для этой цели в растворах H 2 SO 4 применяют Pb или его сплавы. Корпус и крышка ХИТ могут быть изготовлены из стали, либо из различных диэлектриков, но в свинцово-кислотных аккумуляторах корпус выполняют из эбонита, полипропилена, стекла. Электролит в свинцово-кислотном аккумуляторе может участвовать в суммарной токообразующей реакции. Для токоведущих отводов отрицательного электрода применяют Cu, Ti, Al.
3. Регенерация и утилизация ХИТов
Срок службы гальванических элементов кончается (разряд ХИТ) после полного или частичного использования активных материалов, работоспособность которых после разряда может быть восстановлена путем заряда, то есть пропусканием тока в направлении, обратном направлению тока при разряде: такие гальванические элементы называются аккумуляторами . Отрицательный электрод, который при разряде аккумулятора был анодом, при заряде становится катодом. Условиями лучшего использования активных материалов являются низкие плотности тока, высокие температуры до нормы. Обычно причиной нарушения работы ХИТов является пассивация электродов – резкое уменьшение скорости электрохимического процесса при разряде, вызванное изменением состояния поверхности электродов при разряде из-за образования оксидных слоев или солевых пленок. Способ борьбы с пассивацией – уменьшение истинных плотностей тока разряда путем применения электродов с развитыми поверхностями. Производство ХИТ отличается применением разнообразных токсичных веществ (сильных окислителей, соединений Pb, Hg, Zn, Cd, Ni, применяемых в мелкодисперсном состоянии; кислот, щелочей, органических растворителей). Для обеспечения нормальных условий труда предусмотрена автоматизация производственных процессов, рациональные системы вентиляции, включающие применение местных отсосов от аппаратов с токсичными выделениями, герметизация оборудования, замена сухих способов переработки пылящих материалов мокрыми, очистка загрязненного воздуха и газов от аэрозолей, очистка промышленных сточных вод. Массовое использование ХИТ в народном хозяйстве связано с проблемами экологии. Если свинец из аккумуляторов в основном может быть возвращен потребителями на заводы по его переработке, то утилизация небольших бытовых первичных ХИТ экономически нецелесообразна.
Каждая батарея Hg – Zn обеспечивает работу слухового аппарата в течение 5 – 7 дней.
Проводится разработка электромобилей с использованием ХИТ вместо двигателей внутреннего сгорания, которые отравляют атмосферу городов выхлопными газами. По степени отрицательного воздействия на окружающую среду гальваническое производство стоит на первом месте. Причина крайне негативного воздействия гальванического производства заключается в том, что на подавляющем большинстве предприятий в технологических процессах нанесения покрытий полезно расходуется только 10 – 30% солей тяжелых металлов, остальная же часть при неудовлетворительной работе попадает в среду. Выход – максимально сократить потери солей цветных металлов, то есть уменьшить вынос деталями электролитов из гальванических ванн. Это приведет к уменьшению концентраций и объемов сточных вод и создаст тем самым необходимые условия для ведения малоотходной (МОТ) и безотходной (БОТ) технологий нанесения гальванических покрытий. Надо первоначально правильно подобрать электролит. Основополагающий принцип МОТ и БОТ – уменьшать расход химикатов на входе и меньше поставлять ядов на выходе процесса.
Превращение химической энергии в электрическую происходит в электрохимических системах, которые называются гальваническими элементами.
Гальванический элемент представляет собой замкнутую электрохимическую систему, состоящую из двух электродов.
Рассмотрим гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
движение электронов во внешней цепи;
движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток. Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента. Она равна разности электродных потенциалов катода и анода:
В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии:
В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е.
А = nFE0, (7.5)
где n - число электронов, участвующих в реакции;
F- постоянная Фарадея, равная 96500 Кл/моль;
E0 - стандартная ЭДС гальванического элемента (T= 298 К, молярная концентрация электролитов равна 1 моль/дм3). Таким образом, максимальная работа гальванического элемента равна:
А =-DG0= nFE0. (7.6)
Стандартная ЭДС гальванического элемента равна:
Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные.
Химические гальванические элементы - это такие элементы, где электроды и электролиты различны. Примером химического гальванического элемента является элемент Якоби-Даниэля.
Концентрационные гальванические элементы - это такие элементы, которые состоят из одинаковых электродов, но концентрации электролитов различны, например, серебряные электроды, погруженные в растворы нитрата серебра разной концентрации:
Ag | AgNO3 (0,01 моль/дм3) | | AgNO3 (0,1 моль/дм3) | Ag.
Пример 1 . Гальванический элемент состоит из металлического цинка, погруженного в раствор нитрата цинка с молярной концентрацией 0,1 моль/дм3, и металлического свинца, погруженного в раствор нитрата свинца с молярной концентрацией 0,02 моль/дм3 Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (7.2):
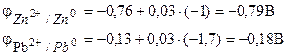
Находим ЭДС элемента по формуле (7.3).
При изучении этого раздела рекомендуется проработать следующие вопросы: понятие об электродных потенциалах; гальванические элементы (ГЭ); электродвижущая сила гальванического элемента (ЭДС) и ее измерение; стандартный водородный электрод и водородная шкала потенциалов; уравнение Нернста; потенциалы металлических, газовых и окислительно-восстановительных электродов; кинетика электродных процессов; электрохимическая и концентрационная поляризация .
Гальванический элемент – электрохимическая система, состоящая из электродов, погруженных в раствор электролитов и соединенных между собой металлическим проводником, образующим внешнюю цепь элемента.
В основе работы гальванического элемента лежат процессы, происходящие на границе металлический электрод – электролит, в результате которых образуется двойной электрический слой. За счет двойного электрического слоя возникает скачок потенциала, называемого электродным. Величина электродного потенциала металла является количественной характеристикой его активности. Для того, чтобы можно было сравнивать активность различных металлов вводится понятие стандартного электродного потенциала j о. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают ионы.
Величина потенциала металлического электрода зависит от температуры, активности ионов и рассчитывается по уравнению Нернста
где – стандартный электродный потенциал, измеренный относительно водородного электрода при стандартных условиях (Т = 298 K; = 1 моль/л, Р = 1 атм) (табл. 9 приложения);
R – универсальная газовая постоянная;
Т – абсолютная температура, K;
n – число электронов, участвующих в процессе;
F – постоянная Фарадея, равная 96 548 Кл/моль;
– активность ионов металла в растворе, моль/л.
После подстановки значений постоянных и перевода натурального логарифма в десятичный формула Нернста приобретает вид:
Потенциалы водородного и кислородного электродов, являющиеся газовыми электродами, зависят от рН раствора и парциального давления. Потенциалы этих электродов приведены в табл. 10.
Пример 1. Вычислите электродный потенциал водородного электрода в нейтральной среде при = 1 атм.
Решение. Электродный потенциал водородного электрода определяется по уравнению Нернста, исходя из схемы электродного процесса:
окисленная восстановленная
форма форма
Активность ионов водорода в нейтральной среде а = 10 –7 и = 0,
тогда 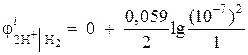 = – 0,418 В.
= – 0,418 В.
Полученное значение сравните с табличным (табл. 10 приложения).
Пример 2. Серебряный электрод опущен в раствор нитрата серебра AgNO 3 с активностью ионов = 1·10 –2 моль/л. Вычислите электродный потенциал.
Решение. Электродный процесс:
окисленная восстановленная
форма форма
Электродный потенциал серебра рассчитывается по уравнению Нернста:
 = 0,8 + 0,059× lg10 –2 = 0,682 B.
= 0,8 + 0,059× lg10 –2 = 0,682 B.
Пример 3. Составьте схему гальванического элемента, состоящего из железного и медного электродов, опущенных в растворы собственных солей. Напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС этого ГЭ, если активности ионов в соответствующих растворах следующие: = 1 · 10 –2 моль/л, а = 1,0 моль/л.
Решение. Ионно-электронные уравнения электродных процессов:
А: Fe – 2 ® Fe 2+
K: Cu 2+ + 2 ® Cu
Железный электрод является анодом , так как его стандартный электродный потенциал ( = – 0,44 В) меньше, чем стандартный потенциал медного электрода ( = + 0,34 В) (табл. 9 приложения).
Схема данного в условии гальванического элемента имеет вид:
(–) Fe | Fe 2+ || Cu 2+ | Сu (+)
Определяем ЭДС элемента:
Электродный потенциал анода определяем по уравнению Нернста, а потенциал катода является стандартной величиной:
ЭДС = 0,34 – (– 0,499) = 0,839 В.
Пример 4. Схема гальванического элемента имеет вид:
(–) Zn |ZnCl 2 || ZnCl 2 |Zn (+). Рассчитайте ЭДС этого элемента, если в одном полуэлементе активность ионов цинка 0,001 моль/л, а в другом – 0,01 моль/л. Напишите уравнения анодного и катодного процессов.
Решение. В условии задачи дан концентрационный гальванический элемент. В таком элементе катодом будет цинк, опущенный в раствор соли с более высокой активностью ионов Zn 2+ = 0,01 моль/л.
Уравнение электродных процессов:
А: Zn – 2 ® Zn 2+
K: Zn 2+ + 2 ® Zn
Определяем ЭДС элемента:
Электродные потенциалы находим по уравнению Нернста:
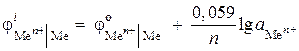 ,
,
ЭДС = – 0,819 – (– 0,848) = 0,029 В.
Пример 5. Для гальванического элемента:
(–) Mn | Mn 2+ || 2H + | H 2 , Ni (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов марганца 1 · 10 –2 моль/л, а ионов водорода 1,0 моль/л (при = 1 атм).
Решение. Уравнения электродных процессов:
А: Mn – 2 ® Mn 2+
K: 2H + + 2 ® H 2 (в кислой среде на катоде идет процесс водородной деполяризации)
При работе гальванического элемента ЭДС и ток уменьшаются. Это связано с изменениями электродных потенциалов анода и катода. Изменение электродных потенциалов, приводящее к уменьшению ЭДС и силы тока, называется поляризацией.
Различают три вида поляризации: газовую, концентрационную и электрохимическую. Разность между равновесным потенциалом электрода и его потенциалом в том же растворе при прохождении электрического тока, называется перенапряжением (табл. 11 приложения).
В условиях данной задачи перенапряжение выделения водорода на катоде = 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю: = 0. Потенциал катода с учетом перенапряжения определяется:
Электродный потенциал анода определяем по формуле . Так как перенапряжение металла на металле условно принято равным нулю, то .
ЭДС = – 0,30 – (–1,239) = 0,939 В.
Пример 6.
Вычислите величину потенциала окислительно-восстановитель-ного электрода Pt | Sn 4+ , Sn 2+ . Реакция восстановления Sn 4+ + 2 ® Sn 2+ протекает в растворе с активностями ионов = 0,1моль/л, = 0,001 моль/л. ![]() .
.
Решение. Потенциал окислительно-восстановительного электрода определяется по уравнению:
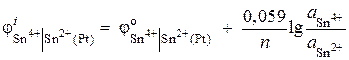 .
.
Пример 7.
Железный электрод в растворе своей соли имеет электродный потенциал ![]() . Вычислите активность ионов в растворе, моль/л.
. Вычислите активность ионов в растворе, моль/л.
Решение. Определяем активность ионов железа, используя уравнение Нернста:
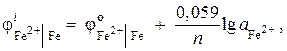
так как = – 0,44 В (табл. 9 приложения), а n = 2, то
![]() ;
;
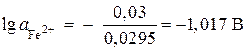 ,
, ![]() моль/л.
моль/л.
Пример 8 . Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие:
Zn + 2Ag + « Zn 2+ + 2Ag ,
если ![]() = – 146,5 кДж/моль, а = 77,2 кДж/моль.
= – 146,5 кДж/моль, а = 77,2 кДж/моль.
Решение. Стандартная ЭДС гальванического элемента определяется по уравнению:
–  ,
,
где nF – количество электричества, которое теоретически можно получить при электрохимическом превращении одного моля вещества;
F – постоянная Фарадея (F = 96,548 кДж/В · моль), или F » 96 500 Кл/моль,
n – количество электронов, участвующих в процессе, для нашего ГЭ n = 2;
– стандартная энергия Гиббса данной реакции равна:
Так как стандартные энергии Гиббса образования простых веществ цинка и серебра равны нулю, то подставляя числовые значения величин, находим:
= – 146,5 – 2 · 77,2 = – 300,9 кДж.
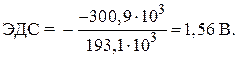
КОНТРОЛЬНЫЕ ЗАДАНИЯ
201. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС цинко-магниевого гальванического элемента, в котором активность ионов цинка = 1·10 –1 моль/л, а ионов магния = 1,0 моль/л.
Ответ: 1,571 В.
202. Для гальванического элемента (–) Cr | Cr 3+ || 2H + | H 2 , Fe (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов хрома = 1·10 –2 моль/л, а ионов водорода = 1,0 моль/л (при = 1 атм).
Ответ: 0,419 В.
203. Алюминиевая и медная пластины соединены внешним проводником и опущены в раствор серной кислоты. Составьте схему гальванического элемента и напишите ионно-электронные уравнения электродных процессов, протекающих на аноде и на катоде.
204. Вычислите электродный потенциал водородного электрода в кислой среде при при = 2 атм и [ H + ] = 1 моль/л.
Ответ: – 9× 10 –3 В.
205. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС железно-ртутного гальванического элемента, в котором активность ионов железа = 1·10 –3 моль/л, а ионов ртути = 1·10 –2 моль/л.
Ответ: 1,319 В.
206. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Mg + 2AgNO 3 ® Mg(NO 3) 2 + 2Ag.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов магния = 0,01 моль/л, а ионов серебра = 0,001 моль/л.
Ответ: 3,043 В.
207. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Zn + Pb(NO 3) 2 ® Zn(NO 3) 2 + Pb.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов цинка = 0,001 моль/л, а ионов свинца = 0,01 моль/л.
Ответ: 0,659 В.
208. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Fe 3+ , Fe 2+ если = + 0,77 В, а активности ионов железа в растворе соответственно равны = 0,001 моль/л и = 0,1 моль/л.
Ответ: 0,652 В.
209. Алюминиевый электрод в растворе соли имеет электродный потенциал ![]() . Вычислите активность ионов Al 3+ , моль/л.
. Вычислите активность ионов Al 3+ , моль/л.
Ответ: 0,095 моль/л.
210. Какой гальванический элемент называется концентрационным? Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух медных электродов, опущенных в растворы сульфата меди CuSO 4 c активностью ионов меди в первом растворе = 0,01 моль/л и с = 0,001 моль/л во втором.
Ответ: 0,029 В.
211. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов ионно-электронные уравнения реакций, протекающих на катоде и аноде.
212. При какой активности ионов Mn 2+ (моль/л) потенциал марганцевого электрода будет на 0,018 В меньше его стандартного электродного потенциала?
Ответ: 0,25 моль/л.
213. Потенциал медного электрода в растворе хлорида меди CuCl 2 составил 97% от величины его стандартного электродного потенциала. Чему равна активность ионов , (моль/л)?
Ответ: 0,46 моль/л.
214. Для гальванического элемента
(–) Mg | Mg 2+ || 2H + | H 2 , Cu (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов магния = 1·10 –3 моль/л, а ионов водорода = 1,0 моль/л (при = 1 атм).
Ответ: 1,968 В.
215. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: Mg + Cd 2+ « Mg 2+ + Cd, если активность ионов магния = 0,01 моль/л, а ионов кадмия = 10 –2 моль/л. Напишите уравнения электродных процессов.
Ответ: 0,709 В.
219. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: 2Na + H 2 O (г) + 1/2O 2 « 2NaOH (к) ,
если = – 228,76 кДж/моль, а ![]() = – 380,46 кДж/моль.
= – 380,46 кДж/моль.
Ответ: 2,76 В.
220. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Co 3+ , Co 2+ с активностями ионов кобальта = 1 моль/л и = 0,001 моль/л, если ![]() .
.
3.5.1 Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При
погружении медного электрода в воду
часть ионов меди, находящихся в узлах
кристаллической решетки, в результате
взаимодействия с диполями воды будет
переходить в раствор. Возникающий при
этом на электроде отрицательный заряд
будет удерживать перешедшие в раствор
ионы в приэлектродном пространстве –
образуется двойной электрический
слой (рис. 3.12а; о моделях строения ДЭС
смотрите п. 4.2.4). Отрицательный заряд на
электроде будет препятствовать
дальнейшему переходу ионов меди в
раствор, и через некоторое время
установится динамическое равновесие,
которое можно однозначно
охарактеризовать потенциалом
электрического поля ДЭС Φ,
зависящего от заряда на электроде, или
некоторой равновесной концентрацией
ионов в приэлектродном слое С o .
При погружении медного электрода в
раствор СuSО 4 , содержащий ионы меди
в концентрации С возможны три
случая:
Рис. 3.12
Схема двойного электрического
слоя на границе электрод-раствор
1. С < С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в поверхностном слое раствора катионов будет больше, чем анионов (рис. 3.9а).
2. С > С o . Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО 4 2- (рис. 3.12b).
3. С = С o . Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zn o ––> Zn 2+ + 2е -
Сu 2+ + 2е - ––> Сu o
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu 2+ + Zn o ––> Сu o + Zn 2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
![]() (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] < становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а 1 > а 2 . Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
![]() (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright
© С. И. Левченков,
1996 - 2005.




