Понятие стандартной эдс гальванического элемента. Основы электрохимии
При прохождении электрического тока через электролит на поверхности электродов протекают электрохимические реакции. Протекание электрохимических реакций может порождаться внешним источником тока. Возможно и обратное явление: электрохимические реакции, протекающие на двух электродах, опущенных в электролит, порождают электрический ток, причем реакции идут только при замкнутой цепи (при прохождении тока).
Электрохимическим (или гальваническим) элементом называется устройство для получения электрического тока за счет электрохимических реакций. Простейший электрохимический элемент состоит из двух металлических электродов (проводников первого рода), опущенных в электролит (проводник второго рода) и соединенных между собой металлическим контактом. Несколько электрохимических элементов, соединенных последовательно, образуют электрохимическую цепь .
Важнейшей количественной характеристикой электрохимического элемента является электродвижущая сила (ЭДС, Е), которая равна разности потенциалов правильно разомкнутого элемента (такого, у которого к конечным электродам элемента присоединены проводники первого рода из одного и того же материала).
Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды, а также элемент или цепь, составленные из них, называются обратимыми . ЭДС обратимых элементов является их термодинамическим свойством, т.е. зависит только от Т,Р, природы веществ, составляющих электроды и растворы, и концентрации этих растворов. Пример обратимого элемента - элемент Даниэля-Якоби :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
в котором каждый электрод обратим. При работе элемента идут следующие реакции: Zn ® Zn 2+ + 2e , Cu 2+ + 2e ® Cu. При пропускании тока бесконечно малой силы от внешнего источника на электродах протекают обратные реакции.
Пример необратимого элемента - элемент Вольта :
(-) Zn ç H 2 SO 4 çCu (+)
При работе элемента протекают реакции: Zn ® Zn 2+ + 2e , 2H + + 2e ® H 2 . При пропускании тока от внешнего источника электродными реакциями будут: 2H + + 2e ® H 2 , Cu ® Cu 2+ + 2e .
ЭДС электрохимического элемента является величиной положительной, т.к. она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. Обратному процессу, который не может протекать самостоятельно, отвечала бы отрицательная ЭДС. При составлении цепи электрохимических элементов процесс в одном из элементов можно направить так, чтобы он сопровождался затратой работы извне (несамопроизвольный процесс), используя для этого работу другого элемента цепи, в котором идет самопроизвольный процесс. Суммарная ЭДС любой цепи равна алгебраической сумме положительных и отрицательных величин. Поэтому очень важно при записи схемы цепи учитывать знаки ЭДС, пользуясь принятыми правилами.
ЭДС электрохимической цепи считается положительной , если при записи цепи правый электрод заряжен положительно относительно левого (катионы при работе цепи проходят в растворе от электрода, записанного слева, по направлению к электроду, записанному справа, и в этом же направлении движутся во внешней цепи электроны). Пример.
ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА .
Пусть в электрохимической системе обратимо и изотермически протекает реакция:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Электрическая энергия, вырабатываемая элементом, равна полезной работе А¢ суммарного процесса. Полезная работа А¢ обратимого процесса максимальна и при Р,Т = const равна убыли изобарного потенциала системы:
DG P,T = nFE P,T
E P , T - обратимая ЭДС системы.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Т.о., измерив ЭДС элемента и ее температурный коэффициент, можно найти величины DG и DS для суммарного процесса, протекающего в гальваническом элементе. Этот процесс является самопроизвольным, следовательно, DG < 0.
По уравнению Гиббса-Гельмгольца можно вычислить изменение энтальпии процесса:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Из уравнений следует, что соотношение между электрической энергией, обратимо генерируемой или поглощаемой в электрохимической системе, и тепловым эффектом протекающей в ней реакции зависит от знака и величины температурного коэффициента ЭДС dE/dT :
1. Если dE/dT > 0 , то nFE > (DG > DH) и система будет превращать в электрическую энергию не только то количество теплоты, которое соответствует тепловому эффекту реакции, но и дополнительную теплоту - теплоту Пелетье Q П = nFT dE/dT , заимствуемую из окружающей среды. В адиабатических условиях (в условиях тепловой изоляции, когда обмен с окружающей средой невозможен) Т системы понижается. Особенно заметно охлаждение системы, если при dE/dT > 0 < 0 (реакция эндотермична).
2. Если dE/dT < 0 , то nFE < (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. Если dE/dT = 0 , то DG = DH и nFE = - произведенная обратимо системой электрическая энергия эквивалентна тепловому эффекту химической реакции. Это соотношение известно как принцип (правило) Томсона .
Для расчета ЭДС уравнения можно переписать в виде:
При использовании уравнений необходимо помнить, что они справедливы только для обратимых электрохимических систем , поэтому при изучении зависимости ЭДС от Т необходимо избегать применения электрохимических систем с жидкостными границами, т.к. возникающие на них диффузионные потенциалы не являются равновесными.
Свяжем ЭДС элемента с константой равновесия реакции, протекающей в элементе. Уравнение изотермы химической реакции:
DG = RT ln K a - RT
E = - = ln K a -
Первый член правой части уравнения при заданных Р,Т - величина постоянная, его можно обозначить через Е о. Е о - стандартная ЭДС элемента (электрохимической системы) , т.е. ЭДС при всех a i = 0.
Е = Е о + ln = E o + 2,303 lg
Т.о., ЭДС электрохимической системы является функцией активностей участников электрохимической реакции. Вышеприведенные уравнения дают возможность вычислить величины DG и К а по экспериментальным значениям Е и, наоборот, рассчитывать Е, зная термодинамические характеристики химической реакции.
ИЗМЕРЕНИЕ ЭДС .
Для измерения равновесной (обратимой) величины ЭДС электрохимического элемента необходимо, чтобы процесс совершался бесконечно медленно, т.е. чтобы элемент работал при бесконечно малой силе тока. Это условие выполняется в компенсационном методе, который основан на том, что элемент включается последовательно против внешней разности потенциалов и последняя выбирается так, чтобы ток в цепи отсутствовал. Тогда внешняя разность потенциалов равна ЭДС цепи.
Пользуясь компенсационным методом, можно непосредственно измерить значение ЭДС, однако это довольно сложная операция, поэтому в лабораторной практике предпочитают сравнивать ЭДС изучаемого элемента с ЭДС так называемых стандартных (нормальных) элементов, которая тщательно измерена при разных Т. Этот сравнительный метод также является компенсационным.
Основным нормальным элементом является насыщенный элемент Вестона .
(Схеме измерения ЭДС - самостоятельно).
СТРОЕНИЕ ГРАНИЦЫ ЭЛЕКТРОД-РАСТВОР. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ .
При соприкосновении проводника первого рода с электролитом на границе электрод-раствор возникает двойной электрический слой . В качестве примера рассмотрим медный электрод, погруженный в раствор CuSO 4 . Химический потенциал ионов меди в металле при данной Т можно считать постоянным, тогда как химический потенциал ионов меди в растворе зависит от концентрации соли; в общем случае эти химические потенциалы неодинаковы.
Пусть концентрация CuSO 4 такова, что > . Тогда при погружении металла в раствор часть ионов Cu 2+ из раствора дегидратируется и перейдет на металл, создав на нем положительный заряд. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ из раствора на металл и приведет к образованию вблизи электрода слоя притянутых к нему анионов SO 4 2- . Установится так называемое электрохимическое равновесие , при котором химические потенциалы ионов в металле и в растворе будут отличаться на величину разности потенциалов образующегося при этом двойного электрического слоя (ДЭС) :
Разность электрических потенциалов и разность химических потенциалов скомпенсированы при электрохимическом равновесии.
Пусть концентрация CuSO 4 настолько мала, что < . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Можно выбрать такую концентрацию электролита, при которой химические потенциалы ионов в металле и растворе одинаковы. Растворы такой концентрации получили название нулевых растворов . При погружении металла в его нулевой раствор на поверхности электрода не возникает ДЭС, однако и в этом случае разность потенциалов между металлом и раствором не равна нулю.
Согласно Нернсту, единственным источником ЭДС электрохимического элемента является ДЭС на поверхности электродов. Потенциал металлов в нулевом растворе Нернст определял как абсолютный нуль потенциалов. В работах А.Н.Фрумкина было показано, что представления Нернста являются неверными. Экспериментально установлено, что ЭДС элемента, составленного их двух различных электродов, погруженных в свои нулевые растворы, весьма значительно отличается от нуля (может быть более 1 В). Потенциал металла в нулевом растворе, получивший название потенциала нулевого заряда , нельзя рассматривать как абсолютный нуль потенциалов.
ТЕОРИЯ КОНДЕНСИРОВАННОГО ДВОЙНОГО СЛОЯ ГЕЛЬМГОЛЬЦА . Первую количественную теорию строения ДЭС на границе металл-раствор создал Гельмгольц (1853). По Гельмгольцу, ДЭС можно уподобить плоскому конденсатору, одна из обкладок которого совпадает с плоскостью, проходящей через поверхностные заряды в металле, другая - с плоскостью, соединяющей центры зарядов ионов в растворе, притянутых к поверхности металла электростатическими силами. Толщина двойного слоя l равна радиусу ионов r . По условию электронейтральности число притянутых к поверхности металла ионов должно быть таким, чтобы их заряды компенсировали поверхностные заряды металла, т.е.
Теория конденсированного двойного слоя позволяет получить значения емкости ДЭС, согласующиеся с опытом, и физически правдоподобную толщину ДЭС. Однако она не может истолковать многие опытные закономерности: экспериментально найденные значения электрокинетического потенциала (x-потенциала) и их зависимость от концентрации электролита, изменение знака заряда поверхности металла в присутствии ПАВ.
ТЕОРИЯ ДИФФУЗНОГО ДВОЙНОГО СЛОЯ ГУИ-ЧАПМАНА . В теории Гельмгольца не учитывается, что свойства ДЭС изменяются с концентрацией электролита и его Т. Гуи (1910) и Чапман (1913) попытались связать плотность заряда в ДЭС с составом раствора. Они учли, что помимо электростатических сил, возникающих между металлом и ионами, на ионы также действуют силы теплового молекулярного движения. При наложении этих двух сил ионы в растворе должны распределяться относительно поверхности металла диффузно - с убывающей при удалении от нее объемной плотностью заряда.
Гуи и Чапман считали, что ионы можно рассматривать как материальные точки, не имеющие собственного объема, но обладающие зарядом, и что их распределение в поле заряда электрода подчиняется распределению Больцмана.
Теория Гуи-Чапмана лучше теории Гельмгольца согласуется с закономерностями электрокинетических явлений. Если предположить, что начиная с некоторого расстояния l 1 ионы уже не связаны прочно с поверхностью электрода при относительном перемещении твердой и жидкой фаз, то соответствующий этому расстоянию потенциал можно считать x-потенциалом (x < j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Т.о., теория Гуи-Чапмана оправдывается лучше всего там, где теория Гельмгольца оказывается неприложимой, и, наоборот, последняя дает лучшую сходимость с опытом в тех случаях, когда первая дает неверные результаты. Следовательно, строению ДЭС должно отвечать некоторое сочетание моделей, предложенных Гельмгольцем и Гуи-Чапманом. Такое предположение было сделано Штерном (1924) в его адсорбционной теории ДЭС.
АДСОРБЦИОННАЯ ТЕОРИЯ ШТЕРНА . Штерн полагал, что определенная часть ионов удерживается вблизи поверхности раздела металл-электролит, образуя гельмгольцевскую или конденсированную обкладку двойного слоя с толщиной, отвечающей среднему радиусу ионов электролита. Остальные ионы, входящие в ДЭС, распределяются диффузно с постепенно убывающей плотностью заряда. Для диффузной части ДЭС Штерн, как и Гуи, пренебрег собственными размерами ионов. Кроме того, Штерн высказал мысль, что в плотной части ДЭС ионы удерживаются за счет не только электростатических сил, но и сил специфической адсорбции, т.е. силами некулоновского происхождения. Поэтому в растворах, содержащих поверхностно-активные ионы, их число в плотной части ДЭС может превосходить заряд поверхности металла на некоторую величину, зависящую от свойств ионов и заряда металла. Т.о., по Штерну, следует различать две модели ДЭС, одна из которых относится к растворам поверхностно-инактивных электролитов, другая - к растворам, содержащим специфически адсорбирующиеся ионы.
В адсорбционной теории также сохраняется равенство:
Q M = q L = q 1 + q 2
Плотность заряда со стороны раствора q L состоит из двух частей: плотности заряда в гельмгольцевском слое q 1 и плотности заряда в диффузном слое q 2 .
Теория Штерна позволяет определить x-потенциал как падение потенциала в диффузной части ДЭС, где уже потеряна прочная связь между металлом и ионами. При таком определении x-потенциал не должен совпадать с нерстовским потенциалом, как это и наблюдается на опыте. Теория Штерна смогла объяснить и перезарядку поверхности твердого тела.
При бесконечно малой концентрации все заряды в растворе распределены диффузно, и строение ДЭС описывается теорией Гуи-Чапмана. Напротив, в концентрированных растворах строение ДЭС приближается к модели, предложенной Гельмгольцем. В области средних концентраций, где x сравним по величине с RT/F, его зависимость от концентрации можно выразить приближенными уравнениями:
для положительных величин x: x = В - ln с
для отрицательных значений x: x = В¢ + ln с
Теория Штерна дает качественно правильную картину ДЭС. Определение емкости с использованием модели Штерна согласуется с опытом как по величинам емкости, так и по характеру ее зависимости от потенциала электрода и концентрации раствора. Но теория Штерна не свободна от недостатков. К их числу относится невозможность количественного описания емкостных кривых, особенно при удалении от потенциала нулевого заряда.
ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ СТОЕНИЯ ДЭС . Было предпринято много попыток разработать теорию ДЭС, количественно согласующуюся с опытными данными (Райс, Фрумкин с сотр., Бокрис, Деванатхан, Есин, Мюллер, Парсонс, Эршлер и др.). Наибольшее признание получила модель Грэма (1947). Согласно Грэму, обкладка ДЭС, находящаяся в растворе, состоит не из двух, а из трех частей. Первая, считая от поверхности металла, называется внутренней плоскостью Гельмгольца; в ней находятся лишь поверхностно-активные ионы (заряд плоскости равен q 1) либо, если их нет в растворе, молекулы растворителя (q 1 = 0); потенциал ее, отнесенный к раствору, обозначается y 1 . Следующая, удаленная от поверхности металла на расстояние, до которого могут подходить ионы (центры их заряда), называется внешней плоскостью Гельмгольца; ее общий заряд равен q 2 , а потенциал плоскости y 2 . За внешней плоскостью Гельмгольца располагается диффузный слой с потенциалом, изменяющимся от y 2 до нуля и с плотностью заряда, совпадающей с q 2 .
Модель Грэма отражает основные черты и особенности структуры ДЭС металл-электролит. Она позволяет рассчитать кривые дифференциальной емкости для любых концентраций данного электролита, если имеется экспериментальная кривая хотя бы для одного его раствора. Однако и эта модель охватывает далеко не все аспекты проблемы.
Электрическая работа равна произведению напряжения (разности потенциалов) на количество прошедшего электричества. В изобарно-изотермических условиях (при постоянных температуре и давлении) максимальная электрическая работа гальванического элемента может быть получена при максимальной разности потенциалов электродов. Максимальная разность потенциалов ΔЕ, равная разности равновесных электродных потенциалов катода (Е к ) и анода (Е а ) элемента, называется ЭДС гальванического элемента
ΔЕ = Е к - Е а
Если электроды находятся в стандартных условиях, то
ΔЕ 0 = Е к 0 - Е а 0 ,
где ΔЕ 0 – стандартная ЭДС элемента,а Е к 0 и Е а 0 – стандартные электродные потенциалы катода и анода, соответственно.
Если на электроде испытывает превращение один моль вещества, то по закону Фарадея через систему протекает количество электричества, равное nF , где n – число молей эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества равна:
A
max.электр.
= nF ΔЕ (1)
ΔЕ (1)
В то же время максимальная полезная работа А max. ОВР , которую может совершать система при протекании реакции при постоянных температуре и давлении, равна энергии Гиббса реакции:
А max. ОВР = - ΔG Р (2)
Так как А max. ОВР = A max.электр. , то:
ΔЕ = - ΔG Р /nF. (3)
В стандартных условиях
ΔЕ 0 = - ΔG Р 0 /nF , (4)
где ΔЕ 0 и ΔG o - стандартные ЭДС и энергия Гиббса реакции.
Следовательно, при известных значениях энергии Гиббса реакции можно рассчитать ЭДС элемента, и наоборот. Уравнение (4.3) показывает связь между химической и электрической энергиями. Энергия Гиббса реакции зависит от активностей. Например, для реакции:
аA (г)
+ bB (г)
 cC (г)
+ dD (г)
cC (г)
+ dD (г)
 G
=
G
=
 G o
+ RT
G o
+ RT
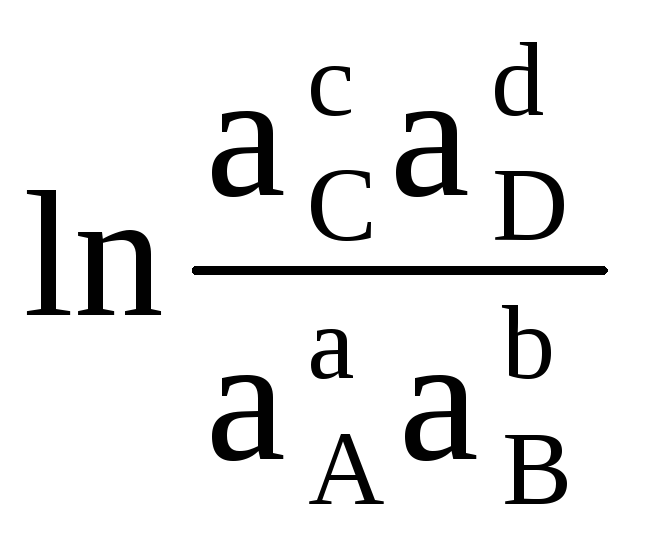 =
=
 G o
-
RT
G o
-
RT
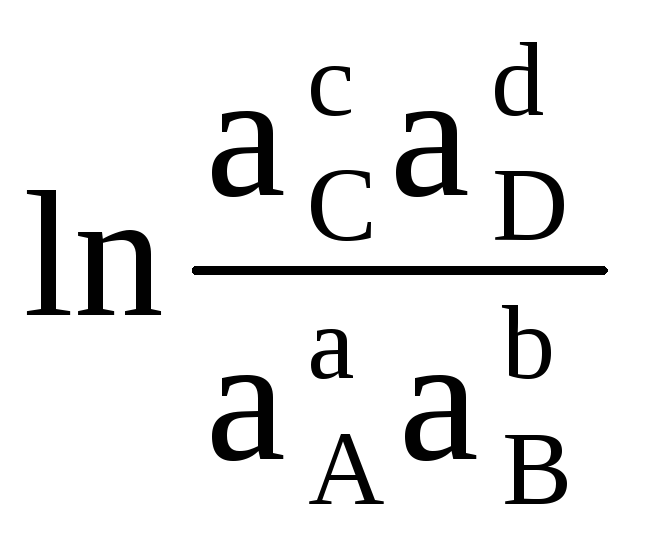 (5)
(5)
 G
=
G
=
 G o
+ RT
G o
+ RT
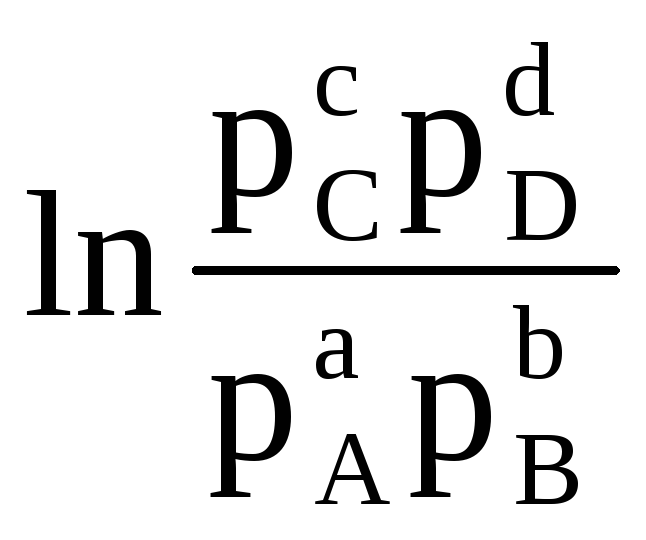 =
=
 G o
- RT
G o
- RT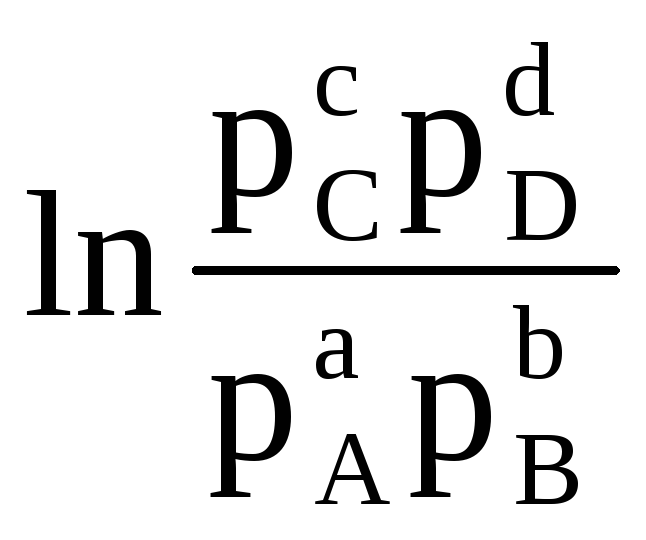 (6)
(6)
Подставляя уравнение (4.5) в уравнение (4.3), получаем:
ΔЕ
=
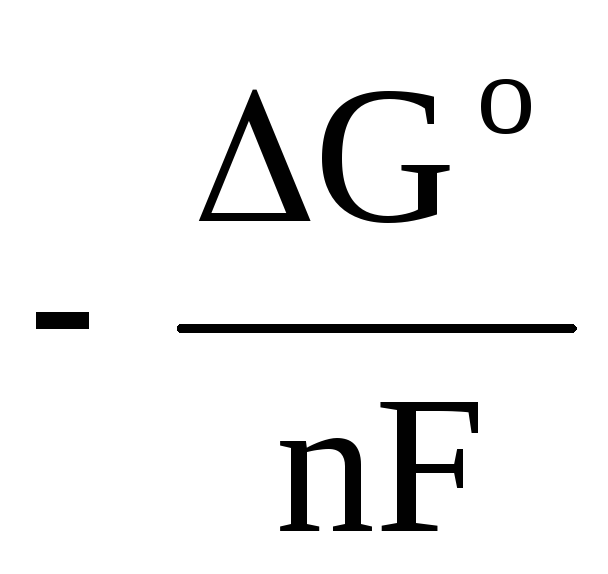 +
+
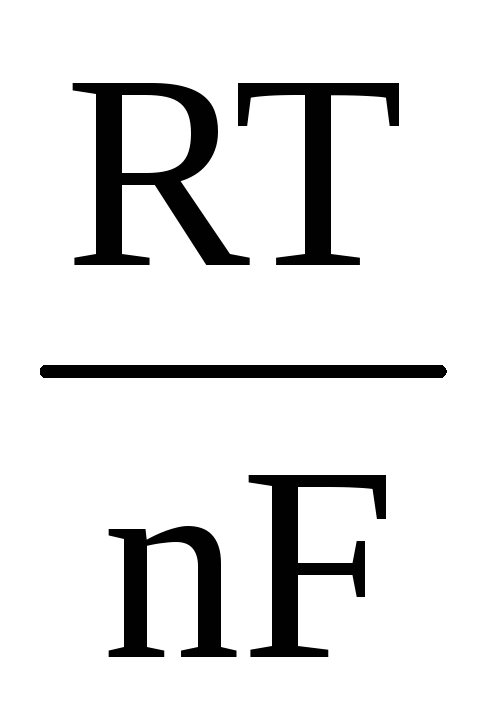
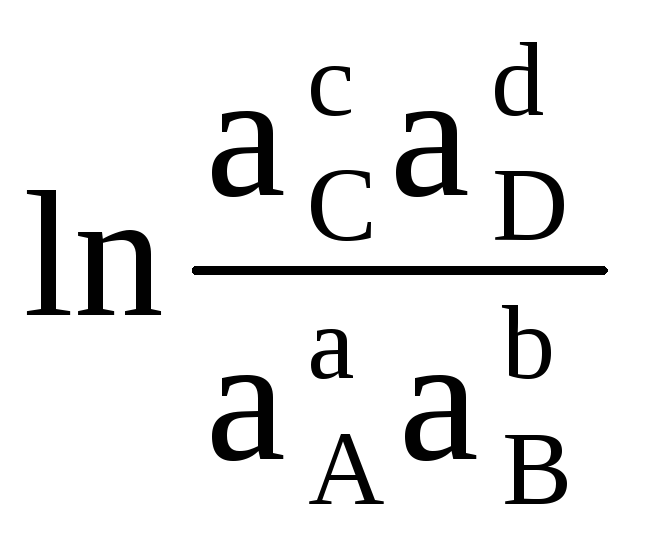 (7)
(7)
(при стандартных условиях, т.е. при активностях всех участников реакции равных единице, ΔЕ = ΔЕ 0 ). Если в реакции участвуют газообразные вещества, то в уравнении (4.7) активности заменяют парциальными давлениями соответствующих веществ.
Таким образом, стандартной называется ЭДС элемента, если активности (или парциальные давления) исходных веществ и продуктов реакций равны единице. Величину стандартной ЭДС (ΔЕ 0 ) гальванического элемента можно вычислить по уравнению (4.4), если известна величина стандартной энергии Гиббса реакции. Последнюю легко рассчитать, зная энергию Гиббса образования продуктов реакции и исходных веществ.
В качестве примера запишем уравнение для расчета ЭДС элемента Даниэля – Якоби:
ΔЕ
= ΔЕ
0
+
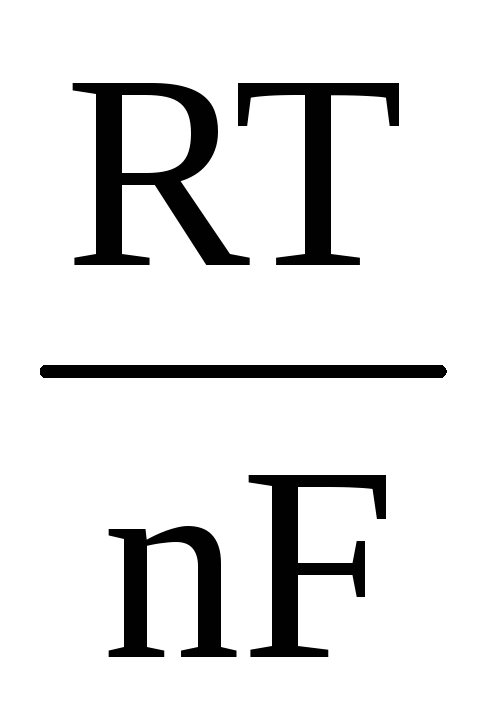
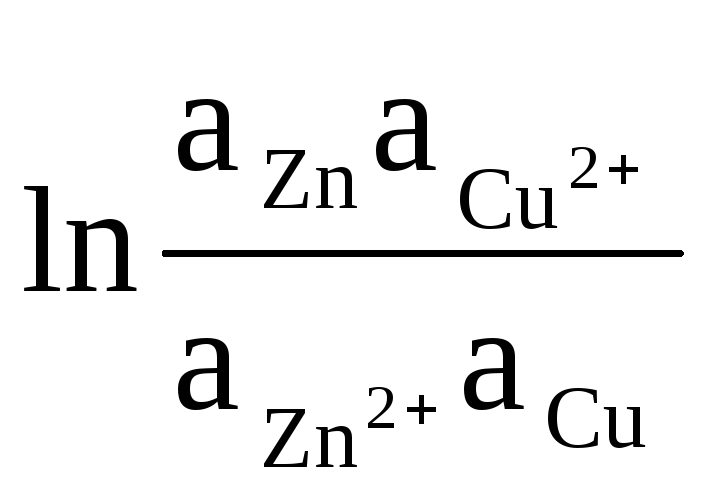 (8)
(8)
Активности твердых Zn и Cu равны единице (реакции, протекающие на электродах, являются гетерогенными). Поэтому получаем:
ΔЕ
= ΔЕ
0
+
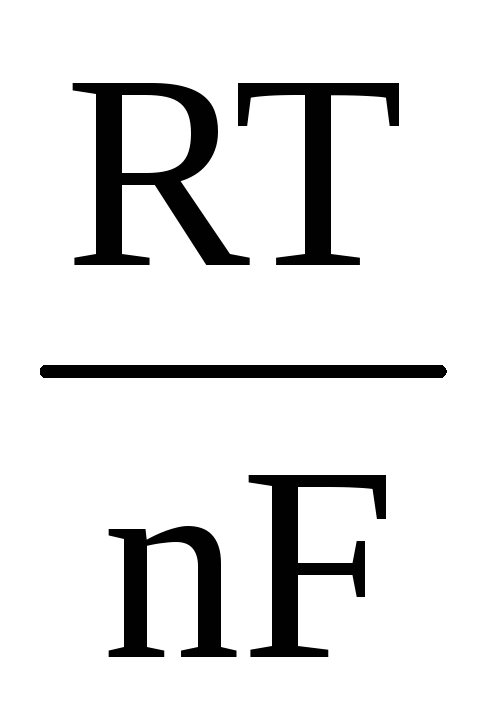
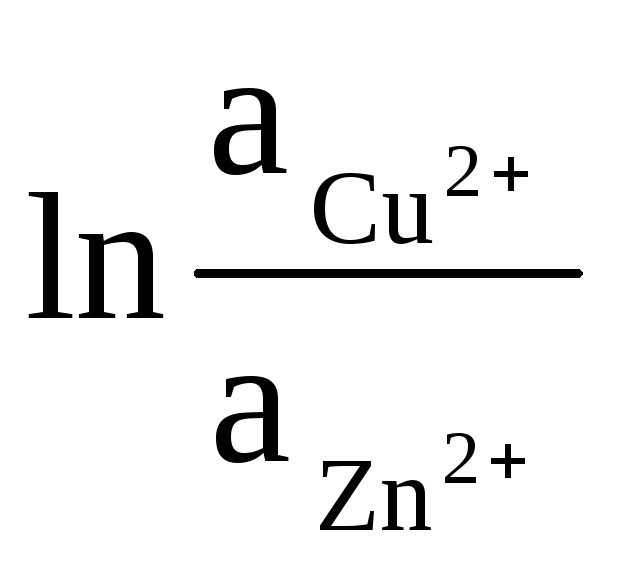 (9)
(9)
При
замене натурального логарифма на
десятичный и подстановке соответствующих
значений концентраций (а Ме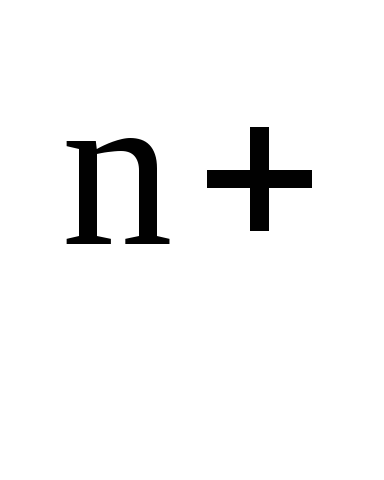
 ),
а также численных значений R, F
и
стандартной температуры 298К, уравнение
(4.9) приобретает еще более простой вид:
),
а также численных значений R, F
и
стандартной температуры 298К, уравнение
(4.9) приобретает еще более простой вид:
ΔЕ
= ΔЕ
0
+
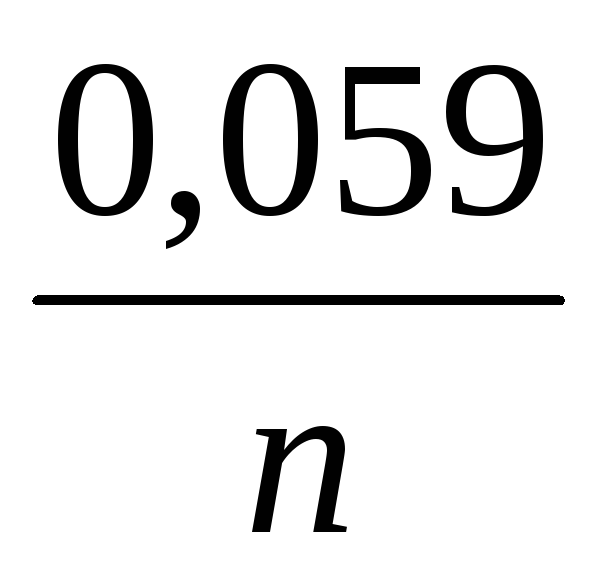
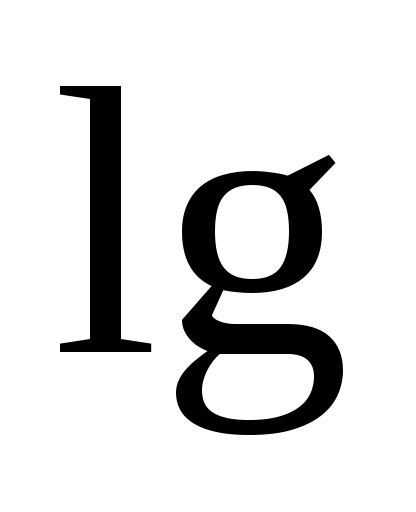
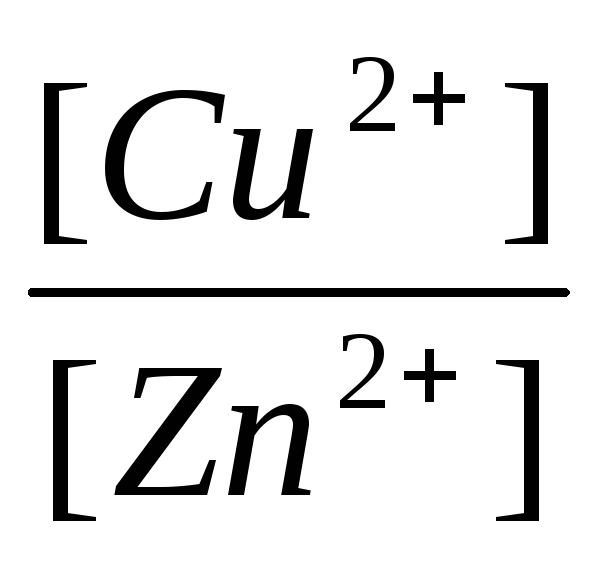 (10)
(10)
ΔЕ
= ΔЕ
0
Cu
+2 / Cu
-
ΔЕ
0
Zn +2 / Zn
+
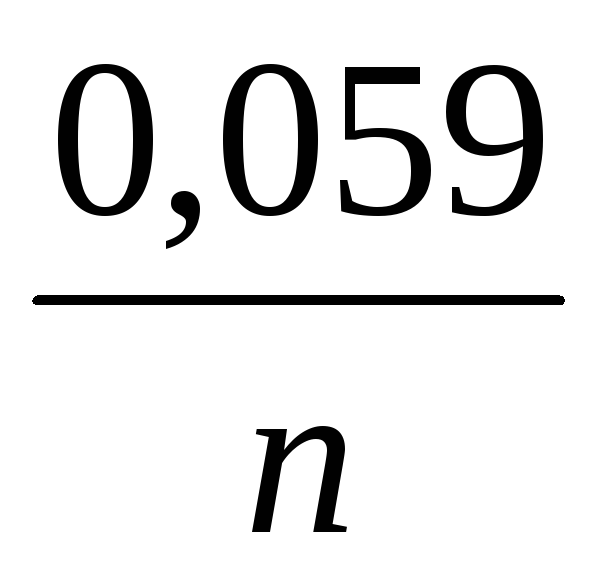
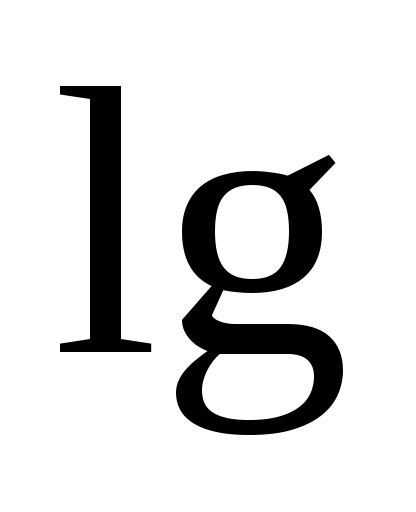
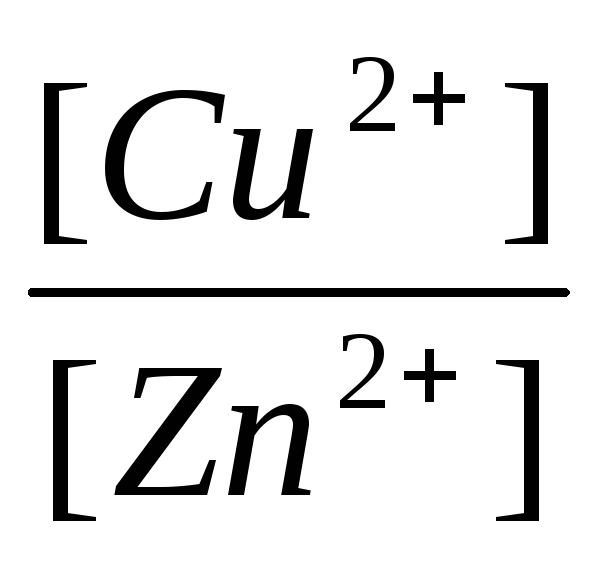 , (11)
, (11)
где n - число электронов, участвующих в процессе окисления-восстановления;
ΔЕ 0 Cu +2 / Cu и ΔЕ 0 Zn +2 / Zn - стандартные электродные потенциалы в вольтах (В);
ΔЕ 0 Cu +2 / Cu - ΔЕ 0 Zn +2 / Zn = ΔЕ 0 - стандартная ЭДС гальванического элемента;
И - концентрации, соответственно, ионов меди и цинка в растворах CuSO 4 и ZnSO 4 , в моль/л.
Измерение ЭДС гальванических элементов. Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента, т.е. U < ЭДС. Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока и другими эффектами. Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент равен нулю. Для этого к элементу от внешнего источника тока подводят ЭДС с противоположным знаком. В измерительную цепь включается также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно ЭДС гальванического элемента (момент компенсации ЭДС), ток в цепи равен нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент вольтметром напряжение на клеммах гальванического элемента равно его ЭДС.
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом . Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов. Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление. Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Цинковая пластинка опущена в раствор сульфата цинка, медная - в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO 4 2- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
Гальванический элемент записывается в виде электрохимической схемы:
A(-) Zn | ZnSO 4 || CuSO 4 | Cu (+)K
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:
A Zn – 2e = Zn 2+
K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
ЭДС= е K - е A
Для медно-цинкового гальванического элемента в стандартных условиях:
ЭДС = 0,34-(-0,76)=1,1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным . Например, никелевый концентрационный гальванический элемент.
(-)Ni | NiSO 4 || NiSO 4 | Ni (+)
0,01моль 0,1моль
Запишем работу такого концентрационного гальванического элемента.
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -2) = -0.25 + (0,058/2)(-2) = -0.308 В
е Ni 2+ / Ni = е 0 + (0,058/n)lg(1*10 -1) = -0.25 + (0,058/2)(-1) = -0.28 В
ЭДС = -0,28 – (-0,308) = 0,028 В
Процессы на электродах:
А: Ni 0 - 2е - = Ni 2+
К: Ni 2+ + 2е - = Ni 0
КОНТРОЛЬНЫЕ ЗАДАНИЯ
48. Вычислить ЭДС кадмиево – серебряного гальванического элемента, если концентрация ионов серебра в растворе равна 0,1 моль/л, а ионов кадмия 0,001 моль/л. Напишите уравнения реакций протекающих на электродах.
49. Составьте схемы двух гальванических элементов в одном из которых никель – катод, а в другом анод. Напишите уравнения реакций протекающих при работе этих элементов.
50. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1М растворы их солей. Напишите уравнения реакций.
51. Рассчитайте ЭДС концентрационного никелевого гальванического элемента. Концентрация ионов металла в растворах равна 1 моль/л и 0,0001 моль/л. Написать процессы, протекающие на аноде и катоде.
52. Какие процессы происходят у электродов медного коцентрированного гальванического элемента, еслиу одного из электродов концентрация ионов металла равна 1 моль/л, а у другого 0,001 моль/л. в каком направлении движутся электроны во внешней цепи. Чему равна ЭДС?
53. Составьте схему гальванического элемента, состоящего из пластин Zn и Fe погруженных в растворы их солей. Напишите уравнения процессов, протекающих на ионы железа, чтобы ЭДС элемента стала равной нулю при концентрации ионов цинка 0,0001 моль/л.
54. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите уравнения реакций, протекающих на пластинах.
55. Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 1М раствор нитрата серебра и стандартного водородного электрода. Напишите урaвнения электродных процессов. Чему равна ЭДС элемента?
56. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов
а) Mg | Mg 2+ | | Pb 2+ | Pb
б) Pb | Pb 2+ | |Cu 2+ | Cu
в) Cu | Cu 2+ | | Ag 2+ | Ag
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев.
57. Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO 3) 2 = Ni(NO 3) 2 + Pb .
Напишите электронные уравнения анодного и катодного процессов, вычислите ЭДС этого элемента при стандартных условиях.
58. ЭДС гальванического элемента, образованного медной пластинкой, погруженной в раствор ее соли с концентрацией ионов меди, равной 0,001 моль/л и хромом, погруженным в раствор его соли равна 1,05 В. определите концентрацию ионов хрома в растворе его соли. Составьте схему гальванического элемента и напишите электронные уравнения электродных процессов.
59. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенные в растворы своих солей с концентрацие ионов металлов, равной 1 моль/л. изменится ли ЭДС этого гальванического элемента, если концентрацию каждого из ионов уменьшить до 0,01 моль / л.
60. ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1М раствор соли свинца равна 126мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода. Составьте схему гальванического элемента и напишите процессы, протекающие на электродах.
61. Какие процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
62. Какие процессы протекают на электродах при зарядке и разрядке кадмиево-никелевого аккумулятора.
63. Какие процессы протекают на электродах при зарядке и разрядке железно-никелевого аккумулятора.
64. Составьте схемы двух гальванических элементов в одном из которых хром был бы анодом, а в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
65. Составьте схему гальванического элемента, состоящего из алюминиевого электрода, погруженного в 1М раствор нитрата алюминия и стандартного водородного электрода. Напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента.
66. В каком направлении будут перемещаться электроны во внешней цепи алюминий – цинкового гальванического элемента. Концентрации ионов в растворах равны 0,1 моль/л. Составьте схему гальванического элемента, напишите уравнения процессов, протекающих на электродах, вычислите ЭДС.
67. В серебряно-цинковом элементе, применяемом для питания различной аппаратуры, протекает реакция
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисление.
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na + и Cl - , двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия:
NaCl = Na + + Cl -
Катод (-) (+) анод
Na + + e - = Na 0 2Cl - - 2e - = Cl 2
Суммарное уравнение реакции:
2Na + + 2Cl - электролиз 2 Na + Cl 2
2NaCl электролиз 2Na + Cl 2
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Первыми на катоде восстанавливаются ионы тех металлов, потенциал которых самый положительный. Например, раствор с ионами Ag + и H + . Первым восстанавливается Ag:
Ag + + e - = Ag 0 e 0 = +0,8 B
Водород не восстанавливается, так как его потенциал меньше.
Потенциалы металлов и водорода зависят от их концентрации в электролите. Поэтому по значениям стандартного потенциала судить о восстановлении ионов Н + не всегда можно. В нейтральном расторе концентрация ионов водорода равна10 -7 моль/л. и по формуле Нернста:
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0,41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0,41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0,41В.
Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – зто разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
Пример .
Потенциал выделения цинка в нейтральном электролите –0.76В, водорода –0.41В. перенапряжение водорода на цинке около –0.72В. Таким образом, водород на цинке будет выделяться лишь при потенциале –0.41+(-0.72)=-1.13В. Если сравнить потенциал разряда цинка (-0.76 В) с потенциалом разряда водорода на цинке (-1.13В), ясно, что будет выделяться цинк. На деле так и есть, при электролизе нейтрального раствора соли цинка выделяется цинк и малое количество водорода.
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18В (от Li до Mn). Восстанавливаются ионы водорода:
2 Н + + 2е - = Н 2 РН < 7
2 Н 2 О + 2е - = Н 2 + 2ОН - РН >= 7
2) ионы металлов, электродный потенциал которых от –1.18В до 0.00В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Me n+ + ne - = Me 0
2H + + 2e - = H 2 PH<7
2H 2 O + 2e - = H 2 + 2OH - PH>=7
3) ионы металлов, электродный потенциал которых больше 0.0В (от H до Au). В этом случае восстанавливаются только ионы металлов
Ме n+ + ne - = Me 0
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. На их поверхности окисляются анионы с более отрицательными потенциалами. Это ионы не содержащие кислорода, такие как J - , Br - , Cl - , S 2- и др. (исключение F -)
Если в растворе имеются ионы Cl - , Br - , то окисляться на инертном аноде будут ионы Br - .
2Br - - 2e - = Br 2
2H 2 0 - 4e - = O 2 +4H + (PH<=7)
4OH - 4e - = 2H 2 O + O 2 (PH>7)
Рассмотрим несколько случаев электролиза водных растворов.
Пример.
Схема электролиза водного раствора хлорида меди с инертным анодом CuCl 2 = Cu 2+ +2Cl -
H 2 O = H + = OH -
Катод(-) Cu 2+ H + (H 2 O) Cl - , OH - (H 2 O) (+)анод
Cu 2+ + 2e - = Cu 0 2Cl - -2e - = Cl 2
У меди потенциал больше 0, поэтому на катоде восстанавливается металл, на аноде окисляется бескислородный кислотный остаток.
Пример.
Схема электролиза раствора сульфата калия с инертным анодом. K 2 SO 4 = 2K + + SO 4 2
H 2 O = H + + OH -
Катод(-) 2K + ,H + (H 2 O) SО 4 2- , OH(H 2 O) (+)анод
2H 2 O + 2e - = H 2 + 2OH - 2H 2 O – 4e - = O 2 + 4H +
K + + OH - = KOH 2H + + SO 4 2- = H 2 SO 4
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода и накопление ионов ОН -
У анода будет идти окисление молекул воды и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример .
Электролиз водного раствора сульфата никеля с активным анодом. Ni SO 4 = Ni 2+ = SO 4 2-
H 2 O H + + OH -
Катод(-) Ni 2+ , H + (H 2 O) SO 4 2- , OH - (H 2 O) (+)анод
Ni 2+ +2e - = Ni 0 Ni – 2e - = Ni 2+
e 0 Ni = -0.25B больше потенциала восстановления ионов водорода из воды(-0,41В), поэтому восстанавливается металл, а на аноде происходит окисление анода-металла, так как потенциал никеля намного меньше потенциала окисления воды (+1,23В).
Законы электролиза
Масса электролита, подверженная химическому превращению, а также массы веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
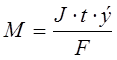 , где
, где
m -масса электролита, подвергшаяся электролизу или масса веществ, выделившаяся на электродах, г;
J -сила тока, А;
э-молярная масса эквивалентов вещества, г/моль;
F-число Фарадея – 96500 Кл;
t-время электролиза, с;
КОНТРОЛЬНЫЕ ЗАДАНИЯ
68. Составьте уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl 2 с инертными электродами.
69. Составьте схемы электролиза водных растворов серной кислоты, хлорида меди, нитрата свинца с платиновыми электродами.
70. Напишите уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и хлорида железа (II) с угольными электродами.
71. Составьте схемы электролиза водного раствора хлорида цинка, если а) анод цинковый; б) анод угольный.
72. Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
73. При электролизе водного раствора SnCl 2 на аноде выделилось 4,48 л. хлора (условия нормальные). Какое вещество и в каком количестве выделилось на катоде.
74. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди. Напишите уравнения процессов на электродах.
75. Составьте схему процессов, происходящих на медных электродах при электролизе водного раствора нитрата калия.
76. Неочищенная медь содержит примеси серебра и цинка. Что происходит с этими примесями при электролитическом рафинировании меди. Напишите уравнения процессов на электродах.
77. Сколько времени потребуется для полного разложения 2 молей воды током силой 2А.
78. Через растворы поваренной соли и фосфата натрия пропустили в течение некоторого времени постоянный ток. Изменится ли от этого количество соли в том и в другом случае. Ответ мотивируйте, составив электронные уравнения процессов идущих на катоде и аноде.
79. При электролизе раствора сульфата меди (II) на аноде выделилось 0,168 л газа (нормальные условия) составьте электронные уравнения процессов и вычислите, какая масса меди выделится на катоде.
80. Составьте электронные уравнения процессов происходящих при электролизе раствора и расплава КОН.
81. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течении 2,5 часов если сила тока равна 6 А.
82. Сколько граммов серной кислоты образуется возле анода при электролизе раствора сульфата натрия, если на аноде выделится 1,12л кислорода (н.у.) вычислить массу вещества, выделившегося на катоде.
83. При электролизе раствора нитрата серебра на аноде выделилось 0,28 л кислорода. Сколько граммов серебра выделилось на катоде.
84. В воде растворены соли алюминия, цинка и меди с концентрацией катионов 1 моль/л. составьте электронные уравнения процессов на электродах и укажите последовательность реакций на катоде.
85. Какие продукты могут быть получены при электролизе раствора NaNO 3 , если анодное и катодное пространства:
а) разделены пористой перегородкой;
б) не разделены и раствор перемешивается.
86. Какие продукты будут выделяться на катоде и аноде в первую очередь при электролизе водных растворов с графитовыми электродами, если в электролите находится смесь сульфата меди (II) и хлорида калия.
87. В водный раствор нитрата серебра опущены медная и серебряная пластинки. К какому полюсу источника тока должна быть присоединена медная пластинка для покрытия ее серебром. Напишите схему процесса электролиза.
КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется самопроизвольное разрушение металла под действием окружающей среды. Коррозия представляет собой окислительно-восстановительный гетерогенный процесс, происходящий на поверхности раздела фаз. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химической коррозией называется окисление металла, не сопровождающееся возникновением электрического тока в системе. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими жидкостями – неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности получается большое количество непрерывно действующих микрогальванических элементов. Более активный металл – анод окисляется с образованием катионов металла или нерастворимых продуктов, например, ржавчины. Освобождающиеся электроны перемещаются к катоду, на котором происходит восстановление окислителя. Растворенный кислород и ионы водорода – важнейшие окислители вызывающие коррозию, называют катодными деполяризаторами. Какой именно процесс восстановления будет протекать на катоде зависит от состава электролита.
Пример .
При контакте железа и меди находящихся в растворе хлороводородной кислоты образуется микрогальванический элемент:
A Fe| HCl | Cu K
e 0 Fe/Fe2+ = -0,44B
e 0 Cu/Cu2+ = +0,34B
Железо - более активный металл будет анодом, а медь – катодом. Реакции, протекающие на аноде и катоде, могут быть выражены:
1 A: Fe -2e = Fe 2+
1 K: 2H + + 2e = H 2
Суммирую анодные и катодные процессы, получим окислительно-восстановительную реакцию, самопроизвольное протекание которой обуславливает коррозию металла:
Fe + 2H + = Fe 2+ + H 2
Fe + 2HCl = FeCl 2 + H 2
Пример.
При коррозии в нейтральной среде, в отсутствие растворенного в воде кислорода происходит так же водородная деполяризация катода, как и в предыдущем примере.
Запишем схему гальванического элемента и уравнения реакций, протекающих в этом гальваническом элементе:
A Fe|H 2 O| Cu K
1 A: Fe – 2e = Fe 2+
1 K: 2H 2 O + 2e = H 2 + 2OH -
Fe + 2H 2 0 = Fe 2+ + H 2 + 2OH -
Или в молекулярном виде: Fe + 2H 2 O = Fe(OH) 2 + H 2
Пример .
При контакте железа с медью во влажном воздухе процессы образуется гальванический элемент
A Fe| H 2 O + O 2 | Cu K
И процесс коррозии выражается следующими уравнениями:
A: Fe – 2e = Fe 2+
K: O 2 + 2H 2 O + 4e = 4OH -
2Fe + O 2 + 2H 2 O = 2Fe(OH) 2
Под влиянием кислорода воздуха, гидроксид железа(2) окисляется дальше по уравнению
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3
Как видно из примера, в этом случае происходит кислородная деполяризация катода.
Возможность протекания самопроизвольного окислительно-восстановительного процесса рассчитывается по ЭДС
ЭДС= е восстановителя – е окислителя
Если ЭДС процесса больше нуля, то процесс возможен.
Из двух электродов может быть составлена электрохимическая цепь - гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Перенос заряда через границу раздела фаз (электрический ток) в такой системе осуществляется за счет электрохимической реакции, протекающей самопроизвольно. Электрод, на котором происходит электровосстановление, называется катодом, а электрод, на котором происходит электроокисление, называется анодом.
Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Обычно это достигается простым подключением к металлам М 1 и М 2 медных проводов. Включение между двумя металлическими проводниками третьего металлического проводника, согласно закону Вольта, не изменяет разности потенциалов на концах цепи.
Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника тока.
При схематической записи электрохимической цепи:
1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов;
2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).
В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают.
Cогласно правилу записи электродной реакции, окисленная форма вещества и электроны записываются слева. , является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то – в обратном направлении.
Учитывая, что на катоде происходим электровосстановление, а на аноде – электроокисление, то в гальваническом элементе (при протекании самопроизвольных процессов) катод будет более электроположительным электродом, а анод более электроотрицательным. Если же элемент подключить к внешнему источнику тока и вызвать вынужденные электрохимические процессы (электролиз), то катодом будет более электроотрицательным электродом, а анод – более электроположительным. Во избежание путаницы термины катод и анод чаще употребляют при рассмотрении электролиза, а при рассмотрении гальванических элементов белее употребляют термины «плюс» и «минус» для обозначения катода и анода, соответственно.
Рассмотрим в качестве примера три случая.
1. Оба электрода имеют общий раствор:
Pt, H 2 (г) | HCl(aq) | AgCl | Ag
(1) AgCl + e Ag + Cl – (aq);
(2) 2H + (aq) + 2 e H 2 (г).
Суммарная реакция, протекающая в элементе
AgCl + 0.5H 2 (г) Ag + HCl(aq).
Если ЭДС этого элемента положительна, то суммарная реакция будет протекать в прямом направлении, правый электрод будет более положительным – плюсом (катодом), а левый электрод – более отрицательным – минусом (анодом).
2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен);
Cd | Cd(NO 3) 2 (aq) ¦ NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e – Ag + Cl – (aq);
(2) Cd 2+ (aq) + 2 e Cd.
AgCl + 1/2Cd Ag + 1/2Cd 2+ (aq) + Cl – (aq).
3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен).
Pt | H 2 (г) | HCl(aq) || NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e Ag + Cl – (aq);
(2) 2H + (aq) + 2 e – H 2 (г).
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2H 2 (г) Ag + H + (aq) + Cl – (aq).
Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E.
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент (рис.4).
Разность потенциалов на концах этой цепи складывается из трех гальвани-потенциалов:
![]() . (3.32)
. (3.32)
В общем виде в формировании ЭДС гальванического элемента участвуют не только скачки потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов – так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов – диффузионный потенциал.
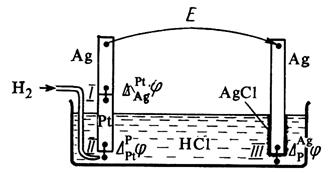
Рис. 4. Гальванический элемент, составленный из водородного
и хлоридсеребряного электродов.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO 3).
Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения гальвани-потенциалов на границе раздела фаз в гальваническом элементе, значение Эдс гальванического элемента вычисляют как разность двух условных электродных потенциалов:
E = E п – E л, (3.33)
где E п– потенциал правого электрода, E л – потенциал левого.
Химические цепи
Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) - окисление, на более положительном (катоде) - восстановление.
Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля - Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой:
Cu | Zn | ZnSO 4 (aq) ¦ CuSO 4 (aq) | Cu.
(1) Cu 2+ (aq) + 2 e – Cu;
(2) Zn 2+ (aq) + 2 e – Zn.
Суммарная реакция, протекающая в элементе
Zn + Cu 2+ (aq) Cu + Zn 2+ (aq).
ЭДС этого элемента
где ![]() .
.
Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля - Якоби.
Химические цепи с одним электролитом могут быть двух видов.
В цепях первого вида один электрод обратим относительно катиона, другой - относительно аниона. Например, элемент
Cd | CdCl 2 (aq) | AgCl | Ag
Он используется для определения среднего коэффициента активности электролита CdCl 2 . Рассчитаем ЭДС этого элемента.
где – средняя активность раствора CdCl 2 .
В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент
Hg | Hg 2 Cl 2 | KCl (aq) | Cl 2 (г) | Pt
Выражение для ЭДС этого элемента равно:
Если создать условия, при которых , то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
Примеры решения задач
Пример 1. Укажите знаки электродов и их тип, напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения процессов, протекающих в гальваническом элементе, схема которого:
Ni½NiSO 4 aq║ CoSO 4 aq½Co.
Вычислите ЭДС этого элемента, если а = 0,001 М, а = 1 М. Стандартные потенциалы электродов соответственно равны: = – 0,25 В; = – 0,28 В. Будет ли такой элемент работать самопроизвольно?
1. Так как стандартный потенциал электрода более положительный, чем у электрода , знаки у электродов такие:
(+) Ni½NiSO 4 aq║ CoSO 4 aq½Co (–).
Это электроды первого рода.
2. На электроде, имеющем более положительный потенциал (), происходит отдача электронов, то есть процесс окисления. Этот электрод называется анодом.
На электроде, имеющем более отрицательный потенциал (), происходит принятие электронов, то есть процесс восстановления. Этот электрод называется катодом.
Процессы, протекающие на электродах в гальваническом элементе:
_______________________________
Молекулярное уравнение: .
3. ЭДС элемента равна:
Е = Е + – Е- = – .
= + = – 0,28 + (0,059/2)lg1= – 0,28 В.
= + = – 0,25 + (0,059/2)lg0,001= – 0,34 В.
Е = – 0,28 – (– 0,34)= 0,06 В.
Так как ЭДС элемента положительная величина, то элемент работает самопроизвольно, так как .
Пример 2. М ожет ли самопроизвольно протекать реакция
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное и молекулярное уравнения. Определите ЭДС этого элемента при активности ионов в растворе, равных 1.
1. Составим гальванический элемент из двух электродов первого рода и . Согласно литературным данным = +0,22 В, а = – 0,40 В, поэтому схема гальванического элемента имеет вид:
Cd½ CdCl 2 (aq) || BiCl 2 (aq) Bi.
2. В гальваническом элементе на отрицательном электроде () протекает реакция окисления кадмия, а на положительном электроде () процесс восстановления иона висмута:
Ионно-молекулярное уравнение: .
Молекулярное уравнение: .
3. Так как активности ионов равны единицы, то электродные потенциалы будут равны стандартным электродным потенциалам. ЭДС элемента равна:
Е = – = +0,22 – (-0,40) = + 0,62 В > 0.
D r G = – zFЕ. Следовательно, D r G > 0 и рассматриваемая реакция
может протекать самопроизвольно.
Пример 3. Вычислить при 298 К ЭДС следующего элемента:
Zn ½ZnCl 2 aq ║ СdCl 2 aq ½Cd
C¢ =0,005 М С²=2 М
Стандартные потенциалы электродов Cd 2+ ½Cd и Zn 2+ ½Zn соответственно равны (– 0,402) и (– 0,763) В. Средние коэффициенты активности CdCl 2 и ZnCl 2 в растворах указанных концентраций равны 0,044 и 0,789. Можно ли за счет изменения концентрации ионов кадмия и цинка в растворах изменить направление тока в элементе?
Решение.Имеется электрохимический элемент, составленный из двух разных электродов первого рода. Сравнивая значения стандартных электродных потенциалов этих электродов, видим, что цинковый электрод в этой цепи электрод отрицательный (Е 0 = – 0,763 В), а кадмиевый – положительный (Е 0 = – 0,402 В).
На электродах протекают реакции:
(–) Zn = Zn 2+ +2 ,
(+) Cd 2+ +2 =Cd.
Суммарная реакция, протекающая при работе электрохимического элемента:
Zn + Cd 2+ = Zn 2+ + Cd.
Значения потенциалов каждого электрода равны:
![]() ;
;
![]() .
.
Значение ЭДС элемента равно:
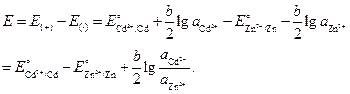
Подставим численные значения, учитывая, что активности ионов равны средней активности э соответствующих электролитов
где .
Для изменения направления тока в элементе, нужно, чтобы Е (–) стало больше Е (+) , т. е. чтобы Е стало отрицательным. Вычислим вначале, при каком отношении активностей ионов кадмия и цинка в растворе потенциалы электродов станут равными. В этом случае ЭДС примет значение, равное нулю.
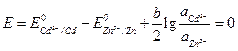 .
.
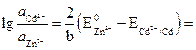
![]() .
.
Следовательно:
 или .
или .
Результат расчета показывает, что изменением концентраций не может быть достигнуто даже равенство потенциалов, поскольку активность ионов цинка должна быть более чем в 10 12 раз больше активности ионов кадмия в растворе. Такие условия практически невозможно реализовать.
Пример 4. Разбавленный раствор FеС1 3 в 0,5 М НС1 (f ± HCl = +0,757) взбалтывается с ртутью (при 298 К), при этом протекает реакция
Fe 3+ + Hg + Cl - = Fe 2+ + 1/2 Hg 2 Cl 2
Определите отношение активностей / после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl – /Hg 2 Cl 2 , Hg и
Fe 3+ , Fe 2+ /Pt относительно стандартного водородного электрода равны 0,268 и 0,771 В.
Решение. Составим электрохимический элемент, в котором бы протекала требуемая по условию реакция. Выберем каломельный и окислительно‑восстановительный железный электроды. По числовым значениям стандартных электродных потенциалов делаем вывод, что отрицательным будет каломельный электрод, а положительным – железный окислительно‑восстановительный. Запишем цепь:
(–) Hg, Hg 2 CI 2 | Cl – || Fe 3+ , Fe 2+ | Pt (+)
Электродные реакции, проотекающие в этом электрохимическом элементе
(–) Hg + Cl - = 1/2 Hg 2 Cl 2 + е -
(+) Fe 3+ + е - = Fe 2+
и суммарную реакцию, протекающую при работе составленного нами электрохимического элемента,
Hg + Fe 3+ + Cl - = Fe 2+ + ½ Hg 2 Cl 2 .
Сравнивая эту реакцию с реакцией, указанной по условию задачи и протекающей в колбе при взбалтывании FеС1з в НС1 с ртутью, делаем вывод, что реакции идентичны.
Запишем выражения для электродных потенциалов и ЭДС элемента:
![]()
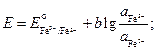
 .
.
По условию задачи требуется найти отношение активностей ионов железа после установления равновесия. Учтем, что электрохимический элемент работает до наступления равновесия, при этом ЭДС становится равной нулю:

Выразим отсюда отношения активностей ионов железа:

Учитывая, что активность хлорид-ионов равна средней активности хлороводорода
где для HCl. Отсюда

Вопросы для самоконтроля
1. Дайте определение термина стандартный электродный потенциал и объясните причину возникновения разности потенциалов между каким-либо металлом и раствором одной из его солей.
2. В химическом источнике тока
Pt½Fe +2 , Fe +3 ║ Ag + ½ Ag
протекает реакция:
Fe +2 (раств) + Ag + (раств) = Fe +3 (раств) + Ag (тв) .
Какое влияние (увеличение, уменьшение или отсутствие эффекта) должны оказать на напряжение источника тока следующие изменения:
а) увеличение концентрации Fe +3 (раств) ;
б) одновременное увеличение концентрации Fe +3 (раств) и Fe +2 (раств) в одинаковое число раз;
в) добавление твердого серебра;
г) добавление некоторого количества NaCl в раствор, где имеются ионы серебра.
3. Как определить направление самопроизвольного химического превращения при протекании процессов в электрохимическом элементе? Дайте обоснованный ответ, в каком направлении будет протекать самопроизвольно реакция:
4.Объясните, какой смысл имеют разделяющие знаки (½и║) в схематической записи химического источника тока:
Zn ½ZnSO 4 aq ║ CuSO 4 aq ½Cu
Укажите, где в этой схеме анод, а где катод? Объясните смысл терминов анод и катод и укажите на схеме направление потока электронов во внешней цепи.
5. Что должно произойти при введении ионов (в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов: = 0,76 В; =1,52 В.
Концентрационные цепи
Гальванические элементы второго типа – концентрационные цепи представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны. Электрическая энергия в концентрационных элементах вырабатывается за счет выравнивания концентраций веществ.
Различают концентрационные цепи без переноса и с переносом. Концентрационными цепями без переноса называются элементы:
а) с одинаковыми электродами, но с разными концентрациями электролитов при отсутствии непосредственного соприкосновения между растворами;
б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации, опущенными в один раствор электролита;
в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа (с одним раствором электролита).
Примером концентрационной цепи без переноса может служить амальгамная концентрационная цепь:
где a1 и a2 – активности кадмия в амальгаме.
На электродах этого концентрационного элемента протекают следующие электрохимические реакции:
Суммарная реакция в элементе - ![]() .
.
ЭДС этого элемента вырабатывается за счет выравнивания активности кадмия в амальгамах ():
Концентрационными цепями с переносом называются такие концентрационные элементы, в которых имеется непосредственная граница соприкосновения между растворами. На границе между растворами двух одинаковых электролитов разной концентрации, в результате разной подвижности катионов и анионов, возникает так называемый диффузионный потенциал
Например,
Cu | CuSO 4 ¦ CuSO 4 | Cu
где и - различные активности ионов меди на электродах, j D - диффузионный потенциал, возникающий на границе растворов.
Запишем потенциалы обоих электродов:
![]() . (3.38)
. (3.38)
Тогда ЭДС элемента будет
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС. Существует несколько соотношений для расчета ЭДС гальванического элемента с учетом диффузионного потенциала.
1. Если электроды обратимы относительно катиона, то ЭДС гальванического элемента будет равна:
![]() , (3.40)
, (3.40)
где t – –число переноса анионов, n – общее число формульных частиц, составляющих данный электролит (общее число ионов, на которые распадается электролит), n + - число формульных частиц катионов(число катионов, на которые диссоциирует электролит), составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению: .

Откуда с 1 = 0,68 М.
Вопросы для самоконтроля
1. Сколько электродов может входить в состав концентрационного элемента?
2. Чем отличаются концентрационные элементы с переносом ионов от концентрационных элементов без переноса ионов?
3. Концентрационный элемент имеет вид:
K(Hg)|KCl(aq)|AgCl,Ag,AgCl|KCl(aq)|K(Hg)
Сколько гальванических элементов в его составе? Оцените знаки элементов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента?
4. Концентрационный элемент имеет вид:
Hg, HgO|KOH(aq)|KOHaq)|HgO,Hg.
К какому типу относится этот концентрационный элемент? Оцените знаки электродов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента?
5. Как связана ЭДС элемента с константами диссоциации электролитов CH 3 COOH и HCOOH?. К какому типу гальванических элементов относится данный элемент и почему?
H 2 ,Pt |CH 3 COOH(aq)|HCOOH(aq)| Pt, H 2 ,
ЛАБОРАТОРНАЯ РАБОТА № 9
Определение электродных потенциалов металлов и ЭДС гальванических элементов.
I. Разделы теоретического курса для повторения.
Возникновение скачка потенциала на границах раздела металл - вода, металл - раствор соли металла. Стандартный водородный электрод. Понятие о гальванических элементах и процессах, протекающих на электродах. Стандартные электродные потенциалы металлов. Ряд стандартных электродных потенциалов. Выводы из положения металла в ряду. Уравнение Нернста. Обратимые и необратимые электроды. Металлические электроды I и II рода, окислительно-восстановительные электроды, газовые электроды. Электроды сравнения. Химические и концентрационные гальванические элементы. Электродвижущая сила (ЭДС) гальванических элементов. Процессы, протекающие на электродах при работе гальванического элемента.
3. Вопросы и упражнения.
1. Чему равен потенциал серебряного электрода, погруженного в раствор соли серебра с концентрацией
См = 10-2 моль/л?
2. Как зависит величина потенциала водородного электрода от рН среды? Чему равен потенциал водородного электрода при рН = I; рН = 7, рН = 10?
3. Рассчитайте потенциал стандартного серебряного электрода по отношению к:
а) насыщенному каломельному электроду,
б) насыщенному медно - сульфатному электроду,
в) насыщенному хлорсеребряному электроду?
4. Составьте схемы гальванических элементов, в которых протекают реакции:
а) 2 Ag + + Cu 0 → Ag 0 + Cu +2
б) Cd 0 + CuSO 4 → CdSO 4 + Cu
5. Определите величину ЭДС и укажите процессы, протекающие на электродах в следующих гальванических элементах:
а) Zn / ZnS О4 // CdS О4 / С d
б) Р b / Р b (NO з)2) // AgN О3/ Ag
6. Рассчитайте ЭДС следующего концентрационного гальванического элемента:
а) Zn / ZnCI 2 // ZnCI 2 / Zn
0,01 моль/л 1,0 моль/л
Какой из электродов является анодом , а какой - катодом?
3. Экспериментальная часть
1. Определение величины стандартного электродного потенциала цинка.
Соберите цинковый электрод (Zn / ZnSO 4 ) , погрузив хорошо зачищенный наждачной бумагой цинковый стержень в раствор соли с концентрацией ионов цинка I моль/л.
Рис. I . Схема установки для определения величины электродного потенциала металла.
1 - исследуемый электрод (цинковый, медный и др.)
2 - хлорсеребряный электрод сравнения
3 - потенциометр.
4 - стаканчик насыщенным раствором хлорида калия
В соответствии с рис.1, соберите гальванический элемент из исследуемого цинкового электрода (Zn / ZnSO 4 ) и насыщенного хлорсеребряного электрода сравнения (KCl / AgCl / Ag ) :
Условная запись этого гальванического элемента:
(-) Zn/ZnSO4//KCl/AgCl/Ag (+)
Для этого носики электродов погружают в стаканчик с раствором хлорида калия, а сами электроды с помощью соединительных проводов подключают к соответствующим клеммам потенциометра.
Потенциал насыщенного хлорсеребряного электрода сравнения по отношению к стандартному водородному электроду равен +0,201В.
Ехл. сер. нас. = +0,201В или 201мВ.
В соответствии с инструкцией о порядке измерений при использовании соответствующего потенциометра определите ЭДС составленного гальванического элемента и потенциал цинкового электрода по насыщенному хлорсеребряному электроду.
Зная величину потенциала электрода сравнения, рассчитайте величину потенциала цинкового электрода по отношению к стандартному водородному электроду. Сравните полученное значение с табличным значением:
E 0 = - 0,76 B .
Запишите найденные значения:
Измеренное значение Э. Д.С. гальванического элемента, составленного из стандартного цинкового электрода и насыщенного хлорсеребряного электрода сравнения:
Э. Д.С. (Zn / ZnSO 4 // KCl / AgCl / Ag ) =
Экспериментальное значение потенциала стандартного цинкового электрода по отношению к насыщенному хлорсеребряному электроду сравнения:
E () по хлор - серебряному насыщ.. =
Экспериментальное значение потенциала стандартного цинкового электрода по отношению к стандартному водородному электроду сравнения:
E () по стандартному водородному. =
Внимание! Учитывая высокую токсичность солей тяжелых металлов, все отработанные растворы не сливаются в раковину, а сдаются лаборанту для последующей утилизации.
2. Определение величины стандартного электродного потенциала меди.
Аналогично п. I, соберите медный электрод, погрузив зачищенный медный стержень в I M раствор сульфата меди.
Составьте гальванический элемент из исследуемого медного электрода и насыщенного хлорсеребяного электрода сравнения.
Определите ЭДС гальванического элемента. Приведите условную запись для данного гальванического элемента.
Чему равен потенциал медного электрода по насыщенному хлорсеребряному электроду?
Рассчитайте потенциал медного электрода по отношению к стандартному водородному электроду и сравните его с табличным значением стандартного электродного потенциала меди:
E 0 = 0,34 B
Запишите найденные значения:
Э. Д.С. (С u / CuSO 4 // KCl / AgCl / Ag ) =
E () по хлор - серебряному насыщ.. =
E () по стандартному водородному электроду =
3. Определение ЭДС химического гальванического элемента. (Медно – цинковый гальванический элемент).
Соберите гальванический элемент, составленный из стандартного цинкового и стандартного медного электродов (рис.2).
Э. Д.С.(С u / CuSO 4 // Zn / ZnSO 4 )эксп. =………..
Сравните полученное в эксперименте значение с расчетным (теоретическим) значением ЭДС для медно - цинкового гальванического элемента:
ЭДС теорет. = E катода –Е анода =
= E0(Cu+2/Cu0) - E0(Zn+2/Zn0) = 0,34 –(- 0,76) = 1,1B.
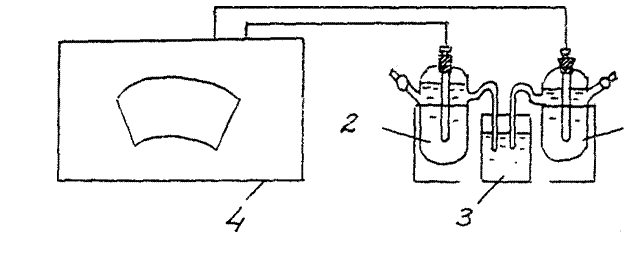 Рис.2 Схема установки для определения ЭДС химического гальванического элемента:
Рис.2 Схема установки для определения ЭДС химического гальванического элемента:
1 – медный электрод, 2 – цинковый электрод
3 - электролитический ключ (стаканчик с раствором хлорида калия),
4 - потенциометр
Напишите уравнения процессов, протекающих на катоде и аноде данного гальванического элемента при его работе.
4. Определение ЭДС концентрационного гальванического элемента.
Соберите гальванический элемент, составленный из стандартного цинкового электрода (цинковый электрод, погружен в раствор соли цинка с концентрацией 1 моль/л) и цинкового электрода, погруженного в раствор соли цинка с концентрацией См = 10-2 моль/л (рис.3).
Zn / ZnSO 4 // Zn / ZnSO 4
См = 10-2 моль/л См = 10-2 моль/л
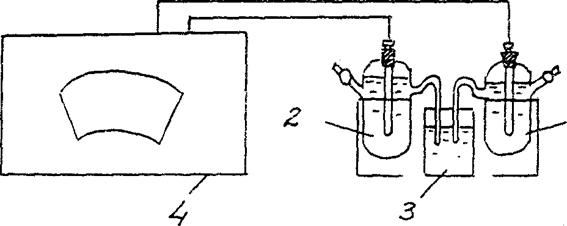
Рис.2 Схема установки для определения ЭДС концентрационного гальванического элемента:
1 – цинковый электрод в растворе соли с См = 10-2 моль/л ,
2 – цинковый электрод в растворе соли с См = 1 моль/л
3 - электролитический ключ (раствор хлорида калия),
4 - потенциометр
В соответствии с инструкцией о порядке измерений с использованием соответствующего потенциометра, определите ЭДС данного гальванического элемента.
Э. Д.С.(С u / CuSO 4 // Zn / ZnSO 4 )эксп. =………..
Сравните полученное в эксперименте значение с расчетным (теоретическим) значением ЭДС для данного концентрационного гальванического элемента.




