يتكون الفينول بالتفاعل. الحصول على الفينول
1. الفينولات- مشتقات الهيدروكربونات العطرية ، في جزيئاتها ترتبط مجموعة الهيدروكسيل (-OH) مباشرة بذرات الكربون في حلقة البنزين.
2. تصنيف الفينولات
هناك واحد ، اثنان ، ثلاث ذرات فينولات اعتمادًا على عدد مجموعات OH في الجزيء:
وفقًا لعدد الدورات العطرية المنصهرة في الجزيء ، يتم تمييز الفينولات نفسها (حلقة عطرية واحدة - مشتقات البنزين) ، النفثول (حلقتان مصهورتان - مشتقات النفثالين) ، الأنثرانول (3 حلقات مدمجة - مشتقات الأنثراسين) والفينانترول:
3. الايزومرية وتسميات الفينولات
هناك نوعان من التماكب:
- تماثل موضع البدائل في حلقة البنزين
- ايزومرية السلسلة الجانبية (هياكل جذور الألكيل وعدد الجذور)
بالنسبة للفينولات ، تستخدم الأسماء التافهة التي تطورت تاريخيًا على نطاق واسع. تستخدم البادئات أيضًا في أسماء الفينولات أحادية النواة المستبدلة أورثو-,ميتاو زوج -،تستخدم في تسميات المركبات العطرية. بالنسبة للمركبات الأكثر تعقيدًا ، يتم ترقيم الذرات التي تتكون منها الحلقات العطرية ويشار إلى موضع البدائل باستخدام المؤشرات الرقمية.
4. هيكل الجزيء
تؤثر مجموعة فينيل C 6 H 5 - وهيدروكسيل-OH على بعضهما البعض
- ينجذب زوج الإلكترون الوحيد من ذرة الأكسجين بواسطة سحابة 6 إلكترون من حلقة البنزين ، مما يجعل رابطة O - H أكثر استقطابًا. الفينول حمض أقوى من الماء والكحول.
- في حلقة البنزين ، ينكسر تناظر سحابة الإلكترون ، وتزداد كثافة الإلكترون في المواضع 2 ، 4 ، 6. وهذا يجعل روابط C-H في المواضع 2 ، 4 ، 6 أكثر تفاعلية و- روابط حلقة البنزين.
5. الخصائص الفيزيائية
معظم الفينولات أحادية الهيدرات في الظروف العادية هي مواد بلورية عديمة اللون مع نقطة انصهار منخفضة ورائحة مميزة. الفينولات ضعيفة الذوبان في الماء ، وقابلة للذوبان في المذيبات العضوية ، وسامة ، وتغمق تدريجياً عند تخزينها في الهواء نتيجة للأكسدة.
الفينول C 6 H 5 OH (حمض الكاربوليك ) - مادة بلورية عديمة اللون تتأكسد في الهواء وتتحول إلى اللون الوردي ، وفي درجات الحرارة العادية تكون قليلة الذوبان في الماء ، فوق 66 درجة مئوية ، يمكن الامتزاج مع الماء بأي نسبة. الفينول مادة سامة ، تسبب حروق الجلد ، مطهر.
6. الخصائص السامة
الفينول سام. يسبب خلل وظيفي في الجهاز العصبي. يؤدي الغبار والأبخرة ومحلول الفينول إلى تهيج الأغشية المخاطية للعينين والجهاز التنفسي والجلد. بمجرد دخوله الجسم ، يتم امتصاص الفينول بسرعة كبيرة حتى من خلال مناطق الجلد السليمة وبعد بضع دقائق يبدأ في العمل على أنسجة المخ. أولاً ، هناك إثارة قصيرة المدى ، ثم شلل في مركز الجهاز التنفسي. حتى عند التعرض لجرعات قليلة من الفينول ، يلاحظ العطس ، والسعال ، والصداع ، والدوخة ، والشحوب ، والغثيان ، وفقدان القوة. تتميز حالات التسمم الشديدة بفقدان الوعي ، والزرقة ، وضيق التنفس ، وحساسية القرنية ، والنبض السريع ، وبالكاد محسوس ، والعرق البارد ، والتشنجات في كثير من الأحيان. في كثير من الأحيان الفينول هو سبب السرطان.
7. تطبيق الفينولات
1. إنتاج الراتنجات الاصطناعية والبلاستيك والبولي أميد
2. الأدوية
3. الأصباغ
4. السطحي
5. مضادات الأكسدة
6. المطهرات
7. المتفجرات
8. الحصول على الفينول في صناعة
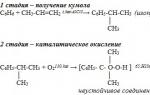
واحد). طريقة الكمون لإنتاج الفينول (اتحاد الجمهوريات الاشتراكية السوفياتية ، سيرجيف ب.ج. ، أودريس رو ، كروزهالوف ب.د ، 1949). مزايا الطريقة: تكنولوجيا غير النفايات (عائد المنتجات المفيدة> 99٪) والاقتصاد. حاليًا ، تُستخدم طريقة الكمون باعتبارها الطريقة الرئيسية في الإنتاج العالمي للفينول.

2). من قطران الفحم (كمنتج ثانوي - عائد منخفض):
C 6 H 5 ONa + H 2 SO 4 (razb) → C 6 H 5 - OH + NaHSO 4
فينولات الصوديوم
(صورة المنتجأحذية الراتنجالصودا الكاوية)
3). من هالوبنزين :
من 6 H 5 -Cl + هيدروكسيد الصوديوم ر , ص→ C 6 H 5 - أوه + كلوريد الصوديوم
4). اندماج أملاح أحماض السلفونيك العطرية مع القلويات الصلبة :
C 6 H 5 -SO 3 Na + NaOH ر → Na 2 SO 3 + C 6 H 5 - OH
ملح الصوديوم
أحماض بنزين سلفونيك
9. الخواص الكيميائية للفينول (حمض الكربوليك)
أنا . خصائص مجموعة الهيدروكسيل
خصائص الحمض- أكثر وضوحا من الكحول المشبع (لا يتغير لون المؤشرات):
- مع المعادن النشطة-
2C 6 H 5 -OH + 2Na → 2C 6 H 5 -ONa + H 2
فينولات الصوديوم
- مع القلويات-
C 6 H 5 -OH + هيدروكسيد الصوديوم (محلول مائي)↔ C 6 H 5 -ONa + H 2 O
! الفينولات - أملاح حمض الكربوليك الضعيف ، المتحللة بواسطة حمض الكربونيك -
C 6 H 5 -ONa + H 2 O +معO 2 → C 6 H 5 -OH + NaHCO3
من حيث الخصائص الحمضية ، يتفوق الفينول 10 مرات على الإيثانول. في الوقت نفسه ، يكون أقل من حمض الأسيتيك بنفس المقدار. على عكس الأحماض الكربوكسيلية ، لا يمكن للفينول أن يحل محل حمض الكربونيك من أملاحه.
ج 6 ح 5 - أوه + ناهكو 3 = لا يذهب التفاعل - كونه قابل للذوبان تمامًا في المحاليل المائية للقلويات ، فإنه في الواقع لا يذوب في محلول مائي من بيكربونات الصوديوم.
يتم تحسين الخصائص الحمضية للفينول تحت تأثير مجموعات سحب الإلكترون المرتبطة بحلقة البنزين ( لا 2 - , ش - )
2،4،6-ثلاثي نتروفينول أو حمض البيكريك أقوى من الكربونيك
ثانيًا . خصائص حلقة البنزين
1). يتجلى التأثير المتبادل للذرات في جزيء الفينول ليس فقط في سلوك مجموعة الهيدروكسي (انظر أعلاه) ، ولكن أيضًا في التفاعل الأكبر لحلقة البنزين. تزيد مجموعة الهيدروكسيل من كثافة الإلكترون في حلقة البنزين ، وخاصة في أورثو-و زوج-أحكام (+ م-تأثير مجموعة OH):
لذلك ، يكون الفينول أكثر نشاطًا من البنزين في تفاعلات الاستبدال الكهربية في الحلقة العطرية.
- نترات. تحت تأثير 20٪ حمض النيتريك HNO 3 ، يتم تحويل الفينول بسهولة إلى خليط أورثو-و زوج-النيتروفينول:
عند استخدام HNO 3 المركز ، يتم تكوين 2،4،6-ثلاثي نتروفينول ( حمض البكريك):
- الهلجنة. يتفاعل الفينول بسهولة مع ماء البروم في درجة حرارة الغرفة لتشكيل راسب أبيض 2،4،6-ثلاثي بروموفينول (تفاعل نوعي للفينول):
- التكثيف مع الألدهيدات. علي سبيل المثال:
2). هدرجة الفينول
C 6 H 5 -OH + 3H 2 ني، 170 درجةج→ ج 6 ح 11 - أوه كحول سيكلوهكسيل (سيكلوهكسانول)
الفينولات -المواد العضوية التي تحتوي جزيئاتها على شق فينيل مرتبط بواحدة أو أكثر من مجموعات الهيدروكسو. تمامًا مثل الكحوليات تصنف الفينولاتبالذرية ، أي بعدد مجموعات الهيدروكسيل.
الفينولات أحادية الذرةتحتوي على مجموعة هيدروكسيل واحدة في الجزيء:

الفينولات متعددة الهيدروكسيلتحتوي على أكثر من مجموعة هيدروكسيل في الجزيئات:

توجد أيضًا فينولات متعددة الهيدروكسيل تحتوي على ثلاث مجموعات هيدروكسيل أو أكثر في حلقة البنزين.
دعنا نتعرف بمزيد من التفصيل على هيكل وخصائص أبسط ممثل لهذه الفئة - الفينول C 6 H 5 OH. شكل اسم هذه المادة الأساس لاسم السجل النقدي بأكمله - الفينولات.
الخصائص الفيزيائية للفينول
الفينول مادة صلبة بلورية عديمة اللون ، درجة انصهارها = 43 درجة مئوية ، نقطة الغليان = 181 درجة مئوية ، لها رائحة مميزة حادة ، سام ، الفينول يذوب قليلاً في الماء عند درجة حرارة الغرفة. يسمى محلول مائي من الفينول حمض الكربوليك. عند ملامسته للجلد فإنه يسببالحروق، لذلك يجب التعامل مع الفينول بحذر شديد!
الخواص الكيميائية للفينول
 تكون الفينولات أكثر نشاطًا في معظم تفاعلات روابط O - H ، نظرًا لأن هذه الرابطة أكثر قطبية بسبب تحول كثافة الإلكترون من ذرة الأكسجين نحو حلقة البنزين (مشاركة زوج الإلكترون الوحيد من ذرة الأكسجين في اقتران p النظام). حموضة الفينولات أعلى بكثير من حموضة الكحول. بالنسبة للفينولات ، فإن تفاعلات كسر رابطة C-O ليست نموذجية ، حيث أن ذرة الأكسجين مرتبطة بقوة بذرة الكربون في حلقة البنزين بسبب مشاركة زوج الإلكترون الوحيد في نظام الاقتران. يتجلى التأثير المتبادل للذرات في جزيء الفينول ليس فقط في سلوك مجموعة الهيدروكسي ، ولكن أيضًا في التفاعل الأكبر لحلقة البنزين. تزيد مجموعة الهيدروكسيل من كثافة الإلكترون في حلقة البنزين ، خاصة في مواضع ortho و para (مجموعات OH)
تكون الفينولات أكثر نشاطًا في معظم تفاعلات روابط O - H ، نظرًا لأن هذه الرابطة أكثر قطبية بسبب تحول كثافة الإلكترون من ذرة الأكسجين نحو حلقة البنزين (مشاركة زوج الإلكترون الوحيد من ذرة الأكسجين في اقتران p النظام). حموضة الفينولات أعلى بكثير من حموضة الكحول. بالنسبة للفينولات ، فإن تفاعلات كسر رابطة C-O ليست نموذجية ، حيث أن ذرة الأكسجين مرتبطة بقوة بذرة الكربون في حلقة البنزين بسبب مشاركة زوج الإلكترون الوحيد في نظام الاقتران. يتجلى التأثير المتبادل للذرات في جزيء الفينول ليس فقط في سلوك مجموعة الهيدروكسي ، ولكن أيضًا في التفاعل الأكبر لحلقة البنزين. تزيد مجموعة الهيدروكسيل من كثافة الإلكترون في حلقة البنزين ، خاصة في مواضع ortho و para (مجموعات OH)
الخصائص الحمضية للفينول
ذرة الهيدروجين في مجموعة الهيدروكسيل حمضية. لان نظرًا لأن الخصائص الحمضية للفينول أكثر وضوحًا من خصائص الماء والكحول ، فإن الفينول يتفاعل ليس فقط مع الفلزات القلوية ، ولكن أيضًا مع القلويات لتكوين الفينولات:

تعتمد حموضة الفينولات على طبيعة البدائل (مانح أو متقبل لكثافة الإلكترون) ، والموقع بالنسبة لمجموعة OH ، وعدد البدائل. يتم التأثير الأكبر على حموضة الفينولات OH من قبل المجموعات الموجودة في المواضع التقويمية والشبهية. يزيد المانحون من قوة رابطة O-H (مما يقلل من تنقل الهيدروجين والخصائص الحمضية) ، ويقلل المتقبلون من قوة رابطة O-H ، بينما تزداد الحموضة:

ومع ذلك ، فإن الخصائص الحمضية للفينول أقل وضوحًا من تلك الموجودة في الأحماض غير العضوية والكربوكسيلية. لذلك ، على سبيل المثال ، فإن الخصائص الحمضية للفينول أقل بحوالي 3000 مرة من تلك الخاصة بحمض الكربونيك. لذلك ، من خلال تمرير ثاني أكسيد الكربون عبر محلول مائي من فينولات الصوديوم ، يمكن عزل الفينول الحر.

تؤدي إضافة حمض الهيدروكلوريك أو الكبريتيك إلى محلول مائي لفينولات الصوديوم أيضًا إلى تكوين الفينول:

رد فعل نوعي للفينول
يتفاعل الفينول مع الحديد (3) كلوريد لتكوين مركب مركّب أرجواني مكثف. يسمح هذا التفاعل باكتشافه حتى بكميات محدودة للغاية. كما تعطي الفينولات الأخرى التي تحتوي على مجموعة هيدروكسيل واحدة أو أكثر في حلقة البنزين لونًا أزرق بنفسجيًا ساطعًا في التفاعل مع الحديد (3) كلوريد.
تفاعلات حلقة البنزين من الفينول
إن وجود بدائل الهيدروكسيل يسهل بشكل كبير مسار تفاعلات الاستبدال الكهربية في حلقة البنزين.
- بروم الفينول.على عكس البنزين ، لا تتطلب المعالجة ببروم الفينول إضافة عامل مساعد (بروميد الحديد (3)). بالإضافة إلى ذلك ، يستمر التفاعل مع الفينول بشكل انتقائي (انتقائي): يتم إرسال ذرات البروم إلى أورثو-و زوج-المواقف ، لتحل محل ذرات الهيدروجين الموجودة هناك. يتم شرح انتقائية الاستبدال من خلال ميزات التركيب الإلكتروني لجزيء الفينول الذي تمت مناقشته أعلاه.
لذلك ، عندما يتفاعل الفينول مع ماء البروم ، يتكون راسب أبيض من 2،4،6-ثلاثي بروموفينول:

يعمل هذا التفاعل بالإضافة إلى التفاعل مع كلوريد الحديد (3) على الكشف النوعي عن الفينول.
2.نترات الفينوليحدث أيضًا بسهولة أكبر من نترات البنزين. التفاعل مع حمض النيتريك المخفف يحدث عند درجة حرارة الغرفة. والنتيجة هي خليط أورثو-و باروايزومرات النيتروفينول:

عند استخدام حمض النيتريك المركز ، 2 ، 4 ، 6 ، حمض ثلاثي نيتريتفينول-بيكريك ، يتم تشكيل مادة متفجرة:

3. هدرجة الحلقة العطرية للفينولفي وجود محفز يمر بسهولة:

4.تكاثف الفينول مع الألدهيدات ،على وجه الخصوص ، يحدث مع الفورمالديهايد مع تكوين منتجات التفاعل - راتنجات الفينول فورمالدهيد والبوليمرات الصلبة.
يمكن وصف تفاعل الفينول مع الفورمالديهايد بالمخطط:

يحتفظ الجزيء الثنائى بذرات الهيدروجين "المتنقلة" ، مما يعني أن التفاعل يمكن أن يستمر أكثر مع كمية كافية من الكواشف:

رد فعل متعدد التكثيف ،هؤلاء. تفاعل إنتاج البوليمر ، الذي يبدأ بإطلاق منتج ثانوي منخفض الجزيئي (الماء) ، يمكن أن يستمر أكثر (حتى يتم استهلاك أحد الكواشف بالكامل) مع تكوين جزيئات ضخمة. يمكن وصف العملية بالمعادلة الشاملة:

يحدث تكوين الجزيئات الخطية في درجة الحرارة العادية. يؤدي إجراء نفس التفاعل أثناء التسخين إلى حقيقة أن المنتج الناتج له بنية متفرعة ، وهو صلب وغير قابل للذوبان في الماء. ونتيجة لتسخين راتنج الفينول فورمالدهايد لهيكل خطي مع وجود فائض من الألدهيد ، والبلاستيك الصلب يتم الحصول على الجماهير ذات الخصائص الفريدة. تستخدم البوليمرات القائمة على راتنجات الفينول فورمالدهايد في صناعة الورنيش والدهانات والمنتجات البلاستيكية المقاومة للتدفئة والتبريد والماء والقلويات والأحماض ، ولها خصائص عازلة عالية. تُستخدم البوليمرات القائمة على راتنجات الفينول فورمالدهايد في صنع الأجزاء الأكثر أهمية والأكثر أهمية من الأجهزة الكهربائية ، وأغلفة وحدات الطاقة وأجزاء الماكينة ، وقاعدة البوليمر للوحات الدوائر المطبوعة لأجهزة الراديو. المواد اللاصقة التي تعتمد على راتنجات الفينول فورمالدهايد قادرة على ربط الأجزاء ذات الطبيعة المختلفة بشكل موثوق به ، مما يحافظ على أعلى قوة للتماسك في نطاق درجة حرارة واسع جدًا. تستخدم هذه المادة اللاصقة لربط القاعدة المعدنية لمصابيح الإضاءة بمصباح زجاجي ، وبالتالي يتم استخدام الفينول والمنتجات القائمة عليه على نطاق واسع.
استخدام الفينولات
الفينول مادة صلبة لها رائحة مميزة تسبب الحروق عند ملامستها للجلد. سام. يذوب في الماء ويسمى محلول حمض الكربوليك (مطهر). كانت أول مطهر يتم إدخاله في الجراحة. يستخدم على نطاق واسع لإنتاج البلاستيك والأدوية (حمض الساليسيليك ومشتقاته) والأصباغ والمتفجرات.
الفينول، مادة كيميائية ذات أصل عضوي ، تنتمي إلى مجموعة الهيدروكربونات العطرية.
في عام 1842 ، تمكن العضوي الفرنسي Auguste Laurent من اشتقاق صيغة الفينول (C6H5OH) ، والتي تتكون من حلقة بنزين ومجموعة هيدروكسي OH. الفينول له العديد من الأسماء التي تستخدم في كل من المؤلفات العلمية والكلام العامية ، ونشأت من تكوين هذه المادة. وهكذا ، غالبا ما يطلق على الفينول أوكسي بنزينأو حمض الكاربوليك.
الفينول سام. يعمل محلول الغبار والفينول على تهيج الأغشية المخاطية للعينين والجهاز التنفسي والجلد. تمتلك خصائص حمضية طفيفة ، تحت تأثير القلويات تشكل أملاح - الفينولات. تحت تأثير البروم ، يتم تكوين ثلاثي بروموفينول ، والذي يستخدم للحصول على مطهر - زيروفورم. تؤثر نواة البنزين ومجموعة OH مجتمعة في جزيء الفينول على بعضهما البعض ، مما يزيد بشكل كبير من تفاعل بعضهما البعض. تكتسب تفاعلات تكثيف الفينولات مع الألدهيدات والكيتونات أهمية خاصة ، ونتيجة لذلك يتم الحصول على منتجات البوليمر.
الخصائص الفيزيائية للفينول
الخواص الكيميائية للفينول
الفينول مادة بلورية بيضاء ذات رائحة سكرية حادة مميزة ، والتي تتأكسد بسهولة عند تعرضها للهواء ، وتتحول إلى اللون الوردي في البداية ، وبعد فترة من الوقت يتحول إلى اللون البني الغني. تتمثل إحدى سمات الفينول في قابليته الممتازة للذوبان ليس فقط في الماء ، ولكن أيضًا في الكحول والوسط القلوي والبنزين والأسيتون. بالإضافة إلى ذلك ، يحتوي الفينول على نقطة انصهار منخفضة جدًا ويسال بسهولة عند +42 درجة مئوية ، وله أيضًا خصائص حمضية ضعيفة. لذلك ، عند التفاعل مع القلويات ، فإن الفينول يشكل أملاح تسمى الفينولات.
اعتمادًا على تقنية الإنتاج والغرض منه ، يتم إنتاج الفينول في ثلاث درجات: A و B و C وفقًا لـ GOST 23519-93. فيما يلي المواصفات الفنية.
الخصائص التقنية للفينول وفقًا لـ GOST 23519-93
|
اسم المؤشر |
المعنى | ||
| الصف أ | مارك ب | درجة ب | |
| مظهر | أبيض بلوري مستوى |
الكريستال الأبيض- تشيسكي في الداخل. مسموح وردي أو مسحة صفراء |
|
| درجة حرارة التبلور ، درجة مئوية ، ليست أقل | 40,7 | 40,6 | 40,4 |
| الكسر الكتلي للبقايا غير المتطايرة ،٪ ، كحد أقصى | 0,001 | 0,008 | 0,01 |
| الكثافة البصرية لمحلول مائي من الفينول (8.3 جرام العلامة التجارية أ ، 8.0 جرام العلامة التجارية ب ، 5.0 جرام العلامة التجارية ج في 100 سم 3 من الماء) عند 20 درجة مئوية ، لا أكثر |
0,03 | 0,03 | 0,03 |
| الكثافة الضوئية للفينول المسلفن لا تزيد عن | 0,05 | لا تقنين | |
| يذوب لون الفينول حسب الكوبالت البلاتيني مقياس ، وحدات هازن: |
|||
| من الشركة المصنعة ، لا أكثر | 5 | لا تقنين | |
| لدى المستهلك: | |||
| أثناء النقل عبر خطوط الأنابيب و خزانات الفولاذ المقاوم للصدأ ، لا أكثر |
10 | نفس | |
| عند نقلها في صهاريج مصنوعة من الكربون الصلب والمجلفن ، لا أكثر |
20 | >> | |
| جزء كبير من الماء ،٪ ، لا أكثر | 0,03 | لا تقنين | |
| الكسر الكتلي للشوائب العضوية الكلية ،٪ ، كحد أقصى | 0,01 | لا تقنين | |
| بما في ذلك أكسيد mesityl ،٪ ، لا أكثر | 0,0015 | 0,004 | لا تقنين |
| مبالغ ميثيل ستيرين وأيزوبروبيل بنزين (كيومين) ،٪ ، كحد أقصى | لا تقنين | 0,01 | نفس |
طرق الحصول على الفينول
في شكله النقي ، لا يوجد الفينول في الطبيعة ؛ إنه منتج اصطناعي للكيمياء العضوية. حاليًا ، هناك ثلاث طرق رئيسية للحصول على الفينول على نطاق صناعي. تقع الحصة الرئيسية من إنتاجها على ما يسمى طريقة cumpole ، والتي تتضمن أكسدة مركب عضوي عطري إيزوبروبيل بنزين بالهواء. نتيجة لتفاعل كيميائي ، يتم الحصول على هيدروبيروكسيد الكومبول ، والذي ، عند التفاعل مع حمض الكبريتيك ، يتحلل إلى أسيتون ، يليه ترسيب الفينول على شكل راسب بلوري. يستخدم ميثيل بنزين (التولوين) أيضًا للإنتاج ، نتيجة للأكسدة التي تتكون منها هذه المادة الكيميائية وحمض البنزويك. بالإضافة إلى ذلك ، في بعض الصناعات ، مثل إنتاج فحم الكوك المعدني ، يتم إطلاق الفينول من قطران الفحم. ومع ذلك ، فإن طريقة الإنتاج هذه غير مربحة بسبب زيادة استهلاك الطاقة. من بين أحدث إنجازات الصناعة الكيميائية إنتاج الفينول عن طريق تفاعل البنزين وحمض الخليك ، وكذلك الكلورة المؤكسدة للبنزين.
لأول مرة في الأحجام الصناعية ، حصلت شركة BASF الألمانية على الفينول في عام 1899 ، عن طريق كبريتنة البنزين بحمض الكبريتيك. تتكون تقنية إنتاجها من حقيقة أن حمض السلفونيك تعرض لاحقًا للذوبان القلوي ، مما أدى إلى تكوين الفينول. تم استخدام هذه الطريقة لأكثر من 100 عام ، ولكن في النصف الثاني من القرن العشرين ، اضطرت الصناعة الكيميائية للتخلي عنها بسبب الكمية الهائلة من نفايات كبريتيت الصوديوم ، والتي كانت نتيجة ثانوية للتخليق العضوي لـ الفينول.
في النصف الأول من القرن العشرين ، قدمت الشركة الأمريكية Dow Chemical طريقة أخرى لإنتاج الفينول ، عن طريق كلورة البنزين ، والتي كانت تسمى عملية Raschig. تبين أن الطريقة فعالة للغاية ، حيث وصلت الثقل النوعي للمادة الناتجة إلى 85٪. في وقت لاحق ، قدمت نفس الشركة طريقة أكسدة ميثيل بنزول مع التحلل اللاحق لحمض البنزويك ، ومع ذلك ، بسبب التعطيل الإشكالي للمحفز ، يتم استخدامه اليوم بحوالي 3-4 ٪ من الصناعة الكيميائية.
الطريقة الأكثر فاعلية هي طريقة الكمبول لإنتاج الفينول ، والتي طورها الكيميائي السوفيتي بيوتر سيرجيف ودخلت حيز الإنتاج في عام 1942. كان أول مصنع ضخم ، تم بناؤه عام 1949 في مدينة دزيرجينسك ، منطقة غوركي ، قادرًا على توفير ثلث طلب الاتحاد السوفيتي على الفينول.
نطاق الفينول
في البداية ، تم استخدام الفينول لإنتاج أنواع مختلفة من الأصباغ ، نظرًا لقدرته على تغيير اللون أثناء الأكسدة من اللون الوردي الباهت إلى اللون البني. توجد هذه المادة الكيميائية في العديد من أنواع الدهانات الاصطناعية. بالإضافة إلى ذلك ، تم تبني خاصية الفينول لتدمير البكتيريا والكائنات الحية الدقيقة في صناعة الجلود عند دباغة جلود الحيوانات. في وقت لاحق ، تم استخدام الفينول بنجاح في الطب كوسيلة لتطهير وتعقيم الأدوات والمباني الجراحية ، وكمحلول مائي بنسبة 1.4 ٪ - كمسكن ومطهر للاستخدام الداخلي والخارجي. بالإضافة إلى ذلك ، فإن الفينول حمض الساليسيليك هو أساس الأسبرين ، ومشتقاته ، حمض بارا أمينوساليسيليك ، يستخدم لعلاج مرضى السل. الفينول هو أيضًا جزء من عقار ملين قوي - بورجن.
حاليًا ، الغرض الرئيسي من الفينول هو الصناعة الكيميائية ، حيث تُستخدم هذه المادة في صناعة البلاستيك ، وراتنجات الفينول فورمالدهايد ، والألياف الاصطناعية مثل النايلون والنايلون ، بالإضافة إلى مضادات الأكسدة المختلفة. بالإضافة إلى ذلك ، يستخدم الفينول في إنتاج الملدنات والمواد المضافة للزيوت ، وهو أحد المكونات التي تتكون منها منتجات وقاية النبات. يستخدم الفينول أيضًا بنشاط في الهندسة الوراثية والبيولوجيا الجزيئية ، كوسيلة لتنقية وعزل جزيئات الحمض النووي.
الخصائص الضارة للفينول
بعد الحصول على الفينول مباشرة تقريبًا ، وجد العلماء أن هذه المادة الكيميائية لا تحتوي فقط على خصائص مفيدة ، مما يسمح باستخدامها في مختلف مجالات العلوم والإنتاج ، ولكنها أيضًا سم قوي. لذلك ، فإن استنشاق أبخرة الفينول لفترة قصيرة يمكن أن يؤدي إلى تهيج البلعوم الأنفي ، وحروق في الجهاز التنفسي والوذمة الرئوية اللاحقة مع نتيجة مميتة. عندما يتلامس محلول الفينول مع الجلد ، تتشكل حروق كيميائية ، والتي تتحول لاحقًا إلى تقرحات. إذا تم علاج أكثر من 25 في المائة من الجلد بمحلول ، فقد يتسبب ذلك في وفاة الشخص. يؤدي تناول الفينول في الجسم بمياه الشرب إلى تطور القرحة الهضمية وضمور العضلات وضعف تنسيق الحركات والنزيف. بالإضافة إلى ذلك ، وجد العلماء أن الفينول هو سبب السرطان ، ويساهم في تطور قصور القلب والعقم.
بسبب خاصية الأكسدة ، فإن أبخرة هذه المادة الكيميائية تذوب تمامًا في الهواء بعد حوالي 20-25 ساعة. عند إطلاقه في التربة ، يحتفظ الفينول بخصائصه السامة طوال اليوم. ومع ذلك ، في الماء ، يمكن أن تصل صلاحيتها إلى 7-12 يومًا. لذلك ، فإن الطريق الأكثر احتمالا لدخول هذه المادة السامة إلى جسم الإنسان وإلى الجلد هو المياه الملوثة.
في تركيبة البلاستيك ، لا يفقد الفينول خصائصه المتطايرة ، وبالتالي فإن استخدام اللدائن الفينولية في صناعة المواد الغذائية ، وإنتاج الأدوات المنزلية ولعب الأطفال ممنوع منعا باتا اليوم. لا ينصح باستخدامها أيضًا لإنهاء المباني السكنية والمكتبية ، حيث يقضي الشخص بضع ساعات على الأقل في اليوم. كقاعدة عامة ، يُفرز الفينول من الجسم مع العرق والبول في غضون 24 ساعة ، ولكن خلال هذا الوقت يمكنه التسبب في أضرار لا يمكن إصلاحها على صحة الإنسان. بسبب الخصائص الضارة في العديد من دول العالم ، هناك قيود على استخدام هذه المادة للأغراض الطبية.
شروط النقل والتخزين
هناك معايير دولية لنقل الفينول ، مصممة لتجنب إطلاق المادة في البيئة.
يتم نقل الفينول بالسكك الحديدية وفقًا لقواعد نقل البضائع في خزانات مزودة بجهاز تدفئة. تصنع الخزانات من صلب الكروم والنيكل أو الصلب الكربوني المطلي بالزنك أو الصلب الكربوني. يتم نقل الفينول ، المخصص لإنتاج المنتجات الطبية ، في صهاريج للسكك الحديدية مصنوعة من فولاذ الكروم والنيكل غير القابل للصدأ والفولاذ الكربوني المطلي بالزنك. يتم نقل الفينول أيضًا عبر خط أنابيب ساخن مصنوع من فولاذ الكروم والنيكل غير القابل للصدأ.
يتم تخزين الفينول في الحالة المنصهرة والصلبة في خزانات محكمة الغلق مصنوعة من فولاذ الكروم والنيكل غير القابل للصدأ أو الفولاذ الكربوني المطلي بالزنك أو الفولاذ الكربوني ، وكذلك في خزانات الألومنيوم المتجانسة. يُسمح بتخزين الفينول في حالة منصهرة تحت النيتروجين (يجب ألا يتجاوز حجم جزء الأكسجين في النيتروجين 2 ٪) عند درجة حرارة (60 ± 10) درجة مئوية لمدة 2-3 أيام. عند التخزين في حاويات الألمنيوم ، يجب التحكم بدرجة الحرارة بدقة لتجنب انحلال الألومنيوم في المنتج.
المركبات التي تحتوي على مجموعة هيدروكسيل واحدة أو أكثر متصلة بحلقة البنزين ؛ تسمى الفينولات. وأهمها الفينول نفسه:
تم اكتشاف الفينول في عام 1834 عندما تم عزله من قطران الفحم. في البداية كان يطلق عليه حمض الكربوليك ، ولا يزال هذا الاسم يستخدم حتى اليوم للفينول السائل المحتوي على 5٪ ماء. حصل الفينول على اسمه الحالي في عام 1841.
جميع الفينولات الأبسط في ظل الظروف العادية هي مواد صلبة ذات نقطة انصهار منخفضة. الفينول مادة بلورية عديمة اللون مع درجة انصهار 43 درجة مئوية. لها رائحة مميزة. مثل الكحول ، تحتوي الفينولات على نقاط غليان أعلى مما هو متوقع من وزنها الجزيئي النسبي. هذا بسبب تكوين روابط هيدروجينية بين الجزيئات في الفينولات. سبق أن لوحظ أعلاه أن 2-نيتروفينول له نقطة غليان أقل من 4-نيتروفينول. يفسر ذلك وجود رابطة هيدروجين داخل الجزيئية في أول هذه المركبات ، بينما يحتوي المركب الثاني على روابط هيدروجينية بين الجزيئية ، مما يجعله أقل تطايرًا (انظر القسم 2.2).
الفينولات ضعيفة الذوبان في الماء ، ولكنها عالية الذوبان في المذيبات العضوية ، وخاصة الكحوليات والإيثرات. الفينول قابل للامتزاج بشكل محدود مع الماء فقط في درجات حرارة أقل من 66 درجة مئوية. فوق 66 درجة مئوية ، الفينول قابل للامتزاج بالماء بأي نسبة (انظر الشكل 6.22 والقسم 6.2).
طرق الحصول على المختبر
للحصول على الفينول في ظروف المختبر ، يتم دمج ملح الصوديوم اللامائي لحمض benzenesulfonic عند 300-350 درجة مئوية مع هيدروكسيد الصوديوم الصلب ، ثم يضاف حمض الهيدروكلوريك المخفف إلى الخليط:

يتم تحضير حمض بنزين سلفونيك بواسطة سلفنة البنزين (انظر القسم 18.2). يؤدي تحييد هذا الحمض مع هيدروكسيد الصوديوم إلى تكوين ملح الصوديوم الخاص به.
يتم الحصول على الفينول أيضًا عن طريق التسخين فوق 10 درجة مئوية محلول مائي من كلوريد الفينديازونيوم:

يتم الحصول على كلوريد فينيلديازونيوم عن طريق ديازوتيزيشن الفينيل أمين (انظر القسم 19.4).
الخواص الكيميائية للفينولات
تفاعلات مجموعة الهيدروكسيل. حموضة. ثابت الحموضة للفينول 9.95. وبالتالي ، فإن لها خصائص حمض ضعيف ، على الرغم من أنها أقوى من الميثانول والإيثانول والماء (انظر الجدول. 19.4). يتم تثبيت الفينول الناتج عن الانقسام الأيوني بسبب عدم التمركز
شحنة سالبة:

يمكن اعتباره مزيجًا من أشكال الرنين المشار إليها (انظر القسمين 2.1 و 18.2).
يتفاعل الفينول مثل الكحوليات مع المعادن شديدة الحساسية مثل الصوديوم لإطلاق الهيدروجين:

ومع ذلك ، على عكس الكحوليات ، تتفاعل الفينولات مع هيدروكسيد الصوديوم:

الفينول ليس حامضيًا مثل الأحماض الكربوكسيلية. الأحماض الكربوكسيلية ، مثل الأسيتيك أو البنزويك ، قادرة على إزاحة ثاني أكسيد الكربون من بيكربونات الصوديوم أو كربونات الصوديوم ، لكن الفينول ليس كذلك. يستخدم هذا التفاعل لأغراض تحليلية للتمييز بين الأحماض الكربوكسيلية والفينولات.
تكوين الإسترات. على الرغم من أن الفينول لا يتفاعل مع الأحماض الكربوكسيلية لتكوين الإسترات ، إلا أنه يتفاعل مع كلوريد حمض الكربوكسيل في المحاليل القلوية:

هذا النوع من التفاعل يسمى أسيلة.
تشكيل الاثيرات. يتفاعل الفينول مع هالو ألكانات في وسط قلوي ، مكونًا إيثرات:

هذا التفاعل هو مثال على تخليق ويليامسون (انظر القسم السابق).
التفاعل مع الفوسفور خماسي كلوريد. على عكس الكحوليات ، لا يتفاعل الفينول مع هاليدات الهيدروجين وثلاثي هاليدات الفوسفور. ومع ذلك ، فإنه يتفاعل ببطء مع خماسي كلوريد الفوسفور لتكوين كلوروبنزين بإنتاجية منخفضة:

التفاعل مع كلوريد الحديد (III). عند إضافة محلول محايد من كلوريد الحديد (III) إلى الفينول ، يتم تكوين مركب له لون أرجواني. يستخدم هذا التفاعل كاختبار تحليلي للفينول. هذا التفاعل هو سمة من سمات المركبات التي تحتوي على مجموعة enol.

رد فعل في حلقة البنزين. تخضع حلقة البنزين في جزيء الفينول لاستبدال محب للكهرباء بسهولة أكبر من البنزين نفسه. ويرجع ذلك إلى حقيقة أن الإلكترونات غير المرتبطة على ذرة الأكسجين يتم سحبها إلى حلقة البنزين وبالتالي تنشيطها. مجموعة الهيدروكسيل للفينول لها تأثير توجيه 2،4 فيما يتعلق بالبدائل الكهربية (انظر القسم 18.2).
الهلجنة. تتم عملية الهالوجين في الفينولات في ظل ظروف أكثر اعتدالًا من هالوجين البنزين. على سبيل المثال ، عند إضافة ماء البروم إلى محلول مائي من الفينول ، يتشكل راسب أبيض من 2،4،6-ثلاثي بروموفينول:

في ثوان. 18.2 ذكر أن المعالجة بالبروم للبنزين تتطلب وجود محفز.
نترات. يمكن نترات الفينول بحمض النيتريك المخفف. في هذه الحالة يتكون خليط من 2-نيتروفينول و 4-نيتروفينول:

دعونا نقارن مرة أخرى هذه الظروف المعتدلة مع شروط رد الفعل المقابل للبنزين. يلزم إجراء نترات البنزين في خليط من حامض النيتريك المركز وحمض الكبريتيك (انظر القسم 18.2).
2-نيتروفينول و 4-نيتروفينول أحماض أقوى من الفينول. كلاهما يتميز بقيم تساوي 7.2 تقريبًا. تفسر زيادة حموضة النيتروفينول حقيقة أن مجموعة النيترو تجذب الإلكترونات نحو نفسها. نتيجة لذلك ، تسحب حلقة البنزين الإلكترونات بقوة أكبر من ذرة الأكسجين لمجموعة الهيدروكسيل.
سلفونات. يؤدي تفاعل الفينول مع حمض الكبريتيك المركز إلى تكوين خليط من أحماض هيدروكسي بنزين سلفونيك:

حمض الهيدروكسي بنزين سلفونيك (ينتج 85٪)
يتفاعل كلا المنتجين من هذا التفاعل مع حمض النيتريك المركز ، مكونين 2،4،6-ترينيتروفينول - مادة بلورية صفراء ، تُعرف بالاسم التافه "حمض البيكريك":

نظرًا للإجراء الشائع لسحب الإلكترون لمجموعات النيترو الثلاث ، فإن حمض البيكريك هو حمض قوي نسبيًا. يتميز بثابت الحموضة بالقرب من 1 ، وعند التفاعل مع محلول كربونات الصوديوم يزيح ثاني أكسيد الكربون منه.
ردود الفعل المركبة. يتفاعل محلول قلوي من الفينول مع محلول كلوريد فينيلديازونيوم ، مما يؤدي إلى تكوين راسب برتقالي من 4-هيدروكسي فينيلازو-بنزين:

هذا المنتج هو صبغة آزو. رد فعل من هذا النوع يسمى تفاعل اقتران (في هذه الحالة ، اقتران azo).
تعريف
الفينولات- مشتقات الهيدروكربونات العطرية ، في جزيئاتها ترتبط مجموعات الهيدروكسيل مباشرة بذرات الكربون في حلقة البنزين. المجموعة الوظيفية ، مثل الكحول ، هي OH.
الفينول مادة بلورية صلبة عديمة اللون ، نقطة انصهار منخفضة ، رطبة للغاية ، لها رائحة مميزة. في الهواء ، يتأكسد الفينول ، لذلك تكتسب بلوراته في البداية صبغة وردية (الشكل 1) ، وتغمق وتصبح أكثر حمراء أثناء التخزين طويل الأمد. إنه قابل للذوبان بشكل طفيف في الماء عند درجة حرارة الغرفة ، ولكنه يذوب بسرعة وبشكل جيد عند 60-70 درجة مئوية. الفينول قابل للانصهار ، ونقطة انصهاره 43 درجة مئوية.
أرز. 1. الفينول. مظهر.
الحصول على الفينول
على المستوى الصناعي ، يتم الحصول على الفينول من قطران الفحم. من بين الأساليب المختبرية الأكثر استخدامًا ما يلي:
- التحلل المائي للكلوروبنزين
C 6 H 5 Cl + NaOH → C 6 H 5 OH + NaCl (kat = Cu، t 0).
- الذوبان القلوي لأملاح أحماض أرينيسولفونيك
C 6 H 5 SO 3 Na + 2 NaOH → C 6 H 5 OH + Na 2 SO 3 + H 2 O (ر 0).
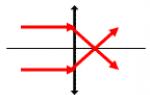
- طريقة الكومين (أكسدة الأيزوبروبيل بنزين)
C 6 H 5 -C (CH 3) H-CH 3 + O 2 → C 6 H 5 OH + CH 3 -C (O) -CH 3 (H +، t 0).
الخواص الكيميائية للفينول
تستمر التحولات الكيميائية للفينول بشكل أساسي مع الانقسام:
1) وصلات O-N
- التفاعل مع المعادن
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2.
- التفاعل مع القلويات
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
- التفاعل مع أنهيدريدات الأحماض الكربوكسيلية
C 6 H 5 -OH + Cl-C (O) -O-C (O) -CH 3 → C 6 H 5 -O-C (O) -CH 3 + CH 3 COOH (ر 0).
- التفاعل مع هاليدات حمض الكربوكسيل
C 6 H 5 -OH + Cl-C (O) -CH 3 → C 6 H 5 -O-C (O) -CH 3 + HCl (t 0).
- التفاعل مع FeCl 3 (رد فعل نوعي للفينول - ظهور لون أرجواني يختفي عند إضافة الحمض)
6C 6 H 5 OH + FeCl 3 → (C 6 H 5 OH) 3 + 3Cl -.
2) وصلات ج ص 2 -H في الغالب في حول- و ن- المخصصات
- المعالجة بالبروم
C 6 H 5 -OH + 3Br 2 (aq) → Br 3 -C 6 H 2 -OH ↓ + 3HBr.
- النترات (تكوين حمض البكريك)
C 6 H 5 -OH + 3HONO 2 (conc) → (NO 2) 3 -C 6 H 2 -OH + 3H 2 O (H +).
3) سحابة واحدة 6π إلكترون من حلقة البنزين
- الهدرجة
C 6 H 5 OH + 3H 2 → C 6 H 11 -OH (kat \ u003d Ni، t 0 \ u003d 130-150، p \ u003d 5-20 atm).
تطبيق الفينول
يستخدم الفينول بكميات كبيرة لإنتاج الأصباغ والبلاستيك الفينول فورمالدهايد والمواد الطبية.
من الفينولات ثنائية الذرة ، يستخدم الريسورسينول في الطب كمطهر ومادة لبعض الاختبارات السريرية ، ويستخدم الهيدروكينون والفينولات ثنائية الذرة الأخرى كمطورين في معالجة المواد الفوتوغرافية.
في الطب ، يستخدم اللايسول ، الذي يحتوي على الفينولات المختلفة ، لتطهير الغرف والأثاث.
تستخدم بعض الفينولات كمضادات للأكسدة - وهي مواد تمنع تلف الطعام أثناء التخزين طويل الأمد (الدهون ، الزيوت ، مركزات الطعام).
أمثلة على حل المشكلات
مثال 1
| يمارس | تمت معالجة محلول مائي يحتوي على 32.9 جم من الفينول مع فائض من البروم. احسب كتلة مشتق البرومو الناتج. |
| قرار | دعونا نكتب معادلة التفاعل لتفاعل الفينول مع البروم: ج 6 H 5 OH + 3Br 2 → C 6 H 2 Br 3 OH + 3HBr. نتيجة لهذا التفاعل ، يتم تشكيل 2،4،6-ثلاثي بروموفينول. احسب كمية مادة الفينول (الكتلة المولية 94 جم / مول): ن (C 6 H 5 OH) \ u003d م (C 6 H 5 OH) / M (C 6 H 5 OH) ؛ ن (C 6 H 5 OH) \ u003d 32.9 / 94 \ u003d 0.35 مول. وفقًا لمعادلة التفاعل n (C 6 H 5 OH): n (C 6 H 2 Br 3 OH) = 1: 1 ، أي ن (C 6 H 2 Br 3 OH) \ u003d n (C 6 H 5 OH) \ u003d 0.35 مول. ثم كتلة 2،4،6-ثلاثي بروموفينول ستكون مساوية لـ (الكتلة المولية -331 جم / مول): م (C 6 H 2 Br 3 OH) = 0.35 × 331 = 115.81 جم. |
| إجابه | كتلة مشتق البرومو الناتج 115.81 جم. |
مثال 2
| يمارس | كيف تحصل على الفينول من اليودوبنزين؟ احسب كتلة الفينول التي يمكن الحصول عليها من 45.9 جم من اليودوبنزين. |
| قرار | نكتب معادلة التفاعل لإنتاج الفينول من اليودوبنزين: C 6 H 5 I + NaOH → C 6 H 5 OH + NaI (kat = Cu، t 0). |