Самая горячая часть свечи. Как сделать цветной огонь? Опыты для детей
Описание:
Смачивая медную пластинку в соляной кислоте и поднося к пламени горелки, замечаем интересный эффект - окрашивание пламени. Огонь переливается красивыми сине-зелеными оттенками. Зрелище довольно впечатляющее и завораживающее.
Медь придает пламени зеленый оттенок. При высоком содержании меди в сгораемом веществе пламя имело бы яркий зеленый цвет. Окислы же меди дают изумрудно-зеленое окрашивание. Например, как видно из ролика, при смачивании меди соляной кислотой пламя окрашивается в голубой цвет с зеленоватым оттенком. А прокаленные медьсодержащие соединения, смоченные в кислоте, окрашивают пламя в лазурно-голубой цвет.
Для справки: Зеленый цвет и его оттенки огню придают также барий, молибден, фосфор, сурьма.
Объяснение:
Почему пламя видимое? Или чем определяется его яркость?
Некоторое пламя почти не видно, а другое наоборот светит очень ярко. Например, водород горит почти совершенно бесцветным пламенем; пламя чистого спирта тоже светит весьма слабо, а свеча и керосиновая лампа горят ярким светящимся пламенем.
Дело в том, что большая или меньшая яркость всякого пламени зависит от присутствия в нем раскаленных твердых частичек.
В топливе в большем или меньшем количестве содержится углерод. Частички углерода, раньше чем сгореть, накаливаются, - оттого-то пламя газовой горелки, керосиновой лампы и свечи светит - т.к. его подсвечивают раскаленные частицы углерода.
Таким образом, можно и несветящееся или слабо светящееся пламя сделать ярким, обогащая его углеродом или раскаляя им негорючие вещества.
Как получить разноцветное пламя?
Для получения цветного пламени к горящему веществу прибавляют не углерод, а соли металлов, окрашивающих пламя в тот или иной цвет.
Стандартный способ окрашивания слабосветящегося газового пламени - введение в него соединений металлов в форме легколетучих солей - обычно, нитратов (соли азотной кислоты) или хлоридов (соли соляной кислоты):
желтое - соли натрия,
красное - соли стронция, кальция,
зеленое - соли цезия (или бора, в виде борноэтилового или борнометилового эфира),
голубое - соли меди (в виде хлорида).
В синий окрашивает пламя селен, а в сине-зеленый - бор.
Этой способностью горящих металлов и их летучих солей придавать определенную окраску бесцветному пламени пользуются для получения цветных огней (например, в пиротехнике).
Чем определяется цвет пламени (научным языком)
Цвет огня определяется температурой пламени и тем, какие химические вещества в нём сгорают. Высокая температура пламени дает возможность атомам перескакивать на некоторое время в более высокое энергетическое состояние. Когда атомы возвращаются в исходное состояние, они излучают свет с определённой длиной волны. Она соответствует структуре электронных оболочек данного элемента.
Несложно догадаться, что цвет пламени будет зависеть от того, какие химические вещества в нем сгорают , если под действием высокой температуры отдельные атомы этих веществ высвобождаются – давая окраску. Было проведено множество экспериментов, о которых я напишу чуть ниже, для того, чтобы понять, как вещества влияют на цвет огня .
Еще в древние времена ученые и алхимики пытались понять, что за вещества сгорают в огне, в зависимости от того, в какой цвет окрашивался огонь.
Практически у всех дома есть газовые плиты или колонки, пламя в которых окрашено в голубой оттенок . Это обусловлено сгораемым углеродом , угарным газом, который и дает этот оттенок. Соли натрия, которыми богата природная древесина, дают желто-оранжевое пламя , которым горит обычный лесной костер или бытовые спички. Посыпав конфорку газовой плиты обычной поверенной солью, вы получите тот же самый оттенок. Медь дает зеленый цвет пламени. Думаю, вы не раз замечали, что обычная, не обработанная защитным составом, медь окрашивает кожу в зеленый оттенок, если долго носить кольцо или цепочку. Так и во время процесса горения. При высоком содержании меди пламя имеет очень яркий зеленый цвет, практически идентичный белому. Вы можете это наблюдать, посыпав медной стружкой все ту же газовую конфорку.
Проводились опыты с обычной газовой горелкой и различными минералами для того, чтобы определить их состав. Минерал берется пинцетом и подносится в пламя – по оттенку, в который окрашивается огонь, можно судить о различных примесях, присутствующих в элементе. Зеленый и его оттенки дают такие минералы как барий, медь, молибден, фосфор, сурьма и бор, дающий сине-зеленый цвет. Также в синий окрашивает пламя селен. Красное пламя даст литий, стронций и кальций, фиолетовое – калий, желто-оранжевый оттенок выходит при сгорании натрий.
Для исследования минералов и определения их состава используется бунзеновская горелка , дающая ровный бесцветный цвет пламени, не мешающий ходу эксперимента, изобретенная Бунзеном в середине XIX века.
Бунзен был ярым поклонником огненной стихии, часто возился с пламенем. Его увлечением было стеклодувное дело . Выдувая из стекла различные хитрые конструкции и механизмы, Бунзен мог не замечать боли. Бывали, что его заскорузлые пальцы начинали дымиться от горячего еще мягкого стекла, но он не обращал на это внимания. Если боль уже выходила за грань порога чувствительности, то он спасался своим методом – сильно прижимал пальцами мочку уха, перебивая одну боль другой.

Именно он и был родоначальником метода определения состава вещества по цвету пламени . Конечно, и до него ученые пытались ставить такие эксперименты, но у них не было бунзеновской горелки с бесцветным пламенем , не мешающим эксперименту. Он вводил в пламя горелки различные элементы на платиновой проволоке, так как платина не влияет на цвет пламени и не окрашивает его.
Казалось бы, метод хороший, не нужен сложный химический анализ, поднес элемент к пламени – и сразу виден его состав. Но не тут то было. Очень редко вещества встречаются в природе в чистом виде, обычно они содержат большой набор различных примесей , изменяющих окраску.
Бунзен пробовал различные методы вычленения цветов и их оттенков. Например, пытался смотреть через цветные стекла . Скажем, синее стекло гасит желтый цвет, который дают наиболее распространенные соли натрия, и можно было различить малиновый или лиловый оттенок родного элемента. Но и с помощью этих ухищрений определить состав сложного минерала удавалось лишь раз из ста.
Мы с детьми задались вопросом: почему огонь от костра и свечки желтого цвета, а вот от газа на плите - синего? И узнали много интересного! Оказывается, цвет пламени зависит от температуры огня и химического состава тех веществ, которые в нем горят. Чаще всего, чтобы окрасить пламя в необычный цвет, требуются достаточно экзотические ингридиенты. Но и у нас дома есть такие вещества, которые будут гореть разными цветами. Вот с помощью них мы и решили красить огонь.
Почитав разнообразную теорию в интернете, мы нашли такие рецепты:
1. В желтый цвет пламя окрашивает натрий (он доступен нам в форме хлорида натрия - обычной поваренной соли и гидрокарбоната натрия - пищевой соды).
2. Синим цветом горит газ метан (тот, что у нас в газовой плите) и спирт.
3. Зеленый цвет дает пламени медь (обычная медная проволока или, например, порошок медного купороса)
С остальными цветами сложнее, уж очень редкие в них компоненты. Ну а вдруг они есть у вас дома или вы знаете, где их можно достать? ;)
4. Зеленый цвет и его оттенки огню кроме меди еще придают барий, молибден, фосфор, сурьма.
5. Синий цвет и его оттенки дают хлорид меди, селен, бор
6. Красный цвет дают соли стронция, кальция, хлорид лития.
7. Багряный цвет - хлорид калия.
Но у нас дома из всего перечисленного нашелся только метан, натрий и медь. Поэтому мы ставили опыты с ними.
Самое простое получить синее пламя - включаешь газовую конфорку - и на плите загорается синий огонек:)
Если внести в него обычную медную проволоку, загнутую на конце колечком, и подождать несколько секунд, пока проволока не раскалится, то можно увидеть зеленое пламя.

Правда, проволока очень быстро покрывается окислом, и медь перестает гореть. Поэтому надо или часто-часто очищать проволоку или использовать медный купорос. Для этого мы просто макали смоченный водой кончик проволоки в голубой порошок медного купороса и подносили к огню. Зеленый цвет пламени держится гораздо дольше, хотя и здесь кристаллики очень быстро окисляются.

А если макнуть ту же проволоку, смоченную водой, в соль или соду и внести ее в синее пламя газовой конфорки, то пламя тут же станет желто-оранжевым. Таким, как мы привыкли видеть его в костре. Ведь огонь костра имеет оранжевый цвет тоже из-за натрия - в древесине содержится много солей.
На протяжении многих веков огонь играет очень важную роль в жизни человека. Без него практически невозможно представить наше существование. Он используется во всех сферах промышленности, а также для приготовления пищи, согревания дома и развития технического прогресса.
Впервые огонь появился в эпоху раннего палеолита. Изначально он применялся в борьбе против различных насекомых и нападений диких животных, а также давал свет и тепло. И только потом пламя огня применяли в кулинарии, изготовлении посуды и орудий труда. Так огонь вошел в нашу жизнь и стал «незаменимым помощником» человека.
Многие из нас замечали, что пламя может быть разным по своей цветовой гамме, но не многие знают, почему же огненная стихия обладает пестрой окраской. Как правило, цветовая гамма огня зависит от того, какое химическое вещество в нем сгорает. Благодаря воздействию высокой температуры все атомы химических веществ освобождаются, таким образом, придавая оттенок огню. Также было проведено большое количество экспериментов, о которых в этой статье будет написано чуть ниже, с целью того, чтобы понять, каким образом эти вещества оказывают воздействие на цвет полымя.
Еще издавна ученые прилагали усилия, чтобы понять, какие химические вещества сгорают в пламени, в зависимости от того, какую окраску принимал огонь.
Все мы дома при приготовлении пищи можем наблюдать огонек с голубым оттенком. Это предопределено легкосгораемым углеродом и угарным газом, который и придает огоньку этот голубой оттенок. Соли натрия, которыми наделена древесина, придают огню желто-оранжевый оттенок, которым пылает обыкновенный костер или спички. Если посыпать конфорку плиты обычной солью, то можно получить тот же самый колер. Зеленый цвет огню придает медь. При очень высокой концентрации меди, огонек обладает весьма ярким оттенком зеленого цвета, что фактически идентичный бесцветному белому. Такое можно наблюдать, если посыпать конфорку медной стружкой.
Также проводились эксперименты с обыкновенной газовой горелкой и разными минералами, с целью того, чтобы установить их составляющие химические вещества. Для этого минерал аккуратно берут пинцетом и подносят к огню. И, по оттенку, который принимал огонь, можно сделать выводы о разных химических добавках, которые присутствуют в элементе. Зеленый оттенок придают такие минералы, как медь, барий, фосфор, молибден, а бор и сурьма дают сине-зеленый цвет. Еще в синий цвет пламя придает селен. Красное пламя получают при добавке лития, стронция и кальция, фиолетовое получается при сгорании калия, а желто-оранжевый колер дает натрий.
Для изучения различных минералов и определения их состава применяется бунзеновская горелка, изобретенная в XIX веке Бунзеном, которая дает бесцветный окрас пламени, не мешающий ходу эксперимента.
Именно Бунзен стал основоположником методики определения химического состава вещества по цветовой палитре пламени. Конечно же, и до него были попытки провести такие опыты, но такие эксперименты не увенчались успехом, так как отсутствовала горелка. Он внедрял в огненную стихию горелки разные химические компоненты на проволоке, сделанной из платины, потому что платина никак не влияет на цвет огня и не придает ему какого-либо оттенка.
На первый взгляд может показаться, что тут не нужно какое-либо сложное химическое исследование, поднес компонент к огню – и моментально можно увидеть его состав. Однако не все так просто. В природе вещества в чистом виде встречаются весьма редко. Как правило, они включают в себя немалый набор разных примесей, которые способны изменять окраску.
Следовательно, с помощью характерных свойств молекул и атомов излучать свет определенной цветовой гаммы – был создан способ определения химического состава веществ. Такой способ определения называется спектральным анализом. Ученые изучают спектр, которое выделяет вещество. К примеру, во время горения, его сравнивают со спектрами известных компонентов, и, таким образом, устанавливают его химический состав.
Пламя - постоянный спутник энергичного горения обычных горючих веществ. Характеристикой пламени могут служить его paзмеры, изменение формы в зависимости от количества горючего вещества и большая или меньшая способность свечения. Пламя представляет собой раскаленный газ, что легко подтверждается тем, что при зажигании струи газа образуется пламя. Твердое вещество, не выделяющее при нагревании воспламеняющихся газообразных продуктов, при своем горении не образует пламени в общепринятом понимании этого слова. Например, при горении угля реакция распространяется по поверхности, которая накаляется; при горении же газа получается не только большая «поверхность» соприкосновения с кислородом воздуха, но и создается во всех направлениях теснейший контакт между горючим веществом и пособником горения. Газы могут светиться лишь во время самого горения или лишь немного спустя. Твердый углерод при горении дает достаточное количество газов, но они так быстро теряют свою теплоту и высокий накал, что перестают светиться, едва лишь потеряют Связь с его поверхностью, где происходит реакция. Если твердое вещество окисляется очень быстро, как например, сгорающий в кислороде углерод, то сгорающие в непосредственном контакте с горящим углеродом газы светятся и количество тепла, образующегося при горении, достаточно для образования «пламени». Светящееся и несветящееся пламя Пламя бывает двух видов - светящееся и несветящееся и, хотя почти всякое пламя является видимым, не всякое испускает достаточное количество света. Свечение пламени обусловлено: a) наличием в нем твердого вещества, b) плотностью его, т. е. давлением и плотностью участвующих в реакции газов, и c) его температурой. Присутствие твердого вещества в пламени - наиболее общая причина свечения, В качестве примера пламени мы возьмем пламя cвечи. Пламя свечи описано было неоднократно. Воск (смесь твердых углеводородов и жирных кислот) плавится под действием теплоты (получающейся в достаточном количестве в результате горения фитиля свечи) и всасывается фитилем. Поскольку фитиль непосредственно связан с пламенем, температура оказывается достаточной для превращения расплавленного воска в газ путем разложения или возгонки. Глазу на первый взгляд пламя кажется состоящим из нижней темной или слабо светящейся части и верхней светящейся части. На самом же деле вокруг нижней темной части имеется тонкая полоска светящегося пламени, а вокруг всего пламени находится как бы оболочка из совершенно незаметных для глаза газов. Темная часть состоит из несгоревших газов. В верхней части, где всосанный воздух благодаря конвекции вступает в контакт с горючими парами, происходит процесс горения; часть паров сгорает. Такое же явление имеет место и в узкой полоске, окружающей ядро пламени, куда также частично всасывается воздух. В наружной, едва заметной части, происходит полное сгорание. Свечение своим происхождением обязано отдельным частицам твердого углерода, накаленным добела; некоторые из них сгорают в светящейся части пламени, остальные в других частях. В пламени правильной формы, образуемом свечей, лампой или старинной газовой горелкой, лишь небольшое количество углерода не подвергается окислению. В пламени, имеющем неправильную форму, например в пламени, получающемся при сжигании обычных горючих материалов - дерева, бумаги, тканей и т. п., - воздуха, входящего в пламя, оказывается недостаточно, чтобы образовать надлежащую смесь с горючими газами, потребную для полного сгорания, и несгоревшие частицы углерода отлагаются в виде сажи и дыма. Образование частиц углерода в пламени горящих углеродистых веществ (в частности углеводородов) в течение долгого времени приписывали «преимущественному горению». Считалось, что кислород воздуха быстрее соединяется с водородом горючего, чем с углеродом, и следовательно часть последнего выделяется в той части пламени, где воздуха для полного горения недостаточно. При выходе же его наружу он сгорает. В результате же произведенных опытов со взрывом смеси углеводородов с водородом обнаружено, что кислород распределяется между водородом и углеродом, образуя воду и окись углерода, причем углерод стремился превратиться в окись углерода прежде, чем водород, сгорая, превращался в воду. Развивалась теория, что в пламени образовывался ацетилен, который экзотермически разлагался на составные элементы. Такая теория однако оказалась неудовлетворительной, так как ацетилен образовывался лишь иногда. Во время процесса разложения углеводорода кислород поглощался и образовывались кислородсодержащие соединения углерода, например альдегиды, которые в пламени разлагались, выделяя углерод. Таким образом процессы, протекающие при горении, оказались сложными. Хотя вопрос об «образовании» углерода оказался спорным, все же отложение несгоревших частиц углерода в виде сажи следует отнести или за счет недостатка кислорода (воздуха) или за счет неполного смешения его с горящими газами. Пламя, свечение которого обусловлено наличием частиц углерода, является наиболее общим типом светящегося пламени и образуется всегда при горении обыкновенных горючих материалов. Свечение пламени, впрочем, может быть обусловлено и наличием в нем других твердых веществ. Так например, при горении легкогорючих металлов, таких например, как магний, пламя получается светящимся вследствие образования твердых окислов (при горении магния пламя получается белое). Твердые вещества, вводимые в пламя, раскаляются, вследствие чего свечение увеличивается. Этот факт легко подметить на обыкновенном газокалильном колпачке, где окислы редких земель накаляются до сильного свечения посредством бунзенского пламени. Так как в данном случае твердые частицы могут быть как введены в пламя, так и выведены из него, то считать самое пламя в этом случае светящимся нельзя. При повышении температуры пламени повышается и свечение; такое повышение температуры может зачастую и несветящееся пламя сделать светящимся. Повышение температуры может быть достигнуто подогревом воспламеняющихся газов и воздуха. Если трубку горелки Бунзена нагреть докрасна и пропустить через нее смешанный с воздухом газ, пламя становится особенно светящимся. Замена воздуха кислородом вызывает увеличение свечения. Высокая температура дает возможность нагреть и инертный азот. Углерод в кислороде горит с образованием пламени, так как окислы углерода, находящиеся в соприкосновении с горящим твердым веществом, имеют достаточно высокий накал. На свечение пламени оказывает большое влияние давление участвующих в реакции газов. Возрастание давления повышает свечение, а понижение давления уменьшает его. Если зажженную свечу поместить под колокол и соединить последний с воздушным насосом, то при частичной откачке воздуха свечение быстро уменьшается. С другой стороны, при увеличении давления газы, горящие обычно несветящимся пламенем (например водород), можно заставить гореть светящимся пламенем. Густые и плотные пары и газы различных веществ обычно горят более светящимся пламенем, чем образованные продуктами, дающими пары меньшей плотности. Например, пары фосфора и его соединений, выделяющие плотные продукты горения, дают желтое пламя; соединения мышьяка - светящееся пламя. Если некоторые соли (лучше всего хлористые соединения щелочных или щелочноземельных металлов) ввести в малом количестве в пламя горелки Бунзена, то соль улетучивается или разлагается, и пламя принимает окраску, меняющуюся в зависимости от присутствующего металлического радикала. Такие металлические соли выделяют пары высокой плотности и таким образом дают светящееся пламя.
 Многие газы горят несветящимся или очень слабо светящимся пламенем. Из них можно отметить водород, окись углерода (бледно-голубое пламя), метан, аммиак (бледно-желтое) и сероводород (голубое как при горении серы). Пары некоторых летучих жидкостей - сероуглерода и спирта - горят едва светящимся пламенем, а пламя эфира и ацетона, связанное с сравнительно небольшим отделением углерода, становится благодаря этому несколько коптящим.
Многие газы горят несветящимся или очень слабо светящимся пламенем. Из них можно отметить водород, окись углерода (бледно-голубое пламя), метан, аммиак (бледно-желтое) и сероводород (голубое как при горении серы). Пары некоторых летучих жидкостей - сероуглерода и спирта - горят едва светящимся пламенем, а пламя эфира и ацетона, связанное с сравнительно небольшим отделением углерода, становится благодаря этому несколько коптящим.
 Коптящее или светящееся пламя может быть превращено в несветящееся путем подмешивания воздуха в горючий пар или газ перед сжиганием. Ближайшим примером может служить горелка Бунзена. В бунзеновской горелке горючий газ поступает через форсунку у дна трубки горелки, воздух всасывается через отверстие благодаря быстрому движению поступающего через форсунку газа. Этого количества воздуха недостаточно для полного горения газа, но его достаточно для образования в соединении с газом горючей смеси, сгорающей вверху горелки. Пламя состоит из внутреннего конуса голубовато-зеленого цвета, окруженного тонкой чуть светящейся оболочкой. Внутренний конус состоит из частично окислившихся газов. Стремительный поток газа всасывает воздух в пламя, и в наружной оболочке происходит полное сгорание.
Коптящее или светящееся пламя может быть превращено в несветящееся путем подмешивания воздуха в горючий пар или газ перед сжиганием. Ближайшим примером может служить горелка Бунзена. В бунзеновской горелке горючий газ поступает через форсунку у дна трубки горелки, воздух всасывается через отверстие благодаря быстрому движению поступающего через форсунку газа. Этого количества воздуха недостаточно для полного горения газа, но его достаточно для образования в соединении с газом горючей смеси, сгорающей вверху горелки. Пламя состоит из внутреннего конуса голубовато-зеленого цвета, окруженного тонкой чуть светящейся оболочкой. Внутренний конус состоит из частично окислившихся газов. Стремительный поток газа всасывает воздух в пламя, и в наружной оболочке происходит полное сгорание.
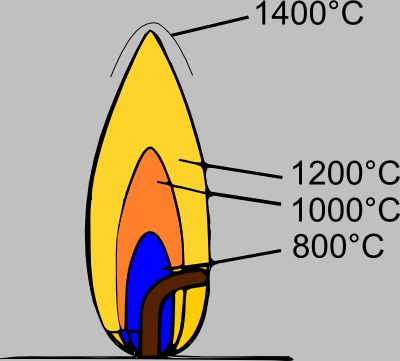 Температура пламени неодинакова для различных горючих газов и паров; неодинакова также и температура различных частей пламени; область полного сгорания имеет и наиболее высокую температуру.
При сжигании некоторого количества горючего вещества выделяется определенное количество теплоты. Если известно строение вещества, можно рассчитать состав и объем получившихся продуктов горения. Зная удельную теплоту этих продуктов, можно высчитать максимальную температуру, достижимую в пламени. Следует помнить, что, если вещество горит в воздухе, на каждый объем кислорода, вступающего в реакцию, приходится 4 объема инертного азота и, поскольку азот присутствует в пламени, он нагревается выделяемой при реакции теплотой, и таким образом температура пламени будет равна температуре продуктов горения плюс азот.
Все данные должны конечно выражаться в единицах одной и той же системы мер. При употреблении британской системы вес должен быть выражен в фунтах, а температура - в градусах Фаренгейта.
Удельная теплота вещества меняется с температурой, так что определить приблизительно температуру возможно; точное же ее определение невозможно.
На практике точный расчет температуры невозможен, так как в продолжение горения имеется непрерывная потеря теплоты. Эта теплота рассеивается различными путями. Часть уходит в виде лучистой теплоты и света и других форм энергии; часть теряется путем конвекции, в результате движения горячих газов пламени, вступающих в контакт с более холодной окружающей атмосферой; наконец, часть теплоты теряется, вследствие проводимости окружающей среды, в воздухе. Направленный вверх стремительный поток горячих газов пламени поглощает большее количество воздуха, чем потребно для горения, - эта «разбавка» также действует охлаждающе. Наибольшие потери теплоты происходят в результате излучения, и, если пренебречь теплом, теряемым вследствие конвекции и теплопроводимости, то получим температуру несколько ниже теоретического максимума.
Повысить температуру пламени, увеличивая количество горючих газов в данный момент, мы не можем, так как при таком увеличении количества горючих газов расходуется и кислород, и таким образом продукты горения будут образовываться в большем количестве.
При тесном смешении определенного количества воздуха, потребного для горения с горючим газом, мы получим наиболее благоприятные условия для получения максимальной температуры пламени. Это достигается путем применения горелки. Если мы попытаемся пропустить полностью потребное количество воздуха через отверстия бунзеновской горелки, то получится «обратный выхлоп» пламени, так как скорость распространения пламени вниз, через взрывчатую смесь, превысит скорость, с которой смесь движется по трубке горелки и выходит в верхнем конце ее. Придав смеси большую скорость посредством дутья или выпуская перед смешиванием воздух из резервуара под большим давлением, мы преодолеем это затруднение и получим довольно правильную подачу смеси в горелку. Вторичное всасывание воздуха будет весьма незначительным, а потому пламя не будет разбавляться избытком воздуха, как это обычно бывает при всасывании воздуха поверхностью пламени. При замене воздуха кислородом полученная температура повысится настолько, что накалит и инертный азот.
Лучистая энергия (излучение)
Светящееся пламя углеводородов, в котором весь воздух, потребный для горения, всасывается из окружающей атмосферы, не достигает столь высокой температуры, как пламя горючих смесей воздуха, например в горелке Бунзена. Кроме того, в первом случае получается неполное сгорание и образуется сажа. Однако, светящееся пламя излучает гораздо большее количество энергии. Обнаружено, например, что при горении ацетилена светящимся пламенем излучалось 28,2% теплоты, полученной при горении, а при горении того же самого газа несветящимся пламенем - всего 6,9%.
Сильное излучение светящегося пламени играет важную роль в распространении огня и является причиной «живости» и тепла горящего угля. При горении газа нужно нагреть до свечения твердые частицы, которые отнимают значительную часть могущей быть излученной энергии.
Температура пламени неодинакова для различных горючих газов и паров; неодинакова также и температура различных частей пламени; область полного сгорания имеет и наиболее высокую температуру.
При сжигании некоторого количества горючего вещества выделяется определенное количество теплоты. Если известно строение вещества, можно рассчитать состав и объем получившихся продуктов горения. Зная удельную теплоту этих продуктов, можно высчитать максимальную температуру, достижимую в пламени. Следует помнить, что, если вещество горит в воздухе, на каждый объем кислорода, вступающего в реакцию, приходится 4 объема инертного азота и, поскольку азот присутствует в пламени, он нагревается выделяемой при реакции теплотой, и таким образом температура пламени будет равна температуре продуктов горения плюс азот.
Все данные должны конечно выражаться в единицах одной и той же системы мер. При употреблении британской системы вес должен быть выражен в фунтах, а температура - в градусах Фаренгейта.
Удельная теплота вещества меняется с температурой, так что определить приблизительно температуру возможно; точное же ее определение невозможно.
На практике точный расчет температуры невозможен, так как в продолжение горения имеется непрерывная потеря теплоты. Эта теплота рассеивается различными путями. Часть уходит в виде лучистой теплоты и света и других форм энергии; часть теряется путем конвекции, в результате движения горячих газов пламени, вступающих в контакт с более холодной окружающей атмосферой; наконец, часть теплоты теряется, вследствие проводимости окружающей среды, в воздухе. Направленный вверх стремительный поток горячих газов пламени поглощает большее количество воздуха, чем потребно для горения, - эта «разбавка» также действует охлаждающе. Наибольшие потери теплоты происходят в результате излучения, и, если пренебречь теплом, теряемым вследствие конвекции и теплопроводимости, то получим температуру несколько ниже теоретического максимума.
Повысить температуру пламени, увеличивая количество горючих газов в данный момент, мы не можем, так как при таком увеличении количества горючих газов расходуется и кислород, и таким образом продукты горения будут образовываться в большем количестве.
При тесном смешении определенного количества воздуха, потребного для горения с горючим газом, мы получим наиболее благоприятные условия для получения максимальной температуры пламени. Это достигается путем применения горелки. Если мы попытаемся пропустить полностью потребное количество воздуха через отверстия бунзеновской горелки, то получится «обратный выхлоп» пламени, так как скорость распространения пламени вниз, через взрывчатую смесь, превысит скорость, с которой смесь движется по трубке горелки и выходит в верхнем конце ее. Придав смеси большую скорость посредством дутья или выпуская перед смешиванием воздух из резервуара под большим давлением, мы преодолеем это затруднение и получим довольно правильную подачу смеси в горелку. Вторичное всасывание воздуха будет весьма незначительным, а потому пламя не будет разбавляться избытком воздуха, как это обычно бывает при всасывании воздуха поверхностью пламени. При замене воздуха кислородом полученная температура повысится настолько, что накалит и инертный азот.
Лучистая энергия (излучение)
Светящееся пламя углеводородов, в котором весь воздух, потребный для горения, всасывается из окружающей атмосферы, не достигает столь высокой температуры, как пламя горючих смесей воздуха, например в горелке Бунзена. Кроме того, в первом случае получается неполное сгорание и образуется сажа. Однако, светящееся пламя излучает гораздо большее количество энергии. Обнаружено, например, что при горении ацетилена светящимся пламенем излучалось 28,2% теплоты, полученной при горении, а при горении того же самого газа несветящимся пламенем - всего 6,9%.
Сильное излучение светящегося пламени играет важную роль в распространении огня и является причиной «живости» и тепла горящего угля. При горении газа нужно нагреть до свечения твердые частицы, которые отнимают значительную часть могущей быть излученной энергии.




