الجزء الأكثر سخونة من الشمعة. كيف تصنع النار الملونة؟ تجارب للأطفال
وصف:
عند ترطيب لوح نحاسي في حمض الهيدروكلوريك وإحضاره إلى شعلة الموقد ، نلاحظ تأثيرًا مثيرًا للاهتمام - وهو تلوين اللهب. تلمع النار بألوان زرقاء وخضراء جميلة. المشهد مثير للإعجاب وساحر للغاية.
يعطي النحاس اللهب لونًا أخضر. مع وجود نسبة عالية من النحاس في المادة القابلة للاحتراق ، سيكون للشعلة لون أخضر ساطع. أكاسيد النحاس تعطي اللون الأخضر الزمردي. على سبيل المثال ، كما يتضح من الفيديو ، عندما يبلل النحاس بحمض الهيدروكلوريك ، يتحول اللهب إلى اللون الأزرق مع صبغة خضراء. والمركبات المحتوية على النحاس المكلس ، المبللة بالحمض ، تلون اللهب باللون الأزرق السماوي.
كمرجع:كما يعطي الباريوم والموليبدينوم والفوسفور والأنتيمون اللون الأخضر وظلاله للنار.
تفسير:
لماذا اللهب مرئي؟ أو ما الذي يحدد سطوعها؟
بعض اللهب يكاد يكون غير مرئي ، في حين أن البعض الآخر ، على العكس من ذلك ، يلمع بشدة. على سبيل المثال ، يحترق الهيدروجين بلهب عديم اللون تقريبًا ؛ تتألق شعلة الكحول النقي أيضًا بشكل خافت جدًا ، وتحترق شمعة ومصباح كيروسين بلهب مضيء ساطع.
الحقيقة هي أن السطوع الأكبر أو الأقل لأي لهب يعتمد على وجود جزيئات صلبة متوهجة فيه.
يحتوي الوقود على قدر أكبر أو أقل من الكربون. تتوهج جزيئات الكربون ، قبل أن تحترق ، - ولهذا السبب تضيء شعلة موقد غاز ومصباح كيروسين وشمعة - لأن. إنه مضاء بجزيئات الكربون المتوهجة.
وبالتالي ، من الممكن جعل اللهب غير مضيء أو ضعيف الإضاءة ساطعًا عن طريق إثرائه بالكربون أو بتسخين المواد غير القابلة للاحتراق به.
كيف تحصل على ألسنة اللهب الملونة؟
للحصول على لهب ملون ، لا يضاف الكربون إلى المادة المحترقة ، ولكن الأملاح المعدنية التي تلون اللهب بلون أو آخر.
الطريقة القياسية لتلوين لهب الغاز الخفيف هو إدخال مركبات معدنية فيه على شكل أملاح متطايرة - عادة النترات (أملاح حمض النيتريك) أو الكلوريدات (أملاح حمض الهيدروكلوريك):
الأصفر- أملاح الصوديوم ،
أحمر - أملاح السترونشيوم والكالسيوم ،
أملاح السيزيوم الخضراء (أو البورون ، في شكل إيثيل البورون أو البورون ميثيل إيثر) ،
أزرق - أملاح النحاس (على شكل كلوريد).
في الأزرق يلون اللهب بالسيلينيوم ، والأزرق والأخضر بالبورون.
تُستخدم هذه القدرة على حرق المعادن وأملاحها المتطايرة لإعطاء لون معين لهب عديم اللون للحصول على حرائق ملونة (على سبيل المثال ، في الألعاب النارية).
ما الذي يحدد لون اللهب (لغة علمية)
يتم تحديد لون النار من خلال درجة حرارة اللهب والمواد الكيميائية التي يحرقها. تسمح درجة حرارة اللهب العالية للذرات بالقفز إلى حالة طاقة أعلى لفترة من الوقت. عندما تعود الذرات إلى حالتها الأصلية ، فإنها تبعث ضوءًا بطول موجي معين. يتوافق مع هيكل غلاف الإلكترون لعنصر معين.
من السهل تخمين ذلك لون اللهبسوف تعتمد على ما يتم حرق المواد الكيميائيةإذا كان تحت العمل درجة حرارة عاليةيتم إطلاق الذرات الفردية من هذه المواد - مما يعطي اللون. تم إجراء العديد من التجارب ، والتي سأكتب عنها أدناه ، من أجل فهم كيفية تأثير المواد لون النار.
حتى في العصور القديمة ، حاول العلماء والخيميائيون فهم نوع المواد التي تحترق في النار ، اعتمادًا على لون النار.
يحتوي كل منزل تقريبًا على مواقد غاز أو سخانات مياه ، يتم تلوين اللهب فيها لون أزرق. هذا بسبب الاحتراق كربون، أول أكسيد الكربون الذي يعطي هذا الظل. تعطي أملاح الصوديوم الغنية بالخشب الطبيعي لهب أصفر برتقالي، الذي يحرق حريق غابة عادي أو أعواد ثقاب منزلية. عند رش موقد الغاز بالملح العادي الموثوق به ، ستحصل على نفس الظل. يعطي النحاس اللون الاخضرلهب. أعتقد أنك لاحظت أكثر من مرة أن النحاس العادي ، غير المعالج بتركيبة واقية ، يلطخ الجلد بلون أخضر إذا كنت ترتدي خاتمًا أو سلسلة لفترة طويلة. هذا هو الحال أثناء عملية الاحتراق. مع نسبة عالية من النحاس ، يكون للهب لون أخضر ساطع للغاية ، مطابق تقريبًا للون الأبيض. يمكنك ملاحظة ذلك عن طريق رش نشارة النحاس على نفس موقد الغاز.
أجريت التجارب مع المعتاد موقد غازوالمعادن المختلفة من أجل تحديد تكوينها. يتم أخذ المعدن بالملاقط وإدخاله في اللهب - بواسطة الظل الذي تم طلاء النار فيه ، يمكن للمرء أن يحكم على الشوائب المختلفة الموجودة في العنصر. لون أخضروظلاله تعطي معادن مثل الباريوم والنحاس والموليبدينوم والفوسفور والأنتيمون والبورون ، مما يعطي اللون الأزرق والأخضر. ايضا في أزرقالسيلينيوم يلون اللهب. أحمرسيعطي اللهب الليثيوم والسترونشيوم والكالسيوم ، ليلكي- البوتاسيوم ، اصفر برتقالييخرج الظل عند احتراق الصوديوم.
لدراسة المعادن وتحديد تكوينها ، موقد بنسن، الذي يعطي لونًا متجانسًا عديم اللون لا يتعارض مع مسار التجربة ، التي اخترعها بنسن في منتصف القرن التاسع عشر.
بنسنكان معجبًا متحمسًا للعنصر الناري ، وغالبًا ما يكون مليئًا باللهب. كانت هوايته نفخ الزجاج. لم يستطع بنسن أن يلاحظ الألم ، وهو ينفخ التصاميم والآليات الماكرة المختلفة من الزجاج. حدث أن أصابعه المتيبسة بدأت في الدخان من الزجاج الساخن الذي لا يزال طريًا ، لكنه لم ينتبه لذلك. إذا كان الألم قد تجاوز بالفعل عتبة الحساسية ، فقد هرب بطريقته الخاصة - لقد ضغط بقوة على شحمة أذنه بأصابعه ، قاطعًا ألمًا بآخر.

كان هو مؤسس الطريقة تحديد تكوين المادة حسب لون اللهب. بالطبع ، حتى قبله ، حاول العلماء إجراء مثل هذه التجارب ، لكن لم يكن لديهم موقد بنسن. مع لهب عديم اللونالتي لا تتعارض مع التجربة. أدخل عناصر مختلفة على سلك البلاتين في لهب الموقد ، لأن البلاتين لا يؤثر على لون اللهب ولا يلونها.
يبدو أن الطريقة جيدة ، ولا حاجة إلى تحليل كيميائي معقد ، لقد أحضرت العنصر إلى اللهب - وتكوينه مرئي على الفور. لكنها لم تكن هناك. نادرًا ما توجد مواد في الطبيعة في صورة نقية ، وعادة ما تحتوي عليها مجموعة كبيرة من الشوائب المختلفةالتي تغير اللون.
جرب بنسن طرقًا مختلفة لعزل الألوان وظلالها. على سبيل المثال ، حاولت انظر من خلال الزجاج الملون. دعنا نقول زجاج أزرقيطفئ الأصفر، والتي يتم الحصول عليها من أملاح الصوديوم الأكثر شيوعًا ، ويمكن للمرء أن يميز اللون القرمزي أو الأرجواني للعنصر الأصلي. ولكن حتى بمساعدة هذه الحيل ، كان من الممكن تحديد تكوين معدن معقد مرة واحدة فقط من بين مائة.
سألنا أنا والأطفال أنفسنا: لماذا النار من النار والشموع صفراء ولكن من الغاز على الموقد - زرقاء؟وتعلمت الكثير من الأشياء الشيقة! اتضح أن لون اللهب يعتمد على درجة حرارة النار و التركيب الكيميائيالمواد التي تحترق فيه. في كثير من الأحيان ، هناك حاجة إلى مكونات غريبة لطلاء اللهب بلون غير عادي. لكن لدينا أيضًا مواد في المنزل تحترق بألوان مختلفة. بمساعدتهم ، قررنا أن نرسم النار.
بعد قراءة مجموعة متنوعة من النظريات على الإنترنت وجدنا الوصفات التالية:
1 في الأصفرلهب ألوان الصوديوم (يتوفر لدينا على شكل كلوريد الصوديوم - ملح الطعام الشائع وبيكربونات الصوديوم - صودا الخبز).
2. باللون الأزرقغاز الميثان يحترق (الذي لدينا فيه موقد غاز) والكحول.
3. اللون الاخضر يعطي لهب النحاس (سلك نحاسي عادي أو ، على سبيل المثال ، مسحوق كبريتات النحاس)
مع بقية الألوان يكون الأمر أكثر صعوبة ، فالمكونات نادرة جدًا فيها. حسنًا ، ماذا لو كان لديك في المنزل أو هل تعرف من أين يمكنك الحصول عليها؟ ؛)
4. اللون الاخضر وظلاله من النار ، بالإضافة إلى النحاس ، تأتي أيضًا من الباريوم والموليبدينوم والفوسفور والأنتيمون.
5. لون ازرقوظلاله تعطي كلوريد النحاس والسيلينيوم والبورون
6. أحمر اللونتعطي أملاح السترونشيوم والكالسيوم وكلوريد الليثيوم.
7. لون قرمزي - كلوريد البوتاسيوم.
لكن في منزلنا ، من بين كل ما سبق ، تم العثور على الميثان والصوديوم والنحاس فقط. لذلك ، قمنا بإجراء تجارب معهم.
أسهل طريقة للحصول على شعلة زرقاء - تشغيل موقد الغاز - وضوء أزرق يضيء على الموقد :)
إذا أدخلت سلكًا نحاسيًا عاديًا ، وثني في النهاية بحلقة ، وانتظرت بضع ثوانٍ حتى يسخن السلك ، يمكنك رؤية لهب أخضر.

صحيح أن السلك مغطى سريعًا بالأكسيد ، ويتوقف النحاس عن الاحتراق. لذلك من الضروري إما تنظيف السلك بشكل متكرر أو استخدام كبريتات النحاس. للقيام بذلك ، قمنا ببساطة بغمس طرف السلك المبلل بالماء في المسحوق الأزرق لكبريتات النحاس وإيصاله إلى النار. يستمر اللون الأخضر للهب لفترة أطول ، على الرغم من أن البلورات تتأكسد بسرعة كبيرة.

وإذا قمت بغمس نفس السلك المبلل بالماء في الملح أو الصودا وإدخاله في اللهب الأزرق موقد غاز، سيتحول اللهب على الفور إلى اللون الأصفر البرتقالي. الطريقة التي اعتدنا أن نراه في النار. بعد كل شيء ، نار النار لها لون برتقالي أيضًا بسبب الصوديوم - فالخشب يحتوي على الكثير من الأملاح.
لقرون عديدة ، لعبت النار دورًا مهمًا للغاية في حياة الإنسان. بدونها ، يكاد يكون من المستحيل تخيل وجودنا. يتم استخدامه في جميع مجالات الصناعة وكذلك للطبخ وتدفئة المنزل وتطوير التقدم التكنولوجي.
ظهرت النار لأول مرة في العصر الحجري القديم المبكر. في البداية ، تم استخدامه في مكافحة الحشرات المختلفة وهجمات الحيوانات البرية ، كما أنه أعطى الضوء والحرارة. وعندها فقط تم استخدام شعلة النار في الطبخ وصنع الأطباق والأدوات. وهكذا دخلت النار حياتنا وأصبحت "مساعدًا لا غنى عنه" للإنسان.
لقد لاحظ الكثير منا أن اللهب يمكن أن يكون مختلفًا في نظام ألوانه ، لكن لا يعرف الكثير من الناس لماذا يكون لعنصر النار لون متنوع. كقاعدة عامة ، يعتمد نظام ألوان النار على المادة الكيميائية التي تحترق فيها. من خلال تأثير درجة الحرارة المرتفعة ، يتم إطلاق جميع الذرات الكيميائية ، مما يعطي لونًا للنار. كما تم إجراء عدد كبير من التجارب ، والتي سيتم وصفها في هذه المقالة بعد ذلك بقليل ، من أجل فهم كيفية تأثير هذه المواد على لون المقلاة.
منذ العصور القديمة ، بذل العلماء جهودًا لفهم المواد الكيميائية التي تحترق في اللهب ، اعتمادًا على لون الحريق.
يمكننا جميعًا في المنزل عند الطهي أن نلاحظ ضوءًا بلون أزرق. يتم تحديد ذلك مسبقًا بواسطة الكربون القابل للاشتعال وأول أكسيد الكربون بسهولة ، مما يعطي الضوء هذا اللون الأزرق. تعطي أملاح الصوديوم ، الممنوحة بالخشب ، لونًا أصفر برتقاليًا يحرق النار العادية أو أعواد الثقاب. إذا تم رشها على الموقد ملح عادي، ثم يمكنك الحصول على نفس اللون. النحاس يعطي اللون الأخضر للنار. عند وجود تركيز عالٍ جدًا من النحاس ، يكون للضوء ظل شديد السطوع من اللون الأخضر ، والذي يتطابق تقريبًا مع اللون الأبيض عديم اللون. يمكن ملاحظة ذلك إذا قمت برش الموقد بقشرة نحاسية.
تم إجراء التجارب أيضًا باستخدام موقد غاز عادي و معادن مختلفة، من أجل إنشاء المواد الكيميائية المكونة لها. للقيام بذلك ، يتم أخذ المعدن بعناية بالملاقط وإحضاره إلى النار. ومن خلال الظل الذي أشعلته النار ، يمكن للمرء أن يستخلص استنتاجات حول الإضافات الكيميائية المختلفة الموجودة في العنصر. تعطي المعادن مثل النحاس والباريوم والفوسفور والموليبدينوم صبغة خضراء ، بينما يعطي البورون والأنتيمون لونًا أخضر مزرقًا. يعطي السيلينيوم اللهب اللون الأزرق. يتم الحصول على لهب أحمر عن طريق إضافة الليثيوم والسترونتيوم والكالسيوم ، ويتم الحصول على اللون البنفسجي عن طريق حرق البوتاسيوم ، واللون الأصفر البرتقالي يعطي الصوديوم.
لدراسة المعادن المختلفة وتحديد تركيبها ، تم استخدام موقد بنسن ، الذي اخترعه بنسن في القرن التاسع عشر ، والذي يعطي لون لهب عديم اللون لا يتعارض مع التجربة.
كان بنسن هو مؤسس طريقة تحديد التركيب الكيميائي لمادة ما لوحة الألوانلهب. بالطبع ، كانت هناك محاولات لإجراء مثل هذه التجارب قبله ، لكن هذه التجارب لم تنجح ، حيث لم يكن هناك موقد. أدخل مكونات كيميائية مختلفة في عنصر النار في الموقد على سلك مصنوع من البلاتين ، لأن البلاتين لا يؤثر على لون النار بأي شكل من الأشكال ولا يعطيها أي ظل.
للوهلة الأولى ، قد يبدو أنه ليست هناك حاجة لأي بحث كيميائي معقد ؛ فأنت تحضر المكون إلى النار - ويمكنك أن ترى تركيبته على الفور. ومع ذلك ، ليس كل شيء بهذه البساطة. في الطبيعة ، المواد في شكلها النقي نادرة جدًا. كقاعدة عامة ، تشتمل على مجموعة كبيرة من الشوائب المختلفة التي يمكن أن تغير لونها.
وبالتالي ، باستخدام الخصائص المميزة للجزيئات والذرات لإصدار ضوء من نطاق لوني معين ، تم إنشاء طريقة لتحديد التركيب الكيميائي للمواد. تسمى طريقة التحديد هذه بالتحليل الطيفي. يدرس العلماء الطيف الذي ينبعث منه مادة ما. على سبيل المثال ، أثناء الاحتراق ، تتم مقارنتها بأطياف المكونات المعروفة ، وبالتالي يتم تحديد تركيبتها الكيميائية.
اللهب هو رفيق دائم للاحتراق القوي للمواد القابلة للاحتراق العادية. يمكن أن تتمثل إحدى سمات اللهب في حجمه ، وتغير في الشكل اعتمادًا على كمية المادة القابلة للاحتراق ، وقدرة أكبر أو أقل على التوهج. اللهب هو غاز متوهج ، وهو ما يمكن تأكيده بسهولة من خلال حقيقة أنه عند اشتعال نفاثة غاز ، يتشكل لهب. المادة الصلبة التي لا تنبعث منها منتجات غازية قابلة للاشتعال عند تسخينها لا تشكل لهبًا بالمعنى التقليدي للكلمة عندما تحترق. على سبيل المثال ، عند حرق الفحم ، ينتشر التفاعل على السطح الذي يتم تسخينه ؛ عندما يحترق الغاز ، لا يتم الحصول على "سطح" كبير من التلامس مع أكسجين الهواء فحسب ، بل يتم أيضًا إنشاء أقرب اتصال في جميع الاتجاهات بين المادة القابلة للاحتراق والشريك في الاحتراق. يمكن أن تتوهج الغازات فقط أثناء الاحتراق نفسه أو بعد ذلك بقليل. ينتج الكربون الصلب أثناء الاحتراق كمية كافية من الغازات ، لكنها تفقد حرارتها ووهجها العالي بسرعة كبيرة بحيث تتوقف عن التوهج بمجرد أن تفقد الاتصال بسطحها ، حيث يحدث التفاعل. إذا تأكسدت مادة صلبة بسرعة كبيرة ، مثل احتراق الكربون في الأكسجين ، فإن الغازات التي تحترق بالتلامس المباشر مع الكربون المحترق تتوهج وكمية الحرارة المتولدة أثناء الاحتراق كافية لتشكيل "لهب". لهب مضيء وغير مضيء اللهب من نوعين ، مضيئة وغير مضيئة ، وعلى الرغم من أن جميع اللهب تقريبًا مرئية ، إلا أنه لا تصدر كل اللهب ضوءًا كافيًا. يرجع توهج اللهب إلى: أ) وجود مادة صلبة فيه ، ب) كثافته ، أي ضغط وكثافة الغازات المتضمنة في التفاعل ، ج) درجة حرارته. وجود مادة صلبة في اللهب هو السبب الأكثر شيوعًا للسطوع ، وكمثال على اللهب ، سنأخذ لهب الشمعة. تم وصف شعلة الشمعة عدة مرات. الشمع (خليط من الهيدروكربونات الصلبة والأحماض الدهنية) يذوب بالحرارة (ينتج بكميات كافية بحرق فتيل الشمعة) ويمتص بواسطة الفتيل. نظرًا لأن الفتيل متصل مباشرة باللهب ، فإن درجة الحرارة كافية لتحويل الشمع المنصهر إلى غاز عن طريق التحلل أو التسامي. بالنسبة للعين ، للوهلة الأولى ، يبدو أن اللهب يتكون من جزء سفلي غامق أو منخفض الإضاءة وجزء علوي مضيء. في الواقع ، يوجد حول الجزء السفلي المظلم شريط رقيق من اللهب المضيء ، وحول اللهب كله ، هناك غلاف من الغازات غير مرئية تمامًا للعين. يتكون الجزء المظلم من غازات غير محترقة. في الجزء العلوي ، حيث يتلامس الهواء الممتص بسبب الحمل الحراري مع الأبخرة القابلة للاحتراق ، تتم عملية الاحتراق ؛ يتم حرق جزء من البخار. تحدث الظاهرة نفسها في شريط ضيق يحيط بجوهر اللهب ، حيث يُمتص الهواء جزئيًا أيضًا. في الجزء الخارجي ، بالكاد يمكن ملاحظته ، يحدث احتراق كامل. يرجع أصل التوهج إلى جزيئات فردية من الكربون الصلب يتم تسخينها إلى اللون الأبيض ؛ بعضها يحترق في الجزء المضيء من اللهب ، والباقي في أجزاء أخرى. في اللهب جيد التكوين مثل شمعة أو مصباح أو موقد غاز عتيق ، لا تتأكسد سوى كمية صغيرة من الكربون. في اللهب غير المنتظم ، مثل اللهب الناتج عن احتراق المواد القابلة للاحتراق الشائعة - الخشب والورق والأقمشة وما إلى ذلك - لا يكفي الهواء الداخل إلى اللهب لتشكيل الخليط المناسب مع الغازات القابلة للاحتراق اللازمة للاحتراق الكامل ، و تترسب جزيئات الكربون غير المحترقة كسخام ودخان. يُعزى تكوين جزيئات الكربون في لهب حرق المواد الكربونية (خاصة الهيدروكربونات) منذ فترة طويلة إلى "الاحتراق السائد". كان يُعتقد أن أكسجين الهواء يتحد بشكل أسرع مع هيدروجين الوقود مقارنة بالكربون ، وبالتالي يتم إطلاق جزء من هذا الأخير في ذلك الجزء من اللهب حيث لا يوجد هواء كافٍ للاحتراق الكامل. عندما يخرج ، فإنه يحترق. نتيجة لتجارب انفجار خليط من الهيدروكربونات مع الهيدروجين ، وجد أن الأكسجين يتوزع بين الهيدروجين والكربون مكونًا الماء وأول أكسيد الكربون ، ويميل الكربون إلى التحول إلى أول أكسيد الكربون قبل أن يتحول الهيدروجين ، والاحتراق ، إلى ماء. تم تطوير نظرية مفادها أن الأسيتيلين يتكون في اللهب ، والذي يتحلل طاردًا للحرارة إلى العناصر المكونة له. ومع ذلك ، تبين أن هذه النظرية غير مرضية ، حيث تم تشكيل الأسيتيلين في بعض الأحيان فقط. أثناء عملية تحلل الهيدروكربون ، يتم امتصاص الأكسجين وتشكلت مركبات الكربون المحتوية على الأكسجين ، مثل الألدهيدات ، والتي تتحلل في اللهب ، وتطلق الكربون. وهكذا ، تبين أن العمليات التي تحدث أثناء الاحتراق معقدة. على الرغم من أن مسألة "تكوين" الكربون كانت مثيرة للجدل ، إلا أن ترسب جزيئات الكربون غير المحترقة في شكل السخام يجب أن يُعزى إما إلى نقص الأكسجين (الهواء) أو إلى اختلاطه غير الكامل مع الغازات المحترقة. اللهب ، الذي يتوهج بسبب وجود جزيئات الكربون ، هو الأكثر النوع الشائع لهب مضيء ويتشكل دائمًا أثناء احتراق المواد القابلة للاحتراق العادية. ومع ذلك ، يمكن أن يكون توهج اللهب أيضًا بسبب وجود مواد صلبة أخرى فيه. على سبيل المثال ، عند حرق المعادن القابلة للاشتعال بسهولة ، مثل المغنيسيوم ، على سبيل المثال ، يتضح أن اللهب يكون مضيئًا بسبب تكوين أكاسيد صلبة (أثناء احتراق المغنيسيوم ، يتحول اللهب إلى اللون الأبيض). يتم تسخين المواد الصلبة التي تدخل إلى اللهب ، مما يؤدي إلى زيادة الوهج. من السهل ملاحظة هذه الحقيقة على غطاء عادي يعمل بالغاز ، حيث يتم تسخين أكاسيد الأتربة النادرة لتوهج قوي بواسطة لهب بنسن. نظرًا لأنه في هذه الحالة يمكن إدخال الجسيمات الصلبة في اللهب وإزالتها منه ، فلا يمكن اعتبار اللهب نفسه مضيئًا في هذه الحالة. وكلما ارتفعت درجة حرارة اللهب ارتفع الوهج. مثل هذه الزيادة في درجة الحرارة يمكن أن تجعل لهبًا غير مضيء في كثير من الأحيان. يمكن تحقيق زيادة في درجة الحرارة عن طريق تسخين الهواء والغازات القابلة للاشتعال. إذا تم تسخين أنبوب موقد بنسن باللون الأحمر وتم تمرير غاز ممزوج بالهواء ، يصبح اللهب مضيئًا بشكل خاص. يؤدي استبدال الهواء بالأكسجين إلى زيادة التألق. درجة الحرارة العالية تجعل من الممكن تسخين النيتروجين وخامله. يحترق الكربون الموجود في الأكسجين بتكوين لهب ، لأن أكاسيد الكربون التي تتلامس مع مادة صلبة محترقة لها حرارة عالية بدرجة كافية. يتأثر توهج اللهب بشكل كبير بضغط الغازات المتضمنة في التفاعل. زيادة الضغط تزيد من التوهج ويقلل من انخفاض الضغط. إذا تم وضع شمعة مضاءة أسفل الجرس وتم توصيل الأخير بمضخة هواء ، فعند الضخ الجزئي من الهواء ، ينخفض التوهج بسرعة. من ناحية أخرى ، مع زيادة الضغط ، يمكن جعل الغازات التي تحترق عادةً بلهب غير مضيء (على سبيل المثال ، الهيدروجين) تحترق بلهب مضيء. عادةً ما تحترق الأبخرة والغازات السميكة والكثيفة من مواد مختلفة بلهب أكثر سطوعًا من تلك الناتجة عن المنتجات التي تعطي أبخرة أقل كثافة. على سبيل المثال ، تنتج أبخرة الفوسفور ومركباته ، التي تنبعث منها نواتج احتراق كثيفة ، لهبًا أصفر ؛ مركبات الزرنيخ - لهب مضيء. إذا تم إدخال أملاح معينة (يفضل مركبات الكلوريد من الفلزات القلوية أو القلوية الأرضية) بكميات صغيرة في لهب موقد بنسن ، يتطاير الملح أو يتحلل ، ويأخذ اللهب لونًا يتغير اعتمادًا على الجذور المعدنية الموجودة. تطلق هذه الأملاح المعدنية أبخرة عالية الكثافة وبالتالي تنتج لهبًا مضيئًا.
 تحترق العديد من الغازات بلهب غير مضيء أو شديد الإضاءة. من بينها الهيدروجين وأول أكسيد الكربون (لهب أزرق شاحب) والميثان والأمونيا (أصفر شاحب) وكبريتيد الهيدروجين (أزرق كما في احتراق الكبريت). تحترق أبخرة بعض السوائل المتطايرة - ثاني كبريتيد الكربون والكحول - بلهب بالكاد مضيئًا ، ويصبح لهب الأثير والأسيتون ، المرتبط بفصل صغير نسبيًا للكربون ، دخانًا إلى حد ما بسبب هذا.
تحترق العديد من الغازات بلهب غير مضيء أو شديد الإضاءة. من بينها الهيدروجين وأول أكسيد الكربون (لهب أزرق شاحب) والميثان والأمونيا (أصفر شاحب) وكبريتيد الهيدروجين (أزرق كما في احتراق الكبريت). تحترق أبخرة بعض السوائل المتطايرة - ثاني كبريتيد الكربون والكحول - بلهب بالكاد مضيئًا ، ويصبح لهب الأثير والأسيتون ، المرتبط بفصل صغير نسبيًا للكربون ، دخانًا إلى حد ما بسبب هذا.  يمكن جعل اللهب المدخن أو المتوهج غير مضيء عن طريق خلط الهواء في بخار أو غاز قابل للاشتعال قبل الاحتراق. أقرب مثال على ذلك هو موقد بنسن. في موقد بنسن ، يدخل الغاز القابل للاحتراق من خلال فوهة أسفل أنبوب الموقد ، ويتم امتصاص الهواء من خلال الفتحة بسبب الحركة السريعة للغاز الذي يدخل عبر الفوهة. هذه الكمية من الهواء لا تكفي للاحتراق الكامل للغاز ، لكنها كافية لتكوين خليط قابل للاشتعال مع الغاز الذي يحترق في الجزء العلوي من الموقد. يتكون اللهب من مخروط داخلي من اللون الأخضر المزرق ، محاط بقشرة رقيقة ومضيئة قليلاً. يتكون المخروط الداخلي من غازات مؤكسدة جزئيًا. يمتص التدفق السريع للغاز الهواء إلى اللهب ، ويحدث الاحتراق الكامل في الغلاف الخارجي.
يمكن جعل اللهب المدخن أو المتوهج غير مضيء عن طريق خلط الهواء في بخار أو غاز قابل للاشتعال قبل الاحتراق. أقرب مثال على ذلك هو موقد بنسن. في موقد بنسن ، يدخل الغاز القابل للاحتراق من خلال فوهة أسفل أنبوب الموقد ، ويتم امتصاص الهواء من خلال الفتحة بسبب الحركة السريعة للغاز الذي يدخل عبر الفوهة. هذه الكمية من الهواء لا تكفي للاحتراق الكامل للغاز ، لكنها كافية لتكوين خليط قابل للاشتعال مع الغاز الذي يحترق في الجزء العلوي من الموقد. يتكون اللهب من مخروط داخلي من اللون الأخضر المزرق ، محاط بقشرة رقيقة ومضيئة قليلاً. يتكون المخروط الداخلي من غازات مؤكسدة جزئيًا. يمتص التدفق السريع للغاز الهواء إلى اللهب ، ويحدث الاحتراق الكامل في الغلاف الخارجي. 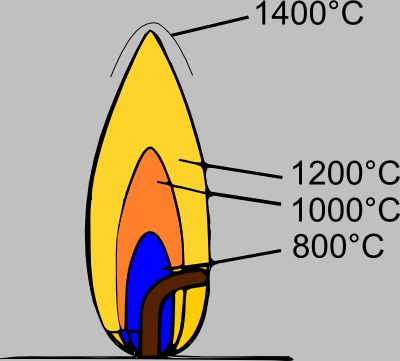 تختلف درجة حرارة اللهب بالنسبة لمختلف الغازات والأبخرة القابلة للاحتراق ؛ درجة حرارة أجزاء اللهب المختلفة ليست هي نفسها ؛ تتميز منطقة الاحتراق الكامل أيضًا بأعلى درجة حرارة. عندما يتم حرق كمية معينة من المادة القابلة للاحتراق ، يتم إطلاق كمية معينة من الحرارة. إذا كانت بنية المادة معروفة ، فيمكن حساب تركيبة منتجات الاحتراق الناتجة وحجمها. من خلال معرفة الحرارة النوعية لهذه المنتجات ، من الممكن حساب درجة الحرارة القصوى التي يمكن تحقيقها في اللهب. يجب أن نتذكر أنه في حالة احتراق مادة في الهواء ، فلكل حجم من الأكسجين يتفاعل ، هناك 4 أحجام من النيتروجين الخامل ، وبما أن النيتروجين موجود في اللهب ، فإنه يتم تسخينه بواسطة الحرارة المنبعثة أثناء التفاعل ، وبالتالي ستكون درجة حرارة اللهب مساوية لدرجة حرارة منتجات الاحتراق بالإضافة إلى النيتروجين. يجب بالطبع التعبير عن جميع البيانات بوحدات من نفس نظام القياسات. عند استخدام النظام الإمبراطوري ، يجب التعبير عن الوزن بالجنيه ودرجة الحرارة بالدرجات فهرنهايت. تختلف الحرارة النوعية للمادة باختلاف درجة الحرارة ، لذلك من الممكن تقريب درجة الحرارة ؛ تعريفه الدقيق مستحيل. من الناحية العملية ، لا يمكن إجراء حساب دقيق لدرجة الحرارة ، نظرًا لوجود فقد مستمر للحرارة أثناء الاحتراق. يتم تبديد هذه الحرارة بطرق مختلفة. يغادر البعض كحرارة مشعة وضوء وأشكال أخرى من الطاقة ؛ يُفقد البعض عن طريق الحمل الحراري ، نتيجة لحركة غازات اللهب الساخنة التي تلامس الأجواء المحيطة الباردة ؛ أخيرًا ، يُفقد جزء من الحرارة ، بسبب توصيل البيئة في الهواء. يمتص التدفق التصاعدي لغازات اللهب الساخنة هواءً أكثر مما هو مطلوب للاحتراق - وهذا "التخفيف" له أيضًا تأثير تبريد. تحدث أكبر خسائر الحرارة نتيجة للإشعاع ، وإذا أهملنا الحرارة المفقودة بسبب الحمل الحراري والتوصيل الحراري ، فسنحصل على درجة حرارة أقل قليلاً من الحد الأقصى النظري. ارفع درجة حرارة اللهب عن طريق زيادة كمية الغازات القابلة للاحتراق فيها هذه اللحظةلا يمكننا ذلك ، لأنه مع هذه الزيادة في كمية الغازات القابلة للاحتراق ، يتم استهلاك الأكسجين أيضًا ، وبالتالي ستتكون منتجات الاحتراق بكميات أكبر. من خلال مزج كمية معينة من الهواء المطلوب للاحتراق بغاز قابل للاحتراق عن كثب ، سنحصل على أقصى استفادة الظروف المواتيةللحصول على درجة حرارة اللهب القصوى. يتم تحقيق ذلك باستخدام الموقد. إذا حاولنا تمرير الكمية الكاملة من الهواء المطلوبة من خلال فتحات موقد بنسن ، فسنحصل على "عادم خلفي" للهب ، لأن سرعة انتشار اللهب لأسفل عبر الخليط المتفجر ستتجاوز السرعة التي بها يتحرك الخليط عبر أنبوب الموقد ويخرج من الطرف العلوي منه. من خلال إعطاء المزيج سرعة عالية عن طريق النفخ ، أو عن طريق تنفيس الهواء من الخزان تحت ضغط عالٍ قبل الخلط ، سنتغلب على هذه الصعوبة ونحصل على إمداد صحيح إلى حد ما من الخليط إلى الموقد. سيكون شفط الهواء الثانوي صغيرًا جدًا ، وبالتالي لن يتم تخفيف اللهب بالهواء الزائد ، كما هو الحال عادةً عندما يمتص الهواء من سطح اللهب. عندما يتم استبدال الهواء بالأكسجين ، سترتفع درجة الحرارة الناتجة كثيرًا بحيث يتوهج النيتروجين الخامل أيضًا. طاقة مشعة (إشعاع)اللهب المضيء للهيدروكربونات ، حيث يتم امتصاص كل الهواء المطلوب للاحتراق من الغلاف الجوي المحيط ، لا يصل إلى درجة حرارة عالية مثل لهب مخاليط الهواء القابلة للاحتراق ، على سبيل المثال ، في موقد بنسن. بالإضافة إلى ذلك ، في الحالة الأولى ، يتم الحصول على احتراق غير كامل وتشكيل السخام. ومع ذلك ، فإن اللهب المتوهج يشع قدرًا أكبر من الطاقة. وجد ، على سبيل المثال ، أنه أثناء احتراق الأسيتيلين بلهب مضيء ، انبعث 28.2٪ من الحرارة الناتجة أثناء الاحتراق ، وعندما تم حرق نفس الغاز بلهب غير مضيء ، فإن 6.9٪ فقط. يلعب الإشعاع القوي للهب المتوهج دورًا مهمًا في انتشار النار وهو سبب "حيوية" وحرارة حرق الفحم. عند حرق الغاز ، من الضروري تسخين الجسيمات الصلبة حتى تتوهج ، مما يزيل جزءًا كبيرًا من الطاقة التي يمكن أن تشع.
تختلف درجة حرارة اللهب بالنسبة لمختلف الغازات والأبخرة القابلة للاحتراق ؛ درجة حرارة أجزاء اللهب المختلفة ليست هي نفسها ؛ تتميز منطقة الاحتراق الكامل أيضًا بأعلى درجة حرارة. عندما يتم حرق كمية معينة من المادة القابلة للاحتراق ، يتم إطلاق كمية معينة من الحرارة. إذا كانت بنية المادة معروفة ، فيمكن حساب تركيبة منتجات الاحتراق الناتجة وحجمها. من خلال معرفة الحرارة النوعية لهذه المنتجات ، من الممكن حساب درجة الحرارة القصوى التي يمكن تحقيقها في اللهب. يجب أن نتذكر أنه في حالة احتراق مادة في الهواء ، فلكل حجم من الأكسجين يتفاعل ، هناك 4 أحجام من النيتروجين الخامل ، وبما أن النيتروجين موجود في اللهب ، فإنه يتم تسخينه بواسطة الحرارة المنبعثة أثناء التفاعل ، وبالتالي ستكون درجة حرارة اللهب مساوية لدرجة حرارة منتجات الاحتراق بالإضافة إلى النيتروجين. يجب بالطبع التعبير عن جميع البيانات بوحدات من نفس نظام القياسات. عند استخدام النظام الإمبراطوري ، يجب التعبير عن الوزن بالجنيه ودرجة الحرارة بالدرجات فهرنهايت. تختلف الحرارة النوعية للمادة باختلاف درجة الحرارة ، لذلك من الممكن تقريب درجة الحرارة ؛ تعريفه الدقيق مستحيل. من الناحية العملية ، لا يمكن إجراء حساب دقيق لدرجة الحرارة ، نظرًا لوجود فقد مستمر للحرارة أثناء الاحتراق. يتم تبديد هذه الحرارة بطرق مختلفة. يغادر البعض كحرارة مشعة وضوء وأشكال أخرى من الطاقة ؛ يُفقد البعض عن طريق الحمل الحراري ، نتيجة لحركة غازات اللهب الساخنة التي تلامس الأجواء المحيطة الباردة ؛ أخيرًا ، يُفقد جزء من الحرارة ، بسبب توصيل البيئة في الهواء. يمتص التدفق التصاعدي لغازات اللهب الساخنة هواءً أكثر مما هو مطلوب للاحتراق - وهذا "التخفيف" له أيضًا تأثير تبريد. تحدث أكبر خسائر الحرارة نتيجة للإشعاع ، وإذا أهملنا الحرارة المفقودة بسبب الحمل الحراري والتوصيل الحراري ، فسنحصل على درجة حرارة أقل قليلاً من الحد الأقصى النظري. ارفع درجة حرارة اللهب عن طريق زيادة كمية الغازات القابلة للاحتراق فيها هذه اللحظةلا يمكننا ذلك ، لأنه مع هذه الزيادة في كمية الغازات القابلة للاحتراق ، يتم استهلاك الأكسجين أيضًا ، وبالتالي ستتكون منتجات الاحتراق بكميات أكبر. من خلال مزج كمية معينة من الهواء المطلوب للاحتراق بغاز قابل للاحتراق عن كثب ، سنحصل على أقصى استفادة الظروف المواتيةللحصول على درجة حرارة اللهب القصوى. يتم تحقيق ذلك باستخدام الموقد. إذا حاولنا تمرير الكمية الكاملة من الهواء المطلوبة من خلال فتحات موقد بنسن ، فسنحصل على "عادم خلفي" للهب ، لأن سرعة انتشار اللهب لأسفل عبر الخليط المتفجر ستتجاوز السرعة التي بها يتحرك الخليط عبر أنبوب الموقد ويخرج من الطرف العلوي منه. من خلال إعطاء المزيج سرعة عالية عن طريق النفخ ، أو عن طريق تنفيس الهواء من الخزان تحت ضغط عالٍ قبل الخلط ، سنتغلب على هذه الصعوبة ونحصل على إمداد صحيح إلى حد ما من الخليط إلى الموقد. سيكون شفط الهواء الثانوي صغيرًا جدًا ، وبالتالي لن يتم تخفيف اللهب بالهواء الزائد ، كما هو الحال عادةً عندما يمتص الهواء من سطح اللهب. عندما يتم استبدال الهواء بالأكسجين ، سترتفع درجة الحرارة الناتجة كثيرًا بحيث يتوهج النيتروجين الخامل أيضًا. طاقة مشعة (إشعاع)اللهب المضيء للهيدروكربونات ، حيث يتم امتصاص كل الهواء المطلوب للاحتراق من الغلاف الجوي المحيط ، لا يصل إلى درجة حرارة عالية مثل لهب مخاليط الهواء القابلة للاحتراق ، على سبيل المثال ، في موقد بنسن. بالإضافة إلى ذلك ، في الحالة الأولى ، يتم الحصول على احتراق غير كامل وتشكيل السخام. ومع ذلك ، فإن اللهب المتوهج يشع قدرًا أكبر من الطاقة. وجد ، على سبيل المثال ، أنه أثناء احتراق الأسيتيلين بلهب مضيء ، انبعث 28.2٪ من الحرارة الناتجة أثناء الاحتراق ، وعندما تم حرق نفس الغاز بلهب غير مضيء ، فإن 6.9٪ فقط. يلعب الإشعاع القوي للهب المتوهج دورًا مهمًا في انتشار النار وهو سبب "حيوية" وحرارة حرق الفحم. عند حرق الغاز ، من الضروري تسخين الجسيمات الصلبة حتى تتوهج ، مما يزيل جزءًا كبيرًا من الطاقة التي يمكن أن تشع.